El diagnóstico bacteriológico de sepsis grave y shock séptico en las Unidades de Cuidado Intensivo es muy complejo y demorado, por lo que se están explorando biomarcadores de inflamación como alternativa.
ObjetivoEvaluar el comportamiento de los niveles séricos de procalcitonina (PCT), en casos de pacientes diagnosticados al ingreso como síndrome de respuesta inflamatoria sistémica (SRIS), y que posteriormente registraron cultivos bacterianos positivos para diversos microorganismos de tipo bacteriano.
Materiales y métodosEstudio observacional, longitudinal prospectivo de cohorte única; mediante muestreo aleatorio secuencial. Se reclutaron 98 pacientes, con al menos 2 criterios diagnósticos de SRIS, y a todos se les realizó medición diaria de los niveles de procalcitonina y cultivo microbiológico. Se incluyeron otras variables como edad, sexo y desenlace al egreso.
ResultadosMedia de edad 62,6 años (SD=17,5); 67,3% de sexo masculino (n=66); Los gérmenes cultivados con mayor frecuencia fueron E.coli, S.aureus, S.epidermidis, P.aeruginosa y Klebsiella spp.; niveles de PCT por encima de 0,5ng/ml y al menos 2 criterios diagnósticos de SRIS se registraron en 85% de los pacientes al ingreso. Al tercer día el 96% habían registrado niveles elevados de PCT. Los niveles promedio de PCT fueron más elevados en pacientes infectados con S.aureus y en los que fallecieron antes de 5días. No se registraron diferencias estadísticamente significativas por sexo y edad.
ConclusionesLa PCT se perfila como un biomarcador útil y confiable para el diagnóstico en casos de sepsis y choque séptico en Unidades de Cuidado Intensivo y Servicios de Emergencias; de la misma manera, la medición secuencial de los niveles séricos de PCT podría ayudar a esclarecer el pronóstico.
Bacteriological diagnosis of severe sepsis and septic shock in intensive care units is complex and time consuming; as an alternative, biomarkers of inflammation are being explored.
ObjectiveTo assess the performance of serum levels of procalcitonin (PCT) in patients admitted and diagnosed with Systemic Inflammatory Response Syndrome (SIRS) and afterwards had positive bacterial cultures to several microorganisms.
Materials and methodsObservational, prospective cohort longitudinal study. A total of 98 patients were enrolled by sequential random sampling; all met at least two SIRS diagnostic criteria. All patients underwent daily measurements of PCT levels and microbiological cultures. We recorded additional variables such as age, sex, and outcome at discharge.
ResultsThe mean age was 62.6 years (SD=17.5), with 67.3% males (n=66). The organisms most frequently found were: E. coli, S. aureus, S. epidermidis, P. aeruginosa and Klebsiella spp. PCT levels above 0.5 ng/mL and at least two diagnoses meeting SIRS criteria were recorded in 85% of patients at the time of admission. On the third day, 96% registered high levels of PCT. PCT mean levels were higher in patients infected with S. aureus and in those who died within 5 days. There were no statistically significant differences in terms of sex or age.
ConclusionsPCT is a useful and reliable diagnostic biomarker in cases of sepsis and septic shock. The sequential measurement of serum PCT levels may help determine the prognosis.
En los pacientes críticos ingresados a las Unidades de Cuidado Intensivo (UCI) la complicación más preocupante indudablemente es la infección de tipo bacteriano, ya sea esta adquirida o nosocomial. Se reconoce claramente que el inicio temprano de un esquema antibiótico apropiado es la mejor herramienta disponible para afrontar los cuadros infecciosos. Para el clínico, el primer paso en la estructuración de un proceso racional de decisión terapéutica consiste en la diferenciación clara de los cuadros de sepsis en contraposición con el síndrome de respuesta inflamatoria sistémica (SRIS)1, y hasta ahora, la mejor alternativa propuesta para esclarecer el cuadro está dada por el empleo de los biomarcadores.
El SRIS ha sido definido como un agregado de manifestaciones fisiológicas que se dan como respuesta generalizada a una agresión sistémica grave y debe cumplir con al menos 2 de los siguientes criterios: temperatura central <36°C o mayor de 38°C, frecuencia cardiaca mayor de 90 por minuto, frecuencia respiratoria mayor de 20 por minuto o PaCO2 <32mmHg, recuento de leucocitos menor de 4.000mm3 o mayor de 12.000mm3, más de 10% de formas inmaduras de leucocitos en el frotis sanguíneo. Un cuadro de SRIS puede tener etiología séptica o no: dentro de los cuadros de SRIS no séptico se consideran pancreatitis aguda, quemaduras extensas, politraumatismos, postoperatorio de cirugía mayor, vasculitis sistémicas, enfermedades autoinmunes y el síndrome anti-fosfolipídico primario.
Estudios extensos adelantados en España sobre la incidencia de las infecciones nosocomiales enfatizan en el riesgo que estos eventos representan para la morbilidad al interior de las UCI, en las que las infecciones asociadas ocurren en un orden de importancia, siendo las neumonías en pacientes en los que se utiliza ventilación mecánica las más frecuentes, seguidas por infecciones urinarias asociadas a las sondas uretrales y bacteriemias primarias en relación con los catéteres venosos. Los gérmenes con más frecuencia aislados son Staphylococcus aureus, Pseudomonas aeruginosa, Acinetobacter baumanii, Escherichia coli, Candida albicans y Enterococcus faecalis2. En el Hospital San Rafael de Tunja se ha reportado alrededor de 16% de pacientes que ingresan a la UCI con cuadros infecciosos, durante un año (2010), lo que representa algo más de la sexta parte del total de pacientes admitidos a la UCI3.
Como resultado del interés que este campo ha despertado, se ha propuesto un amplio espectro de biomarcadores para la caracterización de los estados sépticos, que incluyen la procalcitonina (PCT), varios tipos de interleucinas (IL), recuento de eosinófilos, adrenomedulina (ADM) y pro-adrenomedulina, péptido natriurético, vasopresina, interferones, etc. La PCT ha sido el más estudiado, y en algunas UCI su medición ya se incluye como práctica de rutina en el estudio de los pacientes ingresados con sospecha o riesgo de infección bacteriana4.
La PCT es un péptido compuesto por 116 aminoácidos, precursor de la hormona calcitonina; la PCT se sintetiza en las células C de la tiroides; en condiciones fisiológicas normales los niveles séricos de PCT están por debajo de 0,1ng/ml. Esta situación se ve alterada en condiciones de infección bacteriana por cuanto la PCT comienza a ser sintetizada en otros tejidos neuroendocrinos del pulmón e intestino, tejido hepático y células tipo macrófagos monocitos; se reconoce además que esta síntesis extratiroidea puede ser inducida por el factor de necrosis tumoral (TNF)-α y la interleucina IL-25. Esta elevación de los niveles de PCT parece ser específica de las infecciones bacterianas sistémicas, por cuanto existe evidencia de que no se libera en cantidades significativas en el caso de infecciones virales, o de aquellas bacterianas de tipo intracelular como Mycoplasma pneumoniae6.
A la evaluación de los niveles séricos de PCT también se le ha reconocido valor pronóstico, en la medida que ha sido observado que sus niveles tienden a aumentar significativamente cuando se incrementa la severidad de la sepsis, lo mismo que cuando empeora la falla orgánica. En un estudio adelantado con 472 pacientes críticos ingresados a UCI, a quienes se realizaron mediciones diarias de los niveles de PCT, se encontró que un alto valor máximo de la PCT, así como el aumento progresivo de los valores de PCT después de la primera lectura superior a 1,0ng/ml, incrementan significativamente el riesgo relativo de mortalidad a 90días7.
De la misma manera, un metaanálisis de 49 publicaciones mostró que la PCT resulta significativamente mejor que las titulaciones de proteína C reactiva, cuando se trata de diagnosticar cuadros infecciosos complicados por afectación sistémica8; es importante anotar que existen estudios similares que se manifiestan en sentido contrario9.
Vista la necesidad de perfilar herramientas diagnósticas que permitan tomar decisiones rápidas sobre implementación de terapéuticas antimicrobianas, antes de esperar por más de 48h el resultado de los correspondientes cultivos y antibiogramas, el propósito del presente estudio se centró en evaluar el comportamiento de los niveles séricos de PCT, en casos de pacientes diagnosticados al ingreso como SRIS, y que posteriormente registraron cultivos bacterianos positivos para diversos gérmenes.
Materiales y métodosSe diseñó un estudio observacional, longitudinal prospectivo de cohorte única, que se adelantó en la UCI del Hospital San Rafael de Tunja, durante el período comprendido entre abril de 2011 y diciembre de 2012; se consideraron elegibles todos los pacientes mayores de 18 añosingresados a la UCI con al menos 2 criterios de SRIS. Mediante muestreo secuencial aleatorio se registraron pacientes de ambos sexos que cumplieran los criterios de inclusión, previa obtención de un consentimiento informado. El estudio fue aprobado por el Comité de Bioética en Investigación de la institución. En total se registraron 98 pacientes, con cuadro clínico compatible con SRIS.
A todos los pacientes ingresados con sospecha de infección o que presentaban cuadro compatible con SRIS o diagnóstico de infección les fue extraída diariamente una muestra de sangre para titulación de PCT. Así mismo, dependiendo de la sospecha clínica del foco de la infección fueron practicadas tomas para hemocultivo, urocultivo o muestras de secreciones para cultivo bacteriológico, y los correspondientes antibiogramas. De la muestra final se excluyó un solo paciente, en quien no se demostró por cultivo infección bacteriana.
Para la determinación de PCT se obtuvieron muestras de sangre en tubo seco, que posteriormente se centrifugó para disponer las correspondientes alícuotas de 30μl de suero. Los valores séricos de PCT se determinaron, utilizando como reactivo el kit ELECSYS™, BRAHMS PCT, en un equipo Cobas 601™, mediante la técnica de electroquimioluminiscencia, un test metodológicamente similar a las técnicas de electroinmunoanálisis, sobre todo quimioluminiscencia. En este inmunoanálisis se generan, desde sustratos estables, productos capaces de emitir fotones al pasar de un estado intermedio inestable y energéticamente superior, a uno de energía inferior más estable, de origen electroquímico. El anticuerpo utilizado recubre micropartículas imantadas, que tras la formación del complejo antígeno-anticuerpo se fijan a un electrodo por magnetismo. Dicho anticuerpo está conjugado con un marcador (derivado del rutenio) capaz de emitir fotones cuando se aplica una pequeña diferencia de potencial sobre el electrodo. En cualquier caso la energía lumínica se sigue detectando en un fotomultiplicador. Las ventajas atribuibles a la quimioluminiscencia lo son también a esta técnica, pero además ofrecen fácil separación entre las fases ligada y libre.
En el proceso de obtención de los correspondientes cultivos microbiológicos, las muestras fueron sembradas en medios generales y selectivos, dependiendo del tipo, de agar, sangre, Chocolate, Mac Konkey y Cromagar para urocultivo. Se utilizó un sistema automatizado para microbiología Phoenix 10™, diseñado para la identificación rápida y prueba de sensibilidad a antibióticos en bacterias de importancia clínica. Este sistema proporciona resultados rápidos para la mayoría de bacterias aeróbicas grampositivas, así como para la mayoría de bacterias aeróbicas y anaeróbicas facultativas gramnegativas de origen humano.
Se definió como día 1 al del ingreso y toma de muestra para registrar valores séricos de PCT. Posteriormente se realizó toma diaria de sangre con el mismo propósito. Otros datos incluidos en el protocolo fueron edad, sexo, diagnóstico de ingreso, presencia de SRIS, resultado del cultivo, resultado final de la hospitalización. Se estimaron como variables de salida principales los valores de PCT registrados en los 5 primeros días, dado que se considera que la mínima concentración inhibidora del antibiótico se debe garantizar en al menos 3 días, aunque se postule que una condición de equilibrio en efectividad de tratamiento se logra a las 48h de iniciado el mismo.
El análisis estadístico se llevó a cabo utilizando el programa estadístico Epi-Info 7™, (CDC, Atlanta, EE.UU.). Para las variables categóricas se obtuvieron porcentajes con estimación de intervalos de confianza al 95%; para las variables continuas los promedios con sus correspondientes desviaciones estándar. Se utilizó el test de Kolmogorov-Smirnoff para evaluar las distribuciones muestrales; Las variables continuas fueron comparadas usando el test de Mann-Whitney (comparación de 2 grupos) o de Kruskall-Wallis (comparación de múltiples grupos); para la comparación de variables categóricas se utilizó la prueba de Chi cuadrado o la prueba exacta de Fisher cuando resultaba adecuado. Todos los valores p se estimaron asumiendo hipótesis de 2 colas. La significación estadística se definió como p=0,05.
ResultadosEn el estudio se incluyó un total de 98 pacientes, de los cuales el 67,3% (n=66) eran hombres; la media de edad fue 62,6 años (SD=17,5); no se encontraron diferencias estadísticamente significativas por sexo (p=0,41). El 18,37% de los pacientes tenían entre 18 y 50 años; el 28,67% tenían entre 51 y 65 años, mientras que más de la mitad (53,06%) eran mayores de 65 años; tampoco hubo en esta estratificación por edad diferencias estadísticamente significativas por sexo.
Al momento del ingreso, el 85% de los pacientes presentaban criterios suficientes para el diagnóstico de SRIS, mientras que el 85,1% dieron un resultado de PCT positivo, de manera que la concordancia entre estos 2 criterios fue de 0,9775.
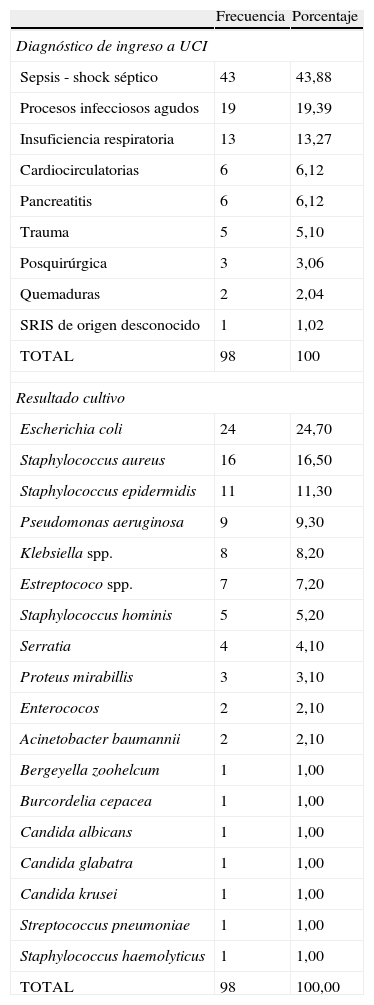
Los diagnósticos de ingreso a la UCI y el resultado de los cultivos se muestran en la tabla 1; se observa que el diagnóstico más frecuente es sepsis y shock séptico, y el microorganismo más asociado a este cuadro es E. coli.
Diagnósticos y cultivos microbiológicos. UCI HSRT. 2011-2012
| Frecuencia | Porcentaje | |
| Diagnóstico de ingreso a UCI | ||
| Sepsis - shock séptico | 43 | 43,88 |
| Procesos infecciosos agudos | 19 | 19,39 |
| Insuficiencia respiratoria | 13 | 13,27 |
| Cardiocirculatorias | 6 | 6,12 |
| Pancreatitis | 6 | 6,12 |
| Trauma | 5 | 5,10 |
| Posquirúrgica | 3 | 3,06 |
| Quemaduras | 2 | 2,04 |
| SRIS de origen desconocido | 1 | 1,02 |
| TOTAL | 98 | 100 |
| Resultado cultivo | ||
| Escherichia coli | 24 | 24,70 |
| Staphylococcus aureus | 16 | 16,50 |
| Staphylococcus epidermidis | 11 | 11,30 |
| Pseudomonas aeruginosa | 9 | 9,30 |
| Klebsiella spp. | 8 | 8,20 |
| Estreptococo spp. | 7 | 7,20 |
| Staphylococcus hominis | 5 | 5,20 |
| Serratia | 4 | 4,10 |
| Proteus mirabillis | 3 | 3,10 |
| Enterococos | 2 | 2,10 |
| Acinetobacter baumannii | 2 | 2,10 |
| Bergeyella zoohelcum | 1 | 1,00 |
| Burcordelia cepacea | 1 | 1,00 |
| Candida albicans | 1 | 1,00 |
| Candida glabatra | 1 | 1,00 |
| Candida krusei | 1 | 1,00 |
| Streptococcus pneumoniae | 1 | 1,00 |
| Staphylococcus haemolyticus | 1 | 1,00 |
| TOTAL | 98 | 100,00 |
Fuente: Base de datos.
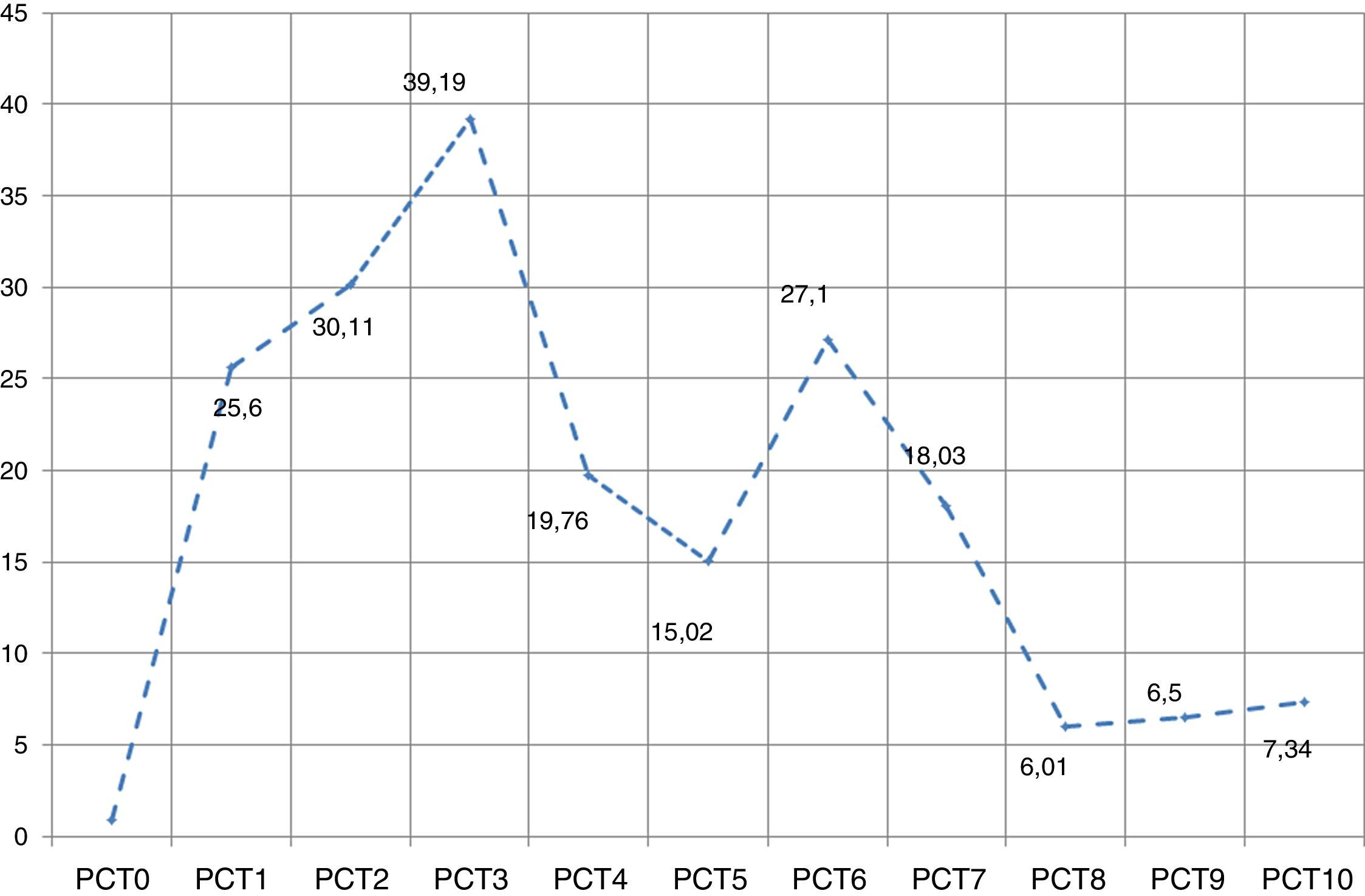
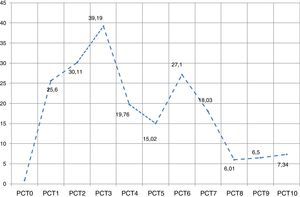
Valores superiores a 0,5ng/ml de PCT se registraron, desde el día del ingreso, en el 85,1% de los pacientes ingresados a la UCI (n=84); para el segundo día, los títulos de PCT eran positivos en el 93,8% (n=90), mientras que al tercero la positividad había ocurrido en el 96% de los casos. El registro del valor promedio de la PCT día tras día durante los primeros 10días se registra en la figura 1.
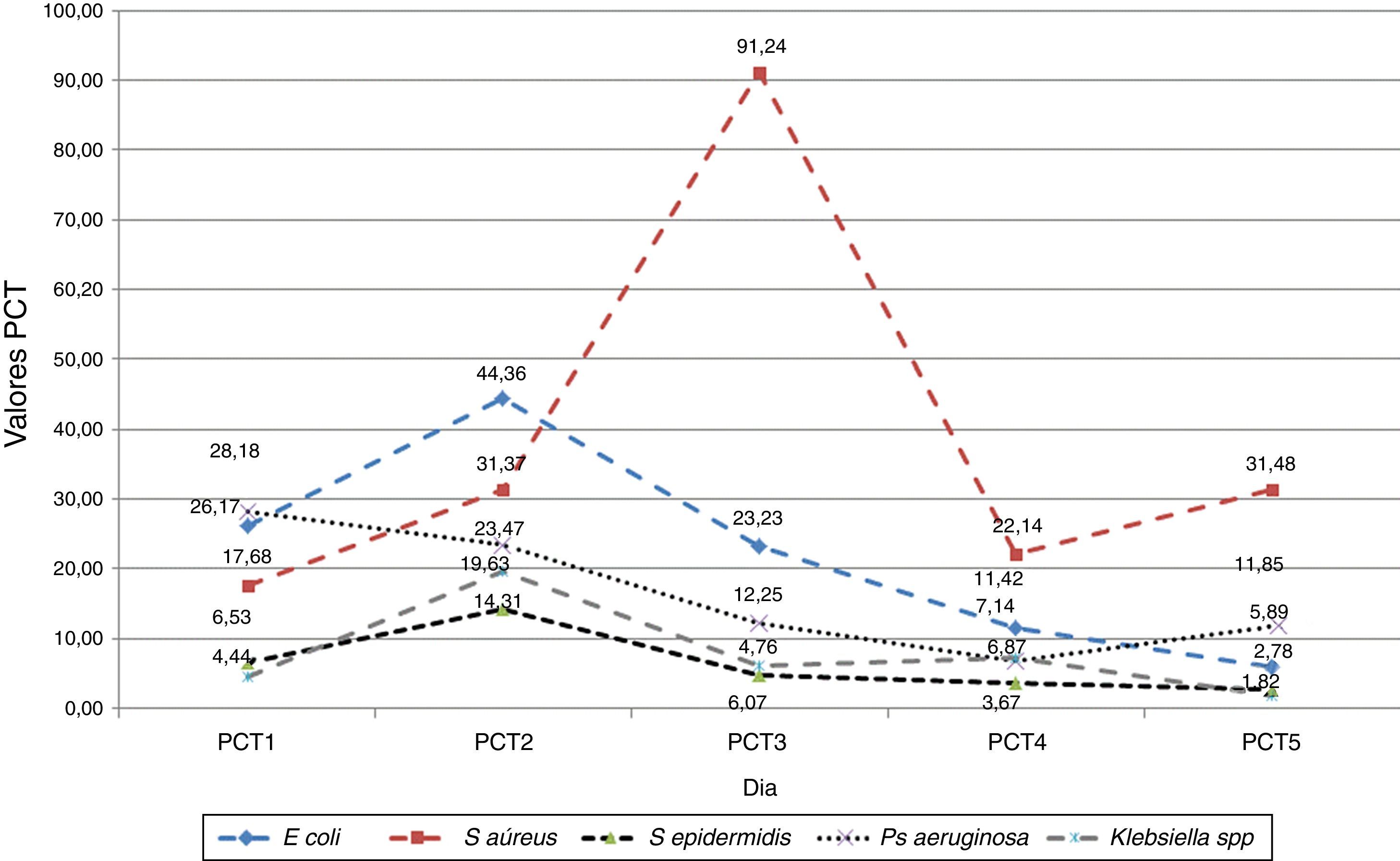
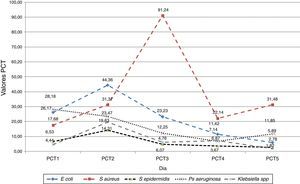
Se encontraron diferencias estadísticamente significativas en la concentración sérica de PCT, medida día a día, dependiendo del germen causante, tal como se muestra en la figura 2.
Se evidencia que los valores medios de PCT en casos de infección por S.aureus se elevan de manera significativamente mayor que en los casos de los otros 4 microorganismos más frecuentemente aislados de los cultivos microbiológicos, a la vez que el pico máximo se alcanza a las 72h; en el otro extremo, en las infecciones por E.coli, S.epidermidis, P.aeruginosa y Klebsiella spp., el pico máximo de PCT se observa al segundo día.
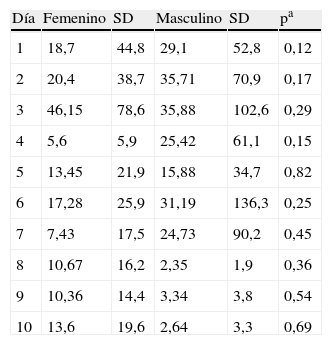
Pese a marcadas diferencias en los valores absolutos promedio de las concentraciones séricas de PCT en los pacientes por sexo, no se encontraron diferencias estadísticamente significativas, aunque el pico máximo de PCT se alcanzó en los hombres al segundo día, mientras que en las mujeres fue más marcado y se evidenció en el tercer día (tabla 2).
Valores diarios promedio de PCT por sexo. Pacientes UCI-HSRT. 2011-2012
| Día | Femenino | SD | Masculino | SD | pa |
| 1 | 18,7 | 44,8 | 29,1 | 52,8 | 0,12 |
| 2 | 20,4 | 38,7 | 35,71 | 70,9 | 0,17 |
| 3 | 46,15 | 78,6 | 35,88 | 102,6 | 0,29 |
| 4 | 5,6 | 5,9 | 25,42 | 61,1 | 0,15 |
| 5 | 13,45 | 21,9 | 15,88 | 34,7 | 0,82 |
| 6 | 17,28 | 25,9 | 31,19 | 136,3 | 0,25 |
| 7 | 7,43 | 17,5 | 24,73 | 90,2 | 0,45 |
| 8 | 10,67 | 16,2 | 2,35 | 1,9 | 0,36 |
| 9 | 10,36 | 14,4 | 3,34 | 3,8 | 0,54 |
| 10 | 13,6 | 19,6 | 2,64 | 3,3 | 0,69 |
a Prueba de Kruskal-Wallis.
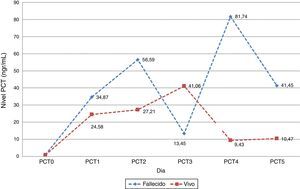
Diez de los pacientes (7 hombres, 3 mujeres) fallecieron durante la estancia en la UCI, de manera que la tasa de mortalidad fue del 10,2%; sin diferencias estadísticamente significativas por sexo, en la prueba de hipótesis de Kruskal-Wallis (p>0,05). El germen más letal fue S.aureus (3 casos), seguido de E.coli (2 casos).
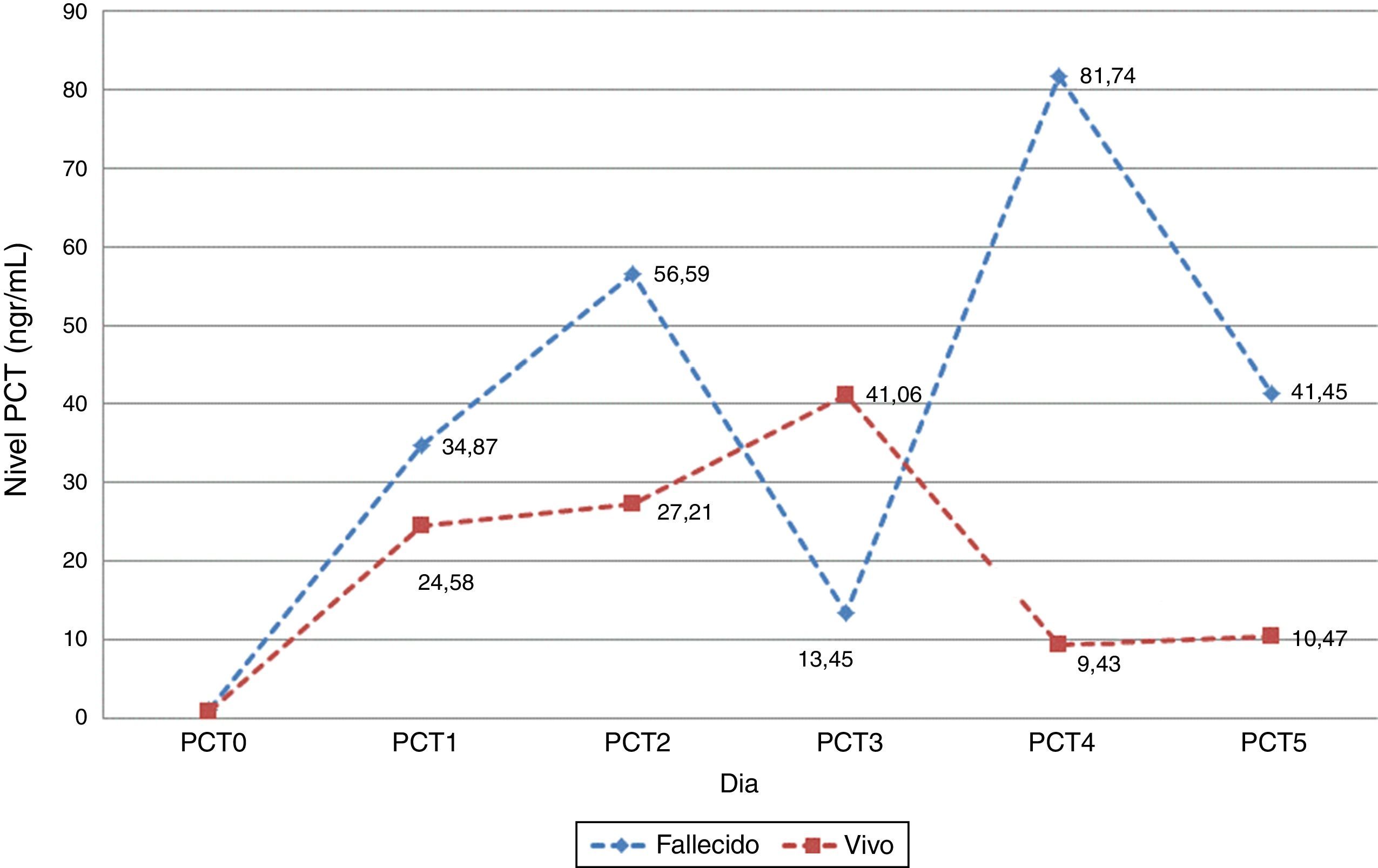
En la evaluación de los promedios diarios de niveles séricos de PCT se puede apreciar que en aquellos pacientes en los que el resultado final fue la muerte, la PCT se encuentra en promedio más elevada. Este resultado podría poner de manifiesto que la magnitud del nivel de PCT podría ser pronóstico de la severidad del cuadro séptico (fig. 3).
DiscusiónA partir de los datos registrados en el presente estudio, se encuentra que la estimación temprana de los niveles séricos de PCT provee información valiosa que permite en principio aproximar criterios de diferenciación del SRIS, a la vez que diferenciar los cuadros de sepsis de los de infecciones localizadas en las fases más tempranas de las enfermedades, criterio que a la vez puede permitir una toma de decisiones más adecuada y oportuna. Se ha visto que los retrasos en el diagnóstico de sepsis y en la adecuación de un esquema terapéutico antimicrobiano pueden incrementar significativamente la mortalidad; hasta el momento no se ha estandarizado un método microbiológico rápido que permita identificar el microorganismo causal, así como el mejor esquema de antibioterapia para cada caso en particular; estas incertidumbres han llevado a investigadores y clínicos a focalizar en los fenómenos asociados a la cascada inflamatoria para identificar moléculas útiles como predictores o marcadores de la sepsis10.
Se considera que niveles de PCT en suero de hasta 0,5ng/ml son normales; desde 0,5 hasta 2,0ng/ml representan una elevación leve; desde 2 hasta 5ng/ml se interpretan como elevación moderada; entre 5 y 10ng/ml hay una elevación significativamente alta, mientras que valores superiores a 10ng/ml se interpretan como cuadros francos de sepsis grave y choque séptico11. Un punto de corte de 0,5ng/ml es reconocido a nivel internacional como el más adecuado, en la medida en que se ha estandarizado en amplias revisiones de la literatura especializada, mediante la determinación en curvas ROC12. Es también importante tener en cuenta que en este tipo de evaluaciones de rendimiento operativo la PCT ha demostrado ser mucho más sensible y específica para el diagnóstico de sepsis y shock séptico que otros biomarcadores habitualmente empleados en las UCI, como la proteína C reactiva, la interleucina y el lactato13.
En términos de pronóstico de resultados, también se ha evidenciado que las mediciones seriadas, que permiten valorar la tasa de cambio en los niveles séricos de PCT son herramientas muy útiles en la detección temprana de la bacteriemia, lo que permite ajustar los criterios y tipos de intervención terapéutica mejorando significativamente el resultado final del ingreso a la UCI14.
Dado que en la gran mayoría de casos se registraron cultivos positivos, es evidente que los valores altos de PCT registrados constituyen información muy valiosa en la estructuración de los diagnósticos de sepsis así como de la severidad del cuadro clínico, hecho que se corrobora en la literatura científica referida a la correlación entre cultivos positivos y diagnóstico de sepsis15.
Es indudable que la combinación de estimación de los niveles séricos de PCT con otros biomarcadores reconocidos por su utilidad en el diagnóstico temprano de la septicemia y de la sepsis mejora significativamente la confiabilidad en la toma de decisiones críticas en un escenario en que tiempo y precisión son variables que deben conjugarse en favor del paciente. No obstante, se ha visto que la PCT se eleva antes que la proteína C reactiva y que otros biomarcadores; un elemento importante radica en el hecho de que la determinación temprana y secuencial del comportamiento de la PCT, cuando está indicado, puede equilibrar los costos en función de la complejidad del equipo a utilizar, elección terapéutica y el tiempo de administración de los medicamentos16, en consideración a que la elevación de los niveles séricos de PCT puede registrarse rápidamente, es decir, hasta 8h de haberse iniciado un cuadro febril17.
Uno de los problemas serios en el diagnóstico temprano de sepsis está integrado al grupo de pacientes que ingresan a la UCI con cuadros concomitantes de inmunodeficiencia, dado que la mayoría de pruebas bioquímicas son altamente sensibles a la inflamación, pero muy poco específicas frente a la sepsis. La PCT, dadas sus características de actuar simultáneamente como una hormona y como citosina, se perfila como la más eficaz solución a este dilema, dado que registra una buena capacidad discriminante de la sepsis bacteriana, frente a cuadros de infección viral y a otras formas de cuadros con características inflamatorias predominantes. No obstante, es importante tener claro que niveles elevados de PCT se pueden registrar también en cuadros de trauma grave, cirugía extensa, quemaduras, carcinoma medular de células C, carcinoma pulmonar de células pequeñas o carcinoide bronquial, tratamiento con medicamentos que estimulan la liberación de moléculas pro-inflamatorias o disminución de linfocitos CD3 (anticuerpos OKT3, interleucinas, TNF-α), cuadros prolongados de choque cardiogénico, anomalías de la perfusión, cirrosis hepática claseC (child-pugh), primera semana después del nacimiento y tratamiento de diálisis peritoneal18.
Otro aspecto importante a considerar en las evaluaciones secuenciales de los niveles séricos de PCT tiene que ver con el valor pronóstico del desenlace letal, dado que también se ha sugerido que la persistencia de valores altos, así como la lentitud en el aclaramiento en un lapso de 24h, se asocian significativamente con mayor mortalidad en pacientes diagnosticados con choque séptico y/o sepsis grave19. De hecho, incluso valoraciones rápidas de tipo semicuantitativo pueden ser muy útiles en la evaluación pronóstica de los pacientes, aun desde los ámbitos de internamiento previos a la UCI, tales como los servicios de urgencias y el bloque quirúrgico, con lo cual se garantizarían decisiones oportunas y adecuadas que podrían disminuir significativamente la mortalidad20.
Si bien no en todos los servicios de UCI es posible realizar mediciones simultaneas con al menos 2 biomarcadores de inflamación, para efectos de optimizar el diagnóstico de sepsis y/o choque séptico es importante anotar que recientemente se ha determinado experimentalmente que la combinación en la medición simultánea de PCT e interleucina-6 registra sensibilidad del 88%, mientras que la misma utilizando una combinación de PCT y proteína C reactiva fue del 82%; las áreas bajo la curva ROC registradas fueron 0,80 y 0,819, respectivamente, con lo que se puede concluir que la estimación combinada de estos 3 biomarcadores podría ser la más eficaz en el diagnóstico temprano de sepsis, especialmente neonatal21.
ConclusionesLa medición de los niveles séricos de PCT se perfila como una herramienta tecnológica de buen desempeño para el diagnóstico temprano de sepsis y choque séptico en las Unidades de Cuidado intensivo; también se puede inferir que mediciones secuenciales de PCT en estos pacientes permiten esclarecer el pronóstico, facilitando de esta manera el proceso de toma de decisiones en el plano terapéutico.
FinanciaciónLa investigación se financió con recursos propios del grupo de investigación en salud pública Hospital San Rafael de Tunja Boyacá, Colombia.
Conflicto de interesesNinguno declarado.
Los autores hacen expresa manifestación de agradecimiento a las directivas y funcionarios del Hospital San Rafael de Tunja por su invaluable colaboración, sin la cual no se hubiesen alcanzado los objetivos del estudio; también a los pacientes que accedieron a colaborar desinteresadamente, en beneficio de los procesos diagnósticos de nuestro equipo de trabajo.