La transmisión congénita de la enfermedad de Chagas ha sido poco estudiada en Colombia y existen pocos procedimientos rutinarios en el sistema de salud para el manejo de esta enfermedad. Por ello se desarrolló un consenso de expertos dirigido a generar recomendaciones de diagnóstico y tratamiento de Chagas congénito y orientación a mujeres en edad fértil. Con ese propósito se realizó una búsqueda extensiva de la literatura, empleando una combinación de términos MeSH (Chagas, Chagas congénito, prevención, control, diagnóstico, tratamiento y embarazo) para reflejar el estado del arte en cada tema de interés. Después de ello, se leyeron los resúmenes y aquellos seleccionados para análisis del texto completo. La literatura relevante se sintetizó, clasificó y organizó en tablas y se presentó al panel de expertos, el cual estaba constituido por 30 profesionales en diferentes áreas. Mediante la metodología Delphi se realizaron 2 rondas de cuestionarios virtuales y una reunión presencial en los cuales se evaluaron los niveles de acuerdo entre los participantes. Los puntos con falta de consenso durante las 2 rondas virtuales se expusieron durante las mesas de discusión en la ronda presencial. La evidencia utilizada se adaptó a las particularidades nacionales según el caso y se aprobó el contenido del documento final. Se propone que estas recomendaciones sean usadas por profesionales de la salud en Colombia.
Congenital transmission of Chagas disease has not been extensively studied in Colombia, and there are no standardized processes in the health system regarding the specific diagnosis, treatment and follow-up of this disease. In order to generate recommendations on congenital Chagas disease and Chagas in women of childbearing age in Colombia, a consensus of experts was developed. An extensive literature search through the Medline database was carried out using the MeSH terms: «Chagas disease/congenital», «prevention and control», «diagnosis», «therapeutics» and «pregnancy». Appropriate abstracts were selected and the full texts were analyzed. The relevant information was synthesized, classified, and organized into tables and figures and was presented to a panel of experts, which was composed of 30 professionals from various fields. Based on the Delphi methodology, three rounds of consultation were conducted. The first and second rounds were based on electronic questionnaires that measured the level of consensus of each question among the participants. The third round was based on a face-to-face discussion focusing on those questions without consensus in the previous consultations. The evidence was adapted to national circumstances on a case-by-case basis, and the content the final document was approved. These recommendations are proposed for use in routine medical practice by health professionals in Colombia.
La transmisión congénita de la enfermedad de Chagas supone un desafío para el control de esta enfermedad parasitaria, pues involucra no solo a los países endémicos de Latinoamérica, sino también a países no endémicos en otros continentes en donde, como consecuencia de la migración, viven mujeres en edad fértil portadoras de la infección por Trypanosoma cruzi (T. cruzi)1.
La atención integral de esta enfermedad incluye no solo la detección temprana y el tratamiento del recién nacido o lactante, sino que, además, se generan nuevos retos en la atención y orientación médica para las mujeres infectadas2. En Colombia, hay poca producción académica en este tema. Por ello, el país es justamente el escenario propicio para plantear una revisión de las estrategias que han mostrado eficiencia en países y contextos similares y, frente a ellas, hacer una discusión de la conveniencia de cada una de estas en el contexto nacional. Es por ello por lo que este primer consenso busca integrar expertos en temas relacionados con la pediatría, la atención prenatal y actores del sistema de salud que toman decisiones a diario con este grupo de mujeres y niños, junto con expertos en enfermedad de Chagas, a fin de formular recomendaciones para la atención de estas poblaciones en Colombia.
Objetivo del consensoGenerar unas serie de recomendaciones sobre diagnóstico, seguimiento y tratamiento de Chagas congénito y orientación a mujeres con Chagas en edad fértil en Colombia.
Preguntas clínicas cubiertas por el consenso- -
¿Cuál es la prevalencia de infección por T. cruzi en gestantes en Colombia?
- -
¿Cuál es el riesgo de transmisión congénita de T. cruzi?
- -
¿Cuáles son las pruebas y procedimientos más adecuados para diagnóstico de infección por T. cruzi en gestantes y en recién nacidos?
- -
¿Cuáles son los medicamentos recomendados para tratamiento etiológico de enfermedad de Chagas en recién nacidos y lactantes?
- -
¿Cuáles son las recomendaciones básicas de tratamiento etiológico de enfermedad de Chagas para mujeres en edad fértil con diagnóstico confirmado?
- -
¿Cuáles son las medidas de salud pública complementarias para el abordaje de Chagas congénito?
Mujeres gestantes en Colombia, recién nacidos y mujeres en edad fértil.
Usuarios del consensoServicios médicos, instituciones prestadoras de servicios de salud, grupos de salud pública a nivel municipal, departamental y nacional en el territorio colombiano.
MetodologíaRevisión de la bibliografía y evaluación de la evidenciaSe llevó a cabo la búsqueda de literatura concerniente a epidemiología, transmisión, diagnóstico, tratamiento y estrategias de salud pública alrededor de la transmisión vertical de T. cruzi y el Chagas congénito desde 1980 hasta abril de 2013. Se diseñaron los siguientes algoritmos dentro de la base de información Medline: ([«Chagas Disease/congenital»{Mesh}]); («Chagas disease/congenital»[Mesh]) AND «prevention and control» (Subheading); («Chagas disease/congenital»[Mesh]) AND «Diagnosis»(Mesh) OR ([«Chagas disease/congenital»{Mesh}] AND «Chagas disease/diagnosis»[Mesh]); («Chagas disease/congenital»[Mesh]) AND «Therapeutics»[Mesh] OR ([«Chagas disease/congenital»{Mesh}] AND «Chagas disease/therapy»[Mesh]) y («Pregnancy»[Mesh]) AND «Chagas disease»[Mesh] NOT ([«Chagas disease/congenital»{Mesh}]). También se incluyó literatura aportada por los expertos y proveniente de búsquedas secundarias a partir de otros consensos publicados sobre el mismo tema. La bibliografía se seleccionó mediante lectura de resúmenes, posteriormente a lo cual se procedió a evaluar la publicación en texto completo. Las publicaciones con información duplicada fueron eliminadas del registro para análisis. Cuando la información de un mismo artículo era relevante para más de un tema, esta era incluida en varias búsquedas. La extracción de datos a partir de los artículos se hizo mediante tablas de evidencia, verificando los datos y las proporciones reportadas y, en algunos casos, las proporciones se calcularon a partir de los datos suministrados en el texto de los artículos. La evaluación de cada publicación se realizó mediante la metodología de reporte de estudios observacionales para evaluación de la evidencia (STrengthening the Reporting of OBservational studies in Epidemiology [STROBE]).
Desarrollo de consenso de expertos basado en metodología DelphiLa inclusión de expertos se basó en las recomendaciones descritas por McGinis et al.3. Se organizaron paneles de 3 expertos por tema para cada uno de los aspectos relacionados con la toma de decisiones para la identificación y manejo de Chagas congénito en las áreas de: ginecología, pediatría, infectología o salud pública, entidades promotoras de salud, así como representantes del Ministerio de Salud y las secretarías de salud departamentales. Adicionalmente, 2 expertos internacionales en el tema específico de Chagas congénito participaron del consenso.
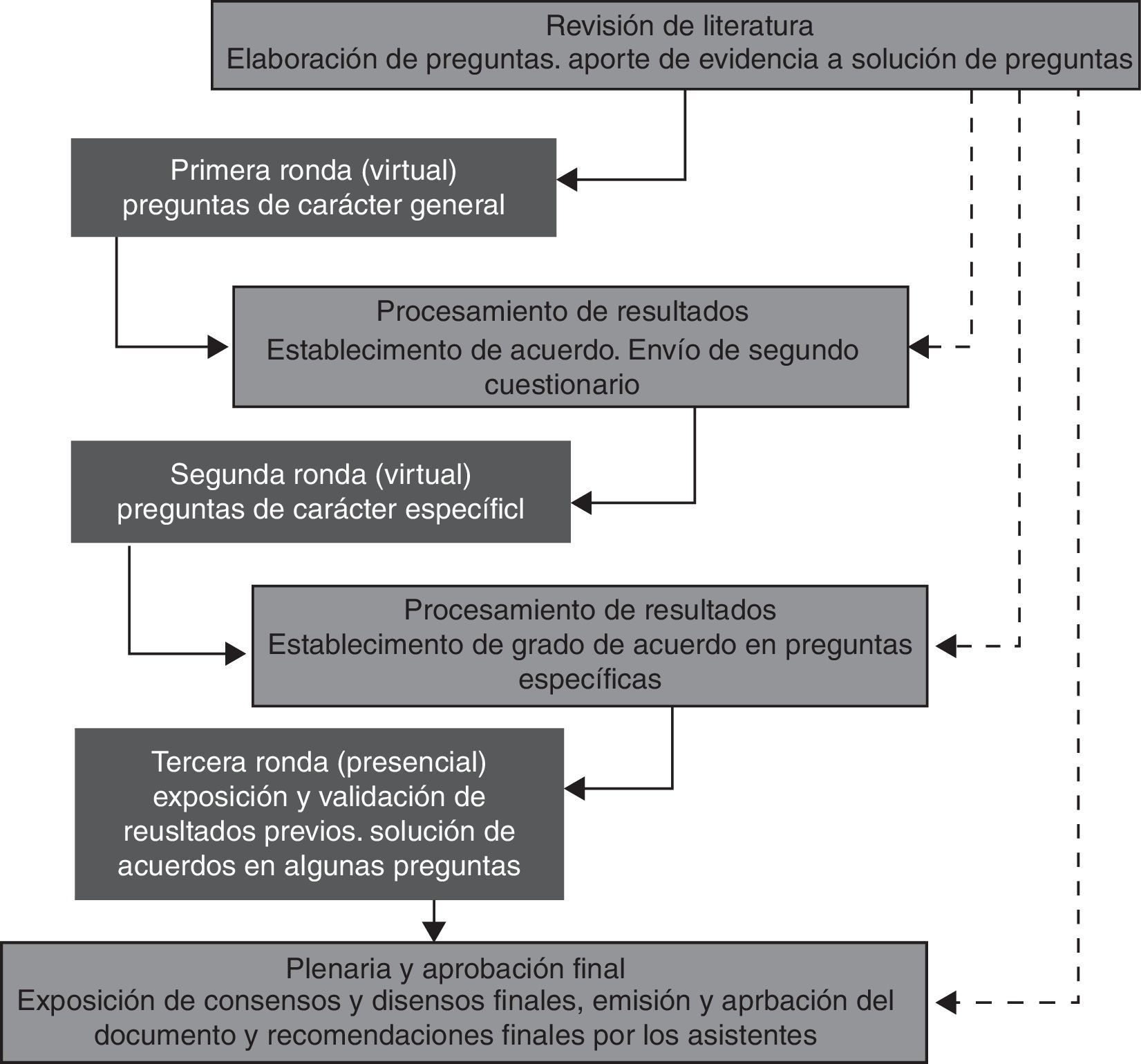
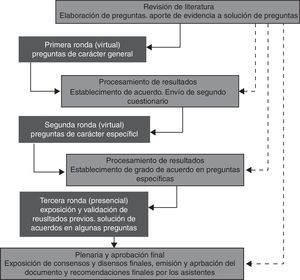
La participación de los consultados se dio en 3 rondas, siendo las 2 primeras virtuales y la última presencial. Estas se llevaron a cabo desde diciembre de 2012 hasta mayo de 2013. Los cuestionarios se enviaron mediante correo electrónico con copia de carbón oculta y recordatorios para el diligenciamiento. Durante todas las rondas se presentó a los participantes un texto con la mejor evidencia disponible para cada tema, acompañado de preguntas conducentes a la toma de decisiones con el paciente. Durante la primera ronda, se preguntó por aspectos generales relacionados con epidemiología, diagnóstico y orientación clínica para niños, gestantes y mujeres en edad fértil con enfermedad de Chagas mediante un cuestionario de 15 preguntas. Durante la segunda ronda, se presentaron los resultados de la primera ronda y se agregó evidencia para preguntas en las cuales no hubo consenso en la primera ronda; adicionalmente, se incluyeron 10 preguntas más específicas. Durante la tercera ronda, de forma presencial, se presentaron resultados consolidados de las rondas anteriores, se resolvieron los disensos basados en los puntos de vista de los expertos de cada área y se aprobó la versión final del documento. Durante todo el proceso los participantes podían sugerir agregar otros estudios a las búsquedas (fig. 1).
Análisis de los datos del consensoDado que los cuestionarios en algunos casos se basaron en preguntas abiertas, las respuestas se analizaron cualitativamente, organizándose grupos de respuestas similares sobre el total para establecer el porcentaje de acuerdo. Se consideró como consenso a partir de un porcentaje de acuerdo del 60%, más la validación de las respuestas durante la tercera ronda. En los casos en que el acuerdo estuvo por debajo del 60%, se formuló una nueva pregunta concerniente al mismo tema en la siguiente ronda y, si no se logró consenso, se registró como ausencia de acuerdo (tabla 1).
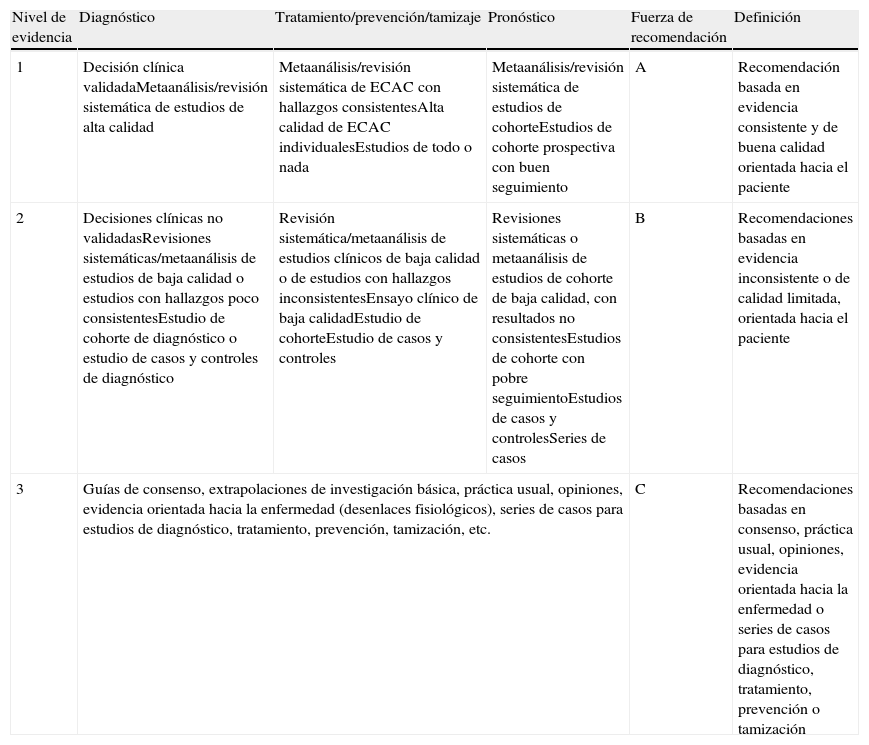
Clasificación de la evidencia y elaboración de las recomendacionesEl nivel de evidencia y los grados de recomendación fueron calificados y catalogados según la escala Strength of Recommendation Taxonomy (SORT). Así, la calidad de la evidencia se clasificó en 3 niveles: buena, limitada y otra. De forma similar, las recomendaciones se clasificaron en 3 categorías según la calidad de la evidencia y el grado de consenso (tabla 2).
Clasificación de la calidad de la evidencia y grado de recomendación aportada por los estudios, según SORT
| Nivel de evidencia | Diagnóstico | Tratamiento/prevención/tamizaje | Pronóstico | Fuerza de recomendación | Definición |
| 1 | Decisión clínica validadaMetaanálisis/revisión sistemática de estudios de alta calidad | Metaanálisis/revisión sistemática de ECAC con hallazgos consistentesAlta calidad de ECAC individualesEstudios de todo o nada | Metaanálisis/revisión sistemática de estudios de cohorteEstudios de cohorte prospectiva con buen seguimiento | A | Recomendación basada en evidencia consistente y de buena calidad orientada hacia el paciente |
| 2 | Decisiones clínicas no validadasRevisiones sistemáticas/metaanálisis de estudios de baja calidad o estudios con hallazgos poco consistentesEstudio de cohorte de diagnóstico o estudio de casos y controles de diagnóstico | Revisión sistemática/metaanálisis de estudios clínicos de baja calidad o de estudios con hallazgos inconsistentesEnsayo clínico de baja calidadEstudio de cohorteEstudio de casos y controles | Revisiones sistemáticas o metaanálisis de estudios de cohorte de baja calidad, con resultados no consistentesEstudios de cohorte con pobre seguimientoEstudios de casos y controlesSeries de casos | B | Recomendaciones basadas en evidencia inconsistente o de calidad limitada, orientada hacia el paciente |
| 3 | Guías de consenso, extrapolaciones de investigación básica, práctica usual, opiniones, evidencia orientada hacia la enfermedad (desenlaces fisiológicos), series de casos para estudios de diagnóstico, tratamiento, prevención, tamización, etc. | C | Recomendaciones basadas en consenso, práctica usual, opiniones, evidencia orientada hacia la enfermedad o series de casos para estudios de diagnóstico, tratamiento, prevención o tamización | ||
ECAC: ensayos clínicos controlados aleatorizados.
En total, se encontraron 545 títulos bajo los algoritmos diseñados, la información aportada por los investigadores y la revisión de la literatura gris. Con la lectura de los resúmenes se eligieron 172 textos para lectura del texto completo, de los cuales, finalmente, se incluyeron 81 textos para aportar la evidencia presentada en los cuestionarios de las 3 rondas. Los resultados relevantes de cada aspecto se muestran a continuación:
Sección 1. EpidemiologíaPrevalencia de Chagas en mujeres en edad fértil en ColombiaDe acuerdo con estimaciones de la Organización Panamericana de la Salud, la prevalencia de la enfermedad de Chagas en Colombia es de 437.960 infectados y aproximadamente 107.800 mujeres en edad fértil (15 a 44 años) padecen la enfermedad4. Se carece de datos precisos de prevalencia de infección en mujeres tanto en población general como en zonas donde se considera endémica la enfermedad de Chagas. Una de las posibles razones de este desconocimiento es que durante el control prenatal obligatorio se incluye la tamización para enfermedades como VIH, toxoplasmosis, sífilis y hepatitis B, pero no para enfermedad de Chagas5,6. Dado que se estima que en Colombia en el año 2011 se presentaron 665.499 nacimientos7 y, de acuerdo a las estimaciones de población en riesgo de transmisión (10,5%), se deduce que alrededor de 69.877 de estas gestantes vivían en zonas endémicas.
Dado que no se cuenta con información de prevalencia de Chagas en gestantes en población general, alternativamente se optó por considerar la prevalencia de individuos seropositivos en donantes de bancos de sangre como dato de referencia para tener una aproximación de la magnitud. Sin embargo, también es conocido que la prevalencia es usualmente menor en bancos de sangre8. Esto se explicaría por la selección de pacientes sanos y la estimulación repetitiva de la donación por parte de donantes aptos9. Por ello, teniendo en cuenta que las estimaciones de prevalencia de reactividad para IgG anti-T. cruzi en bancos de sangre varían en diferentes departamentos entre 0,3 y 0,8%4,10, se podría deducir que la prevalencia en gestantes es superior a estas cifras y podría estar cercana al 1%.
Prevalencia de enfermedad de Chagas en gestantes en población endémicaUn estudio reciente determinó que la prevalencia global de infección por T. cruzi en gestantes de 5 departamentos endémicos fue 2,7%, siendo para cada departamento la siguiente: Casanare: 4,0%; Santander: 3,3%; Boyacá: 3,2%; Arauca: 2,1% y Meta: 0,2%, mientras que el rango entre los 63 municipios participantes osciló entre 0,0 y 20,2%11. Adicionalmente, un estudio realizado en 2 municipios endémicos de Boyacá durante 2006 y 2007 arrojó como prevalencias para Miraflores 4,0% y para Moniquirá 2,8%12. En conclusión, teniendo en cuenta los pocos datos locales se podría estimar que la prevalencia de infección por T. cruzi en gestantes de departamentos endémicos de Colombia aproximadamente oscila entre 2 y 4%, mientras que en algunos municipios puntuales puede llegar al 20%.
Magnitud de la enfermedad de Chagas congénitaSe tiene evidencia confirmada de transmisión congénita de T. cruzi en al menos 9 casos en Colombia. Seis de estos fueron diagnosticados mediante hemocultivo en el marco de un estudio en zona endémica de Boyacá12,13; otros 2 casos fueron diagnosticados en el departamento de Santander; y un caso de un recién nacido en forma prematura (28 semanas), en el departamento de Caldas, quien fue diagnosticado por gota gruesa 8 días después del nacimiento y falleció a consecuencia de la infección antes de alcanzar a recibir tratamiento etiológico. Por otra parte, en brotes de Chagas agudo, se han informado 2 casos en embarazadas: uno ocurrió con menos de 20 semanas de gestación y desencadenó un aborto y el otro caso ocurrió en Villanueva Bolívar, en una gestante de 32 semanas, ocasionando la muerte de madre e hijo14.
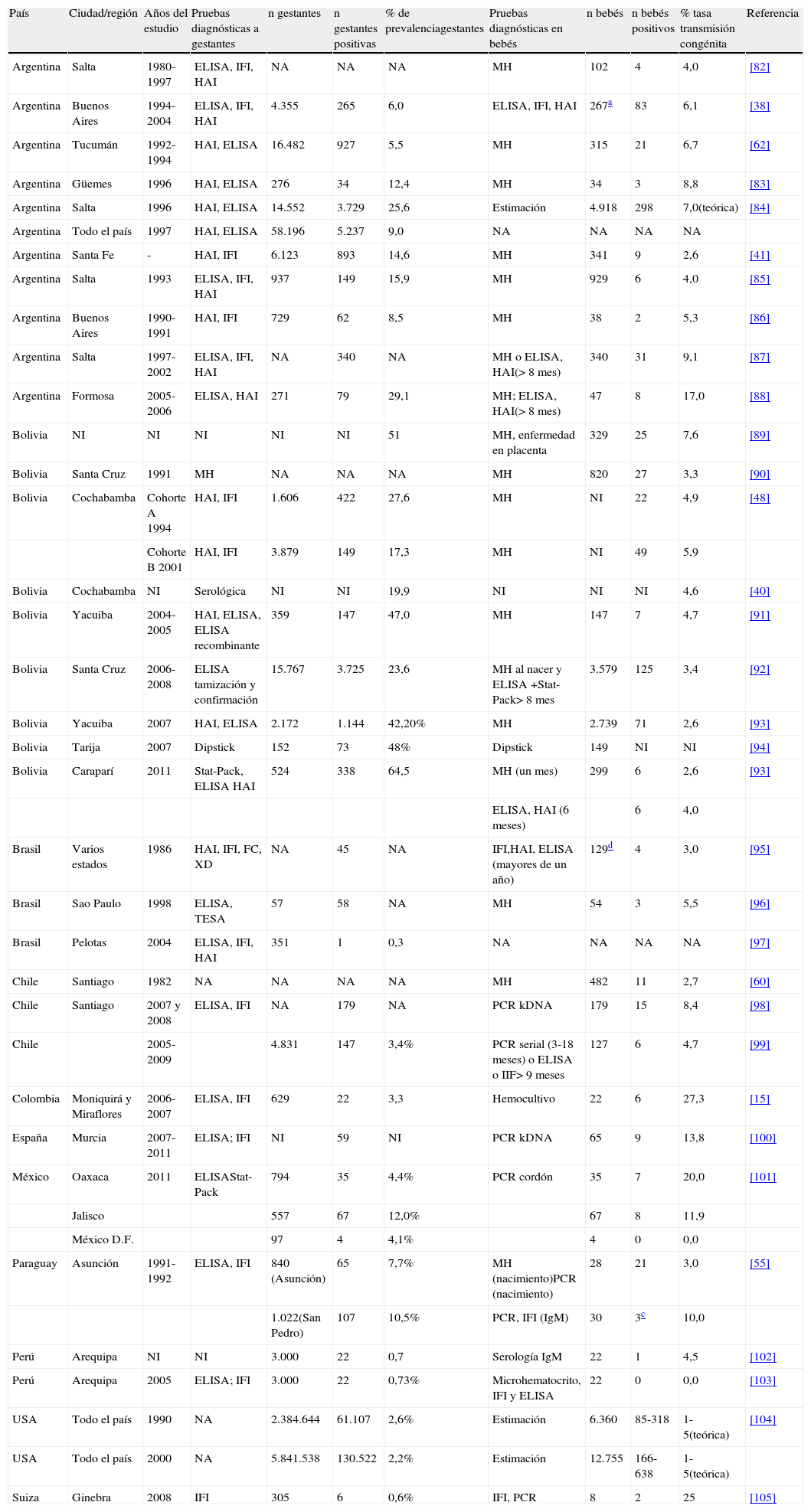
En términos poblacionales, la Organización Panamericana de la Salud estima que la incidencia anual de casos de Chagas congénito en Colombia es de 0,104 y ocasiona un promedio de 1.000 casos por año4. Sin embargo, solo hay en la literatura 2 estudios dirigidos a estimar la magnitud del problema. El primero de estos fue desarrollado en una zona endémica del departamento de Boyacá, con una frecuencia de transmisión de 27,3% (6/22) por hemocultivo, la cual ha sido una de las frecuencias más altas informadas en la literatura15. En contraste, el segundo estudio, según sus resultados preliminares, ha seguido a 114 hijos de madres seropositivas en zonas endémicas, desde su nacimiento y cada 3 meses hasta los 12 meses de edad, y hasta ahora no ha evidenciado la presencia de casos por métodos parasitológicos o serológicos11. Así, aunque en Colombia hay evidencia de la ocurrencia de transmisión congénita de T. cruzi, se considera que se requieren más estudios y búsqueda de literatura gris para establecer la magnitud del problema en el país. Por ahora en los únicos 2 estudios disponibles para Colombia, la frecuencia de transmisión de T. cruzi por vía congénita oscila entre 0 y 27,3%. En la tabla 3, se resumen las estimaciones de tasas de transmisión de Chagas congénito a partir de los datos de Colombia y otros países.
Prevalencia de Chagas en gestantes y tasas de transmisión de Trypanosoma cruzi a recién nacidos
| País | Ciudad/región | Años del estudio | Pruebas diagnósticas a gestantes | n gestantes | n gestantes positivas | % de prevalenciagestantes | Pruebas diagnósticas en bebés | n bebés | n bebés positivos | % tasa transmisión congénita | Referencia |
| Argentina | Salta | 1980-1997 | ELISA, IFI, HAI | NA | NA | NA | MH | 102 | 4 | 4,0 | [82] |
| Argentina | Buenos Aires | 1994-2004 | ELISA, IFI, HAI | 4.355 | 265 | 6,0 | ELISA, IFI, HAI | 267a | 83 | 6,1 | [38] |
| Argentina | Tucumán | 1992-1994 | HAI, ELISA | 16.482 | 927 | 5,5 | MH | 315 | 21 | 6,7 | [62] |
| Argentina | Güemes | 1996 | HAI, ELISA | 276 | 34 | 12,4 | MH | 34 | 3 | 8,8 | [83] |
| Argentina | Salta | 1996 | HAI, ELISA | 14.552 | 3.729 | 25,6 | Estimación | 4.918 | 298 | 7,0(teórica) | [84] |
| Argentina | Todo el país | 1997 | HAI, ELISA | 58.196 | 5.237 | 9,0 | NA | NA | NA | NA | |
| Argentina | Santa Fe | - | HAI, IFI | 6.123 | 893 | 14,6 | MH | 341 | 9 | 2,6 | [41] |
| Argentina | Salta | 1993 | ELISA, IFI, HAI | 937 | 149 | 15,9 | MH | 929 | 6 | 4,0 | [85] |
| Argentina | Buenos Aires | 1990-1991 | HAI, IFI | 729 | 62 | 8,5 | MH | 38 | 2 | 5,3 | [86] |
| Argentina | Salta | 1997-2002 | ELISA, IFI, HAI | NA | 340 | NA | MH o ELISA, HAI(> 8 mes) | 340 | 31 | 9,1 | [87] |
| Argentina | Formosa | 2005-2006 | ELISA, HAI | 271 | 79 | 29,1 | MH; ELISA, HAI(> 8 mes) | 47 | 8 | 17,0 | [88] |
| Bolivia | NI | NI | NI | NI | NI | 51 | MH, enfermedad en placenta | 329 | 25 | 7,6 | [89] |
| Bolivia | Santa Cruz | 1991 | MH | NA | NA | NA | MH | 820 | 27 | 3,3 | [90] |
| Bolivia | Cochabamba | Cohorte A 1994 | HAI, IFI | 1.606 | 422 | 27,6 | MH | NI | 22 | 4,9 | [48] |
| Cohorte B 2001 | HAI, IFI | 3.879 | 149 | 17,3 | MH | NI | 49 | 5,9 | |||
| Bolivia | Cochabamba | NI | Serológica | NI | NI | 19,9 | NI | NI | NI | 4,6 | [40] |
| Bolivia | Yacuiba | 2004-2005 | HAI, ELISA, ELISA recombinante | 359 | 147 | 47,0 | MH | 147 | 7 | 4,7 | [91] |
| Bolivia | Santa Cruz | 2006-2008 | ELISA tamización y confirmación | 15.767 | 3.725 | 23,6 | MH al nacer y ELISA +Stat-Pack> 8 mes | 3.579 | 125 | 3,4 | [92] |
| Bolivia | Yacuiba | 2007 | HAI, ELISA | 2.172 | 1.144 | 42,20% | MH | 2.739 | 71 | 2,6 | [93] |
| Bolivia | Tarija | 2007 | Dipstick | 152 | 73 | 48% | Dipstick | 149 | NI | NI | [94] |
| Bolivia | Caraparí | 2011 | Stat-Pack, ELISA HAI | 524 | 338 | 64,5 | MH (un mes) | 299 | 6 | 2,6 | [93] |
| ELISA, HAI (6 meses) | 6 | 4,0 | |||||||||
| Brasil | Varios estados | 1986 | HAI, IFI, FC, XD | NA | 45 | NA | IFI,HAI, ELISA (mayores de un año) | 129d | 4 | 3,0 | [95] |
| Brasil | Sao Paulo | 1998 | ELISA, TESA | 57 | 58 | NA | MH | 54 | 3 | 5,5 | [96] |
| Brasil | Pelotas | 2004 | ELISA, IFI, HAI | 351 | 1 | 0,3 | NA | NA | NA | NA | [97] |
| Chile | Santiago | 1982 | NA | NA | NA | NA | MH | 482 | 11 | 2,7 | [60] |
| Chile | Santiago | 2007 y 2008 | ELISA, IFI | NA | 179 | NA | PCR kDNA | 179 | 15 | 8,4 | [98] |
| Chile | 2005-2009 | 4.831 | 147 | 3,4% | PCR serial (3-18 meses) o ELISA o IIF> 9 meses | 127 | 6 | 4,7 | [99] | ||
| Colombia | Moniquirá y Miraflores | 2006-2007 | ELISA, IFI | 629 | 22 | 3,3 | Hemocultivo | 22 | 6 | 27,3 | [15] |
| España | Murcia | 2007-2011 | ELISA; IFI | NI | 59 | NI | PCR kDNA | 65 | 9 | 13,8 | [100] |
| México | Oaxaca | 2011 | ELISAStat-Pack | 794 | 35 | 4,4% | PCR cordón | 35 | 7 | 20,0 | [101] |
| Jalisco | 557 | 67 | 12,0% | 67 | 8 | 11,9 | |||||
| México D.F. | 97 | 4 | 4,1% | 4 | 0 | 0,0 | |||||
| Paraguay | Asunción | 1991-1992 | ELISA, IFI | 840 (Asunción) | 65 | 7,7% | MH (nacimiento)PCR (nacimiento) | 28 | 21 | 3,0 | [55] |
| 1.022(San Pedro) | 107 | 10,5% | PCR, IFI (IgM) | 30 | 3c | 10,0 | |||||
| Perú | Arequipa | NI | NI | 3.000 | 22 | 0,7 | Serología IgM | 22 | 1 | 4,5 | [102] |
| Perú | Arequipa | 2005 | ELISA; IFI | 3.000 | 22 | 0,73% | Microhematocrito, IFI y ELISA | 22 | 0 | 0,0 | [103] |
| USA | Todo el país | 1990 | NA | 2.384.644 | 61.107 | 2,6% | Estimación | 6.360 | 85-318 | 1-5(teórica) | [104] |
| USA | Todo el país | 2000 | NA | 5.841.538 | 130.522 | 2,2% | Estimación | 12.755 | 166-638 | 1-5(teórica) | |
| Suiza | Ginebra | 2008 | IFI | 305 | 6 | 0,6% | IFI, PCR | 8 | 2 | 25 | [105] |
ELISA: ensayo ligado a enzimas por inmunoabsorción; FC: prueba de fijación del complemento; HAI: hemaglutinación indirecta; HC: hemocultivo; IgM: inmunoglobulina M; IIF (IFI): inmunofluorescencia indirecta; MH: microhematocrito; NA: no aplica; NI: no información; PCR: reacción en cadena de la polimerasa; Stat-Pack: prueba rápida inmunocromatográfica; XD: xenodiagnóstico.
Algunos estudios de costo-efectividad del tamizaje en gestantes de países endémicos como Chile16 y Bolivia17 y de países no endémicos como España2 indican una buena relación de costo-efectividad de la realización de tamizaje y posterior seguimiento de recién nacidos hijos de madres infectadas y a las mismas mujeres, como una medida para reducir la carga de enfermedad tanto en zonas endémicas como no endémicas y en comparación con no realizar el diagnóstico. Adicionalmente, en otros países se han sugerido estrategias de búsqueda activa de casos en gestantes puerta a puerta en zonas rurales de difícil acceso para mejorar la cobertura del diagnóstico18. Resultados preliminares de un estudio en Colombia muestran que la inclusión de un programa de vigilancia de Chagas congénito es una estrategia costo-efectiva, siendo más costo-efectivo en zonas endémicas19.
Recomendación 1: Aunque no existen datos precisos de la magnitud de la enfermedad de Chagas en mujeres en gestantes y recién nacidos en Colombia, las estimaciones permiten concluir que la magnitud es potencialmente suficiente para considerar la inclusión del tamizaje para infección por T. cruzi en mujeres durante la gestación como parte del conjunto de pruebas durante el control prenatal. Esta estrategia resultaría potencialmente más costo-efectiva en zonas donde la enfermedad es considerada endémica. Se recomienda el tamizaje para gestantes que hayan sido residentes en áreas endémicas reconocidas o con factores de riesgo en cualquier momento de la vida. Los factores de riesgo más ampliamente reconocidos son: conocimiento del vector «pito», vivienda con piso de tierra, techo de palma o pared de bahareque ubicada a menos de 2.000 m sobre el nivel del mar, y tener familiares con diagnóstico de enfermedad de Chagas. (Consenso perfecto). Nivel de evidencia 3. (Grado de recomendación B).
En cuanto a las pruebas diagnósticas para la enfermedad de Chagas en fase crónica, se conoce que las más adecuadas son las pruebas serológicas como el ensayo inmunoenzimático (ELISA) y la inmunofluorescencia indirecta (IFI). La sensibilidad reportada para la prueba de ELISA es de 97 a 100%, mientras su especificidad es de 96,3 a 100%20–22. Respecto a la prueba de IFI, se estima que tiene sensibilidad de 93,3 a 100% y especificidad de 99 a 100%21,23. Estos resultados son similares a los informados en Colombia tanto a partir de muestras de suero como de papel de filtro24. Adicionalmente, un estudio reciente en Colombia comparó la reproducibilidad intraprueba de las serologías para identificación de infección por T. cruzi en gestantes (ELISA, IFI y hemaglutinación indirecta-HAI en suero y ELISA en papel de filtro). Este estudio concluyó que la reproducibilidad del ELISA en suero fue de 0,98, superior a la reproducibilidad de las demás pruebas serológicas y muy por encima de la reproducibilidad del ELISA en papel de filtro, que fue de 0,5525.
Recomendación 2: Se recomienda utilizar la prueba ELISA en suero para el tamizaje serológico en gestantes. Ante un caso reactivo se debe realizar confirmación mediante otra prueba serológica convencional, de diferente principio o con diferente antígeno, como IFI o HAI, que haya sido previamente validada en Colombia. (Buen consenso). Nivel de evidencia 1. (Grado de recomendación A).
Por otra parte, algunos investigadores han evaluado la utilidad de pruebas rápidas por inmunocromatografía para el tamizaje de Chagas en fase crónica con buenos resultados tanto en sensibilidad como en especificidad en población general, con valores superiores al 95%26–30. En Colombia, solo existe un reporte de evaluación de la prueba Stat-Pack en población de 5 a 18 años del departamento de Casanare, en donde se evidenció una sensibilidad de 85,4% y especificidad de 98%, al comparar con pruebas serológicas convencionales, y de 46,7% comparada con ELISA en papel de filtro, mostrando una menor sensibilidad con relación a los estudios anteriormente mencionados31. Por su parte, un estudio en población de gestantes de Argentina, Bolivia, Honduras y México, a partir de muestras de sangre de cordón umbilical, encontró que la prueba rápida presentó en promedio sensibilidad y especificidad de 94,6 y 99,0%, respectivamente, sugiriendo el uso de esta prueba como una alternativa de tamizaje durante el parto32. Finalmente, algunos estudios evidencian que la sensibilidad de las pruebas rápidas podría afectarse por el uso de muestras de sangre completa, ya que los valores de sensibilidad aumentan cuando se analizan muestras de suero33,34. Aunque se identifican limitaciones en términos de reproducibilidad en ciertas regiones, las pruebas rápidas podrían ser útiles en situaciones especiales en que no haya otra alternativa, al permitir tomar decisiones rápidas.
Recomendación 3. En casos en que la gestante se encuentre en trabajo de parto y no se cuente con un resultado previo de serología convencional para anticuerpos anti-T. cruzi, una alternativa es el uso de prueba rápida para Chagas al ingreso al trabajo de parto. Dado que la prueba rápida podría tener una baja sensibilidad, en caso de tener un resultado negativo y existir factores de riego, debe tomarse la prueba de suero. Un resultado positivo en la prueba rápida inducirá la conducta inmediata de evaluación del recién nacido, pero igualmente habrá que hacer pruebas serológicas confirmatorias a la madre. El uso de pruebas rápidas facilitaría las estrategias de tamizaje, por lo cual se requiere incentivar estudios de validación en el contexto nacional y especialmente rural. (Buen consenso). Nivel de evidencia 2. (Grado de recomendación B).
Microhematocrito recién nacido. Este método parasitológico de concentración de sangre a partir de capilares permite la identificación microscópica de T. cruzi en movimiento, mediante la lectura de la fase leucocitaria en el portaobjetos, procedimiento que incluye la rotura del capilar. Su principal ventaja es que puede ser realizada en primer nivel y requiere un bajo volumen de sangre, lo cual es ideal en recién nacidos35. En estudios clásicos se estima que la sensibilidad de esta prueba varía entre 80 y 90%36. Posteriormente, en Bolivia se introdujo el denominado microhematocrito modificado, que consiste en la visualización directa del capilar sin requerir su rotura, generando mejores condiciones de bioseguridad en el procedimiento y permitiendo adicionalmente estimar la carga parasitaria37. La cuantificación de la carga ha permitido determinar una relación directa del nivel de parasitemia, detectado por microhematocrito modificado, con la severidad y letalidad del Chagas congénito. Existe una última modificación a este método denominada micrométodo en «Eppendorf», que consiste en tomar la muestra en viales plásticos cónicos («Eppendorf») de 1,5ml, en lugar de capilares. Esta prueba ha evidenciado unas excelentes características operativas en comparación con el xenodiagnóstico en Argentina38. Estas 3 técnicas de concentración (microhematocrito, microhematocrito modificado y micrométodo en «Eppendorf») han sido ampliamente recomendadas a nivel internacional, como prueba rutinaria para diagnóstico de Chagas congénito en los primeros meses de vida39. Estas pruebas pueden ser realizadas a partir de sangre de cordón o sangre periférica, teniendo mejor desempeño en los primeros meses de vida del niño y aumentando la posibilidad de detección con la repetición de la prueba y con un entrenamiento óptimo del lector40. En Colombia, se ha utilizado este método para el diagnóstico de Chagas agudo en zonas endémicas y con fines de investigación para Chagas congénito, en centros de referencia.
Recomendación 4. Se recomienda realizar pruebas parasitológicas de concentración (microhematocrito y microhematocrito modificado y micrométodo en «Eppendorf») para el diagnóstico de infección congénita por T. cruzi en el recién nacido y en los primeros meses de vida. (Excelente consenso). Nivel de evidencia 2. (Grado de recomendación B).
Recomendación 5. Dado que el rendimiento de las pruebas de concentración depende en gran medida de la habilidad del operador, se recomienda entrenar al personal de los servicios de salud para su adecuada realización, especialmente en instituciones donde se realiza atención de parto. (Muy buen consenso). Nivel de evidencia 2. (Grado de recomendación B).
Pruebas serológicas en lactantes. Se conoce que las pruebas serológicas para detección de IgG anti-T. cruzi son útiles para el diagnóstico de Chagas congénito solo después de que ha transcurrido el tiempo suficiente para que se hayan eliminado los anticuerpos IgG de transferencia pasiva de la madre, de forma que los anticuerpos detectados correspondan realmente al bebé39. El tiempo de espera reportado para la eliminación de los anticuerpos IgG maternos varía de acuerdo con diferentes investigaciones. Mientras un estudio en Santa Fe, Argentina, evidenció eliminación de los anticuerpos maternos a los 6 meses41, otros investigadores han propuesto un umbral de 839,42 o 9 meses43,44 para la realización de dichas pruebas. Por último, hay algunas propuestas de realizar las pruebas serológicas al mes 12 de edad, dada la coincidencia con la fecha de aplicación de vacunas y otras intervenciones de salud pública45. Alternativamente, el antígeno Shed Acute Phase Antigen (SAPA), expresado principalmente en la fase aguda de la enfermedad, ha sido propuesto para el diagnóstico en lactantes a partir de los 3 meses de edad. Esto debido a que los anticuerpos específicos de clase IgG anti-SAPA, transferidos de la madre al bebé de forma transplacentaria se eliminan del bebé entre los 30 y los 90 días de vida44. Diferentes trabajos realizados usando el antígeno SAPA en una prueba ELISA mostraron su potencial en el diagnóstico de la infección congénita44,46–49. Una limitación para el uso de esta prueba es la poca disponibilidad del antígeno para su realización.
Recomendación 6. Se recomienda que en situaciones en que las pruebas parasitológicas iniciales sean negativas, la determinación de infección congénita por medio de pruebas serológicas convencionales IgG anti-T. cruzi se haga a partir de los 8 meses de vida. Toda prueba negativa en ese momento descarta la transmisión congénita. Toda prueba positiva a los 8 meses deberá ser confirmada después de los 10 meses de vida mediante 2 pruebas serológicas con principios diferentes. (Muy buen consenso). Nivel de evidencia 2. (Grado de recomendación B).
PCR: En un estudio colombiano, la prueba de reacción en cadena de la polimerasa (PCR) presentó sensibilidad de 88,8% y especificidad de 92,5% para enfermedad de Chagas crónica en una población adulta50. Adicionalmente, otros estudios en Colombia han mostrado sensibilidad de 80% y especificidad de 100% en pacientes adultos51, recomendándose en general la toma de muestras seriadas en momentos diferentes para aumentar la posibilidad de detectar parásitos en la muestra52. Sin embargo, no existen estudios locales que permitan tener estas estimaciones del uso de esta prueba para diagnóstico de Chagas congénito en Colombia. Por otra parte, publicaciones internacionales evidencian que la PCR podría tener un gran valor diagnóstico de la infección congénita y, especialmente, la PCR en tiempo real (qPCR) por sus atributos de: sensibilidad superior a la de pruebas parasitológicas, detección precoz de la infección congénita, resultado cuantitativo (carga parasitaria) e información de interés epidemiológico como la determinación de linajes del parásito53–56. Sin embargo, en los últimos años se ha informado que el ADN de T. cruzi puede ser transferido de forma transplacentaria, pudiendo circular durante un tiempo en el bebé sin que signifique infección y sugiriendo que el uso de la prueba PCR sea después de los 3 meses de edad para evitar falsos positivos57. A pesar de las potenciales bondades de la prueba, se debe tener en cuenta que esta requiere de una infraestructura especializada y que aún se encuentra en proceso de estandarización y validación en los distintos laboratorios de los países endémicos58,59. Por ello, la PCR aún no es recomendada como método rutinario de diagnóstico33,39.
Recomendación 7. La prueba de reacción en cadena de la polimerasa (PCR) ha mostrado su potencialidad para la detección de infección congénita de T. cruzi. Sin embargo, es una prueba que requiere de mayor infraestructura de laboratorio que las pruebas convencionales y adicionalmente necesita ser validada específicamente en la población de recién nacidos. Teniendo en cuenta esto, aún no se recomienda incorporar esta prueba en el diagnóstico rutinario hasta alcanzar los criterios antes mencionados. (Buen consenso). Nivel de evidencia 2. (Grado de recomendación B).
Entre el 60 y el 90% de los casos con enfermedad de Chagas congénita pueden ser asintomáticos. La forma sintomática puede ser precoz, si aparece en los primeros 30 días de vida, o tardía, si aparece después de este período36. No hay un cuadro clínico patognomónico, pero algunos autores han reportado que clínicamente las formas más graves de la enfermedad no difieren mucho de infecciones del grupo TORCH (toxoplasmosis, rubeola, citomegalovirus, herpes y otras), teniendo signos que comúnmente acompañan a estas infecciones, tales como bajo peso al nacer, prematuridad, edema generalizado, hepatoesplenomegalia, distrés respiratorio y algunos casos más graves de hidrops fetalis y muerte37,60. Respecto a la asociación de prematuridad con infección congénita hay evidencias divergentes, pues mientras algunos autores han reportado disminución en la edad gestacional de los neonatos infectados respecto a los sanos61, hay otros investigadores que no encuentran ninguna diferencia respecto a la edad al nacer entre los hijos de madres infectadas y de no infectadas48. La hepatomegalia y la esplenomegalia se encuentran entre los signos más comúnmente reportados en casos congénitos48,60,62 y hay signos reportados con baja frecuencia, como anasarca, petequias, miocarditis y meningoencefalitis60,62,63. Aunque la ocurrencia de los síntomas y signos no suele llegar a porcentajes elevados, la presencia de estos debe alertar al médico tratante sobre la posibilidad de Chagas congénito57.
Recomendación 8. Se recomienda que a recién nacidos con signos clínicos como bajo peso al nacer, prematuridad, distrés respiratorio, hepatomegalia, esplenomegalia, anormalidades neurológicas, cardiomegalia, hidrops fetalis, muerte fetal y con antecedentes epidemiológicos asociados a la infección por T. cruzi les sea descartado el diagnóstico de Chagas congénito, utilizando la técnica adecuada según sea el caso. (Excelente consenso). Nivel de evidencia 2. (Grado de recomendación A).
La eficacia del tratamiento etiológico en niños con infección congénita en el primer año de vida se considera cercana al 100%, habiéndose demostrado la desaparición de la parasitemia y la seronegativización en pocos meses postratamiento. Estos hallazgos han sido publicados consistentemente en estudios realizados en Paraguay55, Argentina53,64–66 y Bolivia40,42,45, entre otros. Por todo esto, el objetivo del tratamiento etiológico en el bebé es claramente la curación, evidenciada por todos los métodos.
Recomendación 9. Se considera que la eficacia del tratamiento tripanocida para niños con Chagas congénito es cercana al 100% antes del primer año de vida y, por lo tanto, se recomienda el tratamiento etiológico de forma temprana en todos los casos. El criterio de curación es la negativización en pruebas parasitológicas y serológicas. (Muy buen consenso). Nivel de evidencia 1. (Grado de recomendación A).
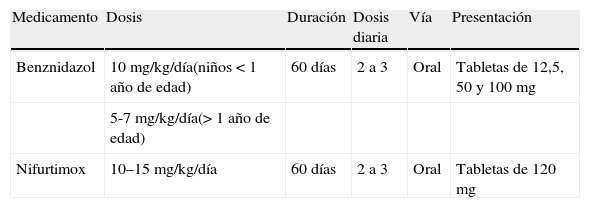
De acuerdo con las recomendaciones internacionales y aunque no existen ensayos clínicos comparativos entre los 2 medicamentos disponibles (benznidazol y nifurtimox), ambos se usan para tratar casos congénitos39. Las dosis recomendadas se especifican en la tabla 4.
Dosificación del tratamiento etiológico para niños con enfermedad de Chagas congénita
| Medicamento | Dosis | Duración | Dosis diaria | Vía | Presentación |
| Benznidazol | 10mg/kg/día(niños<1 año de edad) | 60 días | 2 a 3 | Oral | Tabletas de 12,5, 50 y 100mg |
| 5-7mg/kg/día(> 1 año de edad) | |||||
| Nifurtimox | 10–15mg/kg/día | 60 días | 2 a 3 | Oral | Tabletas de 120mg |
Los objetivos del tratamiento etiológico son: eliminar la infección, reducir la carga parasitaria y disminuir la probabilidad de complicaciones y la muerte67,68. Existe evidencia del efecto positivo del tratamiento etiológico en la eliminación o la diminución de la parasitemia69 y hay alguna evidencia de su efecto en la disminución de morbimortalidad en pacientes adultos tratados con benznidazol en estudios observacionales70–72. Para alcanzar los máximos niveles de evidencia se están desarrollando ensayos clínicos tales como: Tratamiento en Adultos (TRAENA) en Argentina73 y el ensayo clínico Benznidazole Evaluation for Interrupting Trypanosomiasis (BENEFIT) que se desarrolla de forma multicéntrica en 5 países endémicos74. Por su parte, la guía colombiana de tratamiento integral de la enfermedad de Chagas recomienda que el tratamiento etiológico debe ser siempre ofrecido a todos los pacientes menores de 18 años y, a criterio médico, en adultos en fase crónica6. Por lo anterior, el tratamiento etiológico en mujeres en edad fértil está indicado con diferentes niveles de evidencia y fuerza de recomendación, siendo una población con gran potencial de beneficio por ser mayoritariamente jóvenes y asintomáticas. Adicionalmente, existe evidencia creciente del beneficio del tratamiento etiológico en mujeres para prevención de la transmisión congénita en futuros embarazos75. El tratamiento etiológico está claramente contraindicado durante el embarazo. En la fase crónica de la enfermedad, se recomienda aplazar el inicio del tratamiento etiológico durante la lactancia, con el fin de no alterar el vínculo madre-hijo ante eventuales efectos adversos de la medicación en la madre. Cuando se prescribe en mujeres en edad fértil se debe prever la anticoncepción dado que los medicamentos tripanocidas tienen potencial teratogénico.
Recomendación 10. Se recomienda ofrecer tratamiento etiológico con benznidazol o nifurtimox a mujeres en edad fértil. Está contraindicado durante el embarazo y se recomienda aplazar el inicio del tratamiento hasta finalizar la lactancia. En todos los casos, se recomienda realizar anticoncepción en mujeres en edad fértil durante la administración del tratamiento etiológico para Chagas. (Muy buen consenso). Nivel de evidencia 2. (Grado de recomendación B).
El tratamiento etiológico con los tripanocidas disponibles (benznidazol o nifurtimox) puede generar algunos efectos adversos; sin embargo, estos medicamentos son siempre mejor tolerados en población infantil que en adultos76. Los efectos adversos pueden ser bien controlados mediante un manejo sintomático adecuado de los mismos y la posibilidad de un seguimiento médico riguroso permite alcanzar la finalización del tratamiento en más del 85% de los pacientes.
Recomendación 11. Se recomienda que el paciente sea informado con antelación acerca de la posibilidad de efectos adversos del tratamiento etiológico de la enfermedad de Chagas. Así mismo, se recomienda que los pacientes reciban acompañamiento médico constante durante el periodo de tratamiento, con el fin de promover una buena adherencia al tratamiento, así como la finalización del mismo. (Muy buen consenso). Nivel de evidencia 2. (Grado de recomendación B).
La recomendación de estudiar a los familiares de pacientes con Chagas congénito y gestantes con enfermedad de Chagas está ampliamente difundida39,45,67. Dado que la infección congénita se puede presentar en uno o más hijos de gestantes seropositivas, es posible que haya hijos mayores que el neonato con una infección congénita no diagnosticada77. Adicionalmente, en un estudio local en Casanare, Colombia, la prevalencia de enfermedad de Chagas en familiares de gestantes positivas fue de 9,8%78. Otros estudios en Argentina han encontrado que ser hermano de un niño infectado con T. cruzi es un factor de riesgo para poseer la infección, lo que indica que los familiares deberían ser blanco de programas de tamizaje.33.
Recomendación 12. Se recomienda realizar acciones de diagnóstico en el grupo familiar de madres seropositivas (con énfasis en los niños) a fin de confirmar otros posibles casos y garantizarles acceso a tratamiento y seguimiento. (Excelente consenso). (Nivel de evidencia 1). (Grado de recomendación A).
Recomendación 13. Se recomienda la realización de consejería integral en el momento de dar el diagnóstico tanto a la gestante como a su familia, siendo orientados en forma clara en cuanto al tratamiento integral y apoyo en salud mental para minimizar el impacto del diagnóstico. (Excelente consenso). (Nivel de evidencia 3). (Grado de recomendación C).
El control vectorial, además de impactar en la vía de transmisión más importante (vectorial), se constituye en una herramienta indirecta de control del Chagas congénito79 pues reduce la probabilidad de que haya nuevas madres infectadas o que aquellas seropositivas se reinfecten, evitando así que estas sostengan parasitemias que hagan más probable la transmisión madre-hijo80. Algunos estudios en Bolivia han puesto de manifiesto que los hijos de madres provenientes de zonas con mayor exposición a reinfecciones, por presencia vectorial más alta, son más propensos a presentar peores desenlaces en el nacimiento, tales como menor peso al nacer o complicaciones posparto81. Hallazgos similares en Bolivia confirman que existe menos severidad de la enfermedad congénita en ausencia de reinfección de la madre durante el embarazo61.
Recomendación 14. Se recomienda realizar visita domiciliaria para las actividades de control vectorial y vigilancia sostenida, en zonas en donde se encuentran las viviendas de gestantes seropositivas y personas en tratamiento etiológico para enfermedad de Chagas que viven bajo situación de riesgo de transmisión vectorial. (Excelente consenso). Nivel de evidencia 1. (Grado de recomendación A).
Recomendación 15. Dadas las dificultades logísticas para la realización del seguimiento del binomio madre-hijo, así como de su núcleo familiar, se recomienda que los programas de control de enfermedades transmitidas por vectores integren esfuerzos y plataformas con las estrategias ya instauradas como las de salud sexual y reproductiva, comunidades indígenas y programas de atención a la primera infancia. (Excelente consenso). Nivel de evidencia 3. (Grado de recomendación C).
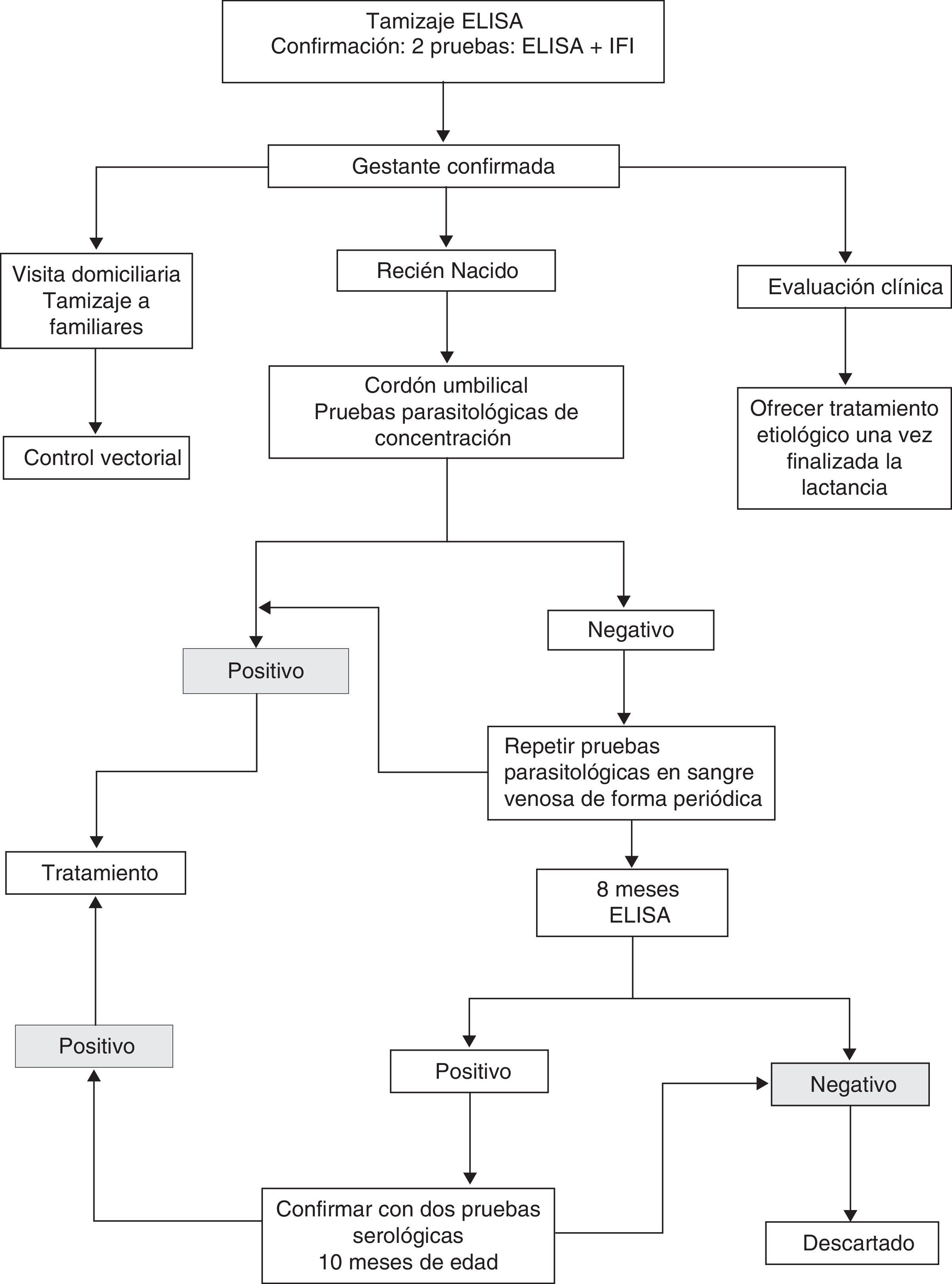
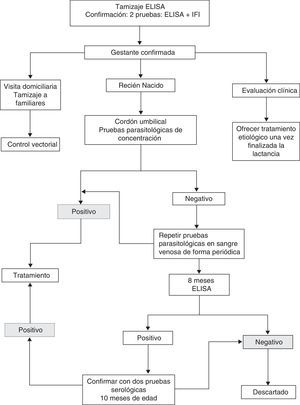
Las recomendaciones del consenso se resumen en la figura 2.
IndicadoresComo indicadores de la aplicación de estas recomendaciones se proponen los siguientes:
- •
% de gestantes con pruebas de tamizaje para infección por T. cruzi
- •
% de gestantes con pruebas confirmatorias para infección por T. cruzi
- •
% de niños de madres seropositivas con pruebas parasitológicas en el primer mes de vida
- •
% de niños de madres seropositivas con pruebas serológicas entre 9 y 12 meses de vida
- •
% de niños con diagnóstico confirmado que reciben tratamiento etiológico
- •
% de mujeres con diagnóstico confirmado que reciben tratamiento etiológico
Se sugiere actualizacion del consenso cada 3 años.
Barreras potenciales de aplicación de las recomendacionesLas barreras potenciales están dadas, en primer lugar, por la aceptación de los profesionales de salud a las recomendaciones. En segundo lugar, por la difusión que tengan las recomendaciones en el territorio nacional. En tercer lugar, por las reformas al sistema de salud que eventualmente modifiquen roles de los actores o que limiten la oportunidad de los procesos.
LimitacionesSe cuenta con poca información con respecto a este tema en Colombia, por cuanto la mayoría de la evidencia presentada proviene de estudios en otros países de Latinoamérica. Aunque el consenso contó con representantes de todos los sectores de la atención, no incluyó pacientes como miembros participantes. Adicionalmente, no se tienen en cuenta las posibles limitaciones de acuerdo a reformas de salud generadas o implementadas con posterioridad a la elaboración del consenso, que modifiquen el itinerario de atención y responsabilidades de los diferentes actores del sistema.
ConclusiónLa metodología de elaboración de este consenso parte de la recopilación y organización de la abundante experiencia internacional, contrastándola con la escasa nacional, para establecer puntos comunes y potenciales aplicaciones en el contexto colombiano. Las recomendaciones se basan en una construcción colectiva de actores de los ámbitos tanto científicos como clínicos y de salud pública, de varios niveles de atención relacionados con la toma de decisiones en este grupo poblacional. Este consenso constituye el primer esfuerzo por generar una herramienta que fundamente la aplicación de prácticas en el sistema sanitario que optimicen la oportunidad del diagnóstico y tratamiento de personas infectadas con T. cruzi, con énfasis en la mujer y el niño. Esfuerzos adicionales por parte de las entidades competentes deberán ser realizados para garantizar la difusión y aplicación de las recomendaciones en el territorio nacional. Finalmente, la actualización del consenso debe darse una vez la evidencia sobre nuevos o mejores procedimientos sea identificada.
Conflictos de interésSe considera que no existe conflicto de interés entre los proponentes y participantes de este consenso.
El Grupo coordinador del consenso forma parte del proyecto Programa Piloto de Vigilancia de Chagas congénito en Colombia, código Colciencias: 1203-459-21581. Este trabajo contó con el apoyo y patrocinio de la Organización Panamericana de la Salud, la Pontificia Universidad Javeriana, el Ministerio de la Protección Social, el Instituto Nacional de Salud y el Programa Red Chagas (cont. Colciencias 080-2011). Especiales agradecimientos a los profesionales convocados y a las instituciones participantes.