Evaluar, en condiciones in vitro, la actividad antibacterial de los extractos de cuerpos grasos y de la hemolinfa de larvas de tercer estadio de Sarconesiopsis magellanica, la cual se comparó con los efectos obtenidos de las mismas sustancias derivadas de Lucilia sericata. S.magellanica (Diptera: Calliphoridae) es una mosca de importancia principalmente forense, utilizada en la determinación del intervalo post mortem. Por sus hábitos necrófagos, es considerada un modelo potencialmente útil en terapia larval.
Material y métodosSe extrajeron los cuerpos grasos de las larvas mediante la técnica de disección corporal y la hemolinfa se obtuvo mediante decapitación y centrifugación de los especímenes larvales. Las bacterias evaluadas fueron Staphylococcus aureus y Pseudomonas aeruginosa. Los métodos utilizados para evaluar la actividad antibacterial fueron difusión en agar y unidades formadoras de colonias (UFC/ml).
ResultadosDespués de la correspondiente incubación, los resultados generales mostraron que la actividad antibacterial de la hemolinfa y de los cuerpos grasos, tanto de L.sericata como de S.magellanica, fueron efectivos contra S.aureus y P.aeruginosa sin diferencias significativas entre las especies de moscas, aunque con algunas diferencias entre las cepas bacterianas.
ConclusionesLos resultados obtenidos sugieren que estas sustancias podrían tener un efecto similar en el tratamiento de heridas infectadas contra los microorganismos evaluados.
This study aimed to evaluate the in vitro antibacterial activity of fat body and hemolymph extracts from Sarconesiopsis magellanica (Diptera: Calliphoridae) third-instar larvae, compared to the effect obtained using the same extracts but derived from Lucilia sericata. S.magellanica blowflies are considered important in forensic sciences due to their usefulness in determining the post mortem interval. This blowfly could be useful in larval therapy due to its necrophagous habits.
Materials and methodsFat body from larvae was removed by dissection, and hemolymph via decapitation and centrifugation of larval specimens. The antibacterial effect was tested against Staphylococcus aureus and Pseudomonas aeruginosa using two methods: agar diffusion and colony forming units (CFU/mL).
ResultsHemolymph and fat body extracts derived from both L.sericata and S.magellanica were effective against S.aureus and P.aeruginosa, with no significant differences between blowfly species, although with some differences between the bacterial strains.
ConclusionsThe results obtained suggest that S.magellanica and L.sericata fat body and hemolymph extracts might have a similar antimicrobial activity against these microorganisms when used to treat infected wounds.
Sarconesiopsis magellanica (Le Guillou, 1842) (Diptera: Calliphoridae) es una especie necrófaga, de importancia principalmente forense, en razón a que es utilizada en la determinación del intervalo post mortem1, y podría también tener utilidad médica, al igual que Lucilia sericata, debido a que sus larvas ocasionan miasis facultativa, sin causar daño en el tejido vivo, lo cual las hace potencialmente útil para terapia larval. Esta mosca ha sido reportada en Suramérica, en países como Bolivia, Chile, Ecuador, Perú, Colombia2 y Argentina3. En Colombia su distribución ha sido registrada en los departamentos de Antioquia, Boyacá, Cundinamarca y Norte de Santander2.
La terapia larval recientemente ha atraído la atención de la comunidad científica y médica especializada, debido a que los métodos convencionales para tratar heridas o úlceras de difícil cicatrización tienen una eficacia limitada4. Además, las bacterias suelen producir con el tiempo cepas resistentes a los antibióticos que aumentan el riesgo de infecciones recurrentes en las heridas. Por lo tanto, la terapia larval se presenta como una alternativa viable, teniendo en cuenta que esta metodología ha demostrado respuesta favorable en el proceso de curación de heridas crónicas. La acción de las larvas sobre las heridas, durante el tratamiento, ocurre mediante 4 mecanismos fisiológicos estrechamente relacionados, los cuales son: desbridamiento del tejido necrótico5, estimulación del tejido de granulación5,6, acción antimicrobiana7–10, inhibición y erradicación de biopelículas11–13.
Algunos estudios han demostrado la efectividad antibacterial mediante evaluación in vitro de ciertas sustancias, principalmente péptidos de bajo peso molecular, presentes en las excreciones y secreciones (ES) larvales, que actúan contra bacterias tales como Staphylococcus aureus, Streptococcus pyogenes, Micrococcus luteus y Pseudomonas aeruginosa14–18. También, recientemente demostramos que las ES larvales de S.magellanica tienen potente actividad antibacterial19.
Por otro lado, la hemolinfa y los cuerpos grasos de L.sericata, así como de otras especies de dípteros, han sido estudiados por el contenido de péptidos antimicrobianos (PAM), antivirales y antifúngicos, que hacen parte del mecanismo de defensa inmune y, por lo tanto, también podrían estimular el tejido de granulación20–22. Los PAM, secretados en la hemolinfa, son sintetizados en los hemocitos y en otros órganos, tejidos y células tales como la región oral, glándulas salivales, túbulos de Malpighi, intestino medio y células pericardiales de las larvas. Sin embargo, estos se producen en una mayor proporción en el cuerpo graso, que es considerado tejido primordial en la síntesis de las moléculas señaladas23. A pesar de los conocimientos anteriores, no hay reportes de trabajos que se hayan efectuado usando extractos de cuerpos grasos y hemolinfa derivados de las larvas de S.magellanica, con la finalidad de evaluar la efectividad que podrían tener estas sustancias contra bacterias Gram-positivas y Gram-negativas.
El objetivo de este trabajo fue evaluar, por primera vez, la actividad antibacterial de los extractos de cuerpos grasos y de la hemolinfa de las larvas de S.magellanica en condiciones in vitro, utilizando S.aureus y P.aeruginosa, la cual se comparó con el efecto antimicrobial de estas mismas sustancias derivadas de L.sericata.
Materiales y métodosObtención y desinfección de larvasEn cada experimento se utilizaron 400 larvas de estadioii de cada una de las especies, S.magellanica y L.sericata, tomadas de colonias previamente establecidas en el Laboratorio de Entomología Medica y Forense de la Universidad del Rosario24,25. Estas larvas se sumergieron en 4ml de soluciones mixtas de las bacterias S.aureus y P.aeruginosa, teniendo en cuenta una proporción de 60 larvas por 4ml de solución bacteriana a una densidad óptica (DO595)=0,5nm durante una exposición de 30min, con el fin de potenciar la respuesta inmune de las larvas26. Bajo estas condiciones, las larvas se retornaron a las colonias respectivas, separadas al interior de recipientes rotulados para evitar confusión y contaminación con otros especímenes, para que pudieran continuar su desarrollo hasta llegar al estadioiii. Posteriormente, estas mismas larvas se desinfectaron mediante lavados con hipoclorito de sodio al 0,5% durante 5min., luego con formaldehido al 0,5% por igual tiempo, y finalmente se lavaron con agua destilada estéril con antibióticos al 1% (estreptomicina y penicilina).
Extracción de cuerpos grasosDoscientas larvas asépticas, usadas en cada experimento, se congelaron ligeramente mediante exposición a nitrógeno líquido por 10s, lo que permitió inmovilizarlas para luego, al quedar inmersas en solución tampón fosfato salino (PBS), efectuar la disección de los cuerpos grasos con ayuda de pinzas finas y alfileres entomológicos. Los cuerpos grasos extraídos se almacenaron en tubos Falcon de 15ml enfriados en hielo; a continuación se homogenizaron en un mortero y el extracto obtenido se centrifugó a 3.900g a 4°C durante 50min. Posteriormente, el sobrenadante se filtró a través de una membrana de 0,22μm de diámetro (33mm MILLEX®) y el producto se almacenó a −20°C para finalmente ser utilizado en la evaluación de la actividad antibacterial14,17.
Extracción de hemolinfaPara cada experimento se tomaron 200 larvas previamente congeladas mediante el procedimiento anterior, se les removió la parte anterior (piezas bucales) y se colectó la hemolinfa sobre una caja Petri que a su vez se mantuvo en frío (gel refrigerante), luego se almacenó en tubos Eppendorf de 2ml colocados sobre hielo e inmediatamente se centrifugó a 4.700g con temperatura de 4°C durante 40min., con la finalidad de separar las células y poder colectar el plasma, que correspondió al sobrenadante transparente, el cual se extrajo con una micropipeta y se filtró a través de una membrana de 0,22μm (33mm MILLEX®), para finalmente almacenar a −20°C.17,21.
Inóculos bacterianosPara la obtención de colonias aisladas, las cepas bacterianas S.aureus (ATCC 29213) y P.aeruginosa (ATCC 27853) fueron sembradas por agotamiento en medio de cultivo agar Muller Hinton (MH) e incubadas toda la noche a 37°C. Posteriormente se tomaron 4 colonias morfológicamente similares y se inocularon en 5ml de caldo Luria Bertani (LB) a 37°C en constante agitación. Se midió la absorbancia a una densidad óptica (DO) de 595nm cada hora durante 14h. Con estos resultados se determinó el tiempo en que las bacterias alcanzaron su fase exponencial, estableciéndose así el período de incubación requerido para la elaboración de los ensayos antibacteriales.
Ensayo de difusión en agarSe obtuvieron 5 colonias aisladas de cada una de las bacterias a ensayar, las cuales previamente fueron sembradas en agar MH e incubadas a 37°C, luego se inocularon en 5ml de caldo LB, seguido de centrifugación a 2.000g durante 20min, y finalmente se resuspendió en PBS. Posteriormente las bacterias, en una concentración de 5×106UFC/ml (DO595=0,2), fueron adicionadas, por separado, al medio tripticasa de soya (TSB) bajo en nutrientes, que consistió en: 0,03% TSB, 1% agarosa y 0,02% Tween, el cual se sirvió en cajas de Petri. Una vez solidificado se realizaron pozos de 4mm de diámetro, donde se adicionaron 10μl de cada una de las sustancias a evaluar a una concentración de 4mg/ml (extractos de cuerpos grasos y hemolinfa), PBS como control negativo, ciprofloxacino al 35% como control positivo y luego se llevaron a incubación a 37°C. Después de una hora, se agregó sobre la superficie una capa de TSB agar de alto nutriente (6% TSB, 0,02% Tween y 1% agarosa). Bajo estas condiciones, de nuevo se volvió a incubar por 18h, y se midieron los diámetros de los halos presentes en los pozos, que fueron expresados en unidades de actividad (UA), cuyos valores se reportaron de acuerdo con la relación establecida previamente por Lozano y Cuca27 de considerar por cada 0,1mm de zona clara, generada por la inhibición del crecimiento bacteriano, la correspondencia de 1UA.
Ensayo unidades formadoras de colonias (UFC/ml)A 20μl de las sustancias a evaluar se les agregaron 2μl de la suspensión bacteriana seleccionada (DO595=0,2), una alícuota de esta dilución fue incubada a 37°C y cada muestra fue tomada a las 0, 2, 4 y 6h, y esparcida en agar MH contenido en cajas Petri, para luego incubar durante 18h a 37°C. Al final se realizaron los conteos manuales de las colonias formadas.
Análisis estadísticosSe realizó la prueba de normalidad por medio del test de Shapiro-Wilk, y con base en los resultados se efectuó la comparación entre múltiples grupos por medio de la prueba Kruskal-Wallis, a continuación se utilizó el test de Tukey, para separar grupos de homogeneidad. También, para complementar los datos de las UFC/ml se realizó un análisis de varianza factorial, usando el programa Statisticx 8.0. Los datos se consideraron estadísticamente significativos cuando el valor de p fue<0,05.
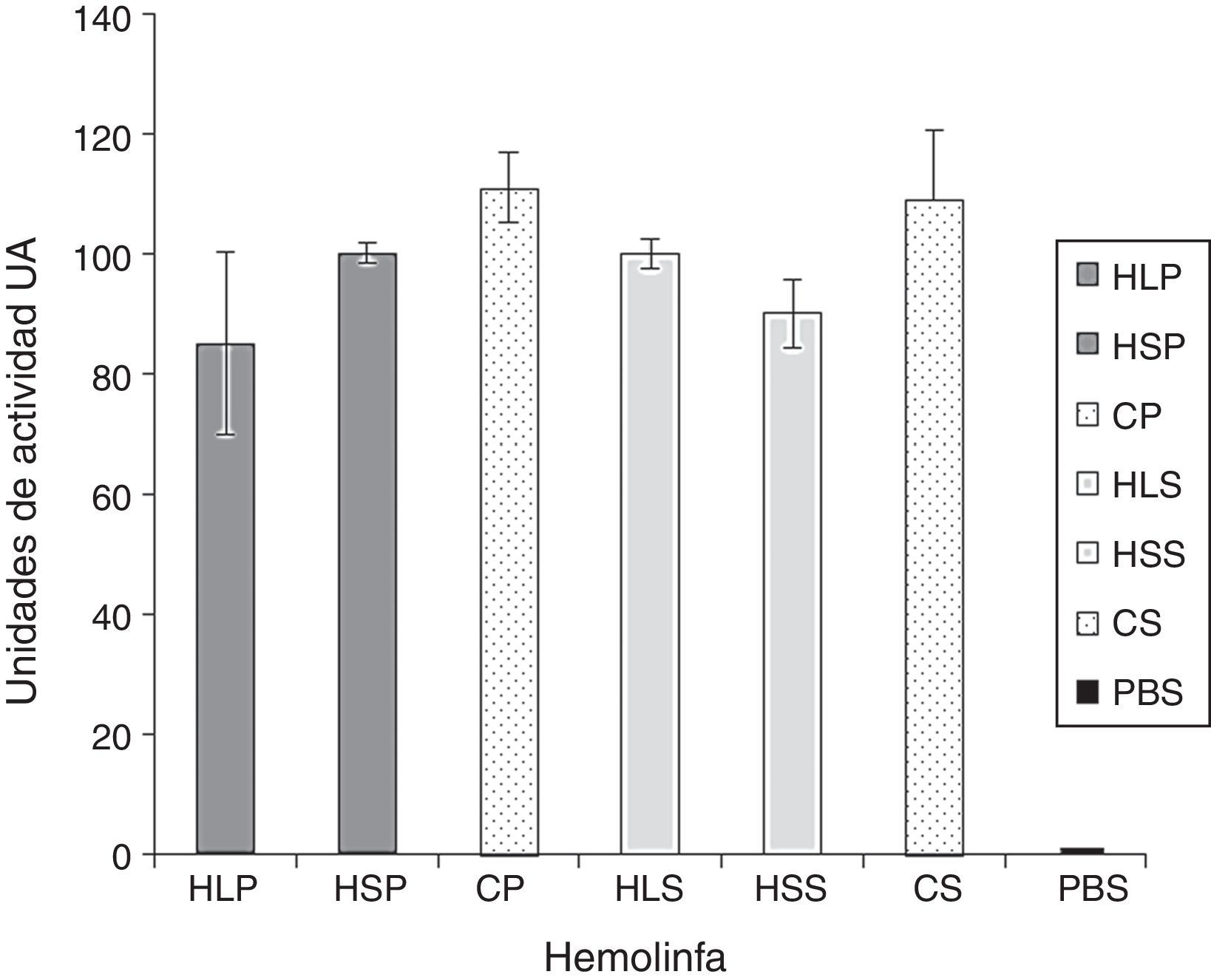
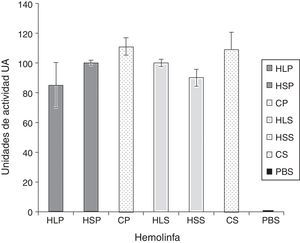
ResultadosDifusión en agarEfecto de la hemolinfa de S.magellanica sobre el crecimiento de P.aeruginosa y S.aureusLa determinación de la actividad antibacterial por medio de difusión en agar mostró halos de inhibición de hemolinfa de S.magellanica contra P.aeruginosa, con diámetros de 10mm (100UA) respecto a 8,5mm (85UA) evidenciados para esta misma sustancia extraída de L.sericata. Por otra parte, la actividad de la hemolinfa contra S.aureus fue de 10mm (100UA) para la hemolinfa derivada de L.sericata y de 9mm (90UA) para la extraída de S.magellanica. La ciprofloxacina, control positivo, registró un valor de 11mm (110UA) contra ambas cepas bacteriana. No hubo halo inhibición (UA=0) con el control negativo (PBS) (fig. 1). Los valores fueron expresados en UA, teniendo en cuenta que 0,1 mm=1UA. En la acción antibacterial de la hemolinfa no hubo diferencias significativas entre las 2 especies de moscas, en relación con las cepas bacterianas tratadas (p=0,8201). Tampoco hubo diferencias al evaluar estas sustancias, individualmente por mosca, contra cada una de las bacterias (p=0,63).
Áreas de inhibición expresadas como unidades de actividad, evaluadas por el método de difusión en agar, generadas a partir de la incubación de Pseudomonas aeruginosa y Staphylococcus aureus, en presencia de los tratamientos con hemolinfa.
CP: ciprofloxacina contra P.aeruginosa; CS: ciprofloxacina contra S.aureus; HLP: hemolinfa de L.sericata contra P.aeruginosa; HLS: hemolinfa de L.sericata contra S.aureus; HSP: hemolinfa de S.magellanica contra P.aeruginosa; HSS: hemolinfa S.magellanica contra S.aureus; PBS: control negativo.
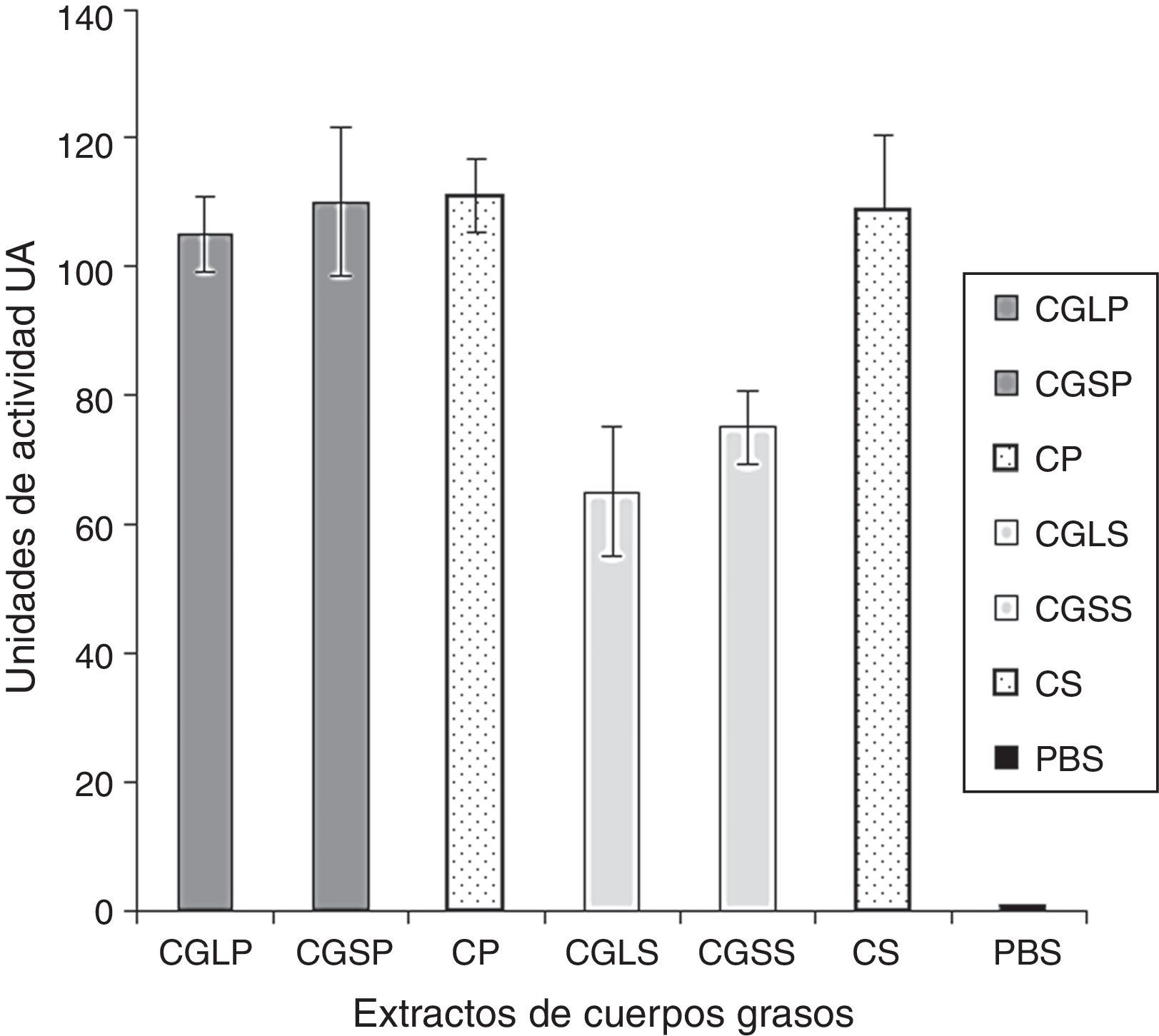
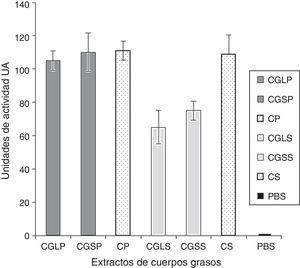
La acción antibacterial de los cuerpos grasos derivadas de cada una de las especies de moscas resultó efectiva contra ambos tipos de bacterias (fig. 2). Sin embargo, esta acción fue diferente entre las bacterias P.aeruginosa y S.aureus, mostrando una mayor acción para las primeras (110UA), en tanto que para S.aureus fue de 75UA; lo anterior se produjo a partir del uso de los extractos de cuerpos grasos de S.magellanica. De forma similar, se encontraron diferencias entre las 2 cepas de bacterias cuando se utilizaron los cuerpos grasos derivados de L.sericata, teniendo un valor para P.aeruginosa de 105UA, mientras que para S.aureus fue de 70UA. Al igual que con la técnica anterior, el control positivo y negativo tuvieron el mismo comportamiento; sin embargo, se registraron diferencias significativas (p=0,03) entre el antibiótico y el valor de los extractos de cuerpos grasos derivados de ambas moscas, al evaluar la acción contra S.aureus. Por otro lado, no hubo diferencias significativas entre la acción de los extractos de cuerpos grasos, derivados de ambas especies de moscas, sobre las bacterias P.aeruginosa y S.aureus (p=0,70). No obstante, cuando se compararon individualmente los efectos de los cuerpos grasos de cada mosca contra las cepas bacterianas hubo diferencias significativas entre ellas (p=0,00), siendo más efectiva la acción sobre la cepa Gram-negativa. Los datos promedios analizados correspondieron a 105UA contra P.aeruginosa vs. 70UA contra S.aureus con los cuerpos grasos de L.sericata, y con estas mismas sustancias extraídas de S.magellanica los valores fueron 110UA contra P.aeruginosa vs. 75UA contra S.aureus.
Áreas de inhibición expresadas como unidades de actividad, evaluadas por el método de difusión en agar, generadas a partir de la incubación de Pseudomonas aeruginosa y Staphylococcus aureus, en presencia de los tratamientos con extractos de cuerpos grasos.
CGLP: extractos de cuerpos grasos de L.sericata contra P.aeruginosa; CGLS: extractos de cuerpos grasos de L.sericata contra S.aureus; CGSP: extractos de cuerpos grasos de S.magellanica contra P.aeruginosa; CGSS: extractos de cuerpos grasos de S.magellanica contra S.aureus; CP: Ciprofloxacina contra P.aeruginosa; CS: ciprofloxacina contra S.aureus; PBS: control negativo.
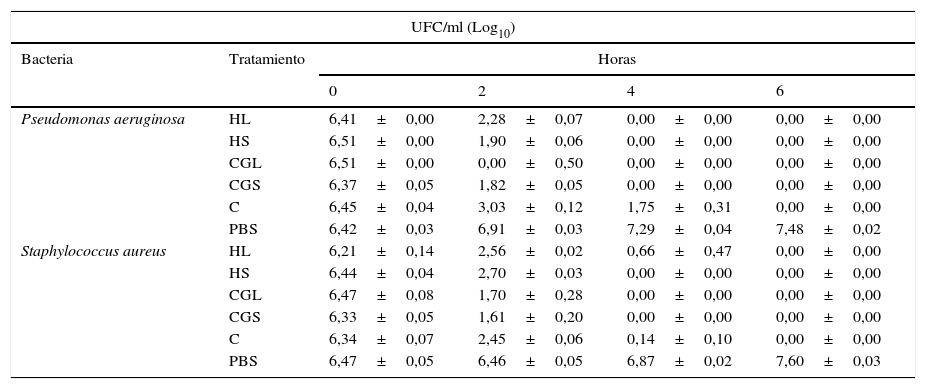
Esta técnica reveló un comportamiento eficaz de los extractos de cuerpos grasos y hemolinfa, derivados de ambas especies de dípteros, contra las especies de bacterias tratadas, en la medida en que se inhibió el crecimiento bacteriano y no hubo formación de colonias. Los resultados no mostraron diferencias significativas en la acción de las anteriores sustancias sobre las especies de bacterias (p=0,7128). En la tabla 1 se puede evidenciar la disminución de las UFC/ml de cada una de las cepas bacterianas evaluadas a las 2h y una reducción total de las mismas a las 6h, como consecuencia de los tratamientos con los extractos de cuerpos grasos, hemolinfa y antibiótico de cada una de las especies de moscas. Según lo esperado, no se observó disminución de las UFC/ml con el control negativo. En este experimento tampoco se observaron diferencias significativas entre las 2 especies de moscas evaluadas (p=0,6093).
Número de unidades formadoras de colonias (UFC), expresadas como Log10, de las cepas bacterianas incubadas a las 0, 2, 4 y 6h con diversos tratamientos
| UFC/ml (Log10) | |||||
|---|---|---|---|---|---|
| Bacteria | Tratamiento | Horas | |||
| 0 | 2 | 4 | 6 | ||
| Pseudomonas aeruginosa | HL | 6,41±0,00 | 2,28±0,07 | 0,00±0,00 | 0,00±0,00 |
| HS | 6,51±0,00 | 1,90±0,06 | 0,00±0,00 | 0,00±0,00 | |
| CGL | 6,51±0,00 | 0,00±0,50 | 0,00±0,00 | 0,00±0,00 | |
| CGS | 6,37±0,05 | 1,82±0,05 | 0,00±0,00 | 0,00±0,00 | |
| C | 6,45±0,04 | 3,03±0,12 | 1,75±0,31 | 0,00±0,00 | |
| PBS | 6,42±0,03 | 6,91±0,03 | 7,29±0,04 | 7,48±0,02 | |
| Staphylococcus aureus | HL | 6,21±0,14 | 2,56±0,02 | 0,66±0,47 | 0,00±0,00 |
| HS | 6,44±0,04 | 2,70±0,03 | 0,00±0,00 | 0,00±0,00 | |
| CGL | 6,47±0,08 | 1,70±0,28 | 0,00±0,00 | 0,00±0,00 | |
| CGS | 6,33±0,05 | 1,61±0,20 | 0,00±0,00 | 0,00±0,00 | |
| C | 6,34±0,07 | 2,45±0,06 | 0,14±0,10 | 0,00±0,00 | |
| PBS | 6,47±0,05 | 6,46±0,05 | 6,87±0,02 | 7,60±0,03 | |
C: antibiótico; CGL: extractos de cuerpos grasos de L.sericata; CGS: extractos de cuerpos grasos de S.magellanica; HL: hemolinfa de L.sericata; HS: hemolinfa de S.magellanica; PBS: control negativo.
Las infecciones producidas por S.aureus representan una seria preocupación, principalmente a nivel intrahospitalario, debido a que desde la introducción de la meticilina en la práctica clínica se han reportado cepas de esta bacteria que son resistentes, la cual es conocida con la sigla en inglés MRSA28. Así mismo, P.aeruginosa adquiere resistencia, tanto de manera natural como adquirida, a un gran número de antibióticos, como cefalosporinas de primera y segunda generación, tetraciclinas, cloranfenicol y macrólidos, moléculas que tienen la capacidad de tornarse ineficaces en el curso del tratamiento29. La amplia distribución de las cepas resistentes a los antibióticos tradicionales ha justificado la búsqueda de nuevos agentes antimicrobianos de carácter natural, a partir de la cual la terapia larval como alternativa cumple un rol importante.
En el presente estudio, con la técnica de difusión en agar, se evidenció que la hemolinfa, derivada de las larvas de las 2 especies evaluadas (L.sericata y S.magellanica), presentó actividad antibacterial contra S.aureus y P.aeruginosa, las cuales son consideradas las más representativas dentro de los grupos clasificados como Gram-positivos y Gram-negativos aerobios, respectivamente; además, estas bacterias son comúnmente aisladas de heridas en pacientes diabéticos26,30,31, siendo, por lo tanto, la sustancia evaluada potencialmente de interés terapéutico en esta población de pacientes. Así mismo, con la técnica de difusión en agar se pudo demostrar la actividad antibacterial de los extractos de cuerpos grasos de L.sericata y S.magellanica contra estos microorganismos. A pesar de que en el proceso de evaluación general de la actividad antibacterial no se registraron diferencias significativas en la acción de los cuerpos grasos entre las moscas seleccionadas, en el análisis estadístico individual de las sustancias derivadas de los insectos contra cada una de las bacterias sí se evidenciaron tales diferencias, siendo más eficiente el efecto antibacterial contra P.aeruginosa. Esta situación coincide con los resultados obtenidos en trabajos previos32,33 donde se estableció una mayor efectividad de las ES larvales contra P.aeruginosa y otras bacterias Gram-negativas, pero a su vez estos hallazgos contrastan con registros efectuados por varios autores quienes reportaron lo contrario, es decir, una acción más eficaz contra microorganismos Gram-positivos26,34,35. De acuerdo con Barnes et al.32, esta controversia podría ser explicada al considerar diversas variables implicadas en las metodologías usadas para evaluar la acción antibacterial y en los procesos desarrollados para la extracción de los tejidos empleados.
Por otro lado, usando la técnica de difusión en agar en la evaluación de los extractos de cuerpos grasos de ambas moscas y el antibiótico contra S.aureus, se establecieron diferencias significativas entre ellos mostrando mayor halo de inhibición con la ciprofloxacina. Estos resultados no son concluyentes para indicar mayor efectividad del antibiótico contra las cepas bacterianas seleccionadas, teniendo en cuenta que en el presente estudio la ciprofloxacina se tomó como control positivo en una concentración estándar, de acuerdo con un antibiograma previo de susceptibilidad a las bacterias señaladas. Sin embargo, es importante resaltar que las combinaciones sinérgicas entre antibiótico y sustancias derivadas de las larvas pueden incrementar la actividad antibacterial contra microorganismos aislados o formando biopelículas36,37.
En los ensayos realizados mediante la técnica de UFC/ml, al emplear hemolinfa y extractos de cuerpos grasos para evaluar actividad antibacterial se observó una reducción del número de colonias a las 2h, para finalmente registrar una ausencia total de las mismas a las 6h, lo cual permite confirmar la naturaleza bactericida de estas sustancias. Aunque la ciprofloxacina también fue eficaz contra ambas cepas microbianas, la inhibición del crecimiento ocurrió en un tiempo más prolongado (6h), todo lo cual coincide con el trabajo de Díaz-Roa et al.19 al utilizar esta misma técnica en la evaluación de la actividad antibacterial de las ES larvales de S.magellanica.
En relación con la metodología, es necesario señalar que en nuestro estudio se usaron larvas previamente inmunizadas, que probablemente potenciaron el efecto bactericida, tal como lo reporta Kawabata et al.26, quienes sugirieron la producción de péptidos antimicrobianos por parte de larvas inmunizadas, mediante exposición previa a los ensayos de estas a suspensiones bacterianas. Así mismo, en otros trabajos, también usando este tipo de larvas, se pudo generar inmunidad innata y, por consiguiente, la síntesis de péptidos a partir de cuerpos grasos, los cuales fueron luego liberados en la hemolinfa17,38.
A pesar de las diferencias obtenidas con las 2 técnicas, son concluyentes los resultados al demostrar actividad antibacterial a partir de las 2 sustancias evaluadas. En algunos estudios previos, en los cuales evaluaron la actividad de las ES larvales de L.sericata, se presentaron resultados contradictorios respecto a la duración y potencia de la actividad antibacterial de dichas sustancias, contra microorganismos comunes en heridas, debido a la diferencia de las técnicas de evaluación utilizadas, así como los procesos de obtención de las sustancias y la pureza de las mismas18,32.
Son diversas las sustancias antimicrobianas aisladas a partir de la hemolinfa de las larvas de diferentes especies de mosca, como la lucifensinai y ii de L.sericata y L.cuprina, respectivamente, que hacen parte de las familias de las defensinas17,39; también se han aislado polipéptidos, en el rango de los 3kDa, algunos fenoles y lisozimas, que son proteínas de 14kDa, producidas principalmente por el cuerpo graso y células pericárdicas que luego son secretadas a la hemolinfa en respuesta a la infección por hongos y algunas bacterias Gram-positivas y Gram-negativas. Dichas sustancias no solo se encuentran presentes en la hemolinfa, sino también en otros tejidos, tales como cuerpos grasos, glándulas salivales; de igual manera, en las ES larvales han sido reportadas14,38,40. Es posible que algunas de estas sustancias, u otras aún no conocidas, se encuentren en los extractos de cuerpos grasos y hemolinfa de S.magellanica, razón por la cual sería de gran importancia, en nuevos estudios, poder aislar, purificar y caracterizar éstos componentes.
Los resultados del presente trabajo evidenciaron que tanto la hemolinfa como los extractos de cuerpos grasos de S.magellanica y L.sericata poseen actividad antibacterial contra las cepas evaluadas, sin diferencias significativas entre las moscas aunque con matices diferentes entre las bacterias, las cuales en su hábitat natural, como una reacción del sistema inmune de sus larvas, actúan controlando los microorganismos presentes en los alimentos que habitualmente consumen mediante digestión extracelular. Sin embargo, es necesario aislar, caracterizar y evaluar los componentes de las sustancias evaluadas, ya que pueden ser valiosos en la búsqueda alternativa de antibióticos naturales que combatan las infecciones bacterianas resistentes, y a su vez podrían ser útiles en el tratamiento de heridas de difícil cicatrización. Estas sustancias eventualmente se utilizarían directamente o como complemento de los tratamientos de actividad antibacterial ya establecidos, tal como han sido evaluadas, bajo condiciones in vitro, en los trabajos previos indicados.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónColciencias (código: 122252128259, contrato 444) y Universidad del Rosario.
Conflicto de interesesLos autores declaran no conocer ningún tipo de conflicto de intereses durante la realización de este trabajo.
A la Fundación Inmunológica de Colombia (FIDIC), doctora Diana Suárez, por el apoyo y la asesoría brindada en el desarrollo de las técnicas de difusión en agar y unidades formadoras de colonias (UFC).