Los últimos avances biológicos han permitido identificar lesiones genéticas susceptibles de transmitirse hereditariamente. Estas lesiones genéticas son las mutaciones de los genes BRCA1 y BRCA2 que permiten identificar a individuos con riesgo elevado de padecer cáncer de mama. Solo el 10% de los cánceres de mama están asociados con una historia genética familiar positiva.
Debido a su magnitud y gravedad, el cáncer de mama se ha convertido en los últimos tiempos en un problema de salud prioritario que obliga a efectuar programas de cribado y de prevención mediante estudios de imagen antes no utilizados. Estos estudios ayudan a incrementar el diagnóstico precoz, a definir los grupos de riesgo y a obtener un mayor seguimiento de la enfermedad.
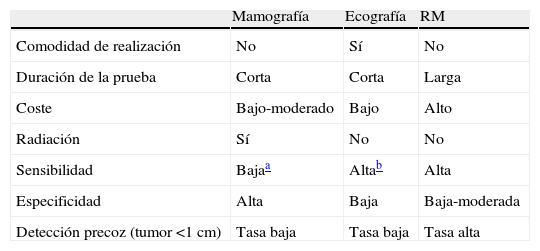
La técnica de imagen más utilizada sigue siendo la mamografía, ya que está aceptada como la técnica con mayor validez en el diagnóstico de anomalías mamarias sospechosas de malignidad.
La ecografía se utiliza para el seguimiento de una anomalía vista en la mamografía de cribado, para aclarar las características de una lesión potencial.
La resonancia magnética (RM) en combinación con la mamografía está dirigida a pacientes de alto riesgo. Hay estudios que comparan la función de la RM respecto a la mamografía, y las conclusiones sobre la RM son que su sensibilidad fue significativamente mejor que la de la mamografía pero su especificidad fue peor. Por tanto, la RM es particularmente útil en mamas densas y con riesgo hereditario familiar, casos en los que la sensibilidad de la mamografía es limitada.
The latest biological advance has enabled hereditary transmissible genetic lesions to be identified. These genetic lesions are mutations of the BRCA1 and BRCA2 genes that help to identify individuals with a high risk of suffering from breast cancer. Only 10% of breast cancers are associated with positive family genetic history.
Due to its magnitude and severity, breast cancer has become a priority health problem in the last few years, and has led to carrying out screening and prevention programs using previously unused imaging studies. These studies help to increase the early diagnosis, on defining risk groups and obtaining a better follow-up of the disease.
The most used imaging technique continues to be mammography, as it is accepted as the technique with a greater validity in the diagnosis of suspected malignant breast anomalies.
Ultrasound is used for the follow-up of an anomaly seen in the screening mammography, to clarify the characteristics of a potential lesion.
Magnetic resonance (MR) in combination with mammography is directed at high risk patients. There are studies that have compared the function of MR compared to mammography, and the conclusions on MR were that its sensitivity was significantly better than that of mammography, but its specificity was lower. Thus, MR is particularly useful in dense breasts and with a familial hereditary risk, cases where the sensitivity of mammography is limited.
La incidencia del cáncer de mama a nivel mundial se ha duplicado en los últimos 20años y continúa en aumento1. El cáncer de mama es el tumor más frecuente en la mujer, y es también la primera causa de muerte por cáncer en el sexo femenino2.
Parece ser que en los países desarrollados la incidencia de cáncer de mama es mayor respecto a los países no desarrollados, aunque se está apreciando con el tiempo una disminución de la diferencia en las tasas.
Las posibilidades que tiene una mujer de desarrollar cáncer de mama a lo largo de su vida son de aproximadamente el 10%, y su incidencia se hace máxima entre los 50 y los 60 años3. La probabilidad de desarrollar la enfermedad está relacionada con el sexo, la raza y especialmente la edad; alteraciones genéticas como la mutación en los genes BRCA confieren un riesgo elevado4. La mayoría de las neoplasias de mama son esporádicas (es decir, no hereditarias), pero se estima que aproximadamente entre el 5 y el 10% son el resultado de una predisposición hereditaria y principalmente están asociadas a mutaciones en los genes supresores de tumores: BReast CAncer genes 1 y 2 (BRCA1 y BRCA2). La detección de mutaciones en los genes BRCA1 y BRCA2 en familias con criterios clínicos indicativos de cáncer de mama y ovario hereditario ha permitido identificar a individuos con riesgo elevado, significativamente superior a la población general, de presentar cáncer de mama5.
La influencia de la mortalidad por cáncer de mama ha impulsado el desarrollo de programas poblacionales de detección temprana para dicha enfermedad. Diversos estudios han demostrado la efectividad de tales programas de prevención secundaria para reducir la mortalidad por cáncer de mama6,7. Con actuaciones como el programa «Europa contra el cáncer»8 la Unión Europea trata de impulsar los programas de cribado poblacional del cáncer de mama. Las recomendaciones actuales más generalizadas hacen referencia al cribado mediante la mamografía de doble proyección, preferentemente en el grupo de edad de 50-64 años, y una periodicidad bianual9-11.
En 1997 se publicaron las primeras recomendaciones para el cribado de mujeres portadoras de mutación en los genes BRCA1 y BRCA2, basadas en la opinión de expertos12. Tras evidenciar las limitaciones del cribado con mamografía en mujeres portadoras de mutación en los genes BRCA, durante los últimos 5años se han realizado, con el objetivo de conseguir optimizar el cribado para el cáncer de mama en estas mujeres, estudios que evalúan la resonancia magnética (RM) mamaria en el cribado de cáncer de mama, determinando su eficacia en términos de sensibilidad, especificidad y estadio clínico al diagnosticar la neoplasia.
El presente trabajo tiene como objetivo analizar los procedimientos de prevención secundaria en mujeres con moderado o alto riesgo genético.
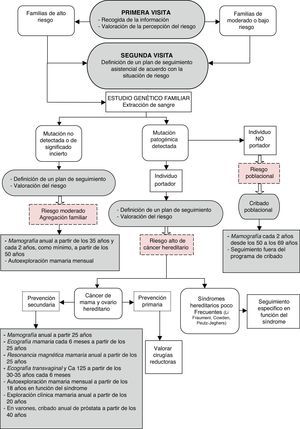
Manejo clínico: historia familiar y personalLos progresos en el conocimiento de las bases genéticas del cáncer de mama han aumentado el interés por la prevención del cáncer en personas de riesgo elevado y plantean nuevos retos en la organización y la provisión de servicios sanitarios13. La historia clínica y los modelos de predicción permiten clasificar el nivel de riesgo individual y, en función de este riesgo (elevado-genético, moderado-familiar y promedio), se puede saber quién necesita qué (fig. 1). En la etiología del cáncer, solo el 5-10% de los casos se pueden atribuir a mutaciones de genes de alta penetración que se transmiten con un patrón de herencia autosómico dominante (riesgo elevado-genético). El 15-20% son cánceres que se presentan en un contexto de agregación familiar y son de etiología multifactorial (riesgo moderado-familiar). La mayoría de los cánceres de mama, el 70-75%, son espontáneos (riesgo promedio)14.
Criterios de derivación a una consulta de evaluación del riesgo de cáncer de mama. Tomado de Schrading y Kuhl17.
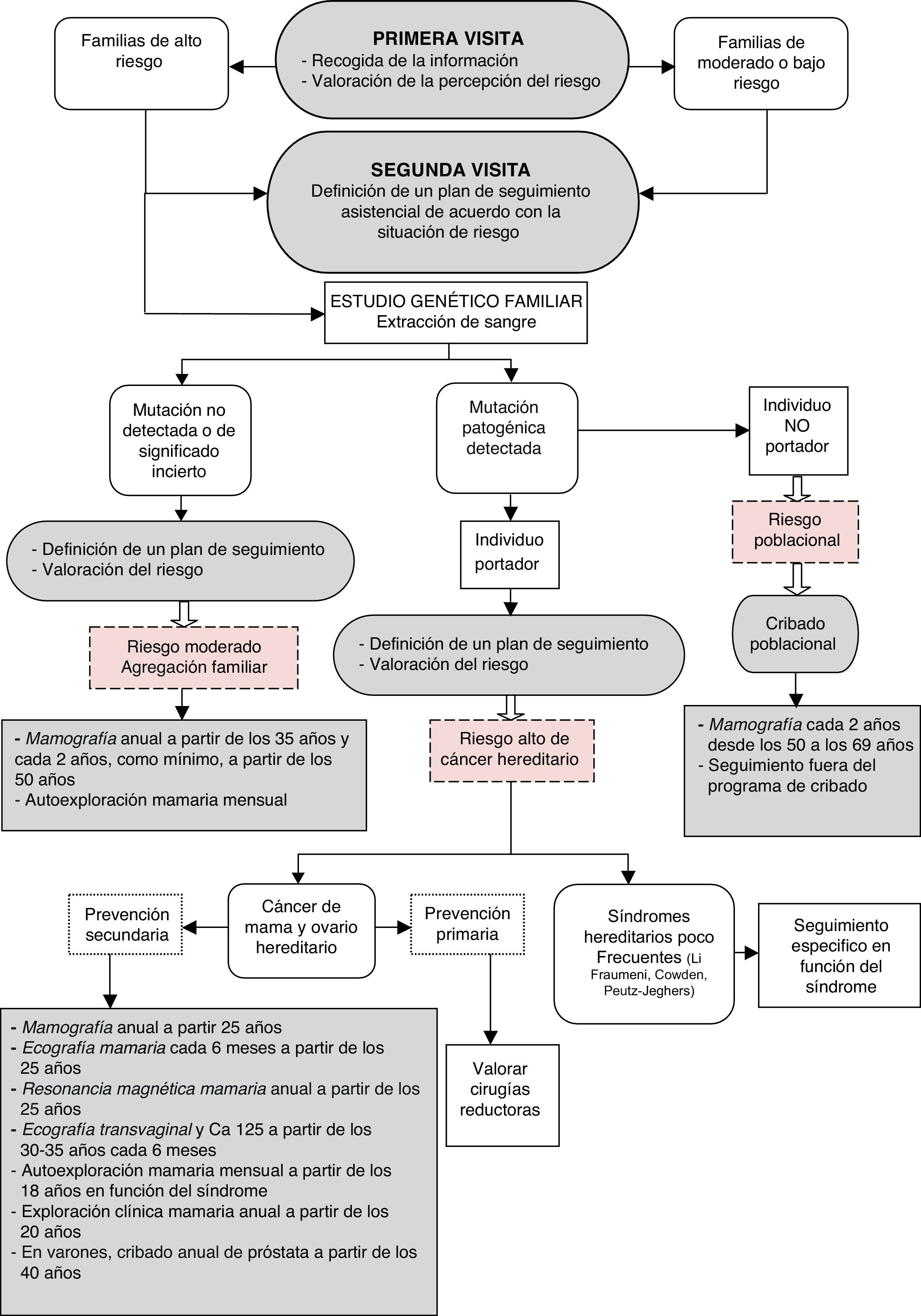
Inicialmente se recogen los antecedentes personales y familiares (árbol genealógico) y se valora el riesgo de cáncer. Posteriormente se proporciona una educación genética, se discute el riesgo individual y se ofrece el estudio genético si se considera apropiado. Finalmente, se comunican los resultados de la prueba y se recomiendan las medidas preventivas más adecuadas15 (fig. 2).
Proceso para la valoración y el seguimiento del riesgo genético de cáncer de mama y ovario. Tomado de OncoGuía del consejo y asesoramiento genéticos en el cáncer hereditario16.
El BCRA1 y el BCRA2 son los genes conocidos más importantes en la susceptibilidad al cáncer de mama en familias y mujeres de alto riesgo. El número de casos de cáncer de mama en una familia generalmente se correlaciona con el descubrimiento de una mutación en los miembros afectados de la familia. Existen diversos estudios que evalúan la presencia de mutaciones de los genes BRCA1 y BRCA216.
Es razonable que al iniciar un estudio analítico de posibles portadores de una mutación genética, los primeros en ser evaluados sean los pacientes que han padecido la enfermedad.
Si se encuentra la mutación en los genes BRCA1 y BRCA2, el riesgo de la familia en primer grado de ser portadores de la mutación es del 50%.
Entre las mujeres que tienen las mutaciones en BRCA1 y BRCA2, el riesgo de padecer cáncer de mama a lo largo de la vida es del 36 al 85%18.
Actualmente no existen ensayos clínicos que hayan demostrado la eficacia de las medidas de seguimiento intensivo a la hora de reducir la mortalidad en estas mujeres portadoras de mutación en BRCA1 y BRCA2. Sin embargo, tanto en Estados Unidos19 como en Europa20,21 se han desarrollado por consenso programas de cribado especializado.
MamografíaEl seguimiento mamográfico se hará en mujeres que tengan:
- •
Riesgo poblacional. Cribado poblacional: mamografía cada 2años desde los 50 a los 69años y seguimiento fuera del programa de cribado.
- •
Riesgo moderado: mamografía anual a partir de los 35años y cada 2años, como mínimo, a partir de los 50años.
- •
Riesgo alto de carácter hereditario. a) cáncer de mama y ovario hereditario: prevención secundaria (mamografía anual a partir de los 25 años); b) síndromes hereditarios poco frecuentes: seguimiento específico en función del síndrome16.
Una mamografía estándar de cribado se compone de 2proyecciones: una craneocaudal (CC) y una oblicua mediolateral (OML). En la proyección CC el haz de rayos atraviesa la mama en dirección craneocaudal (cabeza-pies) y permite visualizar toda la mama desde el músculo pectoral hasta el pezón, incluyendo el pliegue inframamario, el pezón de perfil y la mama estirada y alejada del tórax. En la proyección OML el haz de rayos atraviesa la mama oblicuamente en dirección de medial a lateral, donde se visualiza todo el tejido mamario, el músculo pectoral y el pezón de perfil. Se adquieren las imágenes separadas de las 2mamas para poder compararlas22,23.
Otras proyecciones especiales que se utilizan son las proyecciones ampliadas con compresión para las microcalcificaciones y las proyecciones de compresión focal para las masas o asimetrías focales23.
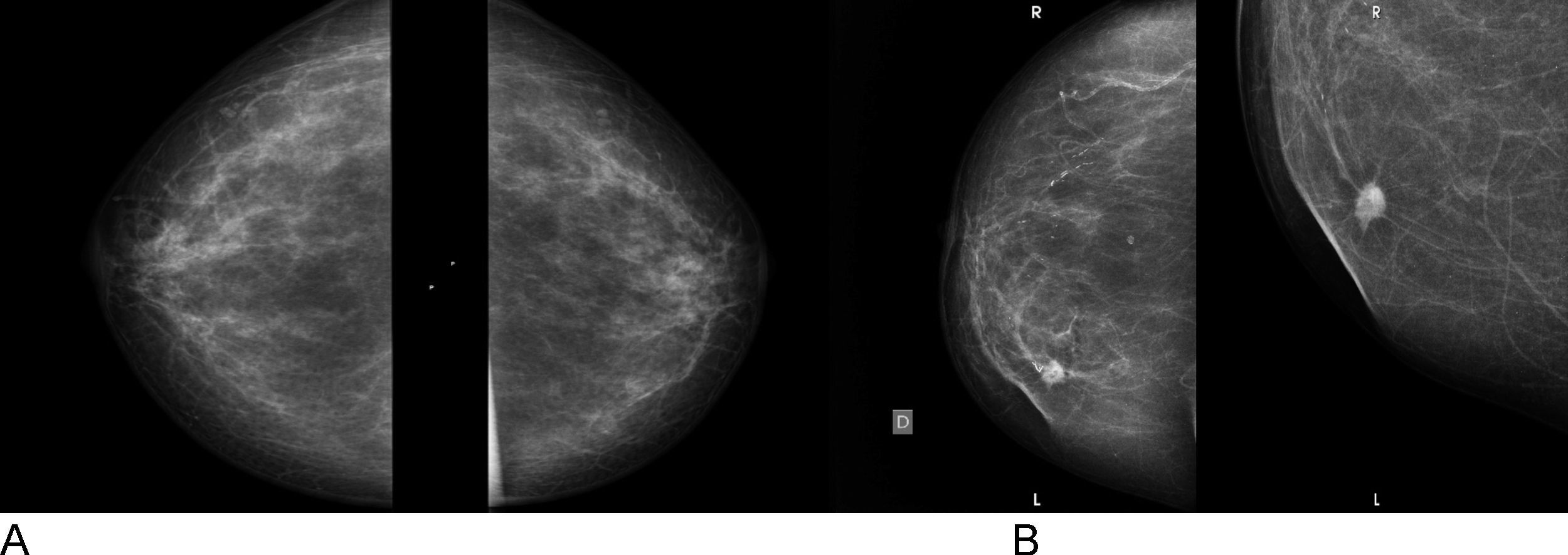
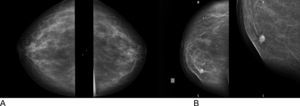
Criterios diagnósticosLas mamografías normales muestran una mezcla de grasa y tejido fibroglandular. También se ven otras estructuras normales, como los vasos sanguíneos y los conductos galactóforos (fig. 3A). Los 2 hallazgos mamográficos principales que sugieren anomalías son las masas y las microcalcificaciones. Otras anomalías son las asimetrías focales, las distorsiones de la estructura y las deformidades de la piel o del pezón23.
El objetivo de la mamografía es buscar o detectar nódulos y cambios en los tejidos de la mama. De esta manera, ayuda a descubrir pequeños nódulos o visualizar masas que ningún especialista o la propia mujer pueden palpar al hacer el examen físico de la mama (fig. 3B).
Ecografía mamariaSe realiza una ecografía en mujeres de alto riesgo cuando no toleren o se encuentre contraindicada la RM, o bien en mujeres de alto riesgo con mamas densas.
La ecografía es una técnica que en mujeres de alto riesgo se utiliza para el cribado de intervalo a los 6meses entre mamografías anuales en mujeres portadoras de mutación en BRCA.
TécnicaEl examen viene precedido por un interrogatorio y la palpación de las mamas.
Se recomienda empezar por la mama derecha en el siguiente orden: cuadrante superior externo, cuadrante superior interno, cuadrante inferior interno y cuadrante inferior externo. Se continúa con la mama izquierda siguiendo la misma secuencia.
Los cuadrantes superiores se deben explorar con la paciente en una inclinación de 30° hacia el lado contrario, con la mano de ese lado sobre la cabeza. Para el estudio del resto de la mama es más cómodo realizarla con la paciente en decúbito supino con los brazos por encima de la cabeza.
La ecografía de mama se ha de realizar preferentemente en la primera parte del ciclo menstrual, pocos días después de la menstruación, que es cuando las mamas están menos congestivas.
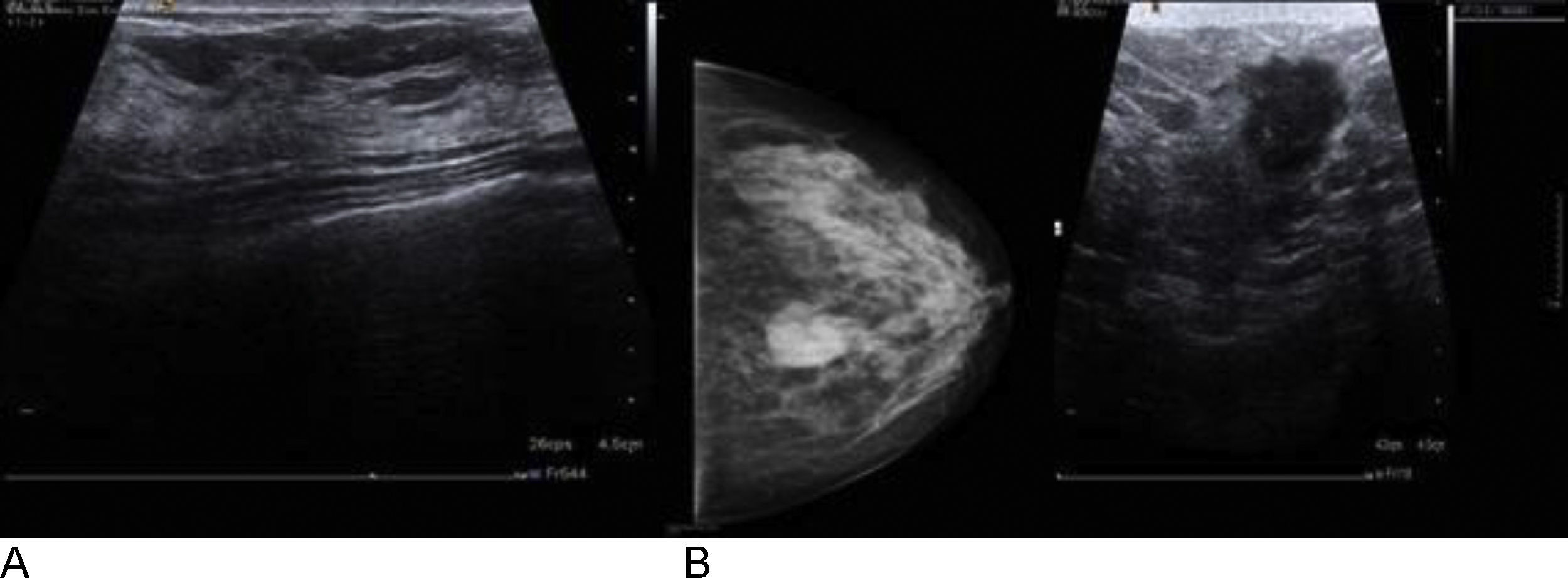
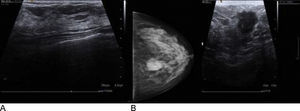
Criterios diagnósticosEn las ecografías normales visualizamos el parénquima mamario. Con señal hipoecoica, los lóbulos mamarios y la grasa. La señal hiperecoica nos muestra los conductos galactóforos, el tejido conjuntivo y los ligamentos de Cooper, que son el soporte de la mama y su representación es similar a un arco (fig. 4A). También se visualizan los ganglios linfáticos: se localizan en la axila y en el parénquima mamario, suelen encontrarse en el cuadrante superior externo de la mama, aparecen como estructuras redondeadas e hipoecoicas y se puede encontrar un punto hiperecogénico central correspondiente al hilio.
La descripción ecográfica de las masas, usando la terminología BIRADS, incluye la forma, la orientación, los márgenes, los límites, el patrón ecográfico interno y las características acústicas posteriores. Las características que sugieren benignidad incluyen una forma redondeada/ovalada, ser más ancha que alta, cápsula fina y lobulación sutil, y las que sugieren malignidad (fig. 4B) incluyen forma irregular, bordes espiculados/angulados/microlobulados, ser más alta que ancha y distorsión de la estructura circundante23.
Resonancia magnética mamariaLa incorporación de la RM mamaria al cribado del cáncer de mama en mujeres portadoras de mutación en los genes BRCA1 y BRCA2, pacientes consideradas de alto riesgo, permite incrementar la sensibilidad del cribado y un diagnóstico más precoz del cáncer de mama5.
En pacientes de alto riesgo, sin que las intervenciones preventivas hayan demostrado tener un impacto en la mortalidad, se recomienda una RM mamaria anual a partir de los 25años, y puede alternarse su periodicidad con la mamografía15.
TécnicaEl examen se realiza con la paciente en decúbito prono, con ambas mamas situadas en una bobina de superficie dedicada. El protocolo se basa en secuencias T1 y T2 con y sin supresión grasa, y se estudia el dinámico, que consiste en la realización de una secuencia rápida en 3D, ponderada en T1, sin contraste, que cubre la totalidad de las mamas en menos de 1min. Después de la inyección de gadolinio, se repite la misma secuencia de manera iterativa, cada minuto hasta 6 o 7min24. Este tiempo es suficiente para determinar la morfología de la curva de contraste y determinar si la captación es continua, en meseta o se lava precozmente.
Posteriormente se realiza una sustracción de imágenes con curva de captación en el tiempo en lesiones sospechosas, proyecciones de intensidad de señal máxima y reconstrucción de las imágenes de sustracción en planos multiplanares. También se pueden crear mapas de imágenes paramétricas o mapas de captación con codificación de color según los parámetros asignados25. Cabe destacar asimismo que el tejido mamario normal también capta contraste en forma fisiológica durante la fase proliferativa del ciclo menstrual, por lo que se recomienda realizar el examen entre la 2.a y la 3.a semanas (5.° y 15.° días) del ciclo para disminuir los falsos positivos por esta causa26.
Criterios diagnósticosLa RM en la valoración del cáncer de mama aporta una información diferente al resto de técnicas diagnósticas tradicionales (mamografía y ecografía) a las que complementa pero no sustituye.
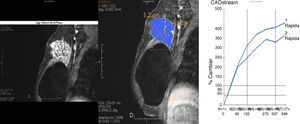
La RM de mama con contraste intravenoso administrado de forma dinámica valora básicamente la morfología y la cinética de captación. La RM es capaz de detectar las lesiones mamarias altamente vascularizadas que se impregnan precozmente con el contraste, lo que ocurre en los tumores malignos infiltrantes. Los neovasos anómalos captan el contraste intensamente y en forma precoz, antes que los vasos normales, por lo cual su detección es posible en las secuencias dinámicas26. El análisis cinético se realizará después del análisis morfológico (fig. 5) y se centrará fundamentalmente en aquellas lesiones cuya captación ya muestra un aumento en la intensidad de señal significativo en la primera imagen post-contraste. Las lesiones malignas suelen mostrar una captación intensa y precoz. Las lesiones benignas en general se impregnan progresivamente (fig. 6) y de forma menos intensa24. Si observamos la parte postinicial de la curva, veremos que las lesiones malignas suelen mostrar una captación posterior en meseta (fig. 7) o de tipo lavado (wash out) (fig. 8), aunque visualmente estos cambios son mucho menos evidentes que la intensa captación observada durante la primera fase de la curva25.
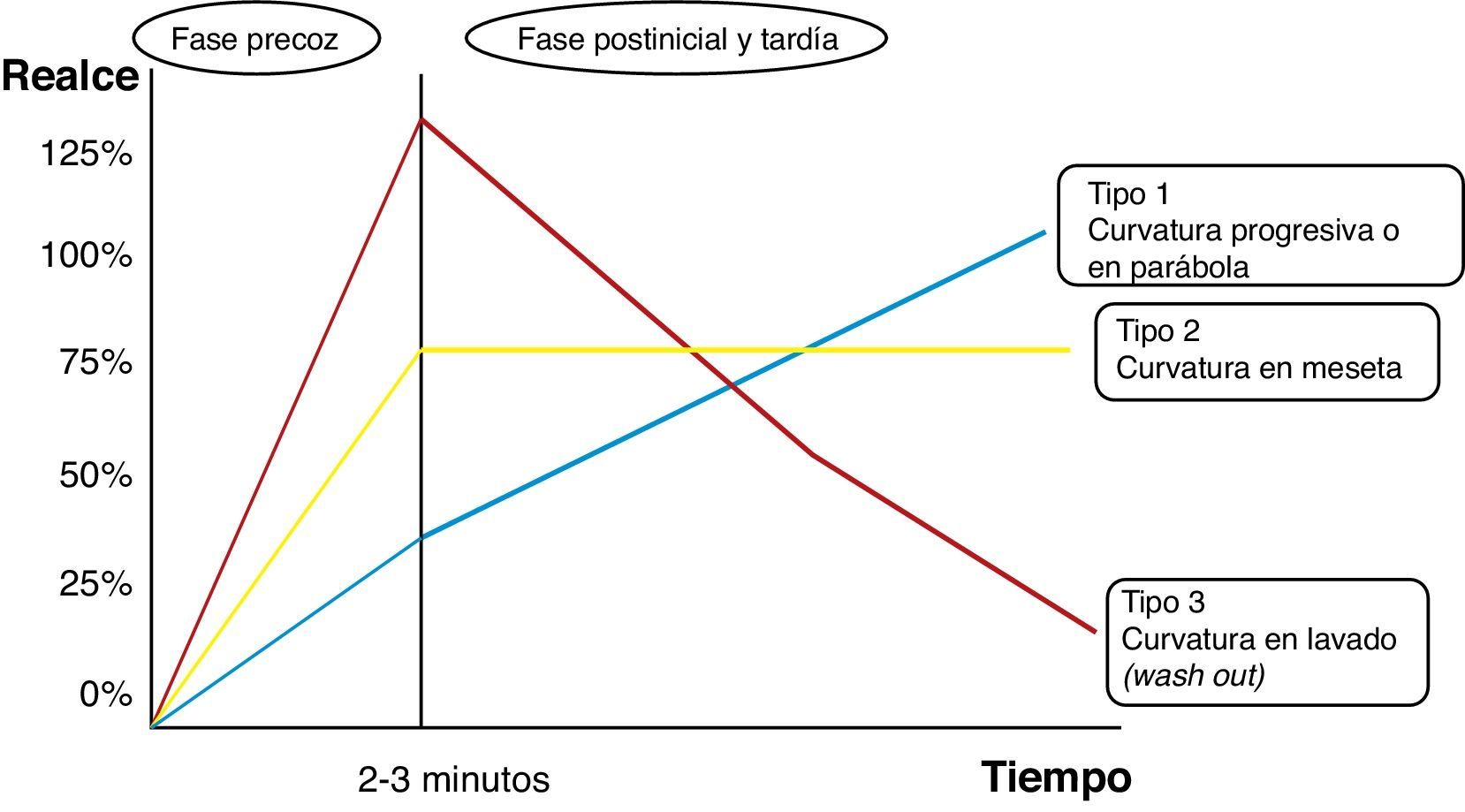
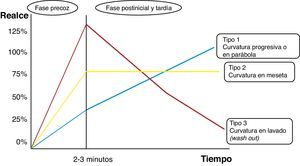
Tipos de curvas tiempo/intensidad en el estudio dinámico RM de la mama. Basado en el esquema de Camps Herrero25.
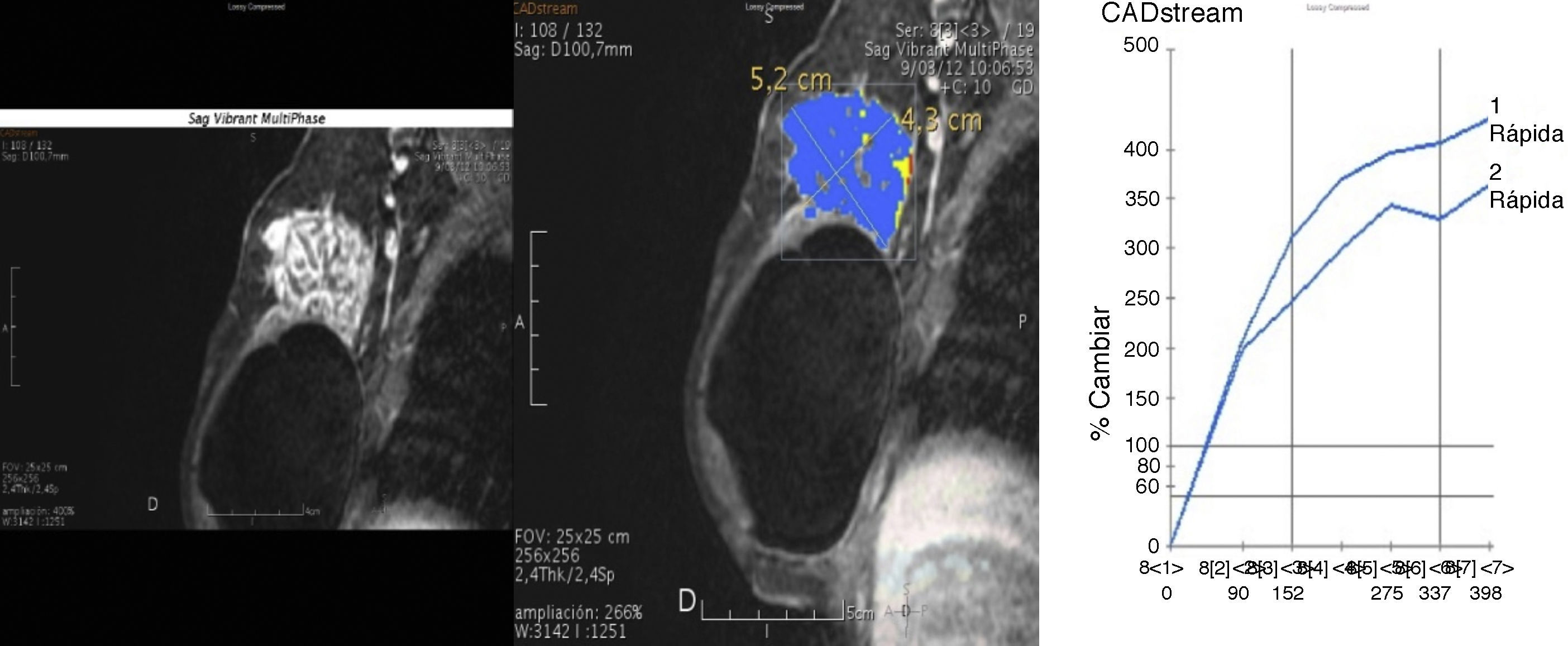
Curva de captación tipo i en parábola o progresiva. El pico de captación de contraste no pasa del 50% en un tiempo inferior a 2min, y posteriormente muestra una impregnación progresiva y en forma menos intensa. Tumor phyllodes benigno (color de la curva y representación del mapa paramétrico en azul).
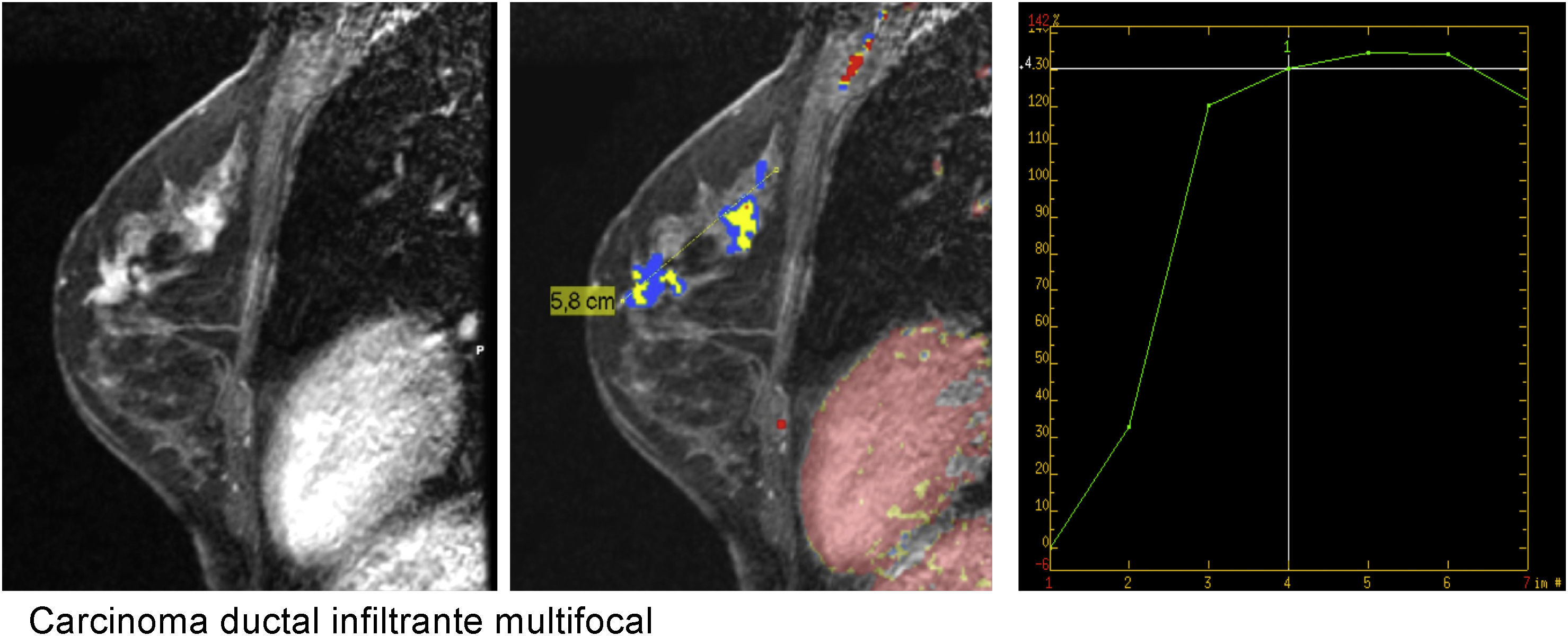
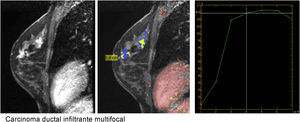
Curva de captación tipo ii en meseta. El pico de captación es precoz e intenso, con un realce superior al 90% en un tiempo inferior a 2min, y muestra posteriormente una meseta. Carcinoma ductal infiltrante multifocal con posibilidad de malignidad (color de la curva y representación del mapa paramétrico en verde o amarillo).
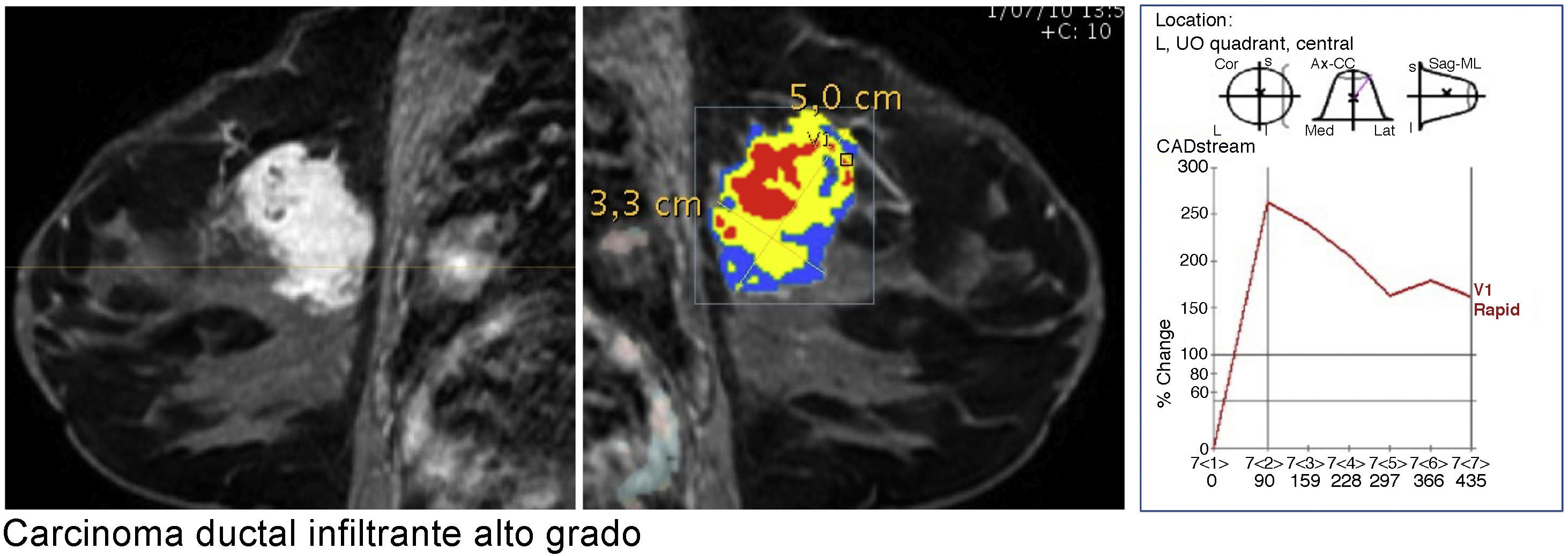
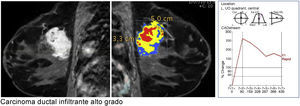
Curva de captación tipo iii en lavado (wash out). El pico de captación es precoz y muy intenso, con un realce muy superior al 90% e incluso llegando al 200% en un tiempo inferior a 2 min, y muestra posteriormente un descenso en la señal (lavado o wash out). Carcinoma ductal infiltrante de alto grado muy maligno (color de la curva y representación del mapa paramétrico en rojo).
En la tabla 1 se muestran las ventajas y las limitaciones de las técnicas empleadas en la prevención y el seguimiento de mujeres con riesgo genético de cáncer de mama.
Comparativa de ventajas y limitaciones de la mamografía, la ecografía y la RM5
El cáncer de mama es una de las enfermedades con más incidencia a nivel mundial. En los últimos años, los estudios genéticos en relación a la predisposición hereditaria al cáncer de mama y/u ovario se han incorporado en la práctica clínica oncológica, creándose unidades de asesoramiento o consejo genético. El estudio genético es el instrumento de ayuda para valorar el riesgo una vez que, por criterios clínicos, se considera alto. Los estudios genéticos permiten mejorar el manejo de riesgo de cáncer, así como reducir la incertidumbre y la ansiedad de desarrollar un cáncer tanto en la persona afectada como en su familia.
El objetivo de estas unidades es la identificación de personas de moderado y alto riesgo que requieren medidas específicas para la prevención primaria o secundaria.
Ante la sospecha de un posible síndrome de predisposición hereditaria al cáncer, la persona y sus familiares son derivados para su evaluación a una unidad de cáncer hereditario, para su primera visita. En ella se evalúa el riesgo personal y familiar de susceptibilidad hereditaria al cáncer mediante la realización de una exhaustiva historia clínica, elaborando un árbol genealógico sobre los antecedentes familiares y personales de cáncer.
Una vez valorado el riesgo se les deriva a una segunda visita, donde son informados de su riesgo. A los individuos de alto riesgo de síndrome hereditario se les realiza un estudio genético, y a los de moderado riesgo se les realiza un plan de seguimiento de acuerdo con su riesgo.
El estudio genético nos conduce a 3 posibles resultados: individuo no portador, considerado como riesgo poblacional; individuo de mutación no detectada o de significado incierto, considerado como riesgo moderado, e individuo de mutación patogénica detectada, considerado como riesgo alto de cáncer hereditario. A cada grupo se le realiza un plan de seguimiento de acuerdo con su riesgo, y cada plan de seguimiento está formado por diferentes técnicas diagnósticas de imagen.
Considerando la limitada sensibilidad del cribado con mamografía en individuos de alto riesgo, asociada principalmente a la densidad mamaria, la rápida progresión tumoral y el crecimiento expansivo, durante los últimos años se ha evidenciado la necesidad de evaluar nuevos métodos de cribado, como la ecografía y la RM mamaria.
EsencialesLa historia clínica y los modelos de predicción permiten clasificar el nivel de riesgo individual y, en función de este riesgo, como elevado-genético, moderado-familiar y promedio.
El BRCA1 y el BRCA2 son los genes conocidos más importantes en la susceptibilidad al cáncer de mama en familias y mujeres de alto riesgo.
La ecografía se utiliza para el seguimiento de una anomalía vista en la mamografía de cribado, para aclarar las características de una lesión potencial.
La RM en combinación con la mamografía está dirigida a pacientes de alto riesgo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosGerard Blasco, Servei IDI, Hospital Universitario Dr. Josep Trueta, por guiarnos de una manera constante en este artículo.
Dr. Joaquim Barceló, Servei de Radiologia, Clínica Girona, por facilitarnos datos e imágenes de resonancia magnética.
Sra. Angela Velasco, Servei ICO, Hospital Universitario Dr. Josep Trueta, por facilitarnos los datos del proceso genético.
Dra. Elsa Pérez, Servei de Radiologia, Hospital Universitario Dr. Josep Trueta, por facilitarnos datos sobre los criterios de derivación a una consulta de evaluación del riesgo de cáncer de mama.
Dr. Pont, Servei de Radiologia, Hospital Universitario Dr. Josep Trueta, por facilitarnos imágenes mamográficas.
Dr. Mateu Ballara Segues, Servei de Radiologia, Centro d’Atención Primaria (CAP) Güell, por facilitarnos los datos de imágenes mamográficas.
Dra. Lluisa Gifre Bassols, Servei de Radiologia, Hospital Sant Jaume d’Olot, por facilitarnos los datos y las imágenes ecográficas.