Los inhibidores de la aromatasa (IA), que han demostrado una gran eficacia en el tratamiento del carcinoma de mama con receptores de estrógenos positivos en mujeres en posmenopausia, determinan una reducción de concentración de estrógenos que sin embargo se revela perjudicial para el mantenimiento de la integridad del esqueleto, asociándose a un aumento significativo de la resorción ósea y en algún caso a un incremento de la incidencia de fracturas, en comparación con las pacientes tratadas con tamoxifeno (11 vs 8%).
La osteopenia inducida por los IA se puede prevenir con el uso concomitante de bifosfonatos (BIS), que pueden reducir la pérdida de masa ósea consecuente a la menopausia inducida. Resulta pero indispensable la valoración de las variaciones mínimas de la masa ósea en el tiempo para monitorizar la eficacia de la terapia por medio de la absorciometría de energía dual de rayosX (DXA), relacionando esas variaciones con el «cambio mínimo significativo» (CMS).
La correcta monitorización de la densidad mineral ósea en mujeres en tratamiento con IA y BIS es confiable únicamente si es realizada siempre con el mismo equipo, en el mismo centro de salud y posiblemente por el mismo técnico, y a condición que los valores de CMS estén mantenidos lo más bajo que sea posible.
Aromatase inhibitors (IAs) have shown great efficacy in the treatment of estrogen receptor positive breast cancer in postmenopausal women, however they may lead to a reduction of estrogen concentration which is associated with a significant increase in bone loss, increasing incidence of fractures in patients treated with these drug, compared to those treated with tamoxifen (11% vs 8%).
Osteopenia induced by aromatase inhibitors can be prevented by concomitant use of bisphosphonates (BIS), which can reduce bone loss due to induced menopause. It is essential to evaluate minimal changes in bone mass over time in order to monitor the effectiveness of the therapy. This can be done by means of dual energy absorptiometry (DEXA), relating these variations to the “least significant change” (LSC).
Proper monitoring of bone mineral density in women on treatment with IAs and BIS is reliable only if always performed with the same equipment, in the same facility (even better when performed by the same technologist), provided that the LSC is maintained at the lowest achievable values.
De acuerdo con los datos que figuran en el último informe elaborado por la International Osteoporosis Foundation, hasta ahora en Europa los números y los costes sanitarios asociados con la osteoporosis y las fracturas resultantes se han subestimado: en 2010 se han registrado, de hecho, 2 millones y medio de nuevos casos de fractura por fragilidad ósea, lo que equivale a 280 fracturas por hora, para un total de 80muertes por día1, y las previsiones para el año 2050 presentan un aumento en la incidencia de fracturas de cuello de fémur del 310% en los hombres y del 240% en las mujeres2. Por lo tanto, la osteoporosis es de gran importancia socioeconómica, amplificada por mal cumplimiento del paciente a la terapia farmacológica1 y por la evidencia de los datos, lo que deja entender que muchos de los pacientes que padecen una fractura por fragilidad no habían sido correctamente diagnosticados y tratados1.
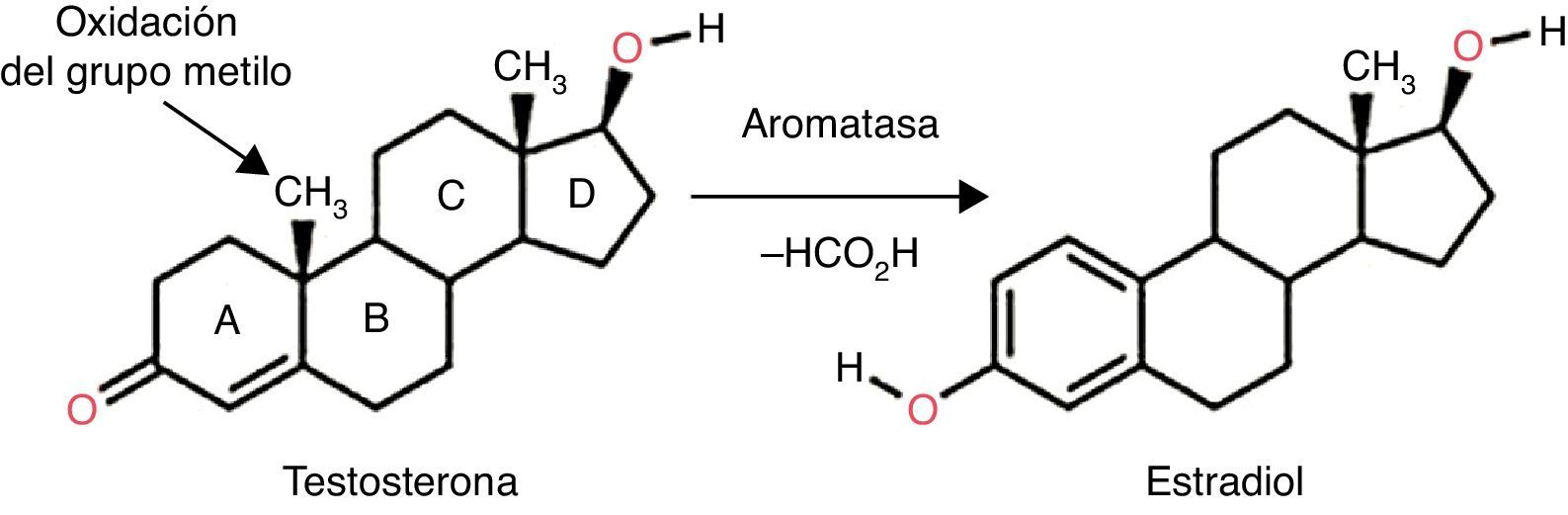
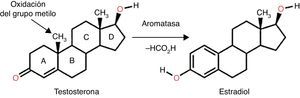
Los inhibidores de la aromatasa (IA) han demostrado una gran eficacia en el tratamiento del carcinoma de mama con receptores de estrógenos positivos en mujeres en posmenopausia, representando la terapia de elección en el tratamiento de ese grupo de pacientes tanto como adyuvante primario en lugar del tamoxifeno (TAM) como en el uso secuencial al mismo TAM. La principal fuente de estrógenos en las mujeres posmenopáusicas viene de la conversión química de andrógenos en estrógenos por la enzima aromatasa (fig. 1), localizada primariamente en el tejido adiposo. Los IA actúan inhibiendo este proceso, determinando una reducción de concentración de estrógenos que sin embargo se revela perjudicial para el mantenimiento de la integridad del esqueleto, ya que los estrógenos juegan un papel fundamental en la conservación de la masa ósea en el sexo femenino. De hecho, independientemente de los mecanismos de acción, todos los IA están asociados a un aumento significativo de la resorción ósea y en algún caso a un incremento de la incidencia de fracturas de hueso en pacientes tratadas con IA, en comparación con las tratadas con TAM (11 vs 8%).
La pérdida anual fisiológica de densidad mineral ósea (DMO) en mujeres en posmenopausia es del 0,5-2%; en mujeres tratadas con IA al cabo de un año resulta ser del 2,6% a nivel lumbar y del 1,7% a nivel femoral. La osteopenia inducida por los IA se puede prevenir con el uso concomitante de los bifosfonatos (BIS), inhibidores específicos de la resorción ósea mediada por osteoclastos, capaces de reducir la pérdida de masa ósea consecuente a la menopausia inducida, llevando a un incremento de la DMO entre el 1 y el 6% cada año. Esta población debería ser investigada por su perfil de riesgo de fractura con evaluaciones densitométricas lumbar y femoral de base y de seguimiento3. La medición de otros segmentos está desaconsejada debido a la respuesta al tratamiento significativamente más lenta4.
En la última década, varios grupos de trabajo han emitido recomendaciones para la evaluación del riesgo de fractura en mujeres que iniciaron el tratamiento con IA5,6. La American Society of Clinical Oncology, por ejemplo, recomienda la evaluación de la DMO con absorciometría de energía dual de rayos X (DXA) para las mujeres posmenopáusicas que toman IA y para las mujeres premenopáusicas que manifiestan menopausia precoz inducida por el tratamiento7. Estas formas secundarias de osteoporosis representan solo el 5% del total, pero resultan ser las más sensibles a la precisión de la medición densitométrica.
Sin embargo, la precisión puede estar influida por una serie de posibles condiciones de interferencia que deberían ser seriamente consideradas por quien redacte el informe o realice las mediciones3; este tema es muy sensible en algunos países (EE.UU., Canadá, Japón) en los que institucionalmente se imparten cursos de capacitación para técnicos y médicos, y se requiere una certificación para los operadores y los centros clínicos. El American College of Radiology (ACR) y la Society of Scheletal Radiology (SSR) reconocen al técnico de radiología la responsabilidad en la determinación del error de precisión y en el cálculo del «cambio mínimo significativo» (CMS), es decir, la más pequeña diferencia entre mediciones consecutivas que se pueda considerar un cambio real, no imputable a la casualidad o a la variabilidad inherente a la técnica utilizada8. Más correctamente, el CMS se define como la variación mínima entre 2 mediciones en el tiempo, que debe ser destacada para que una variación pueda considerarse real8-11; según Nelson et al.9, puede ser influido por el equipo, el técnico y el tamaño del paciente.
En el documento de referencia de la ACR y la SSR, en la SecciónVIII, apartadoD, se recomienda que cada centro clínico determine su propio error de precisión y calcule su CMS, y que en centros con más de un técnico estos valores representen el promedio de todos los datos obtenidos por todos los técnicos12-14.
Aunque valores típicos de la CMS se estiman alrededor del 3-4% para la columna lumbar y del 4-5% para la cadera, la International Society for Clinical Densitometry (ISCD) recomienda valores con tendencia al 2,58% (0,022g/cm2) para el tramo L1-L4 y al 4,63% (0,036g/cm2) para la cadera, con un precisión mínima aceptable individual de 1,9% (CMS=5,3%) para el tramo L1-L4 y de 1,8% (CMS=5,0%) para la cadera8. El CMS «ideal» (CMSI) es matemáticamente igual al error de precisión para mediciones hechas con el mismo equipo, multiplicado por 2,77, aunque puede variar, dependiendo del centro, de 2 a 4%, y también puede variar entre técnicos11.
Solo en caso de variación de DMO igual o superior a lo que será el CMS calculado, esa variación podrá ser considerada estadísticamente significativa. Está muy claro que el papel del CMS es considerablemente importante en la evaluación de cambios en DMO entre la población anteriormente indicada, para asegurar que los resultados no se subestimen debido a graves errores de precisión. Para cumplir con las indicaciones de la ISCD, además del desempeño del programa de Control de Calidad (QC), está recomendado que:
- -
Cada centro DXA determine su error de precisión y calcule el CMS evitando utilizar el error de precisión proporcionado por el fabricante15.
- -
En centros DXA con más de un técnico se utilice un error de precisión promedio combinando información de todos los técnicos para establecer el error de precisión y el CMS para el centro, averiguando que el error de precisión para cada técnico esté dentro del rango de aceptación preestablecido.
- -
Se establezca un umbral de competencia para definir el nivel mínimo de habilidad y que se utilice para verificar que el nivel de habilidad entre técnicos sea similar.
- -
Cada técnico realice una valoración de precisión en vivo utilizando pacientes representativos de la población clínica.
- -
Cada técnico realice una valoración de precisión completa después de haber aprendido las competencias básicas de exploración (formación) y después de haber realizado aproximadamente 100 análisis.
- -
Se repita la valoración de precisión cada vez que se instale un nuevo escáner DXA o en cuanto cambie el nivel de habilidad de un técnico.
Pero ¿cómo se evalúa el CMS individual? ¿Conocemos nuestro CMS?
Según la ISCD, para realizar un análisis de precisión y calcular el CMS es necesario medir 30 pacientes 2 veces (o 15 pacientes 3 veces), volviendo a posicionarlos después de cada escaneo de columna lumbar y cadera (la evaluación del CMS solo se efectúa con la medición de columna y cadera)8, calcular la raíz cuadrada del promedio de la desviación estándar (RPCDE) para el grupo (es este el «error de precisión») y el CMS con un intervalo de confianza del 95%.
La valoración de la precisión no requiere la aprobación de un comité de revisión, sino el consentimiento de los pacientes participantes8.
ObjetivoAveriguar la concreta posibilidad de obtener (y eventualmente reducir) los valores de CMS recomendados para suponer ciertas mínimas variaciones de DMO (dato muy importante al cabo del primer semestre de terapia con IA), y averiguar si esos valores dependen realmente del técnico.
Materiales y métodoSe ha conducido un estudio de evaluación de la precisión con:
- -
60 mujeres.
- -
2 técnicos.
- -
Un equipo DXA Hologic «Delphi»
Se han estudiado 30+30mujeres en doble ciego, repitiendo la prueba 2 veces cada una de ellas por cada técnico en la columna y en la cadera, de acuerdo con las indicaciones de la ISCD.
Se han posicionado escrupulosamente las mujeres y se ha procedido al centrado según las indicaciones del constructor y las recomendaciones dela ISCD.
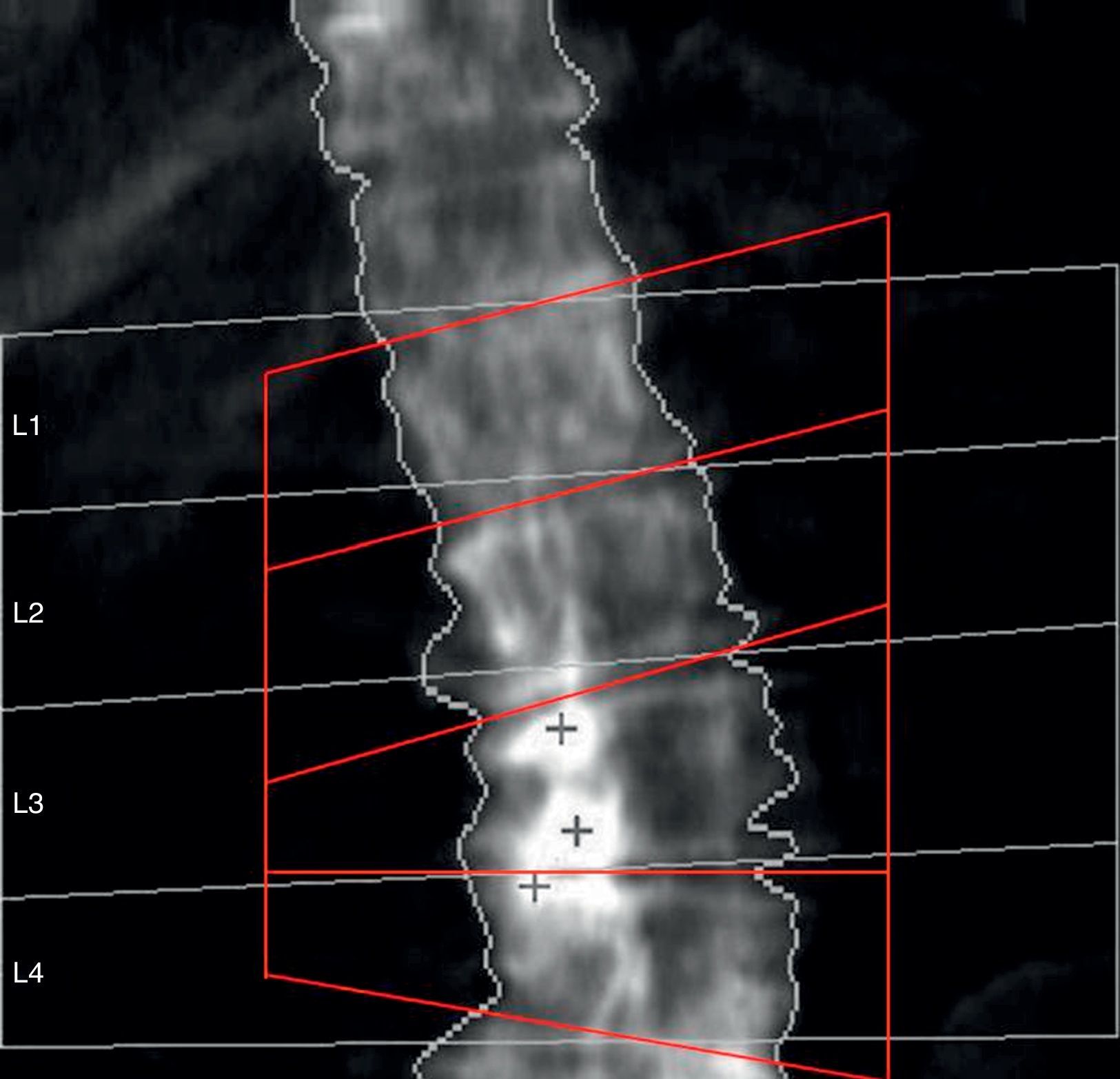
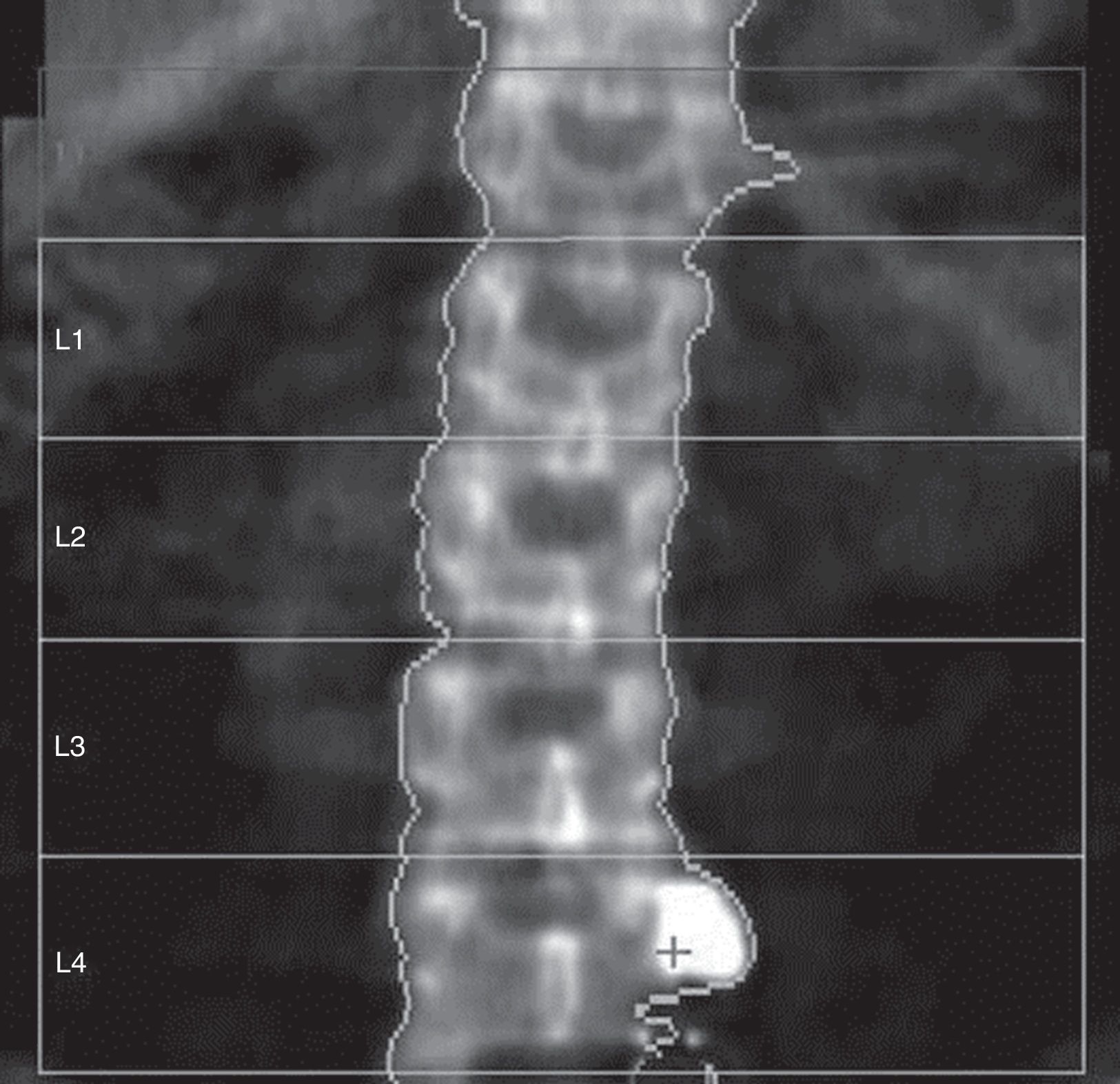
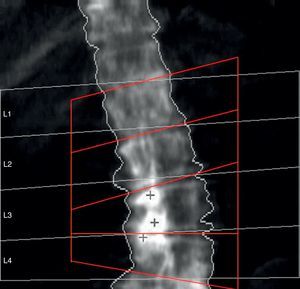
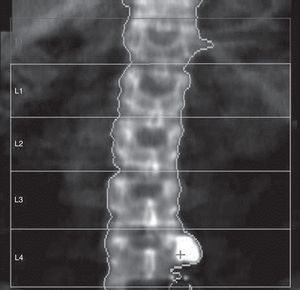
Las mediciones se han hecho posicionando escrupulosamente la caja de la región de interés (ROI) con las líneas laterales en proximidad de las apófisis transversas y las líneas superior e inferior al centro del espacio intervertebral, paralelas a la superficie del cuerpo vertebral más cercano. En caso de escoliosis, cada línea intervertebral va a ser la bisectriz del ángulo formado por 2 líneas paralelas a la vértebra superior e inferior (fig. 2).
Toda eventual exuberancia ósea ha sido escrupulosamente eliminada y se han rellenados los huecos residuales.
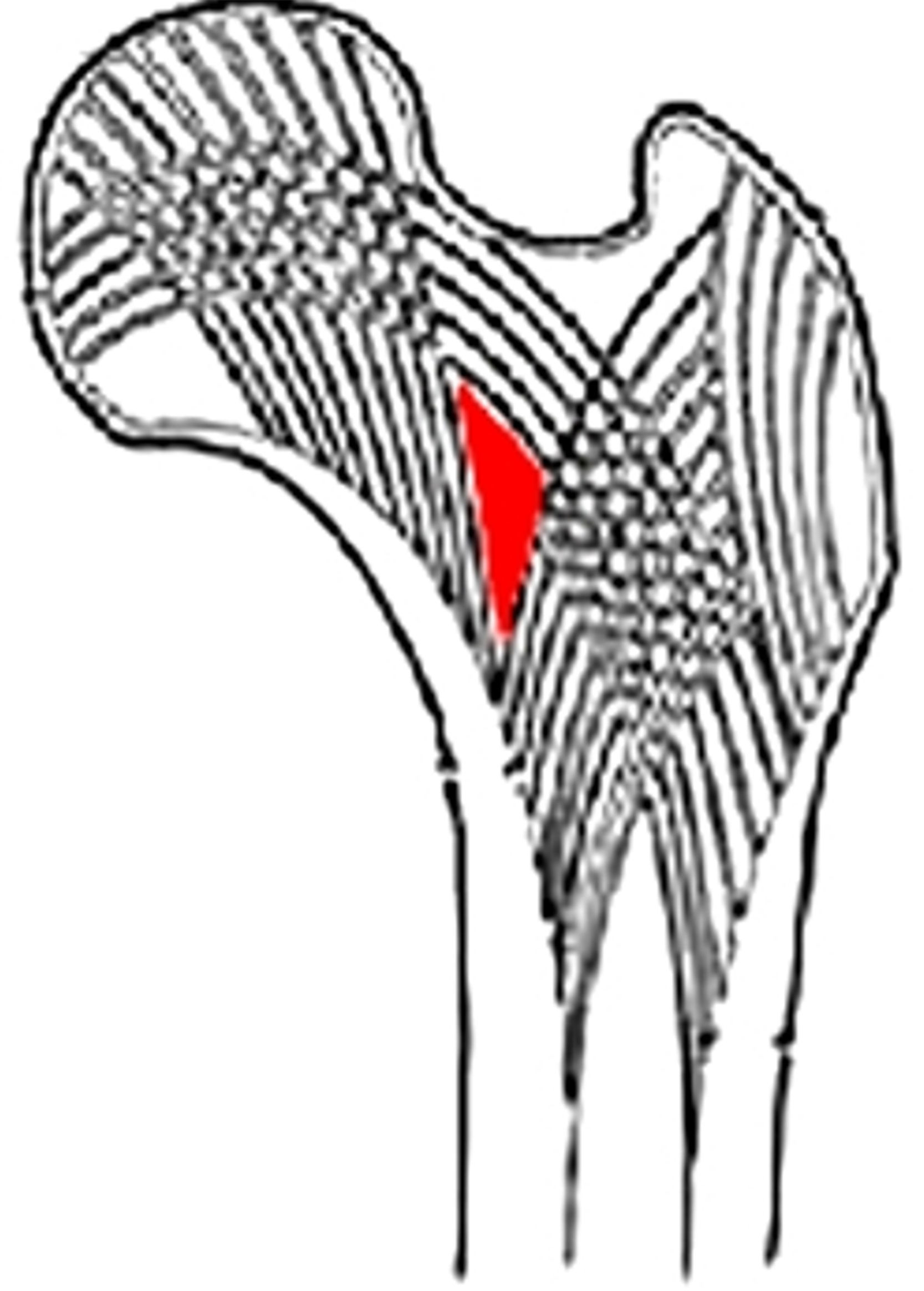
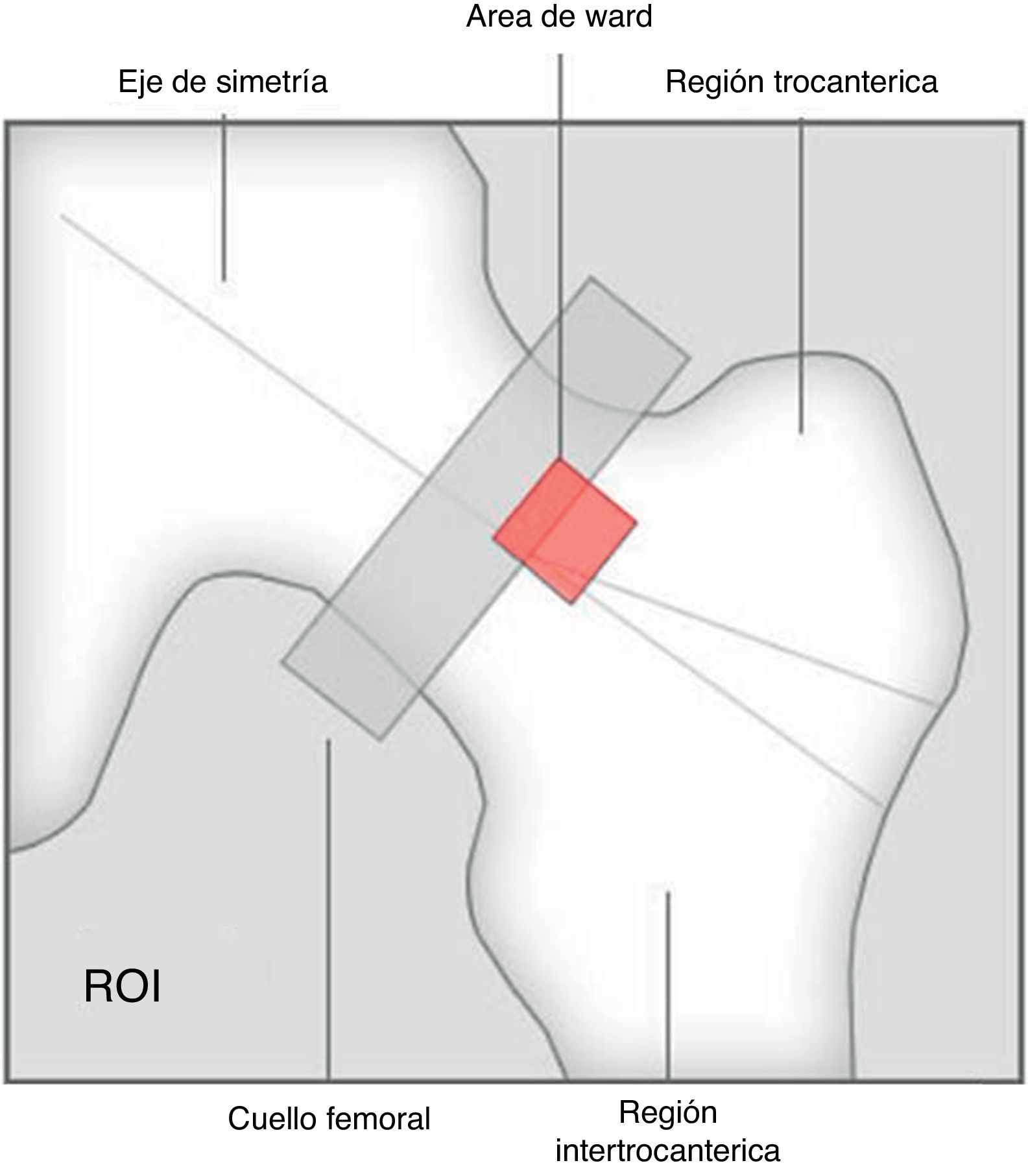
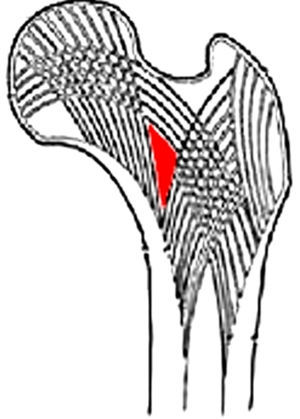
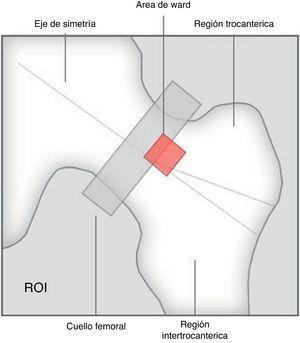
El fémur proximal ha sido correctamente centrado y la línea del trocánter correctamente trazada. El triángulo de Ward (figs. 3 y 4) no ha sido incluido en el cálculo, de acuerdo con las recomendaciones de la ISCD, ya que esta pequeña y mal definida área de la porción central del cuello del fémur presenta una concentración mínima de trabéculas óseas, podría llevar a la reducción del promedio de cálculo y, de paso, a la sobrestimación de la condición de osteoporosis8.
Para cada mujer se ha valorado también el índice de masa corporal (IMC).
Se ha realizado una medición adicional en la columna y la cadera en modalidad «autoanálisis», comparando los resultados con los obtenidos por ambos técnicos.
ResultadosLos datos obtenidos en modalidad automática corresponden a un valor de CMS constante pero objetivamente escaso; en cambio, las mediciones manuales realizadas tras el correcto posicionamiento y el centrado de la mujer, el escrupuloso posicionamiento de las ROI y la correcta utilización de la herramienta de adición y sustracción de hueso han permitido una precisión mayor y una significativa reducción del CMS.
En concreto, no se han evidenciado importantes diferencias entre los 2 técnicos y entre técnicos y autoanálisis en el rango de precisión para la columna, y sí mucha diferencia de valores en el rango de precisión para la cadera (0,007%; 0,021g/cm2), marcando, limitadamente a este segmento, la diferencia entre técnicos y autoanálisis.
La herramienta de autoanálisis se ha demostrado eficaz en la valoración de la DMO de la cadera (a condición de la exclusión del triángulo de Ward), con una precisión más constante que la de ambos técnicos. También en la valoración de la columna vertebral, los resultados conseguidos en modalidad autoanálisis han sido satisfactorios, con un CMS muy cercano al de ambos técnicos, pero únicamente si se utiliza en ausencia de patología vertebral (fig. 5).
Análogamente a los resultados conseguidos por Nelson et al.9, un incremento del IMC de 19 a 31kg/cm2 ha provocado un incremento lineal de 0,020 a 0,031g/cm2 del CMS para la columna lumbar, sin demostrar ningún impacto significativo del IMC en el CMS para la cadera. Siempre según Nelson et al.9, el CMS a nivel de la columna ha resultado ser determinado por el paciente y a nivel de la cadera por el técnico.
ConclusionesLas indicaciones de la ISCD pueden ser fácilmente cumplidas, a condición de que sean seguidas sus recomendaciones y los parámetros de adquisición.
La correcta monitorización de la DMO en mujeres en tratamiento con IA y BIS es confiable únicamente si es realizada siempre con el mismo equipo, en el mismo centro y posiblemente por el mismo técnico, y a condición que el CMS esté mantenido a los valores más bajos que sea posible.
Nota adicionalLa Organización Mundial de la Salud (OMS), en colaboración con la Universidad de Sheffield, ha desarrollado un algoritmo (FRAX®) basado en las instrucciones contenidas en el informe técnico «Evaluación de la osteoporosis en el nivel de atención primaria de salud»16 que, solo o en combinación datos densitométricos, permite la evaluación del riesgo a 10años para las mujeres posmenopáusicas17-20 (fig. 6).
Herramienta de cálculo (disponible on-line en: http://www.shef.ac.uk/FRAX/).
Los resultados de un estudio controlado retrospectivo en un grupo de 402 mujeres posmenopáusicas con cáncer de mama recién diagnosticado han demostrado que mientras que la sola evaluación de la DMO identificaba un número de mujeres <10%, en el grupo al que se hacía necesario el tratamiento la combinación de la densitometría con la evaluación de los factores de riesgo lograba identificar un número superior a 28%21, confirmando que la evaluación de los factores de riesgo en combinación con la DMO predice mejor el riesgo de fractura que los factores de riesgo clínicos o la DMO sola. De hecho, el uso del FRAX® sin DMO es apropiado cuando la DMO no está fácilmente disponible o para identificar individuos que pueden beneficiarse de una medición con DMO22.
Los beneficios de la evaluación de la precisión junto a una predicción fiable de riesgo se traducen en un beneficio directo para los pacientes, permitiendo al médico tomar decisiones clínicas basadas tanto en la estabilidad real como en cambios en la DMO15, y también en un posible ahorro en términos de gasto sanitario1.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.