Las guías clínicas de colitis ulcerosa (CU) recogen la mejor evidencia disponible, aunque no todas las situaciones clínicas quedan respondidas, por lo que su manejo puede ser motivo de controversia. El objetivo de este estudio es identificar las situaciones de la CU leve a moderada susceptibles de controversia y evaluar el grado de acuerdo o desacuerdo a propuestas concretas.
MétodosMediante reuniones de debate de expertos en enfermedad inflamatoria intestinal (EII) se identificaron criterios, actitudes y opiniones respecto al manejo de la CU. A continuación se elaboró un cuestionario Delphi con 60 aseveraciones relativas a antibióticos, salicilatos y probióticos, corticoides locales, sistémicos y tópicos e inmunosupresores.
ResultadosSe alcanzó consenso en 44 aseveraciones (73,3%); 32 en el acuerdo (53,3%) y 12 en el desacuerdo (20,0%). Algunos de ellos fueron: no es necesario el uso sistemático de antibióticos a pesar de la gravedad del brote, quedando reservados ante la sospecha de infección o toxicidad sistémica; ante un brote leve-moderado de CU y en pacientes que no responden a aminosalicilatos es adecuado utilizar una dosis de beclometasona de 10mg/día durante un mes y 5mg/día durante otro mes; se aconseja que la dosis de azatioprina se administre en una única dosis.
ConclusionesLos expertos en EII coinciden en la mayoría de las propuestas identificadas para manejar la CU leve a moderada y se constata la necesidad de evidencia científica en algunas situaciones concretas en las que conocer la opinión de expertos puede resultar de ayuda.
Ulcerative colitis (UC) clinical guidelines include the best available evidence, although not all clinical situations are answered, so their management can be controversial. The aim of this study is to identify the situations of mild to moderate UC susceptible to controversy and to evaluate the degree of agreement or disagreement with specific proposals.
MethodsInflammatory bowel disease (IBD) expert discussion meetings were used to identify criteria, attitudes and opinions regarding the management of UC. A Delphi questionnaire was then developed with 60 items regarding antibiotics, salicylates and probiotics; local, systemic and topical corticosteroids; and immunosuppressants.
ResultsConsensus was reached in 44 statements (73.3%); 32 in agreement (53.3%) and 12 in disagreement (20.0%). Some of them were: it is not necessary the systematic use of antibiotics despite the severity of the outbreak, being reserved when there is suspicion of infection or systemic toxicity; when faced with a mild-moderate outbreak of UC and in patients who do not respond to aminosalicylates, it is appropriate to use a dose of beclomethasone of 10mg/day for one month and 5mg/day for another month; it is advised that the dose of azathioprine be administered in a single dose.
ConclusionsIBD experts agree on most of the proposals identified for managing mild to moderate UC and there is a need for scientific evidence in some specific situations where expert opinion may be helpful.
La colitis ulcerosa (CU) es una enfermedad inflamatoria intestinal (EII) crónica cuya etiología, de tipo multifactorial, solo es parcialmente conocida. Al no existir un criterio único para su definición, el diagnóstico se realiza mediante una combinación de criterios clínicos, endoscópicos e histológicos, excluyendo aquellas enfermedades infecciosas que se manifiestan de forma similar1. Su extensión y su gravedad pueden variar de unos individuos a otros e incluso a lo largo del tiempo, lo que obliga a distinguir estrategias de tratamiento en función de la actividad de la enfermedad y su historia previa. Para su tratamiento se emplean diversos principios activos, como aminosalicilatos, corticoides, inmunosupresores y fármacos biológicos2–4.
Existen diferentes guías clínicas que ofrecen recomendaciones para el tratamiento de la CU5–12, todas ellas bien definidas y respaldadas por evidencia científica. Sin embargo, existen situaciones en las que estas recomendaciones no son llevadas a la práctica clínica por diferentes motivos, o hay prácticas clínicas habituales no recogidas en las recomendaciones por falta de evidencia científica al no haber sido evaluadas. En unas ocasiones la aparición de nuevos estudios clínicos tras la publicación de las guías hace que estas puedan quedar obsoletas. En otras, la propia práctica clínica muestra que hay alternativas que no se han tenido en cuenta o no son adecuadas para determinados pacientes.
El objetivo de este estudio fue identificar aquellas situaciones en las que los expertos en EII tratan a los pacientes con CU de una forma que no refleja el contenido de las recomendaciones de las guías clínicas, o simplemente no están recogidos tales supuestos en las guías. También se valoró el grado de acuerdo entre los especialistas acerca del manejo de los pacientes con CU leve a moderada que presentan dichas situaciones clínicas. Para ello, se llevaron a cabo 2 actuaciones: reuniones de debate con expertos en EII y un consenso con metodología Delphi. Mediante las reuniones de debate se pretendía conocer cuál es la práctica habitual en el tratamiento de la CU de los expertos que participaron en ellas, así como sus inquietudes y reflexiones sobre el tema. A partir de las conclusiones de estas reuniones se elaboró un cuestionario Delphi compuesto de aseveraciones en las que se recogían los temas más controvertidos, complejos o carentes de evidencia para conocer el grado de acuerdo de los expertos en relación con dichas aseveraciones.
MétodosDiseño del estudioEl estudio fue diseñado empleando un método Delphi modificado, una técnica de comunicación estructurada que permite a un grupo de expertos explorar y unificar las opiniones sobre un determinado tema complejo o controvertido para el que no se dispone de suficiente evidencia o su conocimiento es incompleto o incierto13,14.
El estudio fue llevado a cabo en varias fases: 1) creación de un comité científico de expertos; 2) elaboración de una encuesta sobre la práctica clínica habitual en el tratamiento de la CU; 3) revisión de la bibliografía más reciente sobre las recomendaciones terapéuticas de la CU; 4) exposición de la evidencia hallada en 6 reuniones virtuales para comparar y debatir la práctica clínica real con las recomendaciones de las guías clínicas; 5) elaboración de un cuestionario Delphi con aseveraciones relativas a las controversias consideradas más relevantes; 6) consenso Delphi de 2 rondas para conocer la opinión de un panel de expertos; y 7) recopilación, análisis y discusión de los resultados del consenso Delphi para elaborar unas conclusiones.
ParticipantesEn el estudio participaron especialistas en EII, bien como miembros del comité científico, bien como miembros del panel de expertos, así como un equipo técnico. El comité científico constó de un coordinador y 6 expertos en el tratamiento de la CU de la especialidad de aparato digestivo, cuya función fue elaborar una encuesta para conocer la práctica clínica habitual en el tratamiento de la CU, revisar la bibliografía más reciente sobre el tratamiento de la CU, liderar las diversas reuniones de debate y elaborar el cuestionario Delphi. El equipo técnico, que dirigió y supervisó todo el proceso, fue el responsable de la implementación instrumental del método (búsqueda de la bibliografía, distribución de la encuesta y el cuestionario Delphi, análisis de las respuestas e interpretación estadística del consenso). El panel de expertos estaba constituido por profesionales sanitarios de las especialidades de aparato digestivo con reconocida experiencia clínica en CU. Este panel constó de 50 expertos y se procuró disponer de una adecuada representación territorial de todas las comunidades autónomas de España.
Reuniones locales previas al consensoCon el objetivo de conocer la práctica clínica habitual en el tratamiento de la CU, más allá de las recomendaciones de las guías clínicas, el comité científico elaboró una encuesta que fue enviada al panel de expertos. Para poder debatir los resultados obtenidos en la encuesta, se llevaron a cabo 6 reuniones de ámbito territorial y en formato virtual en las que se mostraron las recomendaciones basadas en la evidencia científica publicada. Estas se compararon con la práctica clínica de los panelistas. En cada reunión participó un miembro del comité científico y alrededor de 8 a 10 expertos.
Cuestionario DelphiA partir de las conclusiones obtenidas en las reuniones locales se elaboró un cuestionario Delphi de 60 aseveraciones que recogían las controversias más relevantes y que fueron agrupadas en los siguientes temas: antibióticos, salicilatos y probióticos (38 aseveraciones), corticoides locales, sistémicos y tópicos (14 aseveraciones) e inmunosupresores (8 aseveraciones).
Para la valoración del cuestionario se propuso una única escala ordinal tipo Likert de 9 puntos, según el modelo desarrollado por la UCLA-RAND Corporation para la valoración comparativa y priorización entre distintas opciones sanitarias (mínimo 1 —pleno desacuerdo— y máximo 9 —pleno acuerdo—)14. Esta escala fue estructurada en 3 grupos según el nivel de acuerdo-desacuerdo con la aseveración: de 1 a 3, interpretado como desacuerdo o rechazo; de 4 a 6, interpretado como sin acuerdo o sin desacuerdo; y de 7 a 9, interpretado como expresión de acuerdo o apoyo.
Fases del consenso DelphiSiguiendo el procedimiento de la metodología Delphi15, el cuestionario con las aseveraciones fue enviado al panel de expertos para que respondieran mostrando su grado de acuerdo con ellas. En la primera ronda los panelistas respondieron al cuestionario vía online y se les ofreció la posibilidad de añadir su opinión en texto abierto. Las aseveraciones no consensuadas fueron enviadas de nuevo a los panelistas para que fueran valoradas en una segunda ronda. El proyecto se cerró con una reunión del comité científico para debatir y analizar los resultados.
Análisis e interpretación de los resultadosPara analizar la opinión grupal y el tipo de consenso alcanzado sobre cada aseveración planteada se empleó la mediana y el intervalo intercuartílico de las puntuaciones obtenidas para cada aseveración. Se consideró que hubo consenso en cualquiera de ellas cuando 2/3 o más de los encuestados (≥66,7%) puntuaban dentro del rango de 3 puntos (1-3 o 7-9) que contiene la mediana. El tipo de consenso alcanzado en cada aseveración se determinó por el valor de la mediana de la puntuación. Había consenso en el acuerdo si la mediana era ≥7 y había consenso en el desacuerdo si la mediana era≤3.
Se consideró que no hubo consenso cuando las puntuaciones de 1/3 o más de los panelistas (≥33,3%) se situaban en el rango de 1 a 3 y otro tercio o más en el rango de 7 a 9. Cuando la mediana de la puntuación se situaba entre el rango de 4-6, las aseveraciones eran consideradas como inciertas para una mayoría representativa del grupo.
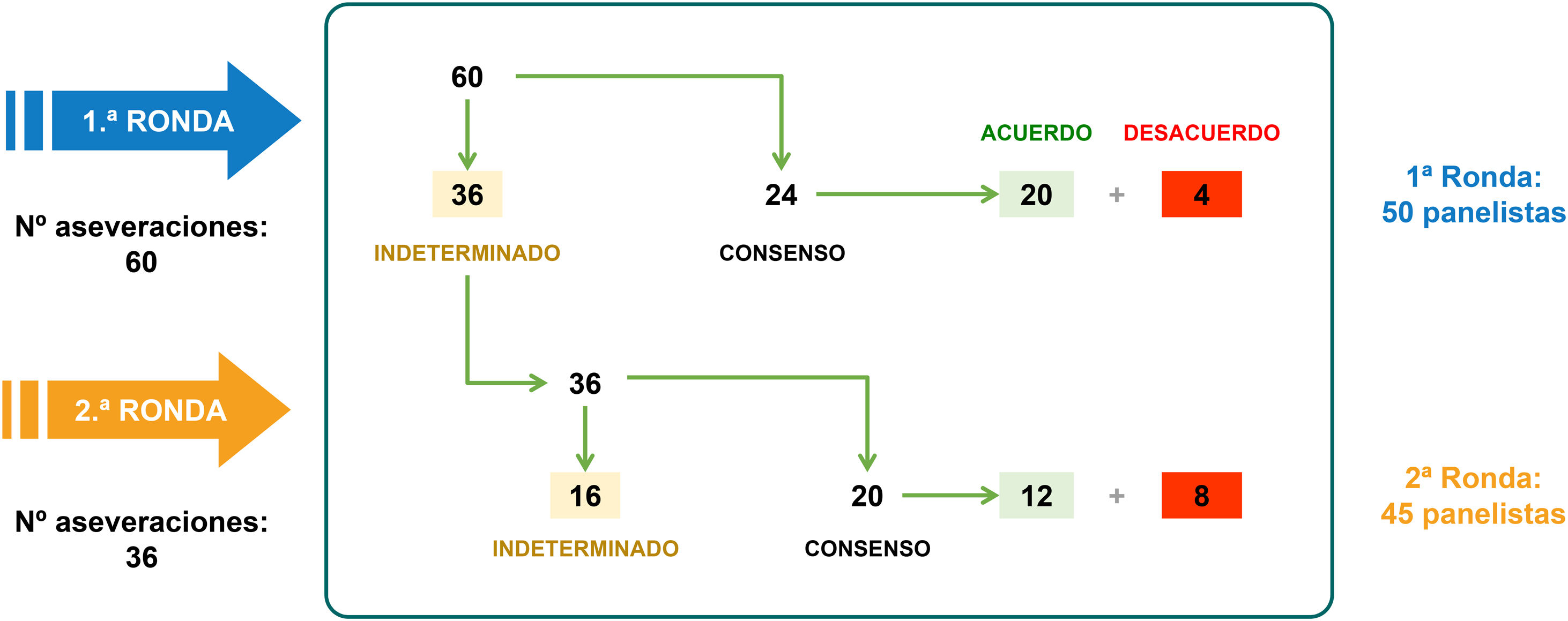
ResultadosConsenso DelphiDe los 50 expertos consultados, 45 completaron las 2 rondas del consenso Delphi sin proponer nuevas aseveraciones. En la primera ronda se alcanzó el consenso en 24 de las 60 aseveraciones: 20 en el acuerdo y 4 en el desacuerdo. En la segunda ronda se devolvieron 36 aseveraciones para su reconsideración y se alcanzó el consenso en 20 de ellas: 12 en el acuerdo y 8 en el desacuerdo. Tras 2 rondas se alcanzó un consenso en 44 aseveraciones (73,3%); 32 en el acuerdo (53,3%) y 12 en el desacuerdo (20,0%). En las 16 aseveraciones restantes (26,7%) no hubo ni acuerdo ni desacuerdo. La figura 1 muestra los resultados de las 2 rondas y las tablas 1 a 3 los resultados globales de todas las aseveraciones analizadas.
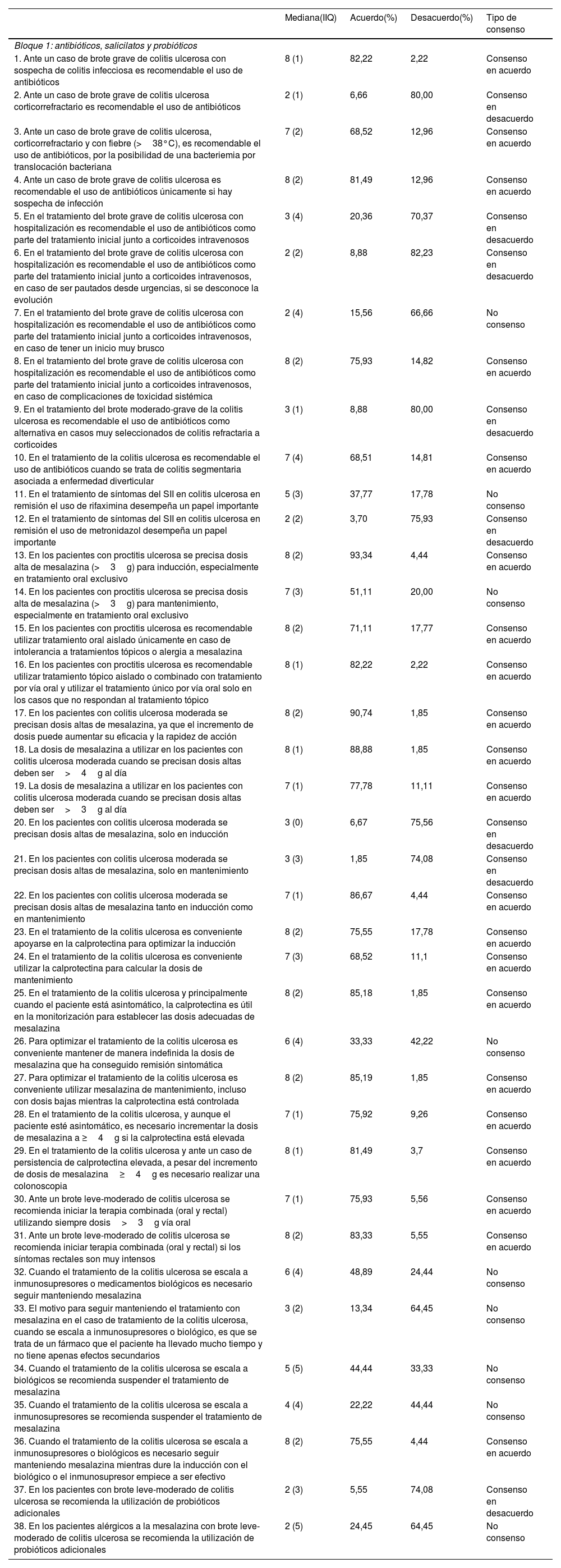
Bloque 1: antibióticos, salicilatos y probióticosDe las 38 aseveraciones propuestas sobre el uso de antibióticos, salicilatos y probióticos, tras 2 rondas fueron consensuadas 29: 21 en el acuerdo y 8 en el desacuerdo. Las 9 aseveraciones restantes no fueron consensuadas (tabla 1). De entre las aseveraciones consensuadas la que obtuvo más acuerdo exponía que los pacientes con proctitis ulcerosa precisan una dosis alta de mesalazina (>3g) para la inducción, especialmente en tratamiento oral exclusivo (aseveración 13; 93,3% de acuerdo). Por el contrario, la aseveración que obtuvo más desacuerdo indicaba que, en los brotes graves de CU con hospitalización, es recomendable el uso de antibióticos como parte del tratamiento inicial junto a corticoides intravenosos en caso de ser pautados desde urgencias si se desconoce la evolución (aseveración 6; 82,23% de desacuerdo).
Resultados obtenidos por el panel de expertos tras 2 rondas de consultas para el bloque de antibióticos, salicilatos y probióticos
| Mediana(IIQ) | Acuerdo(%) | Desacuerdo(%) | Tipo de consenso | |
|---|---|---|---|---|
| Bloque 1: antibióticos, salicilatos y probióticos | ||||
| 1. Ante un caso de brote grave de colitis ulcerosa con sospecha de colitis infecciosa es recomendable el uso de antibióticos | 8 (1) | 82,22 | 2,22 | Consenso en acuerdo |
| 2. Ante un caso de brote grave de colitis ulcerosa corticorrefractario es recomendable el uso de antibióticos | 2 (1) | 6,66 | 80,00 | Consenso en desacuerdo |
| 3. Ante un caso de brote grave de colitis ulcerosa, corticorrefractario y con fiebre (>38°C), es recomendable el uso de antibióticos, por la posibilidad de una bacteriemia por translocación bacteriana | 7 (2) | 68,52 | 12,96 | Consenso en acuerdo |
| 4. Ante un caso de brote grave de colitis ulcerosa es recomendable el uso de antibióticos únicamente si hay sospecha de infección | 8 (2) | 81,49 | 12,96 | Consenso en acuerdo |
| 5. En el tratamiento del brote grave de colitis ulcerosa con hospitalización es recomendable el uso de antibióticos como parte del tratamiento inicial junto a corticoides intravenosos | 3 (4) | 20,36 | 70,37 | Consenso en desacuerdo |
| 6. En el tratamiento del brote grave de colitis ulcerosa con hospitalización es recomendable el uso de antibióticos como parte del tratamiento inicial junto a corticoides intravenosos, en caso de ser pautados desde urgencias, si se desconoce la evolución | 2 (2) | 8,88 | 82,23 | Consenso en desacuerdo |
| 7. En el tratamiento del brote grave de colitis ulcerosa con hospitalización es recomendable el uso de antibióticos como parte del tratamiento inicial junto a corticoides intravenosos, en caso de tener un inicio muy brusco | 2 (4) | 15,56 | 66,66 | No consenso |
| 8. En el tratamiento del brote grave de colitis ulcerosa con hospitalización es recomendable el uso de antibióticos como parte del tratamiento inicial junto a corticoides intravenosos, en caso de complicaciones de toxicidad sistémica | 8 (2) | 75,93 | 14,82 | Consenso en acuerdo |
| 9. En el tratamiento del brote moderado-grave de la colitis ulcerosa es recomendable el uso de antibióticos como alternativa en casos muy seleccionados de colitis refractaria a corticoides | 3 (1) | 8,88 | 80,00 | Consenso en desacuerdo |
| 10. En el tratamiento de la colitis ulcerosa es recomendable el uso de antibióticos cuando se trata de colitis segmentaria asociada a enfermedad diverticular | 7 (4) | 68,51 | 14,81 | Consenso en acuerdo |
| 11. En el tratamiento de síntomas del SII en colitis ulcerosa en remisión el uso de rifaximina desempeña un papel importante | 5 (3) | 37,77 | 17,78 | No consenso |
| 12. En el tratamiento de síntomas del SII en colitis ulcerosa en remisión el uso de metronidazol desempeña un papel importante | 2 (2) | 3,70 | 75,93 | Consenso en desacuerdo |
| 13. En los pacientes con proctitis ulcerosa se precisa dosis alta de mesalazina (>3g) para inducción, especialmente en tratamiento oral exclusivo | 8 (2) | 93,34 | 4,44 | Consenso en acuerdo |
| 14. En los pacientes con proctitis ulcerosa se precisa dosis alta de mesalazina (>3g) para mantenimiento, especialmente en tratamiento oral exclusivo | 7 (3) | 51,11 | 20,00 | No consenso |
| 15. En los pacientes con proctitis ulcerosa es recomendable utilizar tratamiento oral aislado únicamente en caso de intolerancia a tratamientos tópicos o alergia a mesalazina | 8 (2) | 71,11 | 17,77 | Consenso en acuerdo |
| 16. En los pacientes con proctitis ulcerosa es recomendable utilizar tratamiento tópico aislado o combinado con tratamiento por vía oral y utilizar el tratamiento único por vía oral solo en los casos que no respondan al tratamiento tópico | 8 (1) | 82,22 | 2,22 | Consenso en acuerdo |
| 17. En los pacientes con colitis ulcerosa moderada se precisan dosis altas de mesalazina, ya que el incremento de dosis puede aumentar su eficacia y la rapidez de acción | 8 (2) | 90,74 | 1,85 | Consenso en acuerdo |
| 18. La dosis de mesalazina a utilizar en los pacientes con colitis ulcerosa moderada cuando se precisan dosis altas deben ser>4g al día | 8 (1) | 88,88 | 1,85 | Consenso en acuerdo |
| 19. La dosis de mesalazina a utilizar en los pacientes con colitis ulcerosa moderada cuando se precisan dosis altas deben ser>3g al día | 7 (1) | 77,78 | 11,11 | Consenso en acuerdo |
| 20. En los pacientes con colitis ulcerosa moderada se precisan dosis altas de mesalazina, solo en inducción | 3 (0) | 6,67 | 75,56 | Consenso en desacuerdo |
| 21. En los pacientes con colitis ulcerosa moderada se precisan dosis altas de mesalazina, solo en mantenimiento | 3 (3) | 1,85 | 74,08 | Consenso en desacuerdo |
| 22. En los pacientes con colitis ulcerosa moderada se precisan dosis altas de mesalazina tanto en inducción como en mantenimiento | 7 (1) | 86,67 | 4,44 | Consenso en acuerdo |
| 23. En el tratamiento de la colitis ulcerosa es conveniente apoyarse en la calprotectina para optimizar la inducción | 8 (2) | 75,55 | 17,78 | Consenso en acuerdo |
| 24. En el tratamiento de la colitis ulcerosa es conveniente utilizar la calprotectina para calcular la dosis de mantenimiento | 7 (3) | 68,52 | 11,1 | Consenso en acuerdo |
| 25. En el tratamiento de la colitis ulcerosa y principalmente cuando el paciente está asintomático, la calprotectina es útil en la monitorización para establecer las dosis adecuadas de mesalazina | 8 (2) | 85,18 | 1,85 | Consenso en acuerdo |
| 26. Para optimizar el tratamiento de la colitis ulcerosa es conveniente mantener de manera indefinida la dosis de mesalazina que ha conseguido remisión sintomática | 6 (4) | 33,33 | 42,22 | No consenso |
| 27. Para optimizar el tratamiento de la colitis ulcerosa es conveniente utilizar mesalazina de mantenimiento, incluso con dosis bajas mientras la calprotectina está controlada | 8 (2) | 85,19 | 1,85 | Consenso en acuerdo |
| 28. En el tratamiento de la colitis ulcerosa, y aunque el paciente esté asintomático, es necesario incrementar la dosis de mesalazina a ≥4g si la calprotectina está elevada | 7 (1) | 75,92 | 9,26 | Consenso en acuerdo |
| 29. En el tratamiento de la colitis ulcerosa y ante un caso de persistencia de calprotectina elevada, a pesar del incremento de dosis de mesalazina≥4g es necesario realizar una colonoscopia | 8 (1) | 81,49 | 3,7 | Consenso en acuerdo |
| 30. Ante un brote leve-moderado de colitis ulcerosa se recomienda iniciar la terapia combinada (oral y rectal) utilizando siempre dosis>3g vía oral | 7 (1) | 75,93 | 5,56 | Consenso en acuerdo |
| 31. Ante un brote leve-moderado de colitis ulcerosa se recomienda iniciar terapia combinada (oral y rectal) si los síntomas rectales son muy intensos | 8 (2) | 83,33 | 5,55 | Consenso en acuerdo |
| 32. Cuando el tratamiento de la colitis ulcerosa se escala a inmunosupresores o medicamentos biológicos es necesario seguir manteniendo mesalazina | 6 (4) | 48,89 | 24,44 | No consenso |
| 33. El motivo para seguir manteniendo el tratamiento con mesalazina en el caso de tratamiento de la colitis ulcerosa, cuando se escala a inmunosupresores o biológico, es que se trata de un fármaco que el paciente ha llevado mucho tiempo y no tiene apenas efectos secundarios | 3 (2) | 13,34 | 64,45 | No consenso |
| 34. Cuando el tratamiento de la colitis ulcerosa se escala a biológicos se recomienda suspender el tratamiento de mesalazina | 5 (5) | 44,44 | 33,33 | No consenso |
| 35. Cuando el tratamiento de la colitis ulcerosa se escala a inmunosupresores se recomienda suspender el tratamiento de mesalazina | 4 (4) | 22,22 | 44,44 | No consenso |
| 36. Cuando el tratamiento de la colitis ulcerosa se escala a inmunosupresores o biológicos es necesario seguir manteniendo mesalazina mientras dure la inducción con el biológico o el inmunosupresor empiece a ser efectivo | 8 (2) | 75,55 | 4,44 | Consenso en acuerdo |
| 37. En los pacientes con brote leve-moderado de colitis ulcerosa se recomienda la utilización de probióticos adicionales | 2 (3) | 5,55 | 74,08 | Consenso en desacuerdo |
| 38. En los pacientes alérgicos a la mesalazina con brote leve-moderado de colitis ulcerosa se recomienda la utilización de probióticos adicionales | 2 (5) | 24,45 | 64,45 | No consenso |
IIR: intervalo intercuartílico.
De entre las aseveraciones no consensuadas cabe destacar una que quedó en el límite del consenso en el desacuerdo. Esta aseveración decía que en el tratamiento del brote grave de CU con hospitalización, y en caso de tener un inicio muy brusco, es recomendable el uso de antibióticos como parte del tratamiento inicial junto a corticoides intravenosos (aseveración 7; 15,16% de acuerdo y 66,66% de desacuerdo).
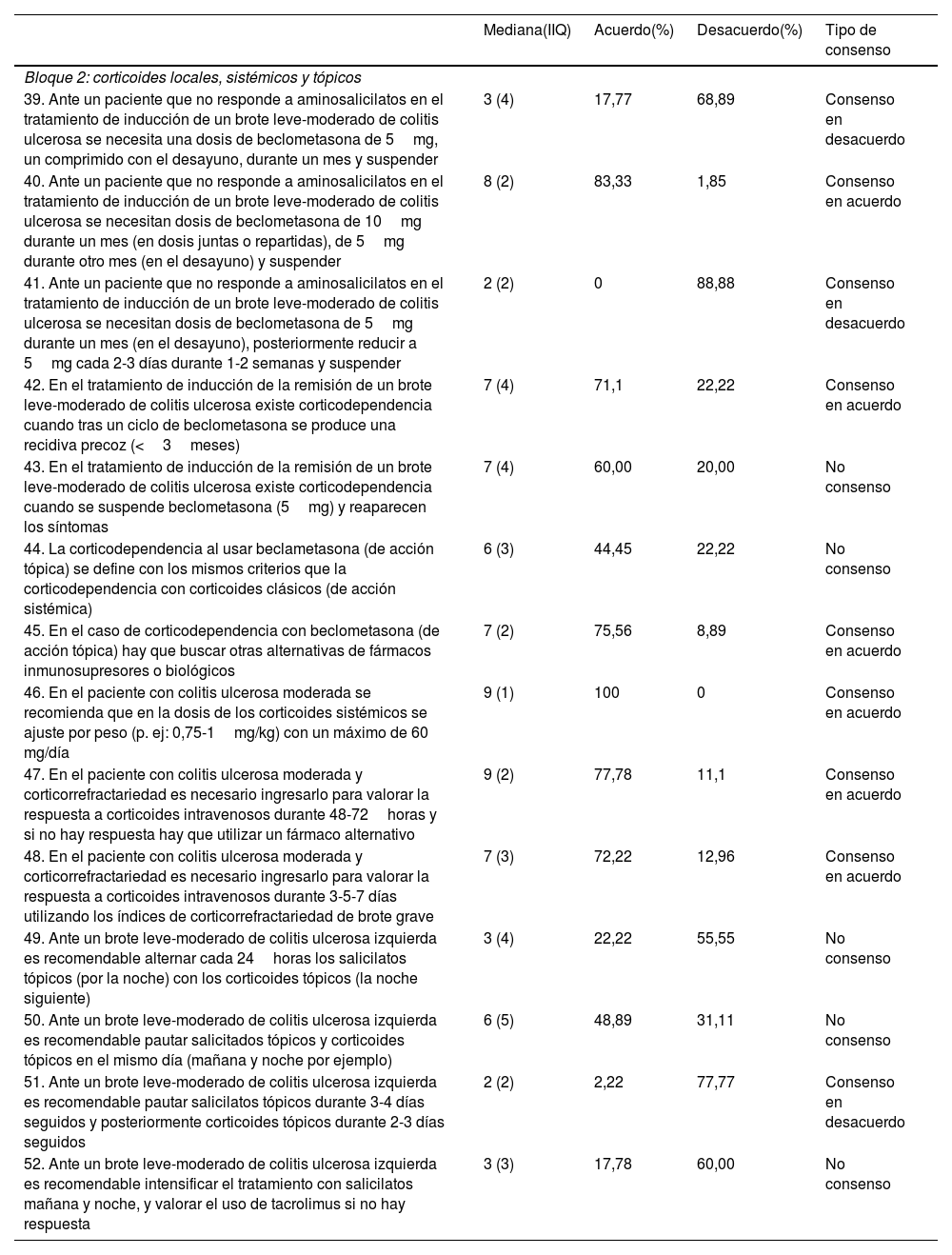
Bloque 2: corticoides locales, sistémicos y tópicosDe las 14 aseveraciones propuestas sobre el uso de corticoides locales, sistémicos y tópicos, tras 2 rondas fueron consensuadas 9: 6 en el acuerdo y 3 en el desacuerdo. Las 5 aseveraciones restantes no fueron consensuadas (tabla 2). La aseveración con mayor acuerdo exponía que la dosis de los corticoides sistémicos debe ajustarse por el peso en los pacientes con CU moderada, con un máximo de 60mg/kg (aseveración 46; 100% de acuerdo). La aseveración con mayor desacuerdo decía que, ante un paciente que no responde a aminosalicilatos en el tratamiento de inducción de un brote leve-moderado de CU, se necesitan dosis de beclometasona de 5mg durante un mes, posteriormente reducir a 5mg en días alternos durante una a 2 semanas y finalmente suspender (aseveración 41; 88,88% de desacuerdo).
Resultados obtenidos por el panel de expertos tras 2 rondas de consultas para el bloque de corticoides locales, sistémicos y tópicos
| Mediana(IIQ) | Acuerdo(%) | Desacuerdo(%) | Tipo de consenso | |
|---|---|---|---|---|
| Bloque 2: corticoides locales, sistémicos y tópicos | ||||
| 39. Ante un paciente que no responde a aminosalicilatos en el tratamiento de inducción de un brote leve-moderado de colitis ulcerosa se necesita una dosis de beclometasona de 5mg, un comprimido con el desayuno, durante un mes y suspender | 3 (4) | 17,77 | 68,89 | Consenso en desacuerdo |
| 40. Ante un paciente que no responde a aminosalicilatos en el tratamiento de inducción de un brote leve-moderado de colitis ulcerosa se necesitan dosis de beclometasona de 10mg durante un mes (en dosis juntas o repartidas), de 5mg durante otro mes (en el desayuno) y suspender | 8 (2) | 83,33 | 1,85 | Consenso en acuerdo |
| 41. Ante un paciente que no responde a aminosalicilatos en el tratamiento de inducción de un brote leve-moderado de colitis ulcerosa se necesitan dosis de beclometasona de 5mg durante un mes (en el desayuno), posteriormente reducir a 5mg cada 2-3 días durante 1-2 semanas y suspender | 2 (2) | 0 | 88,88 | Consenso en desacuerdo |
| 42. En el tratamiento de inducción de la remisión de un brote leve-moderado de colitis ulcerosa existe corticodependencia cuando tras un ciclo de beclometasona se produce una recidiva precoz (<3meses) | 7 (4) | 71,1 | 22,22 | Consenso en acuerdo |
| 43. En el tratamiento de inducción de la remisión de un brote leve-moderado de colitis ulcerosa existe corticodependencia cuando se suspende beclometasona (5mg) y reaparecen los síntomas | 7 (4) | 60,00 | 20,00 | No consenso |
| 44. La corticodependencia al usar beclametasona (de acción tópica) se define con los mismos criterios que la corticodependencia con corticoides clásicos (de acción sistémica) | 6 (3) | 44,45 | 22,22 | No consenso |
| 45. En el caso de corticodependencia con beclometasona (de acción tópica) hay que buscar otras alternativas de fármacos inmunosupresores o biológicos | 7 (2) | 75,56 | 8,89 | Consenso en acuerdo |
| 46. En el paciente con colitis ulcerosa moderada se recomienda que en la dosis de los corticoides sistémicos se ajuste por peso (p. ej: 0,75-1mg/kg) con un máximo de 60 mg/día | 9 (1) | 100 | 0 | Consenso en acuerdo |
| 47. En el paciente con colitis ulcerosa moderada y corticorrefractariedad es necesario ingresarlo para valorar la respuesta a corticoides intravenosos durante 48-72horas y si no hay respuesta hay que utilizar un fármaco alternativo | 9 (2) | 77,78 | 11,1 | Consenso en acuerdo |
| 48. En el paciente con colitis ulcerosa moderada y corticorrefractariedad es necesario ingresarlo para valorar la respuesta a corticoides intravenosos durante 3-5-7 días utilizando los índices de corticorrefractariedad de brote grave | 7 (3) | 72,22 | 12,96 | Consenso en acuerdo |
| 49. Ante un brote leve-moderado de colitis ulcerosa izquierda es recomendable alternar cada 24horas los salicilatos tópicos (por la noche) con los corticoides tópicos (la noche siguiente) | 3 (4) | 22,22 | 55,55 | No consenso |
| 50. Ante un brote leve-moderado de colitis ulcerosa izquierda es recomendable pautar salicitados tópicos y corticoides tópicos en el mismo día (mañana y noche por ejemplo) | 6 (5) | 48,89 | 31,11 | No consenso |
| 51. Ante un brote leve-moderado de colitis ulcerosa izquierda es recomendable pautar salicilatos tópicos durante 3-4 días seguidos y posteriormente corticoides tópicos durante 2-3 días seguidos | 2 (2) | 2,22 | 77,77 | Consenso en desacuerdo |
| 52. Ante un brote leve-moderado de colitis ulcerosa izquierda es recomendable intensificar el tratamiento con salicilatos mañana y noche, y valorar el uso de tacrolimus si no hay respuesta | 3 (3) | 17,78 | 60,00 | No consenso |
IIR: intervalo intercuartílico.
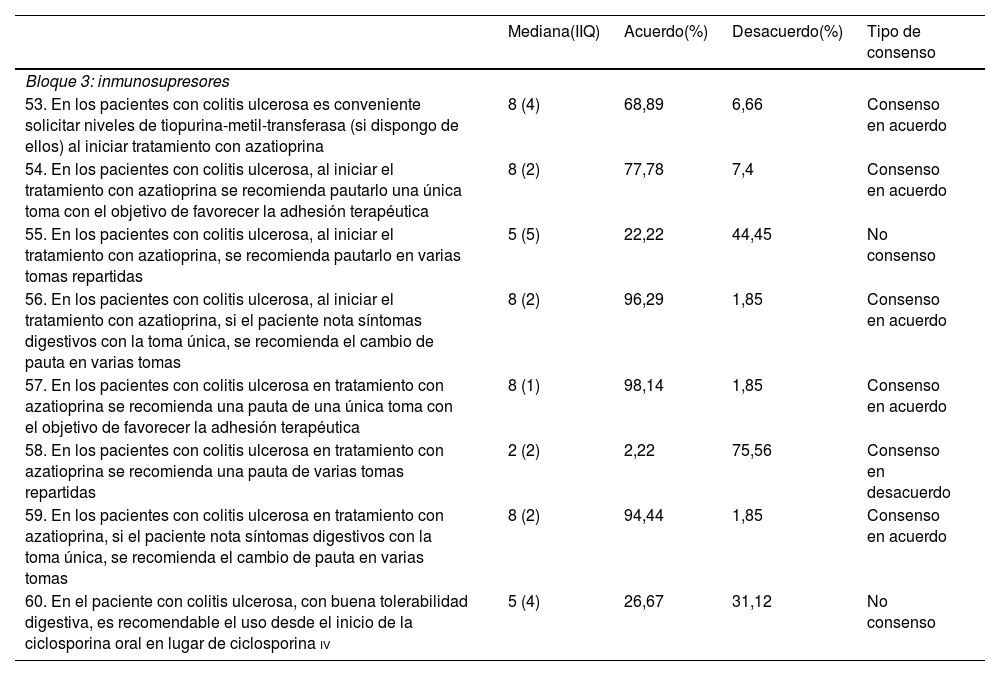
De las 8 aseveraciones sobre el uso de inmunosupresores 6 fueron consensuadas: 5 en el acuerdo y una en el desacuerdo. Las 2 restantes no fueron consensuadas (tabla 3). La aseveración con mayor grado de acuerdo exponía que en los pacientes con CU en tratamiento con azatioprina se recomienda una pauta de una única toma con el objetivo de favorecer la adhesión terapéutica (aseveración 57; 98,14% de acuerdo). La aseveración con mayor desacuerdo decía que los pacientes en tratamiento con azatioprina deben recibir una pauta de varias tomas repartidas (aseveración 58; 75,56% de desacuerdo).
Resultados obtenidos por el panel de expertos tras 2 rondas de consultas para el bloque de inmunosupresores
| Mediana(IIQ) | Acuerdo(%) | Desacuerdo(%) | Tipo de consenso | |
|---|---|---|---|---|
| Bloque 3: inmunosupresores | ||||
| 53. En los pacientes con colitis ulcerosa es conveniente solicitar niveles de tiopurina-metil-transferasa (si dispongo de ellos) al iniciar tratamiento con azatioprina | 8 (4) | 68,89 | 6,66 | Consenso en acuerdo |
| 54. En los pacientes con colitis ulcerosa, al iniciar el tratamiento con azatioprina se recomienda pautarlo una única toma con el objetivo de favorecer la adhesión terapéutica | 8 (2) | 77,78 | 7,4 | Consenso en acuerdo |
| 55. En los pacientes con colitis ulcerosa, al iniciar el tratamiento con azatioprina, se recomienda pautarlo en varias tomas repartidas | 5 (5) | 22,22 | 44,45 | No consenso |
| 56. En los pacientes con colitis ulcerosa, al iniciar el tratamiento con azatioprina, si el paciente nota síntomas digestivos con la toma única, se recomienda el cambio de pauta en varias tomas | 8 (2) | 96,29 | 1,85 | Consenso en acuerdo |
| 57. En los pacientes con colitis ulcerosa en tratamiento con azatioprina se recomienda una pauta de una única toma con el objetivo de favorecer la adhesión terapéutica | 8 (1) | 98,14 | 1,85 | Consenso en acuerdo |
| 58. En los pacientes con colitis ulcerosa en tratamiento con azatioprina se recomienda una pauta de varias tomas repartidas | 2 (2) | 2,22 | 75,56 | Consenso en desacuerdo |
| 59. En los pacientes con colitis ulcerosa en tratamiento con azatioprina, si el paciente nota síntomas digestivos con la toma única, se recomienda el cambio de pauta en varias tomas | 8 (2) | 94,44 | 1,85 | Consenso en acuerdo |
| 60. En el paciente con colitis ulcerosa, con buena tolerabilidad digestiva, es recomendable el uso desde el inicio de la ciclosporina oral en lugar de ciclosporina iv | 5 (4) | 26,67 | 31,12 | No consenso |
IIR: intervalo intercuartílico.
A pesar de la existencia de numerosas guías clínicas sobre el tratamiento de la CU, aún existen dudas no resueltas por los estudios publicados sobre el uso práctico de antibióticos y algunos aspectos relacionados con el uso de aminosalicilatos, así como sobre el uso de corticoides e inmunosupresores. Aunque los expertos consultados mostraron un elevado grado de acuerdo con las aseveraciones propuestas (53,3%), se mostraron en desacuerdo con un número no despreciable de ellas (20,0%). Incluso para el 26,7% de las aseveraciones no hubo un posicionamiento claro, por lo que quedaron sin consensuar. Todo ello pone de manifiesto que en determinados casos concretos de manejo de la CU, la opinión y el criterio de los expertos respecto a las mismas cuestiones resulta notablemente discrepante.
Bloque 1: antibióticos, salicilatos y probióticosRespecto al uso de antibióticos en la CU grave, se concluyó que no era necesario su uso sistemático a pesar de la gravedad del brote, la necesidad de ingreso hospitalario o rapidez con la que se produjo el mismo, quedando reservados ante la sospecha elevada de infección asociada o toxicidad sistémica. Este consenso coincide con lo expresado en las guías clínicas respecto al uso de antibióticos5,8. Otro de los escenarios en los que se alcanzó acuerdo en el uso de antibióticos en la CU fue la existencia de colitis segmentaria asociada a enfermedad diverticular (rifaximina), pero no en el síndrome de intestino irritable asociado a CU, en contraste, en este caso, con las guías clínicas en las que se contemplan estas situaciones5,16,17.
Sobre los salicilatos en la CU no se alcanzó un acuerdo respecto al uso de dosis elevadas en la proctitis ulcerosa para mantenimiento, especialmente en tratamiento oral exclusivo, pero sí para algunos pacientes con CU moderada (3-4g). La evidencia disponible sobre las dosis de salicilatos incluye estudios realizados con diferentes dosis en distintos contextos5,8,18. Otro de los aspectos consensuados fue el uso de calprotectina fecal para optimizar la dosis de salicilatos en CU. Los datos disponibles indican que solo se consigue una significación estadística en cuanto al efecto dosis-respuesta y remisión endoscópica frente a placebo a dosis mayores de 3g3,5,8,19. Un escenario debatido respecto al que no se alcanzó acuerdo fue la persistencia del tratamiento con salicilatos en los pacientes que precisen tratamiento con inmunosupresores y biológicos por escasez de evidencia, si bien la opinión generalizada fue a favor de su mantenimiento, al menos durante la inducción con inmunosupresores y/o biológicos. A este respecto lo que se ha comprobado es que la suspensión de los salicilatos en pacientes con CU que van a iniciar tratamiento con anti-TNF no incrementa el riesgo de acontecimientos adversos20.
Finalmente, la evidencia respecto al uso de probióticos es muy limitada en la CU, lo que quedó reflejado en la falta de acuerdo acerca de su uso en pacientes con CU y alergia a salicilatos21.
Bloque 2: corticoides locales, sistémicos y tópicosA pesar de que la dosis utilizada en los 5 ensayos clínicos que validan la utilización de beclometasona en la inducción del brote leve-moderado de la CU sin respuesta a aminosalicilatos fue de 5mg/día durante un mes22, en la práctica clínica la dosis más utilizada es de 10mg/día durante un mes y, posteriormente, 5mg/día durante un mes. Esta última pauta fue la identificada con mayor consenso en este estudio por parte de los especialistas, y probablemente se base en el estudio de casos de Papi et al., que sin ser un ensayo clínico, publicó porcentajes superiores de remisión con esta estrategia23.
La corticodependencia fue otro punto controvertido en el escenario de utilización de estos corticoides orales de acción tópica, pero los panelistas no llegaron a un consenso sobre su definición. Esto contrasta con la definición de corticodependencia para los corticoides sistémicos, en los que está claramente establecida5. De hecho, en este escenario específico se consensuó la necesidad de evaluar fármacos inmnunosupresores o biológicos.
La indicación de ingreso hospitalario y la utilización de corticoides endovenosos en situación de corticorrefractariedad, antes de cambiar de estrategia de tratamiento, es otro escenario no especificado en las guías clínicas. Sin embargo, según el panel de expertos, en la práctica clínica hay acuerdo en su utilización al menos 48-72horas.
Por último, la utilización de corticoides tópicos en pacientes con CU izquierda es un aspecto individual de cada experto sin llegarse a ninguna conclusión de cómo se debe pautar; bien es verdad que la evidencia en este escenario proviene de un ensayo clínico muy antiguo que utilizaba una fórmula magistral asociando mesalazina y corticoide en el mismo preparado24, acción que no se puede implementar hoy en día como tal y que ha llevado a esta variabilidad de utilización.
Bloque 3: inmunosupresoresEn el presente análisis se pone de manifiesto que existen dudas, no resueltas por los distintos estudios publicados, respecto del uso práctico de los inmunosupresores. El manejo de este grupo de fármacos en el tratamiento de los pacientes con EII se realiza por la mayoría de los especialistas, según su habilidad y en función de lo que hayan ido aprendiendo con la experiencia.
Existe acuerdo, y así nos lo dicen las guías, en solicitar los niveles de tiopurina-metil-transferasa cuando se plantee iniciar tratamiento con azatioprina6. Sin embargo, no todos los especialistas usan la dosis completa desde el principio, o le indican al paciente que tome la dosis completa en una única toma. La aparición de acontecimientos adversos es temida por los especialistas, aunque en el caso de los acontecimientos adversos digestivos existe consenso en tratar de repartir la dosis en varias tomas para intentar mantener el tratamiento con azatioprina.
El metotrexato no está aprobado para el tratamiento de la CU, aunque algunos especialistas lo utilizan por vía oral. La ciclosporina sí está indicada para el manejo del brote grave de la CU, existiendo múltiples estudios que demuestran su eficacia por vía intravenosa5,25. En nuestro estudio se planteaba si, en caso de buena tolerancia digestiva, se podría considerar su empleo por vía oral en lugar de intravenosa. Los resultados obtenidos confirman que no existe consenso en este sentido, aunque en algunos centros emplean la ciclosporina de forma habitual por vía oral con aparentes buenos resultados. Varios estudios han demostrado que la formulación oral es igual o más eficaz que la intravenosa26–29.
Limitaciones del estudioLas limitaciones de este estudio son similares a las de otros con un diseño comparable. Las respuestas de los panelistas son siempre subjetivas y han de tomarse con precaución para ser extrapoladas a la práctica clínica global. Para minimizar una posible influencia en el consenso, el promotor no participó en el desarrollo del estudio. La principal fortaleza del estudio es el disponer de la opinión de 50 expertos que llegaron a matizar sus respuestas tras la segunda ronda del consenso, lo que permite dar a conocer a otros profesionales sanitarios la situación a la que se enfrenta el resto y facilitar su trabajo con los pacientes.
ConclusionesDe las propuestas identificadas por los expertos para el manejo de determinadas situaciones clínicas de la CU (por sus particularidades, su complejidad, sus peculiaridades en cuanto a la evidencia disponible o su previsible controversia, recogidas o no por las guías clínicas), se alcanzó consenso en la mayor parte de ellas, lo que pone de manifiesto que, a pesar de la dificultad, complejidad o falta de evidencia en que se toman algunas decisiones, los expertos coinciden en la mayor parte de los casos. Por otra parte, la falta de consenso en una parte de las propuestas refleja la necesidad y la importancia de disponer de evidencia científica amplia y de calidad. Dado que los especialistas se enfrentan a todas las situaciones clínicas analizadas en el presente estudio, conocer la opinión y el grado de consenso de los expertos puede resultar de ayuda para optimizar el manejo de la CU leve a moderada.
Consideraciones éticasEl trabajo no implicó la participación de pacientes, por lo que no requirió la aprobación de un comité ético de investigación clínica.
FinanciaciónChiesi ha patrocinado este proyecto sin participar en modo alguno en el diseño, el análisis de datos o la redacción de este artículo.
Conflicto de interesesMiquel Sans Cuffi no tiene conflicto de intereses.
Federico Argüelles Arias ha participado en presentaciones/advisory boards/investigaciones promovidas por Janssen, MSD, Abbvie, Pfizer, Kern Pharma, Biogen, Sandoz, Takeda, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Tillotts Pharma, Gebro Pharma, Amgen y Vifor Pharma.
Ana Echarri Piudo no tiene conflicto de intereses.
Daniel Ginard Vicens no tiene conflicto de intereses.
Ana Gutiérrez Casbas no tiene conflicto de intereses.
Ignacio Marín-Jiménez ha sido ponente, consultor o ha recibido financiación para investigación de Abbvie, Amgen, Biogen, Celltrion, Fresenius, Ferring, Dr. Falk Pharma, Hospira, Janssen, MSD, Otsuka Pharmaceutical, Pfizer, Sandoz, Shire Pharmaceuticals, Takeda y Tillotts Pharma.
Los autores desean agradecer a la Unidad de Investigación de Luzán 5 (Madrid) por la asistencia en el diseño y la coordinación; y a Fernando Sánchez Barbero PhD por el apoyo en la preparación de este manuscrito.