Las infecciones por bacterias multirresistentes en pacientes cirróticos se encuentran en aumento y se asocian a una mayor morbimortalidad.
ObjetivosEstudiar la epidemiología y los factores de riesgo y pronósticos de las infecciones por gérmenes multirresistentes en pacientes cirróticos.
Pacientes y métodosEstudio retrospectivo en el que se analizaron a pacientes con cirrosis hepática que presentaron una infección al ingreso o durante la hospitalización entre julio del 2014 y agosto del 2016 en el Hospital Universitario y Politécnico La Fe (Valencia, España).
ResultadosLa infección urinaria (30,2%) y la peritonitis bacteriana espontánea (22,1%) fueron las infecciones más frecuentes. Se analizaron 102 aislamientos microbiológicos: el 50% en infecciones comunitarias, el 36% en asociadas a los cuidados de la salud y el 14% en nosocomiales. Escherichia coli fue el germen más frecuentemente aislado (29,4%). La tasa de multirresistencia fue del 28,4%. El análisis univariante mostró que la infección por gérmenes multirresistentes (28,4%) se asoció a infección nosocomial respecto a las asociadas a los cuidados de la salud (OR 5,46; IC del 95%: 1,22-24,43; p = 0,039) y asociada a los cuidados de la salud (respecto a las comunitarias OR 3,39; IC del 95%: 1,09-10,54; p = 0,048), uso de antibióticos (OR 4,37; IC del 95%: 1,59-11,99; p = 0,005) e ingreso hospitalario en los últimos 90 días (OR 3,18; IC del 95%: 1,19-8,47; p = 0,018), neoplasia activa (OR 2,93; IC del 95%: 1,08-7,99; p = 0,038) y toma de norfloxacino profiláctico (OR 3; IC del 95%: 1,02-8,79; p = 0,012). Además, se asoció a mayor frecuencia de sepsis (OR 3,13; IC del 95% 1,18-8,32; p = 0,025). El fracaso del tratamiento inicial se relacionó con mayor desarrollo de insuficiencia renal aguda (p < 0,001), sepsis (p = 0,012), shock séptico (p = 0,002), ingreso en UCI (p < 0,001) y mortalidad (p < 0,001).
ConclusiónLa tasa de infecciones por gérmenes multirresistentes en nuestro centro es comparable con la de otros centros europeos de características similares. Los resultados obtenidos hacen recomendable la adopción de las pautas de tratamiento antibiótico contempladas en las guías de práctica clínica actuales, limitando el uso de carbapenemes a las infecciones nosocomiales y a las asociadas a los cuidados de salud con otros factores de riesgo de multirresistencia o con signos de gravedad. Un tratamiento empírico adecuado de forma precoz se correlaciona con un mejor pronóstico.
Infections in cirrhotic patients caused by multidrug-resistant bacteria are currently increasing and are associated with greater morbidity and mortality.
ObjectivesTo assess the epidemiology, risk factors and prognoses of infections caused by multidrug-resistant bacterial infections in cirrhotic patients.
Patients and methodsRetrospective study on patients with liver cirrhosis who developed an infection during hospitalisations between July 2014 and August 2016 at our centre (Hospital Universitari i Politècnic La Fe, Valencia, Spain).
ResultsUrinary tract infection (30.2%) and spontaneous bacterial peritonitis (22.1%) were the most common infections. A total of 102 microbiological isolates were analysed: 50% in community-acquired infections, 36% in isolates associated with healthcare infections and 14% in nosocomial infections. Escherichia coli was the main aetiology (29.4%). The overall multiresistance rate was 28.4%. The univariate analysis showed that infection caused by multidrug-resistant bacteria (28.4%) was associated with nosocomial infection compared to those associated with healthcare (OR 5.46; 95% CI: 1.22–24.43; P=.039) and healthcare-associated infections (compared to community-acquired infections, OR 3.39; 95% CI: 1.09–10.54; P=.048), use of antibiotics (OR 4.37; 95% CI: 1.59–11.99; P=.005), hospital admission in the previous 90 days (OR 3.18; 95% CI: 1.19–8.47; P=.018), active cancer (OR 2.93; 95% CI: 1.08–7.99; P=.038), and use of prophylactic norfloxacin (OR 3; 95% CI: 1.02–8.79; P=.012). Moreover, it was associated with a higher rate of sepsis (OR 3.13; 95% CI: 1.18–8.32; P=.025). The failure of initial treatment was related to greater development of acute renal failure (P<.001), sepsis (P=.012), septic shock (P=.002), ICU admission (P<.001) and mortality (P<.001).
ConclusionThe rate of multidrug-resistant bacteria infections in our centre is comparable to that of other European centres with similar characteristics. The results obtained make it recommendable to implement the antibiotic treatment guidelines in current clinical practice guidelines, limiting the use of carbapenems to nosocomial infections and healthcare-associated infections with other risk factors of multidrug resistance or signs of severe sepsis. Early and adequate empirical treatment correlates with a better prognosis.
Las infecciones bacterianas en pacientes con cirrosis suponen una de las causas más frecuentes de descompensación aguda y de insuficiencia hepática crónica reagudizada1,2. Su prevalencia al ingreso o durante la hospitalización es del 25-40%, casi 5 veces superior a la de la población general3-5. Además, las complicaciones y la mortalidad son más elevadas que en pacientes no cirróticos6, con mayor tendencia al desarrollo de sepsis y shock séptico, especialmente en aquellos que requieren cuidados intensivos7.
Estos hechos se fundamentan en la existencia de diversas alteraciones en el sistema inmunitario, reunidas recientemente bajo el nombre de «disfunción inmune asociada a la cirrosis» (por sus siglas en inglés CAID)8, que afectan a la respuesta innata y adaptativa. Todo ello conlleva un riesgo aumentado de infección y, además, una respuesta inmunitaria anómala que predispone a desarrollar un síndrome de respuesta inflamatoria sistémica (SIRS) de manera más frecuente que en la población general9,10.
Las infecciones más frecuentes son la peritonitis bacteriana espontánea (PBE) y las infecciones del tracto urinario (ITU). Los agentes etiológicos clásicos han sido enterobacterias (Escherichia coli, Klebsiella pneumoniae, etc.) y otros bacilos gramnegativos. Por ello, las cefalosporinas de tercera generación (CTG) han constituido el tratamiento empírico de elección de manera clásica.
Sin embargo, el incremento en la tasa de resistencia a cefalosporinas11,12, el aumento de las infecciones por gérmenes grampositivos (Enterococcus spp., Staphylococcus, etc.) y gérmenes multirresistentes3,5,11,13,14ha supuesto un cambio de paradigma en el tratamiento en las infecciones del paciente cirrótico.
La prevalencia de bacterias multirresistentes (BMR) es muy variable entre países e incluso entre hospitales. Las publicaciones más recientes5,11,13,15 coinciden en que los 3ejes que deben guiar la elección de una antibioterapia empírica son la epidemiología local, la gravedad de la infección y la presencia de factores de riesgo para presentar infección por BMR.
El objetivo principal del estudio fue evaluar la prevalencia de infecciones por BMR en nuestro centro, un hospital terciario de referencia en España. Los objetivos secundarios fueron analizar los factores de riesgo y las complicaciones asociados a la aparición de infecciones por BMR, y la relación entre el pronóstico y la efectividad de la antibioterapia empírica.
Pacientes y métodosDiseño del estudioSe trata de un estudio observacional, retrospectivo, de carácter descriptivo, en el que se incluyó a pacientes mayores de 18 años con diagnóstico confirmado de cirrosis hepática y al menos un aislamiento microbiológico demostrable durante el ingreso hospitalario (bien al ingreso o durante la estancia hospitalaria), entre el 1 de julio del 2014 y el 31 de agosto del 2016 en el Hospital Universitario y Politécnico La Fe de Valencia (España). Se excluyó a aquellos pacientes receptores de algún trasplante de órgano sólido o de tejido hematopoyético, que tuvieran infección virus de la inmunodeficiencia humana (VIH) o algún otro tipo de inmunodeficiencia.
Los datos de los pacientes se recogieron a partir de los diagnósticos codificados en los informes de alta de la historia clínica electrónica y fueron cruzados con la información obtenida del laboratorio de microbiología.
Variables del estudioSe analizaron las siguientes variables:
- –
Información microbiológica: germen, tipo de bacteria (grampositivo o negativo), criterios de multirresistencia.
- –
Factores de riesgo: sexo, edad, etiología de la cirrosis, insuficiencia renal crónica, diabetes mellitus, enfermedad oncológica activa, alcoholismo activo, parámetros de gravedad al ingreso (creatinina, bilirrubina, International Normalized Ratio [INR], escala Model of End-stage Liver Disease [MELD]), foco infeccioso, lugar de adquisición, hospitalización en los últimos 90 días, toma de antibióticos en los últimos 90 días, profilaxis antibiótica con norfloxacino, tratamiento con rifaximina, efectividad tratamiento empírico, estancia en la Unidad de Cuidados Intensivos (UCI) y aislamiento de BMR en los últimos 6 meses.
- –
Tipo de infección: PBE, ITU, neumonía, bacteriemia espontánea del cirrótico, celulitis, endocarditis, empiema bacteriano espontáneo y sepsis por catéter.
- –
Medición de impacto clínico: necesidad de ingreso en UCI y de intubación orotraqueal, el desarrollo de insuficiencia renal aguda, sepsis, shock séptico y la mortalidad.
Durante el periodo estudiado los pacientes con PBE o ITU adquiridas en la comunidad recibían tratamiento con CTG. En PBE con mala evolución clínica se modificaba el tratamiento de forma empírica a piperacilina-tazobactam o carbapenemes. Linezolid normalmente era empleado como tercera línea en asociación con uno de los fármacos anteriores. Las PBE o ITU nosocomiales se trataban con piperacilina-tazobactam o carbapenemes como primera línea, asociándose linezolid si se detectaba falta de respuesta.
Las neumonías adquiridas en la comunidad se trataban con CTG en combinación con azitromicina o con levofloxacino. Las nosocomiales recibían carbapenemes y levofloxacino de forma general.
Los pacientes con celulitis recibían tratamiento con amoxicilina-clavulánico o piperacilina-tazobactam, según fuesen comunitarias o nosocomiales, respectivamente. En nuestro centro no existía una política antibiótica definida para las infecciones asociadas a los cuidados de la salud.
Criterios de multirresistenciaLos gérmenes resistentes a 3o más familias de antibióticos fueron considerados como multirresistentes. Las resistencias intrínsecas a diferentes grupos de antimicrobianos no se tuvieron en cuenta para esta definición16.
Los gérmenes aislados que se consideraron como BMR fueron: enterobacterias productoras de betalactamasas de espectro extendido (BLEE), betalactamasa inducible tipo AMPc o carbapenemasas (Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Proteus mirabilis), Pseudomonas aeruginosa, Enterococcus faecium sensible a vancomicina, Acinetobacter baumanii, Staphylococcus aureus resistente a meticilina (SARM) y Stenotrophomonas maltophilia.
Clasificación del foco infecciosoPBE: definida como el hallazgo de más de 250 leucocitos polimorfonucleares (PMN) por mm3 de líquido ascítico, independientemente del resultado de los cultivos, en ausencia de una causa secundaria. Se consideró como infección resuelta cuando el recuento de PMN descendía por debajo de 250 por mm3.
ITU: definida como la presencia de síntomas urinarios acompañada de sedimento urinario patológico (más de 10 leucocitos por campo) o urocultivo positivo. Se consideró resuelta aquella ITU que mejoró clínicamente y negativizó un cultivo previamente positivo.
Neumonía: signos y síntomas sugerentes de infección respiratoria acompañados de hallazgos compatibles en pruebas de imagen. Se consideró resuelta aquella que mostró mejoría clínica acompañada de desaparición de los hallazgos radiológicos.
Otras: bacteriemia espontánea del cirrótico, celulitis, endocarditis, empiema pleural espontáneo y sepsis por catéter, definidas según criterios clásicos.
Clasificación de las infecciones según lugar de adquisición17Infecciones adquiridas en la comunidad: infecciones presentes en el momento del ingreso o desarrolladas en las primeras 48 h desde el mismo.
Infecciones asociadas a los cuidados de la salud: aquellas que iniciaron en las primeras 48 h desde el ingreso en pacientes con ingreso hospitalario reciente (al menos 48 h en los 90 días anteriores), atendidos en un centro de hemodiálisis en los últimos 30 días o residentes en un centro de cuidados de larga estancia o que requieran de cuidados sanitarios especiales.
Infecciones nosocomiales: aquellas que se manifiestan a partir de las 48 h del ingreso.
SIRS, sepsis y shock séptico18SIRS: si se reunían 2o más de los siguientes criterios:
- –
Temperatura corporal > 38°C o < 36°C.
- –
Taquicardia > 90 latidos por minuto.
- –
Taquipnea > 20 respiraciones por minuto o hipocapnia < 32mmHg.
- –
Leucocitos > 12.000/μl o < 4.000/μl o formas inmaduras > 10%.
Sepsis: se definió como sepsis la presencia de SIRS a causa de una infección subyacente.
Shock séptico: sepsis asociada a fallo circulatorio (presión arterial sistólica inferior a 90mmHg o descenso mayor a 40mmHg de la basal, o presión arterial media menor de 60mmHg tras una adecuada resucitación con fluidoterapia) no explicable por otras causas.
Insuficiencia renal aguda19Aumento de creatinina sérica ≥ a 0,3mg/dl en 48 h o aumento > 50% de la creatinina basal en los últimos 7 días.
Efectividad del tratamiento empíricoSe definió como fallo de tratamiento empírico a la sustitución del antibiótico inicial por otro diferente. Se diferenció entre:
Fracaso por resistencias: si el antibiograma mostró resistencia al fármaco inicialmente pautado. A su vez se valoró si esta era intrínseca (propia de los miembros de la especie) o adquirida (variable entre diferentes cepas).
Falta de respuesta inicial: si el cambio fue realizado por mala evolución clínica o analítica a pesar de que un antibiograma posterior mostrara sensibilidad al fármaco inicial.
La adición de otro antibiótico fue considerada como fracaso de tratamiento solo si el antibiograma demostró resistencia al antibiótico empleado en primer lugar.
Análisis de los datosSe realizó un análisis descriptivo de las características basales de la población y demás variables del estudio. De manera adicional, se exploraron los factores de riesgo asociados a la aparición de infecciones por BMR y su impacto clínico. Para establecer la relación entre cada variable individual y desenlace se realizó un análisis bivariado empleando la prueba estadística adecuada en cada caso: t de Student, U de Mann-Whitney y ANOVA para variables cuantitativas, y ji al cuadrado de Pearson para variables cualitatitivas. Se consideraron estadísticamente significativos los resultados con una p menor de 0,05. Para la recogida y el análisis de los datos se usó el software SPSS Statistics 23.0® Centro de Investigación Biomédica en Red del Área de Enfermedades Hepáticas y Digestivas (CIBEREHD), Instituto de Salud Carlos III, Madrid, España.
Aspectos éticosEl protocolo del estudio se ajustó a las pautas éticas de la Declaración de Helsinki de 1975. El diseño del estudio no hizo necesaria la realización de un consentimiento informado por escrito. La identidad de los pacientes fue protegida y anonimizada en todo momento, siendo codificada mediante un código alfanumérico durante la recogida de datos. Todos los archivos fueron digitalizados y protegidos mediante contraseña, imposibilitándose su acceso a personal ajeno al estudio, y cumplen las normas de confidencialidad de acuerdo. El estudio fue aprobado por el Comité de Ética e Investigación Médica del Instituto de Investigación Sanitaria del Hospital Universitario y Politécnico La Fe (número de registro: 2017/0210).
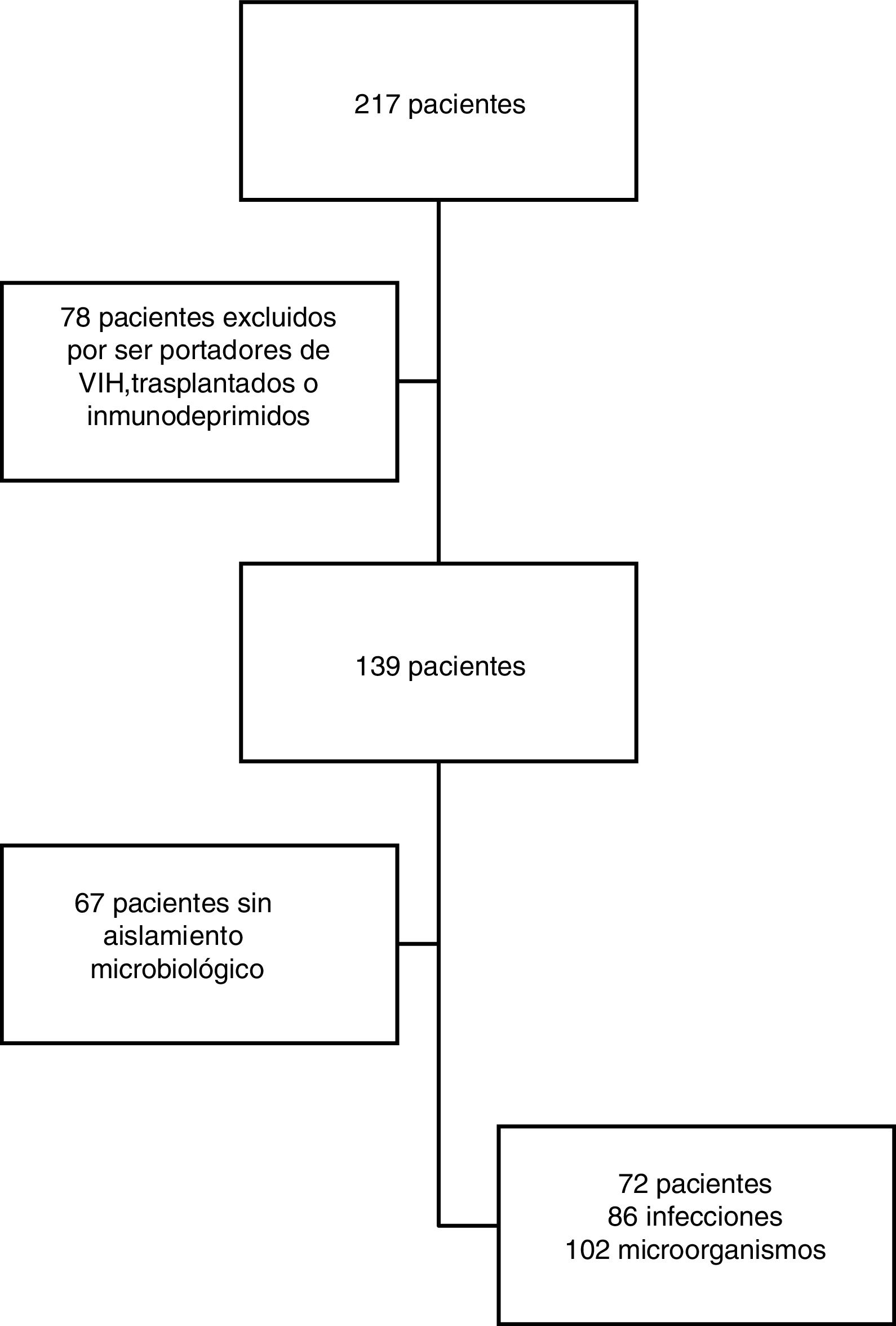
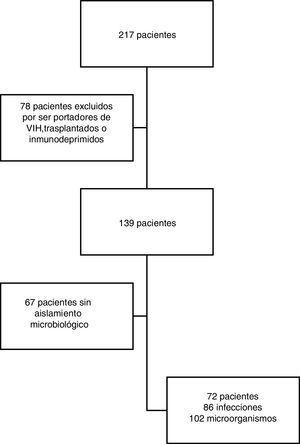
ResultadosPoblación de estudioDurante el periodo de estudio (1 de julio del 2014 al 31 de agosto del 2016) se incluyó inicialmente a 217 pacientes, de los cuales 78 fueron excluidos por presentar algún tipo de inmunodepresión y 67 por no presentar cultivos positivos. Finalmente, se analizaron 72 pacientes, con un total de 102 bacterias aisladas en 86 infecciones (fig. 1). Cada infección desarrollada durante el ingreso fue considerada como un episodio diferente.
Características basalesSe obtuvieron datos de un total de 86 casos de infección (tabla 1), de los que un 70,9% se dieron en hombres (61 en total). La mediana de edad fue de 62 años, con un rango de 63 años (26-89 años). La causa más frecuente de cirrosis fue la alcohólica, seguida del virus de la hepatitis C (VHC), afectando por separado o de manera conjunta a 74 pacientes (86,1%).
Características basales de la población
| Número de pacientes total, N = 86 Media (DE) Mediana (P25 y P75) | |
|---|---|
| Sexo | |
| Hombre (%) | 61 (70,9) |
| Mujer (%) | 25 (29,1) |
| Edad (años) | 62,60 (13,6) 62 (52; 73) |
| Motivo de ingreso | |
| Infección | 60 (69,7) |
| Encefalopatía | 11 (12,8) |
| Ascitis | 7 (8,1) |
| Hemorragia digestiva | 3 (3,5) |
| Otros | 5 (5,8) |
| Etiología de la cirrosis | |
| Alcohol (%) | 35 (40,7) |
| VHC (%) | 30 (34,9) |
| VHC + alcohol (%) | 9 (10,5) |
| NASH (%) | 2 (2,3) |
| Otros (%) | 10 (11,6%) |
| Cáncer reciente (%) | 23 (26,7) |
| Insuficiencia renal crónica (%) | 18 (20,9) |
| Alcoholismo activo (%) | 18 (20,9) |
| Diabetes mellitus (%) | 29 (33,7) |
| Ingreso en los últimos 90 días | 34 (41,5) |
| Antibiótico en los últimos 90 días | 37 (45,1) |
| Profilaxis con norfloxacino | 18 (20.9) |
| Tratamiento con rifaximina | 4 (4,7) |
| Aislamiento BMR previo | 11 (12,8) |
| Al ingreso | |
| Creatinina | 1,44 (0,91) 1,13 (0,77; 1,92) |
| Bilirrubina total | 3,26 (4,08) 1,90 (0,3; 4,05) |
| INR | 1,64 (0,51) 1,51 (1,29; 1,93) |
| MELD | 17,86 (6,46) 17 (13; 23) |
INR: International Normalized Ratio; MELD: Model End-stage Liver Disease; NASH: esteatohepatitis no alcohólica (non alcoholic steatohepatitis); VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VHD: virus de la hepatitis D.
Un 41,5% de los pacientes habían estado ingresados durante los últimos 90 días y un 45,1% (37 pacientes) habían tomado algún antibiótico (incluyendo el consumo de norfloxacino para la profilaxis de la PBE en 18 de ellos) durante los últimos 90 días.
Al ingreso, la media de creatinina e INR fue de 1,44 (DE = 0,91) y 1,64 (DE = 0,51), respectivamente; la mediana de bilirrubina fue de 1,90 (P25 = 0,3 y P75 = 4,05) y el MELD de 17 (P25 = 13 y P75 = 23).
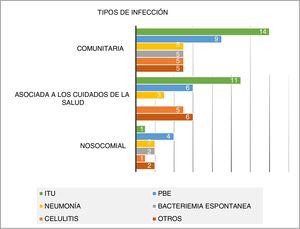
Análisis según foco infeccioso (fig. 2)De manera global la infección urinaria fue el foco infeccioso más frecuente (26 casos; 30,2% del total). Le siguieron la PBE (19 casos; 22,1%), celulitis (11 casos; 12,8%), neumonía (10 casos; 11,6%) y bacteriemia espontánea (7 casos; 8,1%). Otras menos frecuentes (endocarditis, sepsis por catéter, colitis por Clostridium difficile, meningitis, colangitis y empiema pleural) supusieron un total de 13 infecciones (15,2%).
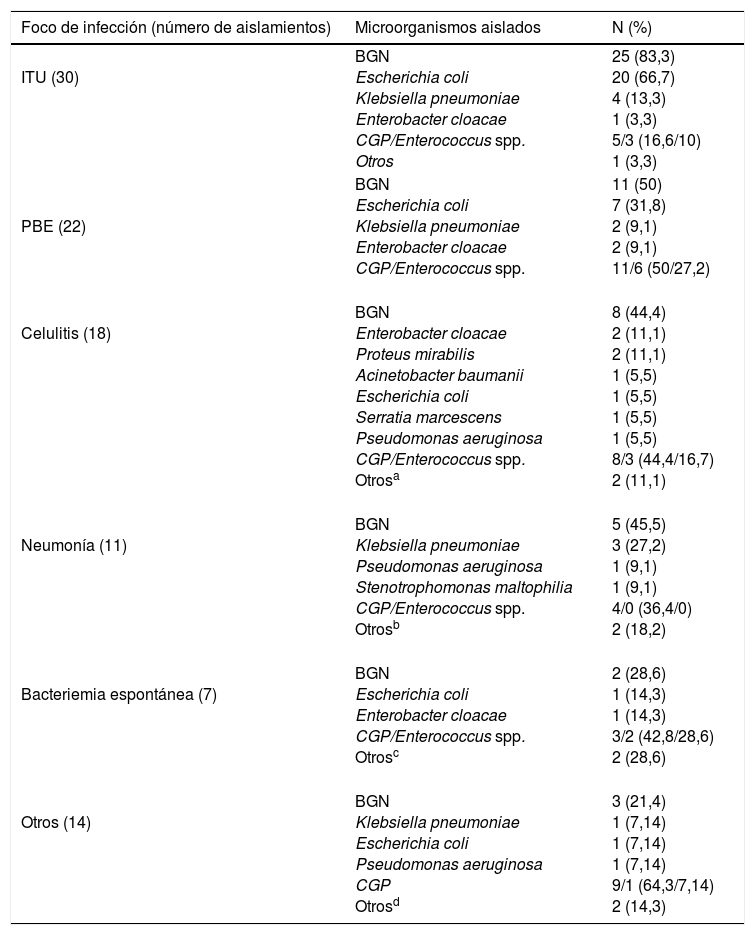
Un análisis más detallado de los aislamientos microbiológicos en función del foco de infección se ofrece en la tabla 2.
Aislamientos microbiológicos según foco de infección
| Foco de infección (número de aislamientos) | Microorganismos aislados | N (%) |
|---|---|---|
ITU (30) | BGN Escherichia coli Klebsiella pneumoniae Enterobacter cloacae CGP/Enterococcus spp. Otros | 25 (83,3) 20 (66,7) 4 (13,3) 1 (3,3) 5/3 (16,6/10) 1 (3,3) |
PBE (22) | BGN Escherichia coli Klebsiella pneumoniae Enterobacter cloacae CGP/Enterococcus spp. | 11 (50) 7 (31,8) 2 (9,1) 2 (9,1) 11/6 (50/27,2) |
Celulitis (18) | BGN Enterobacter cloacae Proteus mirabilis Acinetobacter baumanii Escherichia coli Serratia marcescens Pseudomonas aeruginosa CGP/Enterococcus spp. Otrosa | 8 (44,4) 2 (11,1) 2 (11,1) 1 (5,5) 1 (5,5) 1 (5,5) 1 (5,5) 8/3 (44,4/16,7) 2 (11,1) |
Neumonía (11) | BGN Klebsiella pneumoniae Pseudomonas aeruginosa Stenotrophomonas maltophilia CGP/Enterococcus spp. Otrosb | 5 (45,5) 3 (27,2) 1 (9,1) 1 (9,1) 4/0 (36,4/0) 2 (18,2) |
Bacteriemia espontánea (7) | BGN Escherichia coli Enterobacter cloacae CGP/Enterococcus spp. Otrosc | 2 (28,6) 1 (14,3) 1 (14,3) 3/2 (42,8/28,6) 2 (28,6) |
Otros (14) | BGN Klebsiella pneumoniae Escherichia coli Pseudomonas aeruginosa CGP Otrosd | 3 (21,4) 1 (7,14) 1 (7,14) 1 (7,14) 9/1 (64,3/7,14) 2 (14,3) |
En la columna de la derecha, entre paréntesis, se expresa el porcentaje de detección de cada germen respecto al total de aislamientos en cada foco.
BGN: bacilos gramnegativos; CGP: cocos grampositivos.
La mitad de las infecciones fueron adquiridas en el ámbito comunitario (43 casos en total). Un 36% fueron consideradas como infecciones asociadas a los cuidados de la salud (31 casos) y 12 como nosocomiales (14%). La ITU fue el foco más frecuente (32,6%), seguida de la PBE (20,9%). Esta tendencia también se observó entre las infecciones asociadas a los cuidados de la salud.
Respecto al ámbito hospitalario, la PBE fue en la infección predominante (33,3% de todas las nosocomiales), detectándose un único caso de ITU nosocomial con aislamiento microbiológico válido (fig. 2).
Aislamientos microbiológicosLos aislamientos se obtuvieron de 26 hemocultivos (30,2%), 24 urinocultivos (27,9%), 16 cultivos de líquido ascítico (18,6%), 9 exudados (10,5%), 6 muestras de lavado broncoalveolar o esputo (7%), 2 serologías en heces (2,4%), una serología en sangre (1,2%), una antigenuria (1,2%) y una muestra de líquido pleural (1,2%).
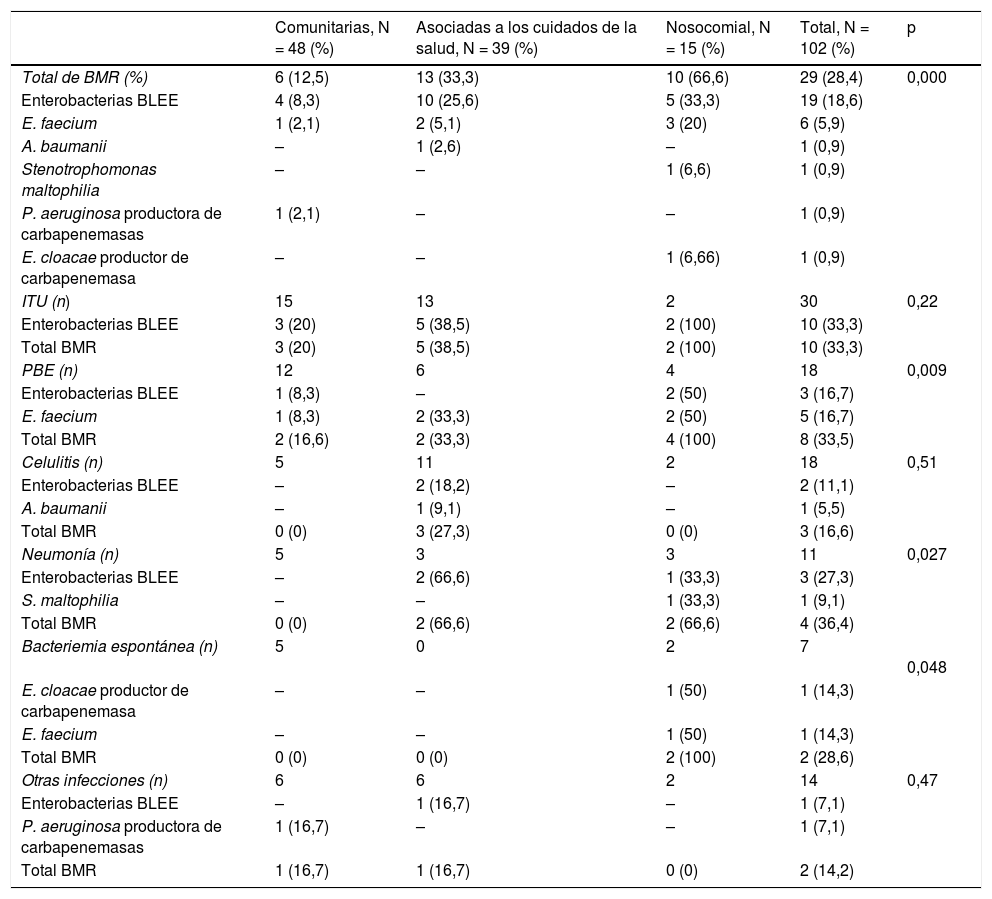
De las 102 bacterias aisladas (tabla 3), 48 correspondían a infecciones adquiridas en la comunidad (47%), 39 asociadas a los cuidados de la salud (38,2%) y 15 nosocomiales (14,7%).
Prevalencia de bacterias multirresistentes según tipo de infección y lugar de adquisición
| Comunitarias, N = 48 (%) | Asociadas a los cuidados de la salud, N = 39 (%) | Nosocomial, N = 15 (%) | Total, N = 102 (%) | p | |
|---|---|---|---|---|---|
| Total de BMR (%) | 6 (12,5) | 13 (33,3) | 10 (66,6) | 29 (28,4) | 0,000 |
| Enterobacterias BLEE | 4 (8,3) | 10 (25,6) | 5 (33,3) | 19 (18,6) | |
| E. faecium | 1 (2,1) | 2 (5,1) | 3 (20) | 6 (5,9) | |
| A. baumanii | – | 1 (2,6) | – | 1 (0,9) | |
| Stenotrophomonas maltophilia | – | – | 1 (6,6) | 1 (0,9) | |
| P. aeruginosa productora de carbapenemasas | 1 (2,1) | – | – | 1 (0,9) | |
| E. cloacae productor de carbapenemasa | – | – | 1 (6,66) | 1 (0,9) | |
| ITU (n) | 15 | 13 | 2 | 30 | 0,22 |
| Enterobacterias BLEE | 3 (20) | 5 (38,5) | 2 (100) | 10 (33,3) | |
| Total BMR | 3 (20) | 5 (38,5) | 2 (100) | 10 (33,3) | |
| PBE (n) | 12 | 6 | 4 | 18 | 0,009 |
| Enterobacterias BLEE | 1 (8,3) | – | 2 (50) | 3 (16,7) | |
| E. faecium | 1 (8,3) | 2 (33,3) | 2 (50) | 5 (16,7) | |
| Total BMR | 2 (16,6) | 2 (33,3) | 4 (100) | 8 (33,5) | |
| Celulitis (n) | 5 | 11 | 2 | 18 | 0,51 |
| Enterobacterias BLEE | – | 2 (18,2) | – | 2 (11,1) | |
| A. baumanii | – | 1 (9,1) | – | 1 (5,5) | |
| Total BMR | 0 (0) | 3 (27,3) | 0 (0) | 3 (16,6) | |
| Neumonía (n) | 5 | 3 | 3 | 11 | 0,027 |
| Enterobacterias BLEE | – | 2 (66,6) | 1 (33,3) | 3 (27,3) | |
| S. maltophilia | – | – | 1 (33,3) | 1 (9,1) | |
| Total BMR | 0 (0) | 2 (66,6) | 2 (66,6) | 4 (36,4) | |
| Bacteriemia espontánea (n) | 5 | 0 | 2 | 7 | 0,048 |
| E. cloacae productor de carbapenemasa | – | – | 1 (50) | 1 (14,3) | |
| E. faecium | – | – | 1 (50) | 1 (14,3) | |
| Total BMR | 0 (0) | 0 (0) | 2 (100) | 2 (28,6) | |
| Otras infecciones (n) | 6 | 6 | 2 | 14 | 0,47 |
| Enterobacterias BLEE | – | 1 (16,7) | – | 1 (7,1) | |
| P. aeruginosa productora de carbapenemasas | 1 (16,7) | – | – | 1 (7,1) | |
| Total BMR | 1 (16,7) | 1 (16,7) | 0 (0) | 2 (14,2) |
Las cifras entre paréntesis reflejan la proporción de BMR con relación al total de aislamientos microbiológicos según foco infeccioso y lugar de adquisición.
Cincuenta y siete (55,8%) fueron gérmenes gramnegativos y 45 (44,2%) grampositivos. Los miembros de la familia Enterobacteriaceae representan la causa más frecuente de infección (49 microorganismos). E. coli (30 casos; 29,4%), K. pneumoniae (10 casos; 9,8%), S. aureus (10 casos; 9,8%), E. faecalis (9 casos; 8,8%), E. faecium (6 casos; 5,8%) y S. pneumoniae (6 casos; 5,8%) fueron los gérmenes más frecuentemente aislados de forma global.
Un total de 29 bacterias (28,4%) reunieron criterios de multirresistencia, dando lugar al desarrollo de 26 infecciones diferentes. Destacan las enterobacterias productoras de BLEE y Enterococcus faecium, que se detectaron en 19 (18,6%) y 6 (5,9%) ocasiones, respectivamente. Además se aislaron 2 bacterias productoras de carbapenemasas (Enterobacter cloacae y Pseudomonas aeruginosa). Otras BMR, como Acinetobacter baumanii y Stenotrophomonas maltophilia, fueron aisladas en una sola ocasión. No se aislaron Staphylococcus aureus resistentes a meticilina ni Enterococcus resistentes a vancomicina (VRE).
La mayoría de BMR se aislaron en infecciones nosocomiales y asociadas a los cuidados de la salud (10 y 13 casos, respectivamente; p < 0,001). De manera global, se aislaron BMR en un 66,6% de las infecciones nosocomiales, en un 33,3% de las asociadas a los cuidados de la salud y en un 12,5% de las adquiridas en la comunidad.
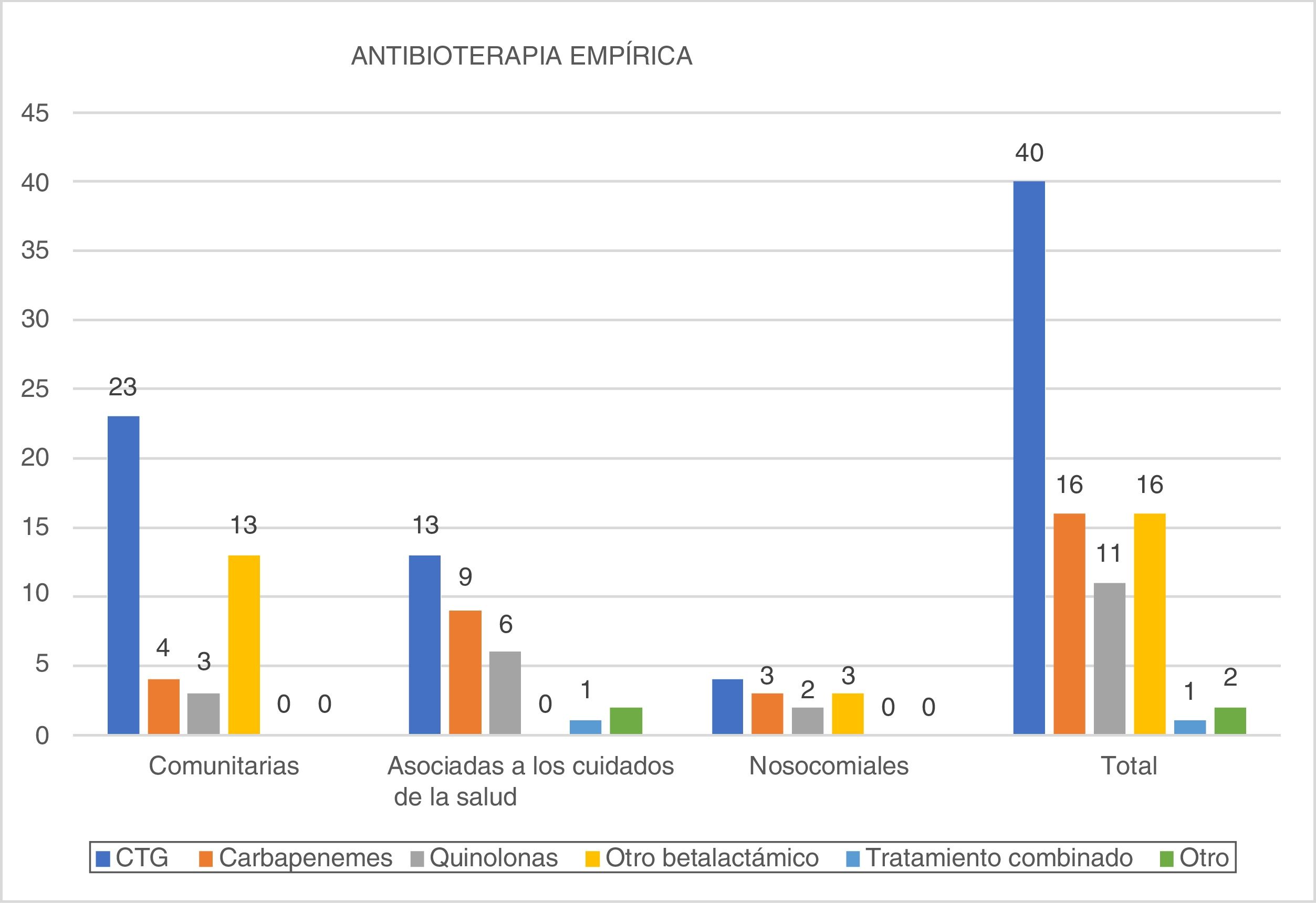
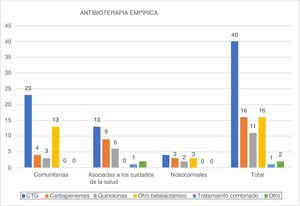
Antibioterapia empírica (fig. 3)Las CTG se emplearon como tratamiento de elección en el 46,5% de los pacientes, seguidas de los carbapenemes y otros betalactámicos (18,6% cada grupo). Los carbapenemes fueron especialmente empleados en las infecciones nosocomiales (25%) y asociados a los cuidados de la salud (29%).
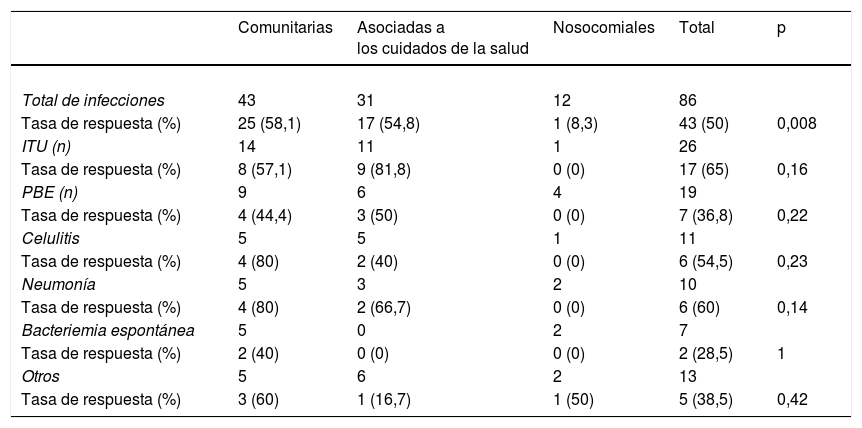
Efectividad del tratamiento empíricoGlobalmente, la antibioterapia empírica elegida fue efectiva en el 50% de los casos (tabla 4), siendo muy superior en las infecciones adquiridas en la comunidad y en las asociadas a los cuidados de la salud (el 58,1 y el 54,8%, respectivamente) respecto a las nosocomiales (8,3%; p = 0,008).
Efectividad de la antibioterapia empírica según foco y lugar de adquisición
| Comunitarias | Asociadas a los cuidados de la salud | Nosocomiales | Total | p | |
|---|---|---|---|---|---|
| Total de infecciones | 43 | 31 | 12 | 86 | |
| Tasa de respuesta (%) | 25 (58,1) | 17 (54,8) | 1 (8,3) | 43 (50) | 0,008 |
| ITU (n) | 14 | 11 | 1 | 26 | |
| Tasa de respuesta (%) | 8 (57,1) | 9 (81,8) | 0 (0) | 17 (65) | 0,16 |
| PBE (n) | 9 | 6 | 4 | 19 | |
| Tasa de respuesta (%) | 4 (44,4) | 3 (50) | 0 (0) | 7 (36,8) | 0,22 |
| Celulitis | 5 | 5 | 1 | 11 | |
| Tasa de respuesta (%) | 4 (80) | 2 (40) | 0 (0) | 6 (54,5) | 0,23 |
| Neumonía | 5 | 3 | 2 | 10 | |
| Tasa de respuesta (%) | 4 (80) | 2 (66,7) | 0 (0) | 6 (60) | 0,14 |
| Bacteriemia espontánea | 5 | 0 | 2 | 7 | |
| Tasa de respuesta (%) | 2 (40) | 0 (0) | 0 (0) | 2 (28,5) | 1 |
| Otros | 5 | 6 | 2 | 13 | |
| Tasa de respuesta (%) | 3 (60) | 1 (16,7) | 1 (50) | 5 (38,5) | 0,42 |
En las infecciones adquiridas en la comunidad la causa más frecuente fallo terapéutico (10 de 18 casos) fue la falta de respuesta inicial, a pesar de que un antibiograma posterior mostró sensibilidad al antibiótico pautado inicialmente. Cuatro bacterias (22,2%) eran resistentes (2 enterobacterias productoras de BLEE, una Listeria monocytogenes y un Staphylococcus coagulasa negativo) y otras 4eran intrínsecamente resistentes (3 Enterococcus faecalis y una Listeria monocytogenes) al tratamiento empírico.
Entre las infecciones asociadas a los cuidados de la salud se detectó resistencia en 6 de los 14 casos (42,9%), falta de respuesta al tratamiento inicial en otros 6 (42,9%) y resistencia intrínseca en 2 de ellos (14,3%). En 8 de los 11 casos (72,7%) de infección nosocomial la causa del fracaso fue la resistencia al tratamiento pautado. Siete de esos 8 casos (87,5%) estuvieron ocasionadas por BMR.
Impacto clínicoEl desarrollo de sepsis fue significativamente mayor en las infecciones ocasionadas por BMR (OR 3,13; IC del 95%: 1,18-8,32; p = 0,025). Aunque en este grupo la tasa de mortalidad y shock séptico fue mayor, no se logró alcanzar significación estadística (p = 0,55 y p = 0,28, respectivamente).
Por otra parte, el fracaso de la antibioterapia empírica se asoció a una mayor tasa de mortalidad (OR 7,05; IC del 95%: 1,86-26,75; p = 0,000); insuficiencia renal aguda en cualquier momento del ingreso (OR 2,72; IC del 95%: 1,45-5,13; p = 0,000); ingreso en UCI (OR 3,53; IC del 95%: 1,23-10,11; p = 0,003); sepsis (OR 2,024; IC del 95%: 1,13-3,63; p = 0,012) y shock séptico (OR 4,69; IC del 95%: 1,26-17,39; p = 0,002).
Factores de riesgoEl análisis bivariado mostró diferencias significativas en las siguientes variables: infección nosocomial (respecto a las comunitarias OR 18,5; IC del 95%: 3,87-88,54; p = 0,000, y respecto a las asociadas a los cuidados de la salud: OR 5,46; IC del 95%: 1,22-24,43; p = 0,039); infección asociada a los cuidados de la salud (respecto a las comunitarias OR 3,39; IC del 95%: 1,09-10,54; p = 0,048); uso de antibióticos en los últimos 90 días, tanto considerando la profilaxis con norfloxacino (OR 4,37; IC del 95%: 1,59- 11,99; p = 0,005), como sin ella (OR 3,62; IC del 95%: 1,35-9,67; p = 0,01); ingreso de más de 48 h en los últimos 90 días (OR 3,18; IC del 95%: 1,19-8,47; p = 0,018); enfermedad oncológica activa (OR 2,93; IC del 95%: 1,08-7,99; p = 0,038) y uso de norfloxacino como profilaxis de la PBE (OR 3; IC del 95%: 1,02-8,79; p = 0,012). Por el contrario, el empleo de rifaximina no se asoció a un aumento en el riesgo de infección por BMR (OR 2,42; IC del 95%: 0,32-18,16; p = 0,58).
Aunque no alcanzó significación estadística, la proporción de infecciones por BMR fue mucho mayor en los pacientes que había estado en UCI recientemente (OR 3,45; IC del 95%: 0,71-16,7; p = 0,19) y en aquellos en los que se había aislado alguna BMR en los últimos 6 meses (OR 2,14; IC del 95%: 0,59-7,78; p = 0,29). No se hallaron diferencias importantes en las siguientes variables: sexo (39,1% versus 25,4%; p = 0,21); alcoholismo activo (8,7% versus 25,4%; p = 0,09); diabetes (34,8% versus 33,3%; p = 0,90) ni insuficiencia renal crónica (17,4% versus 22,4% p = 0,62).
DiscusiónLa tasa de infecciones por gérmenes multirresistentes se encuentra en aumento, especialmente en pacientes con cirrosis hepática. El conocimiento de la epidemiología local es imprescindible para establecer un tratamiento empírico adecuado5,11,13,15.
La tasa de multirresistencia en nuestro estudio es comparable (28,4% del total de infecciones) a la publicada en un reciente estudio multicéntrico europeo20, donde la tasa global de BMR fue del 31%, con un 14% de infecciones originadas por bacterias productoras de BLEE y un 7% por Enterococcus faecium. Sin embargo, un análisis detallado arroja diferencias muy importantes. Por ejemplo: en Italia se han llegado a publicar tasas de multirresistencia de hasta el 50%21, mientras que en otros centros terciarios españoles la tasa de multirresistencia es similar, con un 32,6% en el Hospital Universitario Gregorio Marañón y un 28% de BMR en el Hospital Clínic de Barcelona4,22, pero con una proporción de bacterias BLEE muy diferente; un 7-5-8,7% en el Hospital Clínic (según la serie), un 8-9% en el Hospital Universitario de Bellvitge12 y un 25,2% en el Hospital Gregorio Marañón22.
Estos datos refuerzan la necesidad de conocer la epidemiología local para adecuar las pautas de antibioterapia empírica según la prevalencia de las diferentes BMR.
Factores de riesgoEn nuestro estudio, la presencia de infecciones por BMR se asoció al ámbito nosocomial, el uso de antibióticos o el ingreso hospitalario durante los últimos 90 días, la existencia de enfermedad oncológica activa y el uso de norfloxacino como profilaxis de la PBE, lo que se encuentra en consonancia con los resultados publicados en la literatura científica3,11,22. La asociación de enfermedad oncológica activa y riesgo de infección por BMR en pacientes cirróticos no había sido estudiada hasta el momento, aunque considerando las limitaciones del estudio no se puede generalizar a la práctica clínica diaria por el momento. No se encontró asociación a la estancia reciente en UCI y el aislamiento previo de BMR.
Impacto clínicoLos resultados del estudio orientan a la necesidad de modificar las pautas de antibioterapia empírica empleadas en nuestro centro, especialmente en las infecciones nosocomiales y asociadas a los cuidados de la salud. De este modo, dada la elevada prevalencia de bacterias productoras de BLEE, se debería generalizar el empleo de carbapenemes como fármacos de primera línea en infecciones nosocomiales. Además, y en consonancia con los resultados de un reciente estudio23, se debería generalizar la cobertura frente a gérmenes grampositivos en la PBE nosocomial, ya que la proporción de casos producidos por Enterococcus spp. es muy alta. La implantación de estos cambios debería correlacionarse con una mejoría en el pronóstico de los pacientes cirróticos ingresados en nuestro centro, aunque sería necesario un estudio comparativo para confirmar esta hipótesis.
Por otra parte, a pesar de que la tasa de multirresistencia en infecciones asociadas a los cuidados de la salud es muy parecida a la de otros estudios, la respuesta a tratamiento empírico es muy parecida a la de las infecciones comunitarias (tabla 4). Esto hace dudar sobre la necesidad de implantar en nuestro centro las pautas de las guías de práctica clínica actuales, que recomiendan el empleo de carbapenemes como fármacos de primera línea en este grupo de pacientes. A ello hay que unir la posibilidad de que el empleo de estos antibióticos condicione un aumento de resistencias, además del elevado coste económico que supondría. Hasta la fecha, el único estudio que evalúa el impacto económico de esta estrategia24 muestra que la antibioterapia de amplio espectro en pacientes con infecciones asociadas a los cuidados de salud supone un ahorro de costes, pues reduce la morbimortalidad y la estancia hospitalaria.
Por lo tanto, a la luz de los resultados obtenidos, sería razonable reservar los carbapenemes para los pacientes con factores de riesgo de multirresistencia añadidos y aquellos que presenten síntomas y signos de gravedad, pues un tratamiento empírico adecuado de forma precoz se correlaciona con un mejor pronóstico.
Futuro inmediatoLa restricción en el uso de antibióticos en la población general se ha mostrado como una medida efectiva para reducir las tasas de resistencia antibiótica. Como ejemplo, tenemos un reciente estudio unicéntrico realizado en Holanda25, país que emplea una política muy restrictiva en el uso de antibióticos. Los resultados mostraron que la tasa de BMR y la tasa de resistencia a cefalosporinas en una población de pacientes cirróticos con PBE fueron similares en 2cohortes comparadas con 10 años de diferencia. Las campañas de concienciación sobre la prescripción responsable de antibióticos suponen uno de los puntos a fortalecer para controlar la incidencia de infecciones por gérmenes multirresistentes.
El empleo masivo de antibióticos de amplio espectro está dando y dará lugar a la aparición de nuevas resistencias, lo que dificultará aún más el manejo de estas infecciones11,26. Para minimizar las consecuencias derivadas de ello resulta imprescindible realizar una desescalada antibiótica precoz. La toma correcta de cultivos que permita disponer de resultados microbiológicos precoces es vital para realizar una desescalada de forma segura y evitar la generación de resistencias5,11. La vigilancia epidemiológica a través de la realización de cultivos periódicos, ampliamente usada en la UCI, es cada vez más empleada en las plantas de hospitalización, pues permite establecer medidas de aislamiento precoz si se detectaran gérmenes multirresistentes y ajustar la antibioterapia empírica en caso de desarrollar infección27.
La profilaxis de la PBE es otro punto de importancia. La efectividad en la profilaxis primaria con norfloxacino de pacientes con cirrosis en estadios iniciales es discutida28,29 se asocia a multirresistencia3 y se desconoce su eficacia en profilaxis secundaria tras un primer episodio de PBE por grampositivos o BMR. Por estos motivos, es aconsejable la realización de estudios que busquen limitar las indicaciones del mismo, así como buscar alternativas al uso de este fármaco29. En este sentido, destaca el uso de rifaximina, un antibiótico no absorbible con escasa tasa de resistencias descritas30,31. Aunque los resultados son controvertidos32,33, cada vez parece existir mayor consenso en su papel protector sobre la PBE34. La realización de ensayos clínicos a gran escala resulta necesaria para evaluar su relevancia real.
Nuestro estudio tiene una serie de limitaciones metodológicas. El diseño retrospectivo del mismo limitó la obtención de datos clínicos de interés, especialmente sobre el uso previo de antibióticos. La falta de codificación de diagnósticos en los informes de alta pudo reducir el tamaño de la población estudiada, y por tanto, limitar los resultados obtenidos. Por otra parte, se trata de un estudio unicéntrico, de manera que los resultados obtenidos no se pueden extrapolar a otros hospitales a no ser que se conozca la epidemiología local bacteriana de cada centro.
ConclusionesLa tasa de infecciones por gérmenes multirresistentes en nuestro centro es comparable con la de otros centros europeos de características similares. Los resultados obtenidos hacen recomendable la adopción de las pautas de tratamiento antibiótico contempladas en las guías de práctica clínica actuales, limitando el uso de carbapenemes a las infecciones nosocomiales y a las asociadas a los cuidados de salud con otros factores de riesgo de multirresistencia o con signos de gravedad. Un tratamiento empírico adecuado de forma precoz se correlaciona con un mejor pronóstico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.