El tratamiento con tiopurinas puede optimizarse determinando la concentración de sus metabolitos.
Pacientes y métodosAnálisis retrospectivo sobre una base de datos prospectiva, con inclusión de 31 pacientes con enfermedad inflamatoria intestinal en tratamiento con tiopurinas, que presentaban respuesta insuficiente. Se determinaron los metabolitos de tiopurinas en plasma (6-tioguanina, 6-TGN y 6-metilmercaptopurina, 6-MMP) por cromatografía líquida de alta eficacia (Laboratorios Cerba, Barcelona) ajustando el tratamiento de acuerdo a resultados. Tras 6 meses se reevaluó la respuesta clínica.
ResultadoA pesar de la dosis adecuada teórica de tiopurinas un 45,6% de los pacientes estaba infradosificado (sospechándose falta de adhesión al tratamiento en un 6,45% del total) y un 16,2% sobredosificado o metabolizaba por ruta metabólica alternativa. Tras ajustar a partir de niveles de metabolitos, solo el 25,8% (8/31) requirió biológico, mientras que el 74,2% de los casos (23/31) se manejó mediante optimización.
DiscusiónLa monitorización del tratamiento con tiopurinas mediante determinación de sus metabolitos puede ser utilizada para valorar pacientes no respondedores, antes de sustituir o complementar dichos fármacos con otros alternativos (biológicos, por lo general), con los consiguientes aumentos de toxicidad potencial y coste. Se puede rescatar a pacientes infradosificados, identificar aquellos que presentan una desviación en la ruta metabólica en los que se podría plantear una terapia con dosis bajas de AZA asociada a alopurinol, o aquellos en los que los datos sugieran falta de adhesión al tratamiento. En 3 de cada 4 pacientes puede evitarse la escalada a biológico.
Thiopurine therapy can be optimised by determining the concentration of the drug's metabolites.
Patients and methodsRetrospective analysis on a prospective database of 31 patients with inflammatory bowel disease who failed therapy with thiopurines. Thiopurine metabolites (6-thioguanine, 6-TGN and 6-methylmercaptopurine, 6-MMP) were measured by high-performance liquid chromatography (Laboratorios Cerba, Barcelona) and treatment was duly adjusted in accordance with the results. Clinical response was reassessed after six months.
ResultDespite the appropriate theoretical dose of thiopurines being administered, the dose was insufficient in 45.6% of patients (nonadherence to treatment suspected in 6.45%) and 16.2% received an excessive dose or the drug was metabolised by other metabolic pathways. After treatment was optimised based on metabolite levels, only 25.8% (8/31) were prescribed a biological agent, while 74.2% of cases (23/31) were managed through dose optimisation alone.
DiscussionMonitoring thiopurine metabolite levels may help clinicians to assess non-responsive patients before adding or switching to another drug (generally a biological agent), thereby avoiding any additional costs or potential toxicity. This strategy may also help to identify patients receiving an insufficient dose and those with an alternative metabolic pathway, who could be candidates for low-dose AZA with allopurinol, as well as patients who are suspected of being non-adherent. In three out of four patients, switching to a biological agent can be avoided.
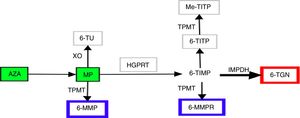
Las tiopurinas son, desde hace medio siglo, uno de los pilares fundamentales del tratamiento inmunosupresor de pacientes con enfermedad inflamatoria intestinal (EII)1,2. Sus usos fundamentales2 son el mantenimiento de la remisión en la enfermedad corticodependiente3 o tras el control de un brote grave de colitis ulcerosa3, la prevención de la recurrencia posquirúrgica en enfermedad de Crohn4 y el empleo en terapia combinada junto con biológicos. Ejercen su acción inmunomoduladora dentro de la célula. Dada su similitud con las purinas endógenas, se incorporan a los ácidos nucleicos como bases anormales, interfiriendo con la síntesis de proteínas y ácidos nucleicos, inhiben la proliferación linfocitaria y activan la apoptosis celular vía Rac15,6. De estas propiedades citotóxicas e inmunosupresoras se deriva su poder terapéutico, pero también su efecto secundario más frecuente, la mielotoxicidad. Conseguir el éxito en el tratamiento, limitando los efectos tóxicos, ha resultado siempre un reto al que el clínico se enfrenta en el manejo de estos pacientes. En los últimos años los avances en el conocimiento del complejo del metabolismo de las tiopurinas han permitido diseñar estrategias que intentan optimizar su uso7. La azatioprina (AZA) y la 6-mercaptopurina (MP) son profármacos, químicamente análogos de las guaninas endógenas, con baja y variable biodisponibilidad, que se metabolizan por al menos 4 vías diferentes, hasta obtener las moléculas finales, que denominamos genéricamente metabolitos de nucleótidos. Aunque los pasos metabólicos son de gran complejidad e incompletamente conocidos, se podrían resumir como sigue (fig. 1). El paso de AZA a MP se produce gracias al glutatión5 en una reacción no mediada por enzimas. A continuación, la MP puede ser catabolizada por la xantina oxidasa a ácido tioúrico, siendo la alta actividad de la xantina oxidasa la principal responsable de que solamente un 16% del fármaco esté disponible en la circulación sistémica. Esta fracción disponible puede ser anabolizada a través de la tiopurina metil transferasa (TPMT) para obtener 6-metil-mercaptopurina (6MMP) y ribonucleótidos de 6MMP ribonucleótidos o catabolizada por la hipoxantin-guanin-fosforribosil-transferasa para obtener 6-tioinosina-5- monofosfato. A continuación, gracias a la inosina-monofosfato-deshidrogenasa este último producto intermedio se transforma en nucleótidos de 6-tioguanina, mono/di/tri-fosfato (6TGN). Es este último grupo de metabolitos el que ejerce el efecto inmunomodulador, mientras que 6MMP y 6MMPR constituyen los metabolitos inactivos y potencialmente tóxicos5,7,8.
Diversos estudios han evaluado la relación entre los niveles de 6TGN en glóbulos rojos y la respuesta clínica a tiopurinas. Si bien existe controversia al respecto9,10, hay datos que sugieren que los niveles de 6TGN superiores a 230pmol/8×108 eritrocitos se relacionan con el éxito clínico11–14, siendo más probable encontrar estas cifras en los pacientes en remisión que en aquellos con actividad, al tiempo que la remisión es más frecuente cuando el paciente presenta niveles superiores a estas cifras. No obstante, es obligado señalar que alcanzar dichos niveles no garantiza la remisión. Asimismo, algunos autores sugieren que niveles superiores a 400pmol/8×108 eritrocitos podrían estar relacionados con mayor riesgo de mielotoxicidad, si bien existen múltiples factores implicados en la aparición de esta, como la existencia de 2 alelos de baja actividad de TPMT en homocigosis (TPMTLL)15,16. Por otra parte, concentraciones de 6MMP superiores a 5.400pmol/8×108 eritrocitos se han relacionado con la aparición de hepatotoxicidad17. En esta línea, algunos autores sugieren incluso que el hallazgo de estos valores, aún sin evidencia de daño hepático, debe obligar a disminuir la dosis administrada18.
Nuestro estudio describe los resultados en práctica clínica y por primera vez en nuestro medio de la optimización del tratamiento con tiopurinas mediante determinación de sus metabolitos y ajuste posterior, optimizando el empleo de fármacos, la escalada terapéutica, la respuesta clínica y la identificación de aquellos sujetos en riesgo de toxicidad.
Material y métodosPoblaciónEn nuestro centro se seguían a fecha del estudio 1.297 pacientes con EII, diagnosticados según los criterios habituales y tratados de acuerdo a las guías internacionales de práctica clínica. De ellos, 690 (53,19%) han sido expuestos a tiopurinas en alguna ocasión. Entre enero y junio de 2017 nos propusimos evaluar el papel de la optimización del tratamiento con tiopurinas, y en ese periodo se seleccionaron dentro de la consulta 31 pacientes bajo tratamiento con tiopurinas, que presentaban una respuesta insuficiente, definida por el médico responsable con la información de los hallazgos clínicos, biológicos (PCR o calprotectina elevadas) o endoscópicos. Se recogió información clínica referente al sexo, la edad, el tipo de enfermedad, la dosis de tiopurina, los tratamientos concomitantes e índices de actividad en cada visita (Harvey-Bradshaw19 para la enfermedad de Crohn y Walmsley20 para la colitis ulcerosa). Asimismo, se recogió información analítica, incluyendo hemograma y cifras de bilirrubina y transaminasas. En nuestro centro, previamente al inicio del tratamiento, se solicita de rutina una determinación de la actividad de la TPMT y ningún paciente con un resultado menor de 5 unidades/ml es candidato a recibir tiopurinas.
Determinación de metabolitosLos niveles de 6TG y 6MMP (pmol/8×108 eritrocitos, pmol/8×108 eritrocitos) fueron determinados en plasma mediante cromatografía líquida de alta eficacia en los Laboratorios Cerba, Barcelona21.
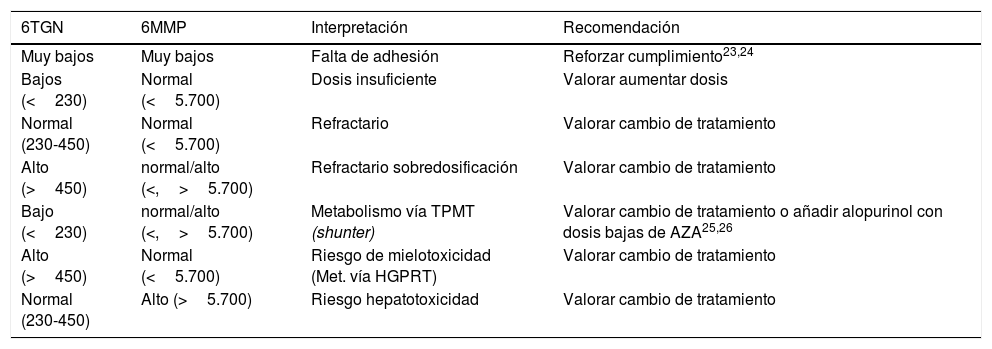
Interpretación de los resultadosDe acuerdo con los valores del laboratorio se consideraban niveles subóptimos de 6TGN aquellos inferiores a 230pmol/8×108 eritrocitos, en rango terapéutico aquellos entre 230 y 450pmol/8×108 eritrocitos, y sobredosificados los superiores a 450pmol/8×108 eritrocitos. En cuanto a los de 6MMP se consideraron óptimos los inferiores a 5.700pmol/8×108 eritrocitos y sobredosificados los superiores a esta cifra. Por tanto, el objetivo fue obtener niveles de 6TGN entre 230 y 450pmol/8×108 eritrocitos y 6MMP inferiores a 5.700pmol/8×108 eritrocitos. Combinando los valores de ambas determinaciones se obtienen distintas posibilidades, cuya interpretación y actitud consecuente en aquellos pacientes en los que no existía una respuesta al tratamiento fueron las mostradas en la tabla 1.
Interpretación de los niveles de metabolitos (medidos en pmol/8×108 eritrocitos) y actitud recomendada
| 6TGN | 6MMP | Interpretación | Recomendación |
|---|---|---|---|
| Muy bajos | Muy bajos | Falta de adhesión | Reforzar cumplimiento23,24 |
| Bajos (<230) | Normal (<5.700) | Dosis insuficiente | Valorar aumentar dosis |
| Normal (230-450) | Normal (<5.700) | Refractario | Valorar cambio de tratamiento |
| Alto (>450) | normal/alto (<,>5.700) | Refractario sobredosificación | Valorar cambio de tratamiento |
| Bajo (<230) | normal/alto (<,>5.700) | Metabolismo vía TPMT (shunter) | Valorar cambio de tratamiento o añadir alopurinol con dosis bajas de AZA25,26 |
| Alto (>450) | Normal (<5.700) | Riesgo de mielotoxicidad (Met. vía HGPRT) | Valorar cambio de tratamiento |
| Normal (230-450) | Alto (>5.700) | Riesgo hepatotoxicidad | Valorar cambio de tratamiento |
HGPRT: hipoxantín-guanín-fosforribosil-transferasa; TPMT: tiopurina metil transferasa; 6MMP: 6-metil-mercaptopurina; 6TGN: 6-tioguanina.
Para variables continuas se calcularon la media, la desviación estándar y el rango, mientras que para las variables categóricas se proporcionó el porcentaje. Para la comparación de muestras se utilizó el estadístico Chi-cuadrado. Un valor de p>0,05 se consideró estadísticamente significativo.
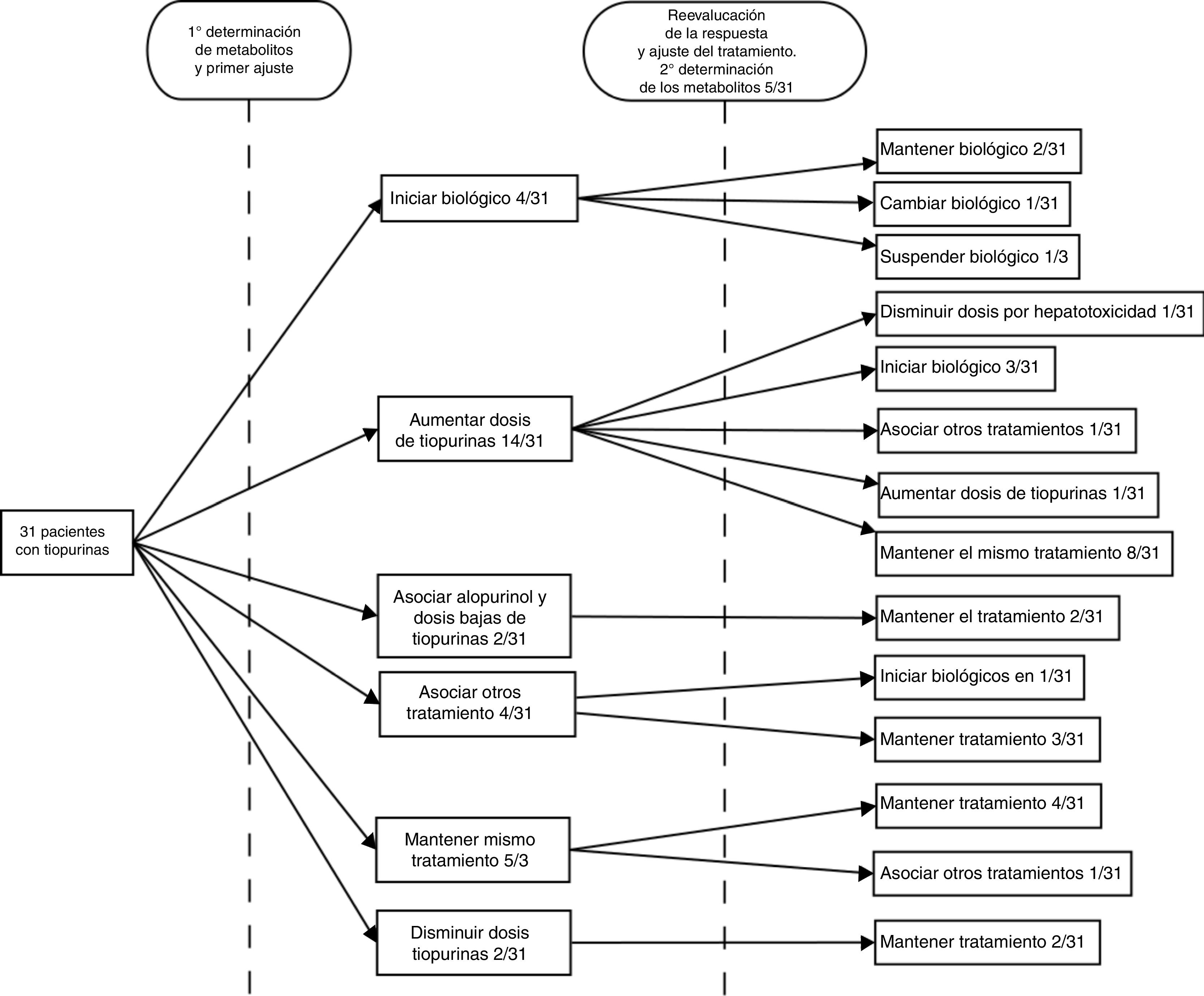
ResultadosSe solicitó esta determinación en 31 casos (74% varones), de los cuales 16/31 (51,6%) padecían enfermedad de Crohn, 14/31 (45,2%) colitis ulcerosa y 1/31 (3,7%) colitis indeterminada. La edad media fue 43,2±14 (22-74) años. La dosis media de AZA en el momento de la determinación fue de 2,33±0,5 (1,1-2,9) mg/kg/d, mientras que la de MP fue 1,13±0,49 (0,5-1,7) mg/kg/d.
En las tablas 2 y 3 se muestran los niveles medios de metabolitos obtenidos y su interpretación.
Niveles de metabolitos. Media, desviación estándar y rango de valores de 6-tioguanina (6TGN), 6-metil-mercaptopurina (6MMP), medidos en pmol/8×108 eritrocitos
| Niveles | Niveles de 6TGN | Niveles de 6MMP |
|---|---|---|
| Nivel medio | 255,4±144,5(102-764) | 2.236,4±25.549 (150-10.000) |
| En rango | 38,7% (12/31) | 90,4% (28/31) |
| Por debajo de rango | 51,6% (16/31) | |
| Por encima de rango | 9,6% (3/31) | 9,6% (3/31) |
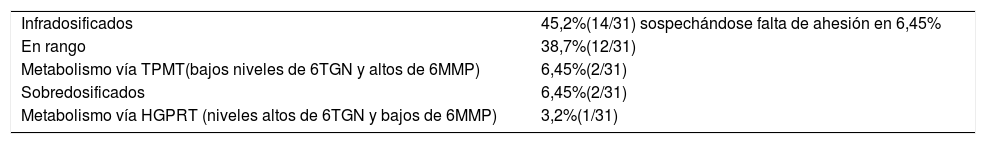
Interpretación de los niveles de metabolitos
| Infradosificados | 45,2%(14/31) sospechándose falta de ahesión en 6,45% |
| En rango | 38,7%(12/31) |
| Metabolismo vía TPMT(bajos niveles de 6TGN y altos de 6MMP) | 6,45%(2/31) |
| Sobredosificados | 6,45%(2/31) |
| Metabolismo vía HGPRT (niveles altos de 6TGN y bajos de 6MMP) | 3,2%(1/31) |
HGPRT: hipoxantín-guanín-fosforribosil-transferasa; TPMT: tiopurina metil transferasa; 6TGN: 6-tioguanina; 6MMP: 6-metil-mercaptopurina.
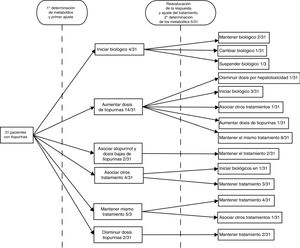
Tras obtener el resultado de la determinación la actitud consecuente fue escalar el tratamiento empleando un fármaco biológico en un 12,9% (4/31) de los casos, aumentar la dosis de tiopurinas en un 45,2% (14/31), asociar alopurinol a dosis bajas de tiopurinas en un 6,45% (2/31), prescribir un ciclo de corticoides en un 6,45% (2/31), asociar mesalazina en un 6,45% (2/31), mantener el mismo tratamiento en un 16,1% (5/31) y disminuir la dosis en un 6,45% (2/31). Se sospechó falta de adhesión al tratamiento en el 3,2% (1/31) de los casos.
Se siguió a los pacientes durante los 6 meses siguientes a realizar el ajuste, reevaluando entonces la respuesta clínica. Por decisión del médico responsable en esta segunda evaluación se solicitaron nuevos niveles en el 16,6% (5/31) de los casos, encontrándose el 20% (1/5) en rango, el 60%(3/5) infradosificados (estando 1/3 asintomático y sospechándose falta de adhesión en 1/3) y obteniéndose nuevos niveles en rango de hepatotoxicidad en el restante 20% (1/5). Tras el ajuste inicial el 67,7% había conseguido un buen control de la enfermedad. En el seguimiento posterior a esta decisión terapéutica, en el 13% (4/31) se inició el biológico, en un 3,2% (1/31) se suspendió tratamiento biológico por reacción adversa al mismo y un 6,5%(2/31) precisó ciclo de esteroides, en el 3,2%(1/31) se obtuvieron nuevos niveles en rango de hepatotoxicidad, por lo que se disminuyó la dosis de AZA, y en el 3.2%(1/31) se obtuvieron nuevos niveles infradosificados, por lo que se aumentó. Durante el periodo completo de seguimiento se sospechó falta de adhesión en 6,45% de los pasos; en un paciente (3,2%) en la primera evaluación y en un segundo paciente (3,2%) en la segunda evaluación. Siguiendo la práctica clínica habitual del centro, los pacientes que recibieron tratamiento con fármacos biológicos mantuvieron dosis bajas de AZA (50mg/día) como estrategia de optimización. En ninguno de ellos se solicitó nuevos niveles de metabolitos de tiopurinas22.
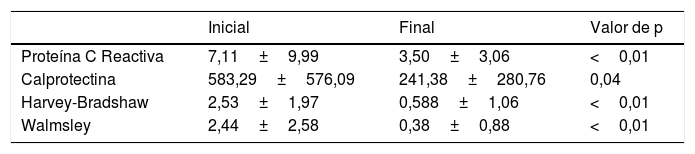
Aunque la opinión del médico tratante en cuanto a la existencia de remisión es un parámetro empleado en numerosos estudios (por ejemplo, el Physician General Assesment forma parte del índice de actividad de Mayo de la colitis ulcerosa), para reforzar la evaluación de nuestra actitud terapéutica consideramos analizar los cambios en parámetros más objetivos, como son la PCR, la calprotectina fecal y los respectivos índices de actividad, observándose en todos los casos una disminución de los niveles iniciales (fig. 2, tabla 4).
Parámetros evaluados
| Inicial | Final | Valor de p | |
|---|---|---|---|
| Proteína C Reactiva | 7,11±9,99 | 3,50±3,06 | <0,01 |
| Calprotectina | 583,29±576,09 | 241,38±280,76 | 0,04 |
| Harvey-Bradshaw | 2,53±1,97 | 0,588±1,06 | <0,01 |
| Walmsley | 2,44±2,58 | 0,38±0,88 | <0,01 |
Proteína C reactiva medida en mg/l y calprotectina fecal medida en mcg/g. Media y desviación estándar.
Nuestros datos corroboran que, a pesar de recibir una dosis considerada a priori adecuada de tiopurinas, el tratamiento de un 45,6% de los pacientes emplea dosis subóptimas (sospechándose la existencia de falta de adhesión al tratamiento en un 6,45% de los casos) y un 16,2% de los pacientes se encuentra sobredosificado o metaboliza por ruta metabólica alternativa. Tras realizar un ajuste de tratamiento a partir de la evaluación de los niveles de metabolitos de fármaco obtenidos, solo el 25,8% (8/31) inicia tratamiento con un agente biológico, mientras que un 74,2% (23/31) se manejan mediante optimización. Por tanto, según nuestra experiencia, la determinación de la concentración de los metabolitos de tiopurinas podría ser utilizada como una herramienta adicional en la práctica clínica que permita optimizar e individualizar el tratamiento con estos fármacos. Así, permite valorar aquellos pacientes no respondedores antes de sustituir las tiopurinas por otros tratamientos alternativos (biológicos por lo general) o asociarlos a ellos, con los consiguientes aumentos de toxicidad potencial y coste. La ventajas de esta estrategia, observadas en este estudio, incluyen la identificación de posibles causas de no respuesta al tratamiento. De este modo, permitiría rescatar a aquellos que se beneficiarían de recibir una mayor dosis de fármaco, aquellos que presentan una desviación en la ruta metabólica en los que se podría plantear una terapia con dosis bajas de AZA asociado a alopurinol, o aquellos en los que los datos sugieran falta de adhesión al tratamiento, un problema potencial en todos los pacientes, en particular en adolescentes, y distinguirlos de aquellos pacientes refractarios al tratamiento con tiopurinas que serían candidatos a un cambio de estrategia terapéutica. Si bien la falta de adhesión al tratamiento con tiopurinas puede resultar un problema potencial en el seguimiento de los pacientes con EII, en nuestro estudio no se observan tasas elevadas de no adhesión (6,45%), siendo las cifras similares a los resultados de no adhesión mediante determinación de metabolitos descritos previamente en la literatura27. En el abanico de opciones terapéuticas empleadas para la optimización del tratamiento con tiopurinas se encuentra la asociación de alopurinol y dosis bajas de tiopurinas como estrategia para aumentar tanto la eficacia como la tolerabilidad de las segundas, fundamentalmente en aquellos pacientes que presentan una desviación en la ruta metabólica que favorece la síntesis de metabolitos inactivos sobre los activos25,26.
Es necesario explicar la razón por la que se decidió que el ajuste era necesario en pacientes con inactividad clínica en los que los marcadores permanecían elevados. Dentro de los objetivos terapéuticos en la EII el clínico se ve en una posición adecuada para ser cada vez más ambicioso, buscando no solo la mejoría sintomática, sino también la normalización de marcadores y, en último término, probablemente la reversión de las lesiones mucosas. En este sentido el control estrecho parece ir aparejado a mejor calidad de vida y mejores resultados clínicos y endoscópicos28.
Nuestro estudio presenta importantes limitaciones, la mayoría derivadas de su carácter retrospectivo y del reducido número de pacientes incluidos. Por otro lado, entre sus fortalezas principales se encuentra la ausencia de análisis previos en práctica clínica en nuestro medio. Asimismo, dada la complejidad del metabolismo de las tiopurinas y la inmensa variedad de factores farmacocinéticos y farmacogenómicos implicados, se precisa de más estudios que permitan precisar con mayor exactitud la utilidad e interpretación de los niveles de metabolitos de estos fármacos.
En conclusión, nuestros resultados apoyan la utilización de la determinación de la concentración de 6TGN y 6MMP para optimizar el tratamiento con tiopurinas.
Conflicto de interesesLos autores afirman no tener conflicto de intereses.