Los fármacos anti-TNFα, infliximab y adalimumab, son eficaces en el tratamiento de la enfermedad de Crohn. No obstante, aproximadamente un tercio de los pacientes no responden inicialmente al tratamiento y una proporción relevante experimenta pérdida de eficacia o intolerancia al mismo. Por ello, es evidente que precisamos nuevos fármacos, dirigidos a otras dianas terapéuticas distintas del TNFα. Dentro de las alternativas terapéuticas destacan los fármacos dirigidos contra las integrinas. Vedolizumab es un anticuerpo monoclonal humanizado que se une específicamente a la integrina α4β7, inhibiendo la unión de los linfocitos T a las moléculas de adhesión (MAdCAM-1) que se expresan principalmente en el intestino delgado y colon. Por este motivo, y a diferencia de natalizumab, vedolizumab puede considerarse un inmunosupresor específico del intestino, lo que lo hace especialmente atractivo. El presente artículo revisa el papel de vedolizumab en la enfermedad de Crohn, prestando especial atención a sus propiedades farmacocinéticas/farmacodinámicas, indicaciones, eficacia y seguridad.
The anti-TNFα agents, infliximab and adalimumab, are effective in the treatment of Crohn's disease. Nevertheless, approximately one-third of patients do not initially respond to treatment and a substantial proportion experience loss of efficacy or intolerance to these drugs. Therefore, new drugs are obviously required, aimed at therapeutic targets other than TNFα. Notable among the therapeutic alternatives are drugs targeting integrins. Vedolizumab is a humanized monoclonal antibody that binds specifically to the α4β7 integrin, inhibiting T lymphocytes from binding to adhesion molecules (MAdCAM-1), which are expressed mainly in the small bowel and colon. Consequently, and unlike natalizumab, vedolizumab can be considered a specific intestinal immunosuppressant, making it especially attractive. The present article reviews the role of vedolizumab in Crohn's disease, paying special attention to its pharmacokinetic/pharmacodynamic properties, indications, effectiveness, and safety.
Aunque ha habido grandes avances en el tratamiento farmacológico de la enfermedad de Crohn, este continúa siendo insuficiente para una proporción notable de pacientes. Así, los aminosalicilatos son escasamente eficaces (o probablemente ineficaces, sobre todo en la enfermedad de Crohn de localización ileal). Los corticosteroides son eficaces para inducir la remisión, pero no logran mantenerla a largo plazo. Con frecuencia —habitualmente por corticodependencia— es preciso presentar recurrencias a los fármacos inmunosupresores (fundamentalmente tiopurínicos, como la azatioprina o la mercaptopurina, y metotrexato), los cuales tienen una eficacia discreta en la enfermedad de Crohn y además se asocian con una relativamente elevada incidencia de efectos adversos (que en no pocas ocasiones obligan a su retirada)1–5. Por otra parte, los inmunosupresores tienen un inicio de acción lento (varios meses), lo que los hace inadecuados para inducir la remisión. Por todo lo anterior, con cierta frecuencia —aproximadamente en un tercio de los casos— se requiere escalar el tratamiento y emplear alguno de los fármacos bloqueantes del factor de necrosis tumoral alfa (TNFα), que en nuestro medio se limitan a infliximab o adalimumab6–9. No obstante, aproximadamente un tercio de los pacientes no responden inicialmente al tratamiento anti-TNFα (fracaso primario), y una proporción relevante experimenta pérdida de eficacia (fracaso secundario) o intolerancia al mismo7,10–15. Por otra parte, los efectos secundarios asociados al empleo de estos últimos fármacos, aunque infrecuentes, pueden ser graves16,17. Por todo ello, es evidente que se precisa disponer de nuevos fármacos —dirigidos a otras dianas terapéuticas distintas del TNFα— para mejorar el tratamiento de los pacientes con enfermedad de Crohn18–22.
Uno de los mecanismos claves en la autoperpetuación inflamatoria de la mayoría de enfermedades mediadas por la inmunidad, y por tanto de la enfermedad de Crohn, es la migración de células inflamatorias activadas hacia los tejidos afectos. En este proceso se requiere de la captura, rodamiento (rolling), adhesión y migración de leucocitos a través de la pared vascular, habiéndose descrito fundamentalmente 2 tipos de mecanismos: las selectinas (que permiten el enlentecimiento de los leucocitos y su «rodamiento» por la superficie endotelial), y las moléculas de adhesión o integrinas (que son moléculas presentes en la superficie del leucocito que permiten el cese del rodamiento y el inicio de la migración del leucocito a través de la pared vascular).
Dentro de las alternativas terapéuticas al bloqueo del TNFα destacan los fármacos dirigidos contra las integrinas23–31. El primero de ellos fue natalizumab, un anticuerpo monoclonal dirigido contra la integrina α4 y, por tanto, ubicua en el organismo32,33. A pesar de haber demostrado eficacia en el tratamiento de la enfermedad de Crohn activa, el riesgo de leucoencefalopatía multifocal progresiva (LMP) al inhibir la migración de linfocitos a través de la barrera hematoencefálica desaconsejó su uso en estos pacientes.
Vedolizumab es un anticuerpo monoclonal humanizado que se une específicamente a la integrina α4β7 que se expresa mayoritariamente en linfocitos T34–36. Mediante su unión a α4β7 linfocitaria, vedolizumab inhibe la unión de estas células a moléculas de adhesión (MAdCAM-1) que se expresan principalmente en las células endoteliales del intestino delgado y colon, jugando un papel crítico en la migración de los linfocitos T a los tejidos del tracto gastrointestinal26–31,37,38. Por este motivo se considera un inmunosupresor biológico específico del intestino, lo que hace de vedolizumab un anticuerpo monoclonal muy atractivo en el manejo de las enfermedades inflamatorias crónicas intestinales39.
El presente artículo pretende revisar el papel de vedolizumab en la enfermedad de Crohn, prestando especial atención a sus propiedades farmacocinéticas y farmacodinámicas, su posología, sus indicaciones, su eficacia, su seguridad y, finalmente, cuál podría ser el lugar que ocupe este fármaco en el tratamiento de esta enfermedad.
Propiedades farmacocinéticas de vedolizumabCon respecto a la distribución, los análisis de farmacocinética poblacional indican que el volumen de distribución de vedolizumab es de aproximadamente 5 litros40. Vedolizumab no atraviesa la barrera hematoencefálica tras su la administración intravenosa, no habiéndose detectado el fármaco en el líquido cefalorraquídeo de sujetos sanos después de la administración de 450mg por vía intravenosa41.
En relación con su eliminación, los análisis de farmacocinética indican que vedolizumab tiene un aclaramiento total en el organismo de aproximadamente 0,157l/día y una semivida plasmática de 25 días. Se desconoce la ruta de eliminación exacta de vedolizumab y los factores de los que esta depende. Así, los diversos análisis de farmacocinética sugieren que el bajo nivel de albúmina, el mayor peso corporal, el tratamiento previo con fármacos anti-TNFα y la presencia de anticuerpos antivedolizumab pueden aumentar el aclaramiento de vedolizumab, si bien la magnitud de estos efectos no se considera clínicamente relevante42.
La edad no influye en el aclaramiento de vedolizumab en pacientes con enfermedad de Crohn según los análisis de farmacocinética poblacional previamente mencionados. Por último, no se han realizado estudios específicos para examinar los efectos de la insuficiencia renal o hepática sobre la farmacocinética de vedolizumab42.
Propiedades farmacodinámicas de vedolizumabVedolizumab pertenece al grupo farmacoterapéutico de los inmunosupresores (inmunosupresores selectivos, código ATC: L04AA33). Es un inmunosupresor biológico específico del intestino. Se trata de un anticuerpo monoclonal humanizado que, como se ha mencionado previamente, se une específicamente a la integrina α4β7, la cual se expresa mayoritariamente en linfocitos T que migran al intestino23,24,31,35,36. Mediante la unión a α4β7 de ciertos linfocitos, vedolizumab inhibe su adhesión a la molécula de adhesión celular adresina de la mucosa 1 (MAdCAM-1). Esta molécula de adhesión se expresa principalmente en las células endoteliales del intestino y desempeña un papel fundamental en la migración de los linfocitos T a los tejidos del tracto gastrointestinal26–30,43,44.
La integrina α4β7 se expresa en un subtipo concreto de linfocitos T colaboradores de memoria que migran preferentemente al tracto gastrointestinal y causan la inflamación que es característica la enfermedad de Crohn37. La inhibición de la interacción entre la α4β7 y MAdCAM-1 con vedolizumab evita la migración de estos linfocitos T a través del endotelio vascular al tejido parenquimatoso en primates e induce un incremento reversible de 3 veces en el número de estas células en sangre periférica. El precursor murino de vedolizumab ha demostrado disminuir la inflamación gastrointestinal en un modelo animal de colitis45.
En los ensayos clínicos con vedolizumab en un rango de dosis de 2-10mg/kg, se observó un grado de saturación>95% en los receptores α4β7 de los subconjuntos de linfocitos circulantes implicados en la vigilancia inmunitaria del intestino43.
Por último, es importante mencionar que en sujetos sanos o en pacientes con enfermedad de Crohn, vedolizumab no incrementa el número global de leucocitos ni el de ninguna de sus subpoblaciones, como neutrófilos, basófilos, eosinófilos o linfocitos43.
Dosis y frecuencia de administración de vedolizumab en la enfermedad de CrohnDosis y frecuencia de administración: la pauta posológica recomendada de vedolizumab es de 300mg administrados mediante perfusión intravenosa (durante 30 minutos) en las semanas 0, 2 y 6, y cada 8 semanas a partir de entonces. No se debe continuar el tratamiento en pacientes con enfermedad de Crohn si no se observan evidencias de beneficios terapéuticos en la semana 14. Por el contrario, en pacientes que respondan se continuaría el tratamiento cada 8 semanas a partir de dicha semana46.
Pérdida de eficacia: los pacientes que hayan experimentado una pérdida de respuesta al tratamiento podrían beneficiarse de un aumento en la frecuencia de la administración de vedolizumab a 300mg cada 4 semanas46. Esta conclusión se basa en los resultados del estudio GEMINI LTS, en el que los pacientes que habían participado previamente el estudio GEMINI II y que habían perdido respuesta a la dosis de vedolizumab de 300mg cada 8 semanas, recibían una dosis «intensificada» del fármaco (300mg cada 4 semanas), con lo que se lograba un incremento en la eficacia sin aumentar la incidencia de efectos adversos47 (véase más adelante apartado de «pérdida de respuesta»).
Repetición del tratamiento: si tras la interrupción del tratamiento existe la necesidad de repetir el tratamiento con vedolizumab, se puede considerar su readministración. El periodo de interrupción del tratamiento en ensayos clínicos ha tenido una duración máxima de un año. En los casos en los que se reinstauró el tratamiento con vedolizumab, se recuperó la eficacia sin describirse un incremento evidente de acontecimientos adversos o reacciones relacionadas con la perfusión46.
Pacientes de edad avanzada: no es necesario ajustar la dosis en pacientes de edad avanzada. Los análisis de farmacocinética no han revelado ningún efecto del incremento de la edad46.
Población pediátrica: no se dispone de datos en esta población, no habiéndose establecido la seguridad ni la eficacia de vedolizumab en niños de 0-17 años46.
Indicaciones de vedolizumab en la enfermedad de CrohnSegún la ficha técnica, vedolizumab está indicado para el tratamiento de pacientes adultos con enfermedad de Crohn activa de moderada a grave que han tenido una respuesta inadecuada, pérdida de respuesta o intolerancia al tratamiento convencional o a un anti-TNFα39,46.
Eficacia de vedolizumab en la enfermedad de CrohnLa eficacia y seguridad de vedolizumab para el tratamiento de pacientes adultos con enfermedad de Crohn activa moderada o grave (es decir, con una puntuación del Crohn's Disease Activity Index [CDAI] de 220-450) ha sido evaluada en 2 ensayos clínicos denominados GEMINI II48 y III49. Los pacientes participantes en estos estudios habían fracasado al menos a un tratamiento convencional, incluidos corticosteroides, inmunomoduladores, y/o anti-TNFα (incluyendo tanto pacientes no respondedores primarios como secundarios, es decir, con respuesta inicial pero posterior pérdida de respuesta a un anti-TNFα). En ambos estudios se permitieron dosis estables concomitantes por vía oral de inmunomoduladores (fundamentalmente fármacos tiopurínicos, como la azatioprina y la mercaptopurina)48,49.
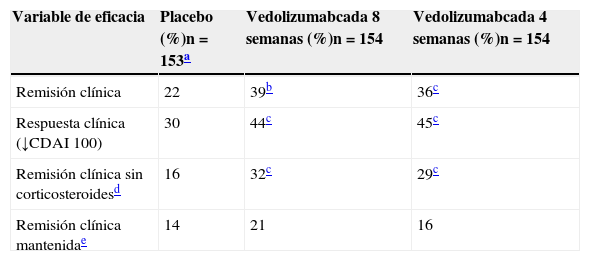
El estudio GEMINI II48 es un ensayo clínico aleatorizado, doble ciego, controlado con placebo, en el que las variables de eficacia se evaluaron en las semanas 6 y 52. Los pacientes (n=368) fueron aleatorizados en un diseño doble ciego (3:2) a recibir 2 dosis de 300mg de vedolizumab o placebo en las semanas 0 y 2. Las 2 variables principales fueron la proporción de pacientes en remisión clínica (definida como una puntuación del CDAI ≤150) en la semana 6 y la proporción de pacientes con respuesta clínica (definida como una disminución ≥100 puntos en la puntuación del CDAI con respecto al nivel basal) en la semana 6. El ensayo incluía 2 cohortes de pacientes que recibieron vedolizumab en las semanas 0 y 2: en la cohorte 1, los pacientes fueron aleatorizados a recibir 300mg de vedolizumab o placebo mediante un diseño doble ciego y, en la cohorte 2, los pacientes fueron tratados con 300mg de vedolizumab en régimen abierto. Para evaluar la eficacia en la semana 52, 461 pacientes de las cohortes 1 y 2 que fueron tratados con vedolizumab y que habían logrado una respuesta clínica (definida en este caso como una disminución ≥70 puntos en la puntuación del CDAI) en la semana 6 fueron aleatorizados mediante un diseño doble ciego (1:1:1) a 1 de los siguientes regímenes, que comenzaron a partir de la semana 6: 300mg de vedolizumab cada 8 semanas, 300mg de vedolizumab cada 4 semanas, o placebo cada 4 semanas. La variable principal fue la proporción de pacientes en remisión clínica en la semana 52. Los resultados de este estudio, tanto a corto como a largo plazo, se resumen, respectivamente, en las tablas 1 y 2.
Resultados de eficacia de los estudios GEMINI II y III en las semanas 6 y 10
| EstudioVariable de eficacia | Placebo (%) | Vedolizumab (%) |
|---|---|---|
| Estudio GEMINI II | ||
| Remisión clínica, semana 6 | ||
| Global | 7 (n=148) | 15a (n=220) |
| Fracaso con anti-TNFα | 4 (n=70) | 11 (n=105) |
| Sin tratamiento previo con anti- TNFα | 9 (n=76) | 17 (n=109) |
| Respuesta clínica (↓CDAI 100), semana 6 | ||
| Global | 26 (n=148) | 31b (n=220) |
| Fracaso con anti-TNFα | 23 (n=70) | 24 (n=105) |
| Sin tratamiento previo con anti-TNFα | 30 (n=76) | 42 (n=109) |
| Cambio en la PCR sérica desde el nivel basal hasta la semana 6, mediana (μg/ml) | ||
| Globalc | −0,5 (n=147) | −0,9 (n=220) |
| Estudio GEMINI III | ||
| Remisión clínica, semana 6 | ||
| Globalc | 12 (n=207) | 19 (n=209) |
| Fracaso con anti-TNFαe | 12 (n=157) | 15d (n=158) |
| Sin tratamiento previo con anti-TNFα | 12 (n=50) | 31 (n=51) |
| Remisión clínica, semana 10 | ||
| Global | 13 (n=207) | 29 (n=209) |
| Fracaso con anti-TNFαc,e | 12 (n=157) | 27 (n=158) |
| Sin tratamiento previo con anti-TNFα | 16 (n=50) | 35 (n=51) |
| Remisión clínica mantenidae,f | ||
| Global | 8 (n=207) | 15 (n=209) |
| Fracaso con anti-TNFαc,e | 8 (n=157) | 12 (n=158) |
| Sin tratamiento previo con anti-TNFα | 8 (n=50) | 26 (n=51) |
| Respuesta clínica (↓CDAI 100), semana 6 | ||
| Globalg | 23 (n=207) | 39 (n=209) |
| Fracaso con anti-TNFαc | 22 (n=157) | 39 (n=158) |
| Sin tratamiento previo con anti-TNFαg | 24 (n=50) | 39 (n=51) |
Resultados de eficacia del estudio GEMINI II en la semana 52
| Variable de eficacia | Placebo (%)n=153a | Vedolizumabcada 8 semanas (%)n=154 | Vedolizumabcada 4 semanas (%)n=154 |
|---|---|---|---|
| Remisión clínica | 22 | 39b | 36c |
| Respuesta clínica (↓CDAI 100) | 30 | 44c | 45c |
| Remisión clínica sin corticosteroidesd | 16 | 32c | 29c |
| Remisión clínica mantenidae | 14 | 21 | 16 |
El grupo de placebo incluye a aquellos sujetos que recibieron vedolizumab en las semanas 0 y 2, y fueron aleatorizados a recibir placebo desde la semana 6 hasta la semana 52.
Remisión clínica sin corticosteroides: pacientes que tomaban corticosteroides orales al inicio del estudio, que interrumpieron los corticosteroides a partir de la semana 6 y que estaban en remisión clínica en la semana 52. El número de pacientes fue n=82 con placebo, n=82 con vedolizumab cada 8 semanas y n=80 con vedolizumab cada 4 semanas.
El estudio GEMINI III49 es un segundo ensayo clínico aleatorizado, doble ciego, controlado con placebo, que evaluó la eficacia en las semanas 6 y 10 en el subgrupo de pacientes que habían fracasado al menos a un tratamiento convencional y además al tratamiento con anti-TNFα, así como en la población total, que también incluía pacientes que habían fracasado al menos a un tratamiento convencional y que no habían recibido tratamiento previo con anti-TNFα. Los pacientes (n=416), de los que aproximadamente un 75% habían fracasado previamente al tratamiento con un anti-TNFα, fueron aleatorizados mediante un diseño doble ciego (1:1) a recibir 300mg de vedolizumab o placebo en las semanas 0, 2, y 6. La variable principal fue la proporción de pacientes en remisión clínica en la semana 6 de la subpoblación que había fracasado al tratamiento con anti-TNFα. Como se indica en la tabla 1, aunque no se demostraron diferencias estadísticamente significativas en la variable principal, los análisis exploratorios/subanálisis mostraron resultados clínicamente relevantes en las demás variables de estudio.
La eficacia de vedolizumab a largo plazo se evaluó inicialmente en un estudio en el que los pacientes con enfermedad de Crohn fueron aleatorizados a recibir 2, 6 o 10mg/kg de vedolizumab50. Los pacientes fueron tratados con un esquema de inducción en los días 1, 15 y 43, seguido de una dosis de mantenimiento cada 8 semanas durante aproximadamente 18 meses. Al final del seguimiento (día 491), la eficacia se pudo evaluar en tan solo 10 pacientes con enfermedad de Crohn. La remisión clínica se constató en el 40% de los casos, mientras que el 70% evidenciaron una respuesta clínica.
Más recientemente se han publicado los datos del estudio GEMINI LTS51. Se trata de un estudio de extensión, abierto, en el que 295 pacientes que completaron el GEMINI II (durante el primer año de tratamiento) fueron seguidos a lo largo de un segundo año, durante el cual recibían vedolizumab a dosis de 300mg cada 4 semanas. La tasa de remisión global a los 2 años de comenzar el tratamiento con vedolizumab fue del 61%.
Análisis exploratorios/subanálisis de los estudios con vedolizumaba) Efecto del tratamiento concomitante con corticosteroidesSe han llevado a cabo análisis exploratorios para evaluar el efecto de los corticosteroides concomitantes sobre la inducción de la remisión con vedolizumab. El tratamiento combinado con corticosteroides fue más eficaz en lo que respecta a la inducción de la remisión de la enfermedad de Crohn frente al tratamiento con vedolizumab aisladamente. Así, la tasa de remisión clínica en el estudio GEMINI II en la semana 6 fue del 10% (diferencia respecto a placebo del 2%) al administrarse sin corticosteroides, frente al 20% (diferencia respecto a placebo del 14%) al administrarse junto con ellos48. Por su parte, en el estudio GEMINI III, en las semanas 6 y 10 las tasas de remisión clínica fueron respectivamente del 18% (diferencia respecto a placebo del 3%) y del 22% (diferencia respecto a placebo del 8%) al administrarse sin corticosteroides, frente a una tasa del 20% (diferencia respecto a placebo del 11%) y del 35% (diferencia respecto a placebo del 23%) al administrarse con ellos49. Estos efectos se observaron con independencia de que se administrasen o no inmunomoduladores de forma concomitante. En resumen, los subanálisis de los ensayos clínicos en enfermedad de Crohn sugieren que, cuando se administra a pacientes que no reciben tratamiento concomitante con corticosteroides, vedolizumab puede ser menos eficaz en lo que respecta a la inducción de la remisión que en pacientes que ya estén recibiendo concomitantemente estos fármacos.
b) Tratamiento previo con fármacos anti-TNFαEn el ensayo clínico GEMINI II, aproximadamente la mitad de los pacientes habían fracasado previamente al tratamiento con anti-TNFα. De entre estos pacientes, el 28% de los que recibían vedolizumab cada 8 semanas, el 27% de los que recibían vedolizumab cada 4 semanas y el 13% de los tratados con placebo lograron la remisión clínica en la semana 5248. La respuesta clínica (descenso de 100 puntos en el CDAI) se logró en el 29, 38 y 21%, respectivamente, y la remisión clínica sin corticosteroides se logró en el 24, 16 y 0%, respectivamente52. Por su parte, en el estudio GEMINI III49, al considerar los 315 pacientes en los que había fracasado un tratamiento previo con fármacos anti-TNFα, el 27% de los tratados con vedolizumab, frente al 12% de los que recibieron placebo, alcanzaron la remisión en la semana 10, siendo estas diferencias estadísticamente significativas (este beneficio no había alcanzado la significación estadística en la semana 6 al considerar la remisión como objetivo, pero sí al considerar la respuesta clínica). Por último, los resultados del estudio GEMINI LTS (el estudio de extensión del GEMINI II durante un segundo año), confirman que, aunque las tasas de remisión son más elevadas en los pacientes naïve a los fármacos anti-TNFα (69%), estas son también aceptables (51%) en aquellos en los que previamente han fracasado los anti-TNFα51.
c) Ausencia de respuesta inicial (semana 6)Los pacientes que no mostraron respuesta en la semana 6 en el ensayo GEMINI II continuaron en el estudio y recibieron vedolizumab cada 4 semanas (en lugar de cada 8). La respuesta clínica (descenso de 100 puntos en el CDAI) se logró en las semanas 10 y 14 en una mayor proporción de pacientes tratados con vedolizumab (16 y 22%, respectivamente), en comparación con los pacientes tratados con placebo (7 y 12%, respectivamente). No hubo diferencias clínicamente relevantes en la remisión clínica entre los grupos de tratamiento en los momentos indicados53. Los análisis de la remisión clínica en la semana 52 en pacientes que eran no respondedores en la semana 6 pero que lograron una respuesta en las semanas 10 o 14, sugieren que los pacientes con enfermedad de Crohn inicialmente no respondedores (semana 6) pueden beneficiarse de una dosis de vedolizumab en la semana 10. En resumen, parece que la inducción de la remisión de la enfermedad de Crohn puede tardar hasta 14 semanas en algunos casos.
Se desconoce el motivo de esta relativamente prolongada latencia de vedolizumab en algunos pacientes, pero podría estar relacionado con su mecanismo de acción (se ha postulado que la inhibición de las integrinas precisaría de un tiempo superior al de la inhibición del TNFα para ejercer su efecto terapéutico). En cualquier caso, la ausencia de estudios que comparen directamente vedolizumab frente a fármacos anti-TNFα hace difícil extraer conclusiones definitivas respecto a la eficacia y rapidez relativa de ambos tipos de fármacos. Esta prudencia a la hora de establecer comparaciones indirectas debe extremarse cuando las características basales de los pacientes incluidos en los diversos estudios pueden diferir; así, por ejemplo, la población incluida en el estudio GEMINI II es una de las más graves que se ha incluido en estudios que evalúan medicamentos biológicos, ya que la puntuación media del CDAI en el momento basal era de 324 y aproximadamente el 50% de los pacientes había experimentado un fallo previo a uno o 2 fármacos anti-TNFα.
d) Pérdida de respuestaA los pacientes que presentaron pérdida de respuesta a vedolizumab mientras recibían el fármaco cada 8 semanas en el ensayo GEMINI II se les permitió participar en un estudio de extensión abierto y recibir vedolizumab cada 4 semanas (esto es, «intensificando» el tratamiento). Mediante esta estrategia se logró la remisión clínica en el 6,8% de los pacientes en la semana 10, en el 10% en la semana 14 y en 19% en la semana 52 desde la intensificación. En el grupo que recibió placebo, los resultados fueron del 4,3, 10 y 7% en las semanas 10, 14 y 52 respectivamente54.
e) Efecto sobre la calidad de vidaLos análisis exploratorios muestran una mejoría clínicamente relevante (desde la visita basal a la semana 52) en los pacientes que recibieron vedolizumab cada 4 y cada 8 semanas en el ensayo GEMINI II, que fue significativamente mayor que la evidenciada en el grupo placebo. Dicha mejoría se constató en las puntuaciones del EQ-5D, EQ-5D VAS y en la puntuación total del Inflammatory Bowel Disease Questionnaire (IBDQ)48.
Perfil de seguridad de vedolizumabLa seguridad de vedolizumab se ha estudiado con detalle en 3 ensayos clínicos controlados con placebo en pacientes con colitis ulcerosa (GEMINI I)55 o enfermedad de Crohn (GEMINI II y III)48,49. En 2 ensayos controlados (GEMINI I y II)48,55 participaron 1.434 pacientes que recibieron 300mg de vedolizumab en la semana 0, la semana 2 y posteriormente cada 8 o cada 4 semanas durante un máximo de 52 semanas. Se notificaron acontecimientos adversos en el 84% de los pacientes tratados con vedolizumab y en el 78% de los pacientes que recibieron placebo. Durante 52 semanas, el 19% de los pacientes tratados con vedolizumab experimentaron acontecimientos adversos graves, frente al 13% de los pacientes del grupo placebo. Se observaron tasas similares de acontecimientos adversos en los grupos con administración de dosis cada 8 y cada 4 semanas. La proporción de pacientes que interrumpió el tratamiento debido a acontecimientos adversos fue del 9% en los pacientes tratados con vedolizumab y del 10% en los que recibieron placebo. En los estudios combinados GEMINI I y II las reacciones adversas que se produjeron en el más del 5% de los pacientes fueron: náuseas, nasofaringitis, infección de las vías respiratorias superiores, artralgia, fiebre, fatiga, cefalea y tos. Por último, se notificaron reacciones relacionadas con la perfusión en el 4% de los pacientes tratados con vedolizumab56.
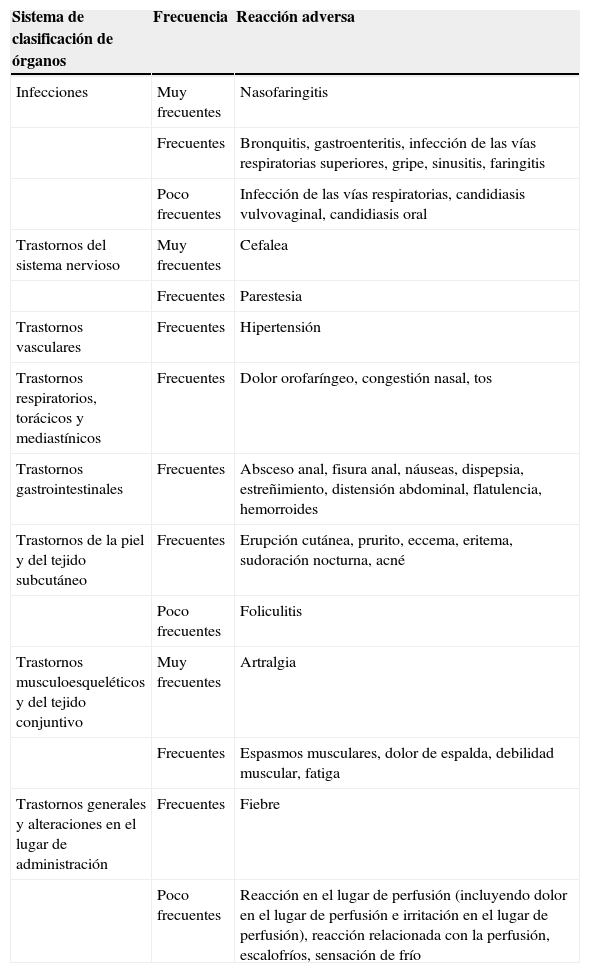
En la tabla 3 se resumen las reacciones adversas según el «sistema de clasificación de órganos», basada en la experiencia de los ensayos clínicos. Dentro de las distintas categorías, las reacciones adversas se enumeran bajo encabezamientos con las siguientes frecuencias: muy frecuentes (≥1/10), frecuentes (de ≥1/100 a<1/10) y poco frecuentes (de ≥1/1.000 a<1/100). En dicha tabla, las reacciones adversas se enumeran por orden decreciente de gravedad dentro de cada grupo de frecuencia.
Reacciones adversas a vedolizumab
| Sistema de clasificación de órganos | Frecuencia | Reacción adversa |
|---|---|---|
| Infecciones | Muy frecuentes | Nasofaringitis |
| Frecuentes | Bronquitis, gastroenteritis, infección de las vías respiratorias superiores, gripe, sinusitis, faringitis | |
| Poco frecuentes | Infección de las vías respiratorias, candidiasis vulvovaginal, candidiasis oral | |
| Trastornos del sistema nervioso | Muy frecuentes | Cefalea |
| Frecuentes | Parestesia | |
| Trastornos vasculares | Frecuentes | Hipertensión |
| Trastornos respiratorios, torácicos y mediastínicos | Frecuentes | Dolor orofaríngeo, congestión nasal, tos |
| Trastornos gastrointestinales | Frecuentes | Absceso anal, fisura anal, náuseas, dispepsia, estreñimiento, distensión abdominal, flatulencia, hemorroides |
| Trastornos de la piel y del tejido subcutáneo | Frecuentes | Erupción cutánea, prurito, eccema, eritema, sudoración nocturna, acné |
| Poco frecuentes | Foliculitis | |
| Trastornos musculoesqueléticos y del tejido conjuntivo | Muy frecuentes | Artralgia |
| Frecuentes | Espasmos musculares, dolor de espalda, debilidad muscular, fatiga | |
| Trastornos generales y alteraciones en el lugar de administración | Frecuentes | Fiebre |
| Poco frecuentes | Reacción en el lugar de perfusión (incluyendo dolor en el lugar de perfusión e irritación en el lugar de perfusión), reacción relacionada con la perfusión, escalofríos, sensación de frío |
Por otra parte, actualmente, se está llevando a cabo un estudio de extensión abierto para evaluar la seguridad del fármaco a largo plazo en los pacientes incluidos en los ensayos clínicos y que están recibiendo vedolizumab 300mg cada 4 semanas57. Se dispone actualmente de datos intermedios, incluyendo 1.534 pacientes que han sido tratados con vedolizumab durante al menos 6 meses, 1.
149 durante al menos un año y 502 durante al menos 2 años. Los acontecimientos adversos más comunes incluyen cefalea (6%), nasofaringitis (4%), náuseas (4%), artralgia (4%), infecciones del tracto respiratorio superior (3%) y fatiga (3%). No se han documentado por el momento casos de candidiasis sistémica, herpes zoster diseminado, hepatitis, neumonía o LMP. La aparición de tumores se ha registrado en menos del 1% de los pacientes. Estos datos apoyan la seguridad a medio plazo de vedolizumab y confirman que su perfil es similar al observado en los ensayos clínicos57.
A continuación se describen con detalle las reacciones adversas más relevantes que se han asociado al uso de vedolizumab.
a) Reacciones relacionadas con la perfusiónEn los ensayos clínicos GEMINI I y II, el 4% de los pacientes tratados con vedolizumab y el 3% de los pacientes que recibieron placebo experimentaron un acontecimiento adverso definido por el investigador como «reacción relacionada con la perfusión»56. La mayoría de estas reacciones fueron de intensidad leve o moderada y menos del 1% provocaron la interrupción del tratamiento. Las reacciones relacionadas con la perfusión se resolvieron generalmente sin intervención o con intervención mínima después de la perfusión. Se notificó un acontecimiento adverso grave relacionado con la perfusión en un paciente con enfermedad de Crohn durante la segunda perfusión (los síntomas notificados fueron disnea, broncoespasmo, urticaria, rubefacción, erupción cutánea y aumento de la presión arterial y frecuencia cardíaca), que respondió satisfactoriamente a la interrupción de la perfusión y a la administración de antihistamínicos e hidrocortisona por vía intravenosa. En los pacientes a los que se les administró vedolizumab en las semanas 0 y 2 y luego se continuó con placebo, no se observó ningún aumento en la tasa de reacciones relacionadas con la perfusión al reanudar el tratamiento con vedolizumab después de la pérdida de respuesta a este. Se recomienda monitorizar a todos los pacientes de forma continua durante cada perfusión; además, en las 2 primeras perfusiones es necesario vigilarlos durante aproximadamente 2 horas después de haber finalizado la perfusión, para así detectar signos y síntomas de reacciones de hipersensibilidad agudas. En todas las perfusiones posteriores se debe monitorizar a los pacientes durante aproximadamente una hora después de haber finalizado la perfusión46.
b) InfeccionesEn los estudios GEMINI I y II, la tasa de infecciones fue de 0,85 por paciente-año en los pacientes tratados con vedolizumab y de 0,70 en los que recibieron placebo. Las infecciones consistieron fundamentalmente en nasofaringitis, infección de las vías respiratorias superiores, sinusitis e infecciones urinarias. La mayoría de los pacientes continuaron recibiendo vedolizumab una vez desaparecida la infección. En los estudios GEMINI I y II, la tasa de infecciones graves fue de 0,07 por paciente-año en los pacientes tratados con vedolizumab y de 0,06 en los que recibieron placebo. En los estudios abiertos con vedolizumab se han notificado también algunas infecciones graves, que incluyen tuberculosis, sepsis por salmonella, meningitis por listeria y colitis por citomegalovirus56. Por último, recientemente se ha evaluado la incidencia de complicaciones infecciosas considerando conjuntamente la población de los estudios GEMINI I y II, dependiendo de que los pacientes recibieran vedolizumab en monoterapia o combinado con corticoides o inmunomoduladores58. En los 1.434 pacientes que recibieron vedolizumab, la incidencia de infecciones fue similar a la observada en los que recibieron placebo (únicamente se constató una mayor incidencia de nasofaringitis); por otra parte, dicha tasa de infección fue similar independientemente del tratamiento concomitante recibido.
Mención especial merece el apartado de seguridad de vedolizumab respecto al desarrollo de LMP. Algunos antagonistas de las integrinas se han asociado con el desarrollo de LMP, que es una infección oportunista poco frecuente y a menudo mortal causada por el virus de John Cunningham (JC)59,60. Así, natalizumab, un anticuerpo monoclonal que bloquea tanto las integrinas α4β7 (presentes fundamentalmente en el tracto digestivo) como las α4β1 (presentes en diversos órganos, incluido el sistema nervioso central), se ha asociado con la aparición de varios casos de LMP, por lo que en Europa se decidió no aprobarlo para el tratamiento de la enfermedad de Crohn (estando disponible únicamente bajo un programa de prescripción especial)32,33,61,62.
Vedolizumab es un anticuerpo monoclonal que bloquea específicamente las integrinas α4β7, impidiendo las uniones con su receptor endotelial MAdCAM-1 únicamente a nivel intestinal. La ventaja de vedolizumab en comparación con natalizumab es que bloquea la migración de los leucocitos específicamente en el tubo digestivo, evitando así el riesgo de LMP. Así, al no bloquear la integrina α4β1, vedolizumab no afecta a la migración de linfocitos al sistema nervioso central. Acorde con ello, tras la administración de vedolizumab en voluntarios sanos no se modifica la relación CD4+/CD8+ en el líquido cefalorraquídeo63. Estos datos son coherentes con los estudios llevados a cabo en animales, que no han detectado efectos sobre la vigilancia inmunitaria ni la inflamación del sistema nervioso central en encefalomielitis autoinmune experimental en primates, un modelo de esclerosis múltiple64. No se han notificado hasta el momento casos de LMP en los ensayos clínicos realizados con vedolizumab50; no obstante, parece sensato controlar la aparición de signos y síntomas neurológicos en los pacientes tratados con vedolizumab y considerar su derivación al neurólogo si se producen46.
c) InmunogenicidadEn los estudios fase 2 iniciales con vedolizumab, más del 30% de los pacientes desarrolló anticuerpos contra el fármaco, una cifra considerablemente elevada65. Por ello se desarrolló una nueva formulación del fármaco y se administró con un esquema posológico distinto (más frecuente durante la inducción y a una dosis mayor), tras lo que se comprobó una reducción notable en el desarrollo de anticuerpos anti-vedolizumab43. Así, en los estudios controlados GEMINI I y II, vedolizumab mostró una tasa de inmunogenicidad del 4% (56 de los 1.434 pacientes que recibieron tratamiento continuado con vedolizumab tuvieron un resultado positivo para anticuerpos anti-vedolizumab en algún momento durante el tratamiento)48,55. La frecuencia de detección de anticuerpos anti-vedolizumab 16 semanas después de la última dosis de vedolizumab (aproximadamente 5 semividas tras la última dosis) fue de aproximadamente del 10% en los estudios GEMINI I y II. En dichos estudios, el 5% de los pacientes que tuvieron un acontecimiento adverso considerado por el investigador como relacionado con la perfusión dieron positivo de forma repetida para anticuerpos anti-vedolizumab. En general, no se demostró una correlación entre el desarrollo de anticuerpos anti-vedolizumab y la respuesta clínica o los acontecimientos adversos. No obstante, el número de pacientes que desarrolló anticuerpos fue demasiado reducido como para poder establecer una conclusión definitiva50.
d) Neoplasias malignasNo se ha descrito un aumento del riesgo de desarrollar neoplasias malignas asociadas al tratamiento con vedolizumab. Sin embargo, el número de tumores evidenciado en los estudios realizados ha sido muy pequeño y la exposición a largo plazo es todavía limitada50. Por tanto, es evidente que se precisa continuar evaluando la seguridad a largo plazo de este fármaco.
Contraindicaciones e interacciones de vedolizumaba) ContraindicacionesSe han descrito las siguientes contraindicaciones para el uso de vedolizumab: 1) hipersensibilidad al principio activo o a alguno de los excipientes; y 2) infecciones graves activas, como tuberculosis, sepsis, citomegalovirus y listeriosis, e infecciones oportunistas46.
b) Interacciones medicamentosasVedolizumab se ha estudiado en pacientes con enfermedad de Crohn y que reciben, de forma concomitante, corticosteroides, inmunomoduladores (azatioprina, mercaptopurina y metotrexato) y aminosalicilatos. Los análisis realizados sugieren que la administración conjunta de dichos fármacos no tiene un efecto clínicamente relevante sobre la farmacocinética de vedolizumab48,55.
Lugar de vedolizumab en el tratamiento actual de la enfermedad de CrohnComo se ha mencionado previamente, vedolizumab está indicado para el tratamiento de pacientes con enfermedad de Crohn con fracaso previo al tratamiento convencional, por lo que en esa indicación coincidiría —competiría— con los 2 fármacos anti-TNFα actualmente aprobados en España, infliximab y adalimumab. Vedolizumab ha demostrado ser más eficaz que el placebo para inducir la remisión clínica de la enfermedad de Crohn y, sobre todo, para mantenerla a lo largo del seguimiento (al menos durante un año). Si bien la rapidez de su efecto inicial en la inducción de la remisión de la enfermedad de Crohn parece ser modesto y podría ser menor que la de los fármacos anti-TNFα, la eficacia a más largo plazo parece ser similar a la de infliximab y adalimumab. En cualquier caso, la ausencia de estudios que comparen directamente vedolizumab frente a fármacos anti-TNFα hace difícil extraer conclusiones definitivas respecto a la eficacia y rapidez relativa de ambos tipos de fármacos.
Por otra parte, uno de los escenarios más atractivos para el empleo de vedolizumab es el de aquellos pacientes con exposición previa a anti-TNFα. Es conocido que aproximadamente un tercio de los pacientes no tienen respuesta primaria a un primer anti-TNFα, y un porcentaje difícil de cuantificar presentarán solo una respuesta parcial que puede resultar insuficiente a largo plazo; en estas situaciones la eficacia de un segundo anti-TNFα es todavía menor66. Por otro lado, la pérdida secundaria de respuesta a los fármacos anti-TNFα suele manejarse mediante la optimización (intensificación) del tratamiento, estrategia que incrementa notablemente los costes13. El cambio a otro anti-TNFα tras la pérdida de eficacia constituye también una maniobra muy extendida en la actualidad, pero su eficacia es discreta a corto plazo y pobre a medio plazo66.
Por último, en caso de que hubieran fracasado varios fármacos anti-TNFα previamente, vedolizumab sería también una alternativa terapéutica, en lugar de los medicamentos de uso compasivo —en situaciones especiales— que se venían empleando hasta este momento, como certolizumab o ustekinumab67.
Vedolizumab ha demostrado ser un fármaco bastante seguro, sin haberse demostrado por el momento las complicaciones neurológicas, como la LMP, que se habían descrito previamente con otros fármacos que comparten un mecanismo de acción similar (inhibición de las integrinas), lo que probablemente se explica por la selectividad de vedolizumab sobre el tracto digestivo. Precisamente, esta especificidad podría suponer una potencial ventaja sobre otros fármacos que tienen un efecto menos selectivo o sistémico, como los anti-TNFα. Finalmente, la inmunogenicidad (esto es, la formación de anticuerpos frente a vedolizumab) parece ser infrecuente, y menor a la descrita con infliximab y adalimumab.
En resumen, vedolizumab puede considerarse una opción prometedora para el tratamiento (inducción y, sobre todo, mantenimiento) de la enfermedad de Crohn moderada o grave. Constituye una alternativa a las terapias biológicas actuales (anti-TNFα), al disponer de un mecanismo de acción diferente. Su posición en el arsenal terapéutico en relación a los demás fármacos —en especial a los anti-TNFα— no está aún establecida. Ello dependerá de la experiencia que se vaya acumulando con vedolizumab en cuanto a eficacia (incluyendo un mayor número de pacientes y un seguimiento más prolongado) y seguridad (si se confirma el favorable perfil de seguridad descrito hasta el momento). Por último, algunos aspectos relevantes deberán clarificarse en el futuro, como son la eficacia de vedolizumab en los pacientes con enfermedad de Crohn perianal o con manifestaciones extraintestinales, o el posible sinergia entre este fármaco y los inmunosupresores tradicionales.
Confidencialidad de los datosEl autor declara que en el presente artículo no aparecen datos de pacientes
Conflicto de interesesJ.P. Gisbert: asesoramiento científico, soporte para investigación y/o actividades formativas: MSD, Abbvie, Takeda, Hospira, Pfizer, Janssen, Ferring, Faes Farma, Shire Pharmaceuticals, Chiesi, Laboratorios Casen Fleet, Otsuka Pharmaceutical, Uriach y Dr. Falk Pharma y Gebro Pharma.
E. Domènech: asesoramiento científico, conferencias, soporte para investigación y/o actividades formativas de MSD, AbbVie, Takeda, Hospira, Ferring, Faes Farma, Shire Pharmaceuticals, Chiesi, Otsuka Pharmaceuticals, Dr. Falk Pharma y Gebro Pharma.