INTRODUCCIÓN
La colangiopancreatografía retrógrada endoscópica (CPRE) es una técnica endoscópica que ofrece un amplio abanico de posibilidades diagnósticas y sobre todo terapéuticas en la vía biliar y pancreática, muy segura incluso en pacientes de edad avanzada y con pluripatología1,2, pero que no está exenta de complicaciones. La pancreatitis aguda es la complicación más frecuente de la CPRE, con una incidencia que ronda el 1-10%, si bien es en los estudios prospectivos donde se describen las incidencias más altas3. En las últimas décadas se han llevado a cabo numerosos estudios con el fin de encontrar un procedimiento eficaz a la hora de prevenir esta complicación. Se han empleado maniobras endoscópicas, como la colocación de prótesis pancreáticas o drenaje nasobiliar, y la administración de distintos fármacos. La colocación de prótesis pancreáticas con este fin puede resultar difícil, no está exenta de complicaciones por sí misma y puede requerir la presencia de un endoscopista experto4. En cuanto a los fármacos, se ha analizado el posible papel protector de muchos de ellos, con buenos resultados en algún caso, e incluso con buenas perspectivas desde el punto de vista de la farmacoeconomía5. Los más estudiados son la somatostatina, el gabexato y el octreótido.
Los primeros trabajos realizados con la somatostatina no demostraron su utilidad para prevenir el desarrollo de pancreatitis aguda, probablemente debido al pequeño número de pacientes incluidos en los diferentes estudios (error beta)6. A finales de los años noventa se publicaron 2 trabajos prospectivos aleatorizados y doble ciego, con un número adecuado de pacientes, que demostraron el efecto protector de la somatostatina7,8. Este efecto pareció confirmarse posteriormente en un metaanálisis en el que se incluyeron los estudios realizados antes del año 2000 y en el que tanto la somatostatina como el gabexato, pero no el octreótido, demostraron un efecto protector para el desarrollo de pancreatitis post-CPRE9.
Sin embargo, en los últimos 5 años este papel protector se ha cuestionado en nuevos trabajos en los que no sólo no se apreció efecto profiláctico, sino que además se observaron más casos de pancreatitis aguda en los pacientes medicados con somatostatina (diferencias no significativas)10,11. Al hacer una revisión del metaanálisis previo, que incluía los resultados de uno de estos estudios, la somatostatina no parecía ser útil para prevenir la pancreatitis aguda10.
En estos últimos años también se han publicado otros 2 trabajos en los que la somatostatina sí fue útil y disminuyó significativamente la incidencia de pancreatitis aguda post-CPRE12,13, por lo que el debate sigue abierto.
Ante esta situación, nos planteamos hacer este estudio, cuyo objetivo ha sido evaluar, en una serie propia, el posible efecto protector de la somatostatina para el desarrollo de pancreatitis aguda post-CPRE.
PACIENTES Y MÉTODOS
En nuestra Unidad de Endoscopia realizamos un estudio controlado no aleatorizado para evaluar la utilidad de la somatostatina administrada en bolo intravenoso inmediatamente antes del intento de canulación. Incluimos a todos los pacientes consecutivos a los que se realizó una CPRE en un período de 16 meses. Los criterios de inclusión fueron: pacientes con edad superior a 18 años, que no presentaban ninguna de las siguientes situaciones: embarazo, esfinterotomía previa, historia de intolerancia a somatostatina, infarto agudo de miocardio en los 6 meses anteriores a la realización de la CPRE, pancreatitis aguda o pancreatitis crónica.
Todos los pacientes consecutivos a los que se realizó una CPRE en nuestro servicio a partir de enero de 2004 y que cumplían criterios de inclusión se incluyeron prospectivamente en un primer grupo (grupo somatostatina). En este grupo se administraba un bolo intravenoso de 250 µg de somatostatina inmediatamente antes de intentar la cateterización de la vía biliar. Estos pacientes se compararon con otra cohorte compuesta por los pacientes consecutivos a los que se había realizado una CPRE en nuestro servicio en los meses previos a enero de 2004 y que cumplían criterios de inclusión, hasta incluir el mismo número de pacientes en ambos grupos. En este segundo grupo no se había administrado somatostatina antes de la CPRE (grupo placebo).
El período de inclusión de pacientes en ambos grupos duró 16 meses. Durante este período no hubo ningún cambio en cuanto a la técnica de realización de CPRE, sedación, enfermería, sala de trabajo o aparato de radioscopia (Fluorospot® T.O.P.; Siemens AG Germany 2000 versión VD10A). Únicamente 2 endoscopistas (J.J.V. y F.J.J.) efectuaron todas las exploraciones tras la obtención del consentimiento informado de cada paciente.
En los pacientes con sospecha de afección biliar se intentaba únicamente la canulación biliar, sin canulación pancreática si era posible. La canulación pancreática se buscaba sólo si se sospechaba enfermedad en este órgano. Tras la canulación, y en función de los datos disponibles por exploraciones previas y los obtenidos en la propia CPRE, el endoscopista decidía en cada caso el tratamiento endoscópico más oportuno.
Después de la exploración se mantenía a los pacientes en ayunas durante al menos 6 h, tras las cuales un miembro de nuestro servicio los evaluaba clínicamente. Los pacientes permanecían en observación en nuestra planta durante al menos 24 h, tras las cuales, si no presentaban signos de complicación, se les daba de alta.
Consideramos pancreatitis aguda post-CPRE aquellos casos que presentaron dolor abdominal de perfil pancreático que requirió analgesia durante más de 24 h y que se asoció a una elevación de amilasa de al menos 3 veces su valor normal.
Todas las CPRE se efectuaron con sedación con propofol intravenoso, bajo control del Servicio de Anestesia. Sólo se administraron previamente antibióticos por vía intravenosa a los pacientes que presentaban cuadro de colangitis o sepsis de origen biliar.
Además de los datos epidemiológicos de los pacientes, como la edad y el sexo, se recogieron otras variables como el motivo de la CPRE, los hallazgos de ésta, el tratamiento realizado, el desarrollo de complicaciones tras la CPRE, la inyección de contraste en Wirsung y el endoscopista que efectuó la exploración.
El objetivo de este trabajo fue valorar si la administración de un bolo de somatostatina antes de la cateterización de la papila tiene efecto profiláctico para el desarrollo de pancreatitis tras la realización de la CPRE.
Análisis estadístico
Las variables cuantitativas se indican con la media ± desviación estándar. El análisis estadístico se realizó con las pruebas de la *2 y de Fisher. La prueba de la t de Student se utilizó para comparar variables cuantitativas. En el análisis de los factores de riesgo de pancreatitis aguda calculamos la odds ratio (OR) de los factores que mostraron una asociación estadísticamente significativa. Indicamos también el intervalo de confianza poblacional (IC) de la OR para un nivel de confianza del 95%. Se consideró que existían diferencias estadísticamente significativas para valores de p < 0,05.
RESULTADOS
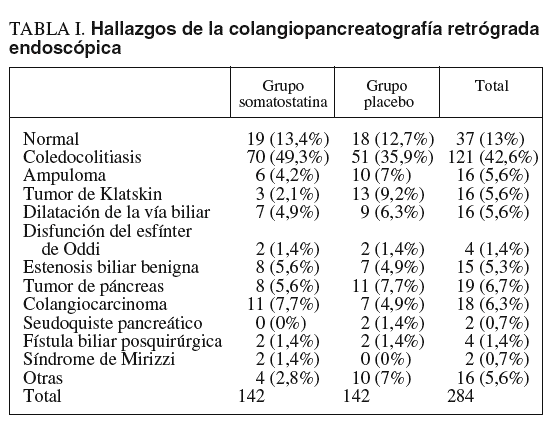
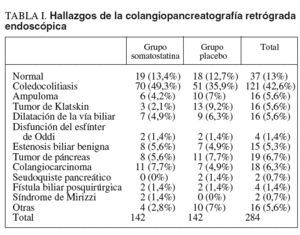
Durante el período mencionado se efectuaron en nuestra unidad 320 CPRE, de las cuales 248 se realizaron a pacientes que cumplían los criterios de inclusión y fueron analizados. Incluimos a 142 (50%) pacientes en cada grupo: grupo somatostatina y grupo placebo. De todos estos pacientes, 152 (53,5%) eran varones y 132 (46,5%) mujeres. La edad media (± desviación estándar) fue de 70,05 ± 13,83 años (rango: 27-93 años). La gran mayoría de las CPRE se realizaron por coledocolitiasis (146 pacientes; 51,4%); la ictericia de etiología maligna motivó la exploración en 46 pacientes (16,2%), la colangitis en 23 (8,1%) y otros motivos en el resto. Los hallazgos de la CPRE se resumen en la tabla I.
El tratamiento realizado en estos pacientes consistió en: esfinterotomía, extracción de coledocolitiasis, colocación de prótesis biliar plástica o metálica y dilatación de estenosis biliares y/o esfínter de Oddi.
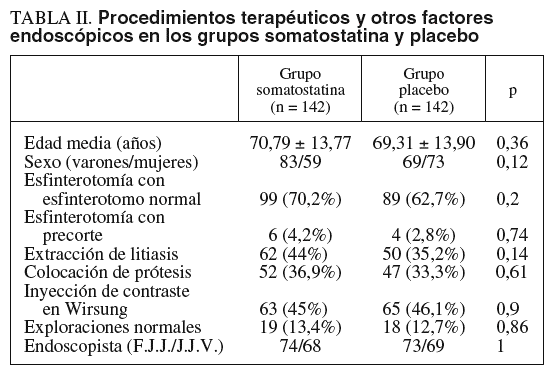
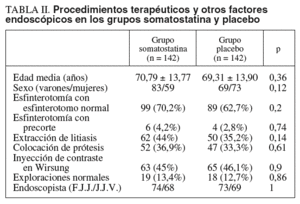
No había diferencias significativas entre ambos grupos en cuanto a edad, sexo, realización de esfinterotomía, colocación de prótesis, extracción de litiasis biliar, inyección de contraste en Wirsung, proporción de exploraciones normales ni endoscopista que realizó la exploración (p = NS). Estos datos se indican en la tabla II. Tampoco hubo diferencias estadísticamente significativas entre ambos endoscopistas en cuanto a edad o sexo de los pacientes, indicaciones y hallazgos de las CPRE o tratamiento endoscópico realizado por ambos (p = NS).
No se apreciaron diferencias estadísticamente significativas en cuanto a la incidencia de pancreatitis post-CPRE entre los grupos somatostatina y placebo (el 7 frente al 3,5%; p = NS). Así, se diagnosticaron 10 casos de pancreatitis post-CPRE en el grupo somatostatina y 5 en el grupo placebo.
Tampoco se objetivaron diferencias estadísticamente significativas dentro del grupo somatostatina para el desarrollo de pancreatitis post-CPRE en relación con la realización de esfinterotomía, colocación de prótesis, extracción de litiasis, inyección de contraste en Wirsung o endoscopista que realizó la exploración. Sin embargo, dentro del grupo placebo las 5 pancreatitis que se produjeron ocurrieron en pacientes a quienes se había realizado una inyección de contraste en Wirsung, sin que hubiera ningún caso entre aquellos en los que no se efectuó esta maniobra (p = 0,019).
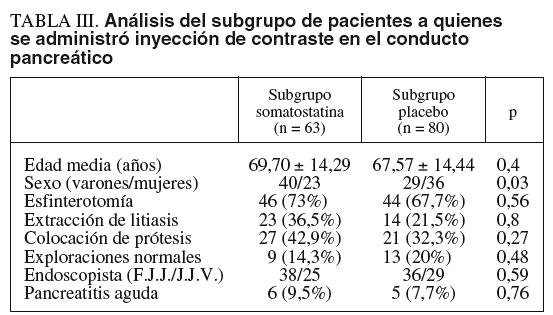
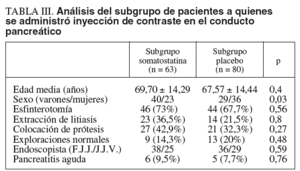
Al realizar el subanálisis del posible efecto protector de la somatostatina en el subgrupo de pacientes a quienes se administró contraste en Wirsung tampoco apreciamos diferencias significativas entre ambos grupos. Así, en el subgrupo somatostatina, compuesto por 63 pacientes, se produjeron 6 casos de pancreatitis, mientras que en el subgrupo placebo, compuesto por 65 pacientes, se produjeron las 5 pancreatitis previamente mencionadas (p = NS). Tampoco se demostró en este subanálisis ningún efecto de los otros factores analizados para el desarrollo de pancreatitis aguda, a saber, esfinterotomía, extracción de litiasis, colocación de prótesis o endoscopista (tabla III).
Al efectuar el análisis de los factores de riesgo relacionados con el desarrollo de pancreatitis aguda del total de pacientes, vimos que únicamente la inyección de contraste en Wirsung se asoció de forma significativa al desarrollo de pancreatitis aguda (p = 0,03; OR = 3,5; IC del 95%, 1,08-11,28). Este riesgo aumentaba en los pacientes con inyección de contraste en Wirsung a los que además se les practicaba una esfinterotomía (OR = 4,72; IC del 95%, 1,56-14,26). El resto de variables analizadas no mostró diferencias significativas.
Nuevamente procedimos al subanálisis del papel protector de la somatostatina en este subgrupo de pacientes a los que se había realizado inyección de contraste en Wirsung y esfinterotomía endoscópica. Este subgrupo estaba formado por un total de 90 pacientes, a 46 de los cuales se les había administrado somatostatina (subgrupo somatostatina) y a 44 no (subgrupo placebo). En 6 pacientes del subgrupo somatostatina y en 4 del subgrupo placebo se produjo una pancreatitis post-CPRE, con diferencias no significativas estadísticamente (p = NS).
Las otras complicaciones objetivadas en los 248 pacientes incluidos en el estudio fueron 5 casos de hemorragia y 4 de colangitis. No hubo ningún caso de perforación. Estos 9 pacientes tuvieron un curso favorable y no fue necesario tratamiento quirúrgico en ningún caso.
DISCUSIÓN
En nuestro estudio no se ha demostrado que la somatostatina tenga un efecto protector para el desarrollo de pancreatitis aguda post-CPRE. Incluso en el grupo somatostatina se objetivaron más pancreatitis que en el grupo placebo, sin diferencias significativas.
El diseño de nuestro estudio puede favorecer un sesgo a la hora de obtener los datos correspondientes a las diferentes variables, sobre todo en el grupo somatostatina. Es decir, puede que, dado que el grupo somatostatina era prospectivo, los pacientes incluidos en él estén mejor estudiados. Si bien esto es cierto desde el punto de vista teórico, las variables que analizamos se tienen habitualmente en cuenta y se recogen en el manejo clínico de estos pacientes, aunque no se trate de un estudio de investigación. Además, no apreciamos diferencias significativas entre ambos grupos en la distribución de estas variables, por lo que parece que en este sentido serían grupos comparables. Por último, durante todo el período de inclusión no se realizó ningún cambio en cuanto a la técnica de la exploración, endoscopista, aparatos utilizados ni manejo clínico. Por todos estos motivos, creemos que puede ser un diseño válido y los resultados, por tanto, fiables.
Nuestros resultados coinciden con los de otros estudios y un metaanálisis publicados recientemente, en los que tampoco se aprecia beneficio con la administración de somatostatina y sí más casos de pancreatitis aguda en el grupo tratado con este fármaco, aunque también sin diferencias significativas10,11.
En los últimos 5 años se han publicado 2 metaanálisis que analizan la utilidad de la somatostatina como profilaxis de la pancreatitis post-CPRE9,10. En el primero de ellos, que incluyó los trabajos realizados antes del año 2000, tanto la somatostatina como el gabexato ejercían un efecto protector9. En este metaanálisis, y desde un punto de vista farmacoeconómico, la somatostatina parecía ser más coste-efectiva que el gabexato, dado que el número de pacientes que debían ser tratados con somatostatina para evitar un caso de pancreatitis aguda era de 13, mientras con el gabexato era de 27. Estos resultados parecían ser concluyentes para la somatostatina, describiéndose además en el metaanálisis un sesgo de publicación más favorable que para el gabexato. Sin embargo, una revisión posterior del metaanálisis tras incluir los datos de un nuevo estudio no consiguió mantener el efecto beneficioso de la somatostatina, aunque sí el del gabexato con pautas de infusión prolongadas10. Un segundo trabajo realizado por el mismo grupo y publicado recientemente parece confirmar las conclusiones del segundo metaanálisis y coincide también con nuestros resultados al respecto11.
Se han analizado las posibles razones de estos resultados discordantes entre ambos metaanálisis. Esta discrepancia se achaca a la gran heterogeneidad de los diferentes estudios incluidos en los metaanálisis en cuanto a la población estudiada, las dosis administradas, las pautas de administración e incluso la definición de pancreatitis aguda post-CPRE6,14. Empezando por este último punto, en nuestro estudio hemos utilizado una definición de consenso15: consideramos pancreatitis aguda post-CPRE los casos que tras una CPRE presentaron dolor abdominal de perfil pancreático que requirió analgesia durante más de 24 h y que se asoció a una elevación de amilasa de al menos 3 veces su valor normal. A esta definición de consenso se le han criticado 2 aspectos fundamentalmente16: a) que no es útil en pacientes con pancreatitis aguda establecida a los que se realiza CPRE, y b) su sensibilidad disminuye en pacientes con pancreatitis crónica. Dado que en nuestro estudio tanto la pancreatitis aguda como crónica eran criterios de exclusión, no hubo ningún paciente con estos diagnósticos, por lo que esta definición nos parece válida. Otro punto controvertido es el valor de la elevación enzimática necesario para considerar que estamos ante una pancreatitis post-CPRE. Nosotros consideramos válida la elevación de amilasa definida en el consenso, dado que, coincidiendo con otros autores, lo crucial es que el dolor de perfil pancreático persista más de 24 h asociado a elevación enzimática, independientemente del valor de ésta17.
Aunque los criterios de inclusión son bastante coincidentes en la mayoría de los estudios, incluido el nuestro, sí es llamativa la heterogeneidad de la pauta de administración de la somatostatina. Se pueden describir 3 tipos de pautas: a) la administración de bolo intravenoso, como en nuestro estudio; b) la pauta de perfusión corta (menos de 3 h), y c) la pauta de perfusión larga (más de 6 h)14. La mayoría de los trabajos en los que se ha demostrado la utilidad profiláctica de la somatostatina utilizaban o bien bolo intravenoso o pauta de perfusión larga.
Se han publicado 3 estudios en los que la somatostatina administrada en forma de bolo intravenoso tiene utilidad. En el primero de ellos, la utilidad de la somatostatina se aprecia sobre todo en los pacientes a quienes se realiza una esfinterotomía, sin que se objetiven diferencias entre grupo somatostatina y el placebo en los pacientes a los que se realiza una CPRE diagnóstica7. Uno de los criterios de inclusión de este trabajo era que debía administrarse una inyección de contraste en el conducto pancreático. Esta maniobra se ha descrito como factor de riesgo de desarrollo de pancreatitis aguda8,18-20; sin embargo, en el grupo de pacientes sin otro factor de riesgo asociado como es la esfinterotomía, no se demuestra un beneficio de la somatostatina. En nuestro estudio, a pesar de que a todos los pacientes del grupo placebo que desarrollaron pancreatitis aguda se les había inyectado contraste en el conducto pancreático, al hacer el subanálisis del posible efecto protector de la somatostatina en este subgrupo de pacientes los resultados fueron también negativos. Tampoco encontramos diferencias en el subgrupo de pacientes a los que se había realizado inyección de contraste en Wirsung y esfinterotomía.
El segundo trabajo, publicado posteriormente y en el que también se utilizó un bolo intravenoso de somatostatina, se diferencia de los demás en cuanto al momento en que se administró el bolo12. En dicho estudio sólo se incluyó a los pacientes a quienes se realizaba una maniobra terapéutica y la somatostatina se administraba inmediatamente antes de la realización de dicho tratamiento. Este planteamiento es bastante lógico si se tiene en cuenta que entre los factores de riesgo de la pancreatitis post-CPRE se encuentra el tratamiento biliar, fundamentalmente esfinterotomía, y que la vida media de la somatostatina administrada en bolo intravenoso es menor de 3 min y la duración de su acción inhibitoria sobre la secreción pancreática puede rondar los 10 min21,22. De esta forma, si se administra la somatostatina inmediatamente antes del intento de cateterización de la vía biliar, como en nuestra serie, es posible que para cuando esta cateterización se consiga, o cuando se hagan maniobras terapéuticas como la esfinterotomía, el posible efecto protector de la somatostatina haya desaparecido. Por el contrario, con este planteamiento la somatostatina no podría evitar las pancreatitis de los casos con cateterización difícil, que es a su vez uno de los factores de riesgo más potentes identificados en los diferentes estudios realizados8,10,11.
El último estudio en el que se aprecia un efecto beneficioso de la somatostatina administrada en bolo se ha publicado recientemente13. En él se compara además el efecto de la administración de somatostatina en bolo y la administración en perfusión larga (empezando 30 min antes de la canulación y durante 12 h después de la CPRE), sin objetivar diferencias significativas entre ambas pautas en cuanto a su eficacia.
Otro factor que influye en el desarrollo de pancreatitis aguda post-CPRE es la experiencia y la carga de trabajo del endoscopista que realiza la exploración23. Según algunos autores, esta influencia está infraestimada en la bibliografía24. En un trabajo que evaluaba los factores de riesgo de pancreatitis post-CPRE se vio que los centros con una carga de trabajo inferior a 150 CPRE anuales presentaban mayor incidencia de pancreatitis aguda24. Esto no se confirmó en otros estudios posteriores en los que se analizó esta cuestión10. En nuestro estudio todas las CPRE fueron realizadas por sólo 2 endoscopistas con una carga de trabajo individual superior a 100 exploraciones anuales. En lo que sí se diferenciaban ambos endoscopistas era en la experiencia acumulada, de forma que uno de ellos (F.J.J.) tenía más de 2.000 exploraciones realizadas y más de 10 años de experiencia, mientras que el otro endoscopista (J.J.V.), tenía aproximadamente 150 exploraciones realizadas y menos de 2 años de experiencia en el momento de iniciar el estudio. Sin embargo, no apreciamos diferencias significativas entre ambos en cuanto al riesgo de pancreatitis aguda. Como se ha señalado, tampoco hubo diferencias significativas entre ambos endoscopistas en cuanto a las características de los pacientes ni en cuanto al tratamiento realizado. Por tanto, según nuestros datos, puede que el factor relacionado con el endoscopista que realmente influye en la aparición de esta complicación sea el volumen de trabajo del endoscopista, una vez que se haya adquirido una aptitud mínima. De hecho, la pancreatitis aguda post-CPRE es una complicación que puede aparecer aun en manos expertas6,10.
Por tanto, los resultados de los estudios realizados acerca de la utilización de la somatostatina para prevenir el desarrollo de pancreatitis aguda post-CPRE son muchas veces contradictorios y difíciles de explicar14, lo que impide sacar una conclusión definitiva en cuanto a su posible beneficio. En lo que sí coinciden todos los autores es en que el tratamiento profiláctico debe hacerse en los pacientes que presenten un alto riesgo de desarrollar pancreatitis aguda en relación con la CPRE6,14,25. Sin embargo, los estudios realizados en pacientes con riesgo alto ofrecen también resultados discordantes8,10. Así, diversos autores apuntan que debe continuarse la búsqueda de factores de riesgo que nos permitan hacer una mejor selección de los pacientes y evaluar en éstos el beneficio del tratamiento profiláctico6,14.
Por otro lado, la pauta de somatostatina que debería administrarse tendría que ser lo más corta posible. Siguiendo este razonamiento, la administración en bolo intravenoso es la más atractiva desde el punto de vista de la farmacoeconomía.
Con estas 2 medidas (selección de pacientes y optimización de las pautas de administración) posiblemente se obtendría una buena relación coste-efectividad con el fármaco empleado. En este sentido, la administración de somatostatina en perfusión no sería coste-efectiva teniendo en cuenta el precio del fármaco, el elevado número de pacientes que es necesario tratar para evitar un caso de pancreatitis aguda y el hecho de que sería prácticamente incompatible con la realización de CPRE en régimen ambulatorio12. En nuestro servicio realizamos un estudio teórico para determinar la relación coste-efectividad de esta pauta de administración de la somatostatina, con resultados positivos teniendo en cuenta las características de la sanidad en nuestro país, pero puede que nuestros datos no sean extrapolables a otros países26.
Otros autores11 ofrecen otras hipótesis de trabajo que deberían evaluarse y que nos parecen interesantes, como:
1. La observación de que la mayoría de los estudios en que la somatostatina ejerce un efecto beneficioso tienen una incidencia de pancreatitis post-CPRE en el grupo control superior al 7%. En nuestro estudio, en el que no se apreció efecto beneficioso de la somatostatina, la incidencia de pancreatitis aguda en el grupo placebo fue del 3,5%, por lo que concuerda con esta observación.
2. El riesgo de que se produzca una pancreatitis tras la realización de una CPRE parece depender más de factores que están en relación con el proceso de cateterización de la vía biliar: papila que ofrezca especial dificultad para su cateterización, inyecciones repetidas en el conducto pancreático, incluso sin que se produzca acinarización, y empleo de determinadas maniobras como la esfinterotomía con precorte.
A estas hipótesis nos gustaría añadir alguna otra, como: ¿sería más efectiva la administración en bolo de una mayor dosis de somatostatina, que podría llegar incluso a ser similar a la utilizada para el tratamiento de la hemorragia digestiva alta por varices esofágicas? En este cuadro clínico hay estudios en los que se administran repetidos bolos si no hay respuesta clínica, sin que se produzcan complicaciones importantes27.
En conclusión, el presente estudio parece apoyar los resultados obtenidos en los últimos años por otros autores en el sentido de que la somatostatina es ineficaz para prevenir el desarrollo de pancreatitis post-CPRE. La pancrea-titis aguda post-CPRE es una complicación iatrogénica relativamente frecuente, potencialmente grave, con importante morbilidad y en ocasiones mortalidad28. Por ello, creemos que se deben seguir buscando tanto nuevos factores que permitan hacer una mejor selección de los pacientes de mayor riesgo como nuevos fármacos, o nuevas pautas de los ya estudiados, hasta conseguir disminuir significativamente la incidencia de la pancreatitis aguda post-CPRE.