INTRODUCCIÓN
Los tumores del estroma gastrointestinal (GIST) son los tumores mesenquimales más frecuentes del tracto gastrointestinal. La primera vez que se usó este término fue en 1983, por Mazur y Clark. En 1998, Hirota descubrió la mutación del protooncogén c-kit en los GIST. Las localizaciones más comunes son la pared gástrica y el intestino delgado, pero pueden ocurrir en cualquier porción del tubo digestivo que tenga músculo liso y, ocasionalmente, (< 5%) en el omento y el peritoneo1-3.
El origen de estos tumores es desconocido; tradicionalmente se decía que provenían del tejido muscular liso, pero en la actualidad se considera que derivan de células stem cells que se diferencian hacia la célula intersticial de Cajal (CIC) o de un precursor común a la CIC y GIST. No se conoce el origen de la CIC y se considera que es una célula marcapasos que podría regular la peristalsis del tubo digestivo. Los GIST, al igual que las CIC expresan CD117, una glucoproteína de membrana codificada por el oncogén c-kit. Se postula que los GIST se originan de stem cells CD-34 (+) de la pared del intestino y se diferencian a células marcapaso4-6.
Presentamos 2 casos de GIST que comenzaron como masas pelvianas de probable origen ovárico.
OBSERVACIONES CLINICAS
Caso clínico 1
Mujer de 44 años de edad que, en agosto de 2003, comienza con un dolor en la pelvis. En la exploración y en la ecografía se detecta una tumoración pelviana, por lo que, en octubre de 2003, es intervenida y se objetiva un hemoperitoneo con tumor dependiente del sigma diseminado por la cavidad abdominal, por lo que se realiza una escisión tumoral con sigmoidectomía segmentaria y anastomosis terminoterminal, apendicectomía y biopsias epiploicas, sin quedar enfermedad residual macroscópica. La anatomía patológica demuestra un tumor mesenquimal maligno de alto grado con moderada inmunorreactividad para CD117 altamente sugestivo de tumor estromal de elevado índice mitótico, de más de 10 cm, con amplias áreas de necrosis e índice de proliferación Ki67 alto; un implante tumoral peritoneal de tumor mesenquimal de 8 mm de diámetro, y un segmento de sigma con una pared intestinal sin lesiones que presenta un tejido adiposo submucoso con implantes de tumor mesenquimal. El apéndice no presenta lesiones. El nódulo peritoneal es positivo para tumor mesenquimal maligno: vimentina (+), CD 34 (), actina (), S100 () y antígeno epitelial de menbrana (EMA) (). Tras un postoperatorio sin complicaciones, fue remitida a nuestra consulta e inició tratamiento con imatinib mesilato, 400 mg/24 h. En febrero de 2004 presenta nuevamente molestias abdominales y se detecta una tumoración supravesical adherida a la pared abdominal y ascitis, por lo que se le practica nueva laparotomía, donde se observa un hemoperitoneo y una gran tumoración de aspecto encefaloide parcialmente encapsulada y con hemorragia intratumoral e implantes en algún asa del intestino delgado y en la pared abdominal. Se practica exéresis de la tumoración y de los implantes; la anatomía patológica es semejante a la del tumor previo. Se valora como recurrencia abdominal y se decide continuar el tratamiento con imatinib, aumentando la dosis a 800 mg/24 h a partir de abril de 2004. La paciente presenta edema facial y anemia como efectos adversos del tratamiento a esas dosis. En mayo de 2004, se realiza una tomografía copmputarizada (TC) y se objetiva recidiva en el recto anterior y un implante en la unión ileocecal, considerados irresecables. Se remite a otro centro para plantear su inclusión en un ensayo clínico.
Caso clínico 2
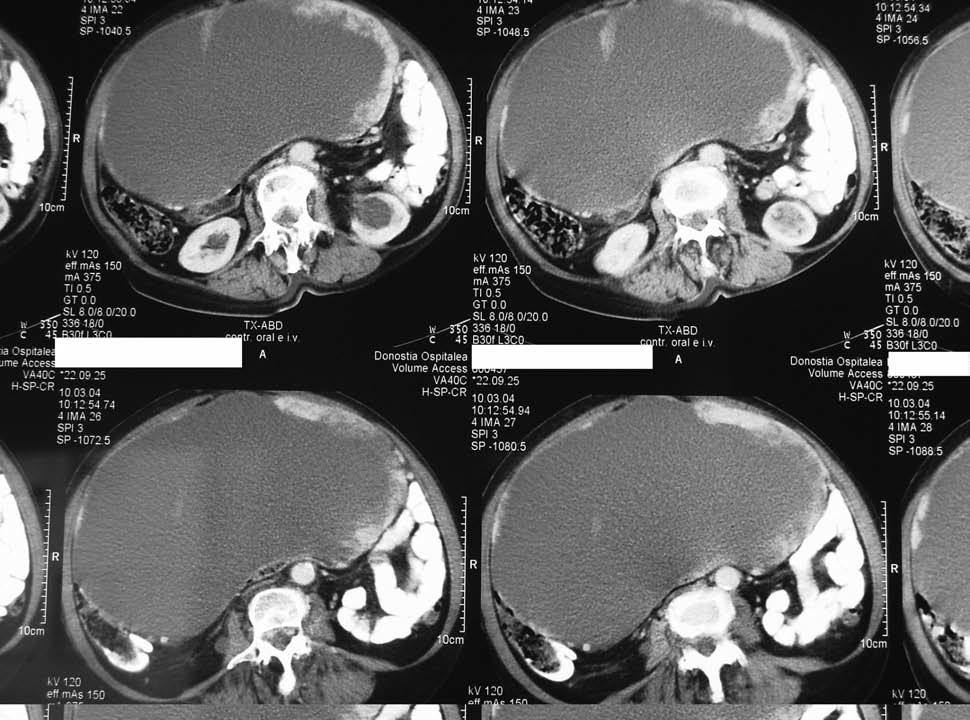
Mujer de 78 años, sin antecedentes de interés, que en febrero de 2004 presenta una alteración del ritmo intestinal, vómitos y síndrome constitucional, por lo que ingresa para estudio. En la TC se observa una gran masa abdominal quística con implantes sólidos con una probable relación con un tumor de ovario (fig. 1). En la ecografía ginecológica se detecta una gran tumoración líquida, densa, que ocupa todo el abdomen. En marzo, es intervenida; se observa una tumoración gigante muy vascularizada con mamelones carnosos friables en la superficie, adherida al epiplón y las asas intestinales del intestino delgado, sin infiltrarlos, con adherencias laxas en el peritoneo parietal; el útero y los anejos son atróficos. La superficie hepática es lisa y regular, y las cúpulas diafragmáticas son normales. Se practica la extirpación completa de la tumoración, tras la liberación de las adherencias, histerectomía y doble anexectomía. El resultado de anatomía patológica es de tumor mesenquimal de crecimiento epitelioide con inmunofenotipo positivo para CD117 y negativo para CD34, actina, desmina, proteína S-100, queratina, EMA, CD99, cromogranina y melan-A, compatible con GIST de 25 cm de diámetro mayor, con índice proliferativo moderado (Ki67 < 10%) y muy aisladas figuras de mitosis. Los anejos no presentan lesiones histológicas.
Fig. 1. Tomografía computarizada abdominopelviana: gran masa quística que ocupa todo el abdomen, compatible con un tumor del estroma gastrointestinal.
En abril de 2004, inicia tratamiento con imatinib, 400 mg/día. Actualmente, está en curso de tratamiento y sin evidencia de enfermedad en el último control, en junio de 2004.
DISCUSIÓN
Los GIST malignos son los sarcomas más frecuentes del tracto gastrointestinal y suponen el 5% de todos los sarcomas7. Los síntomas de presentación más comunes son dolor abdominal, masas abdominales palpables con anemia asociada y sangrado tumoral8. El 15-50% presenta metástasis en el momento del diagnóstico; la diseminación intraabdominal es la más frecuente.
Los GIST pueden aparecer en cualquier tramo del tubo digestivo, aunque la localización más frecuente es el estómago (50-60%) seguida del intestino delgado (20-30%), el intestino grueso (10%), el esófago (5%) y el peritoneo (< 5%)6.
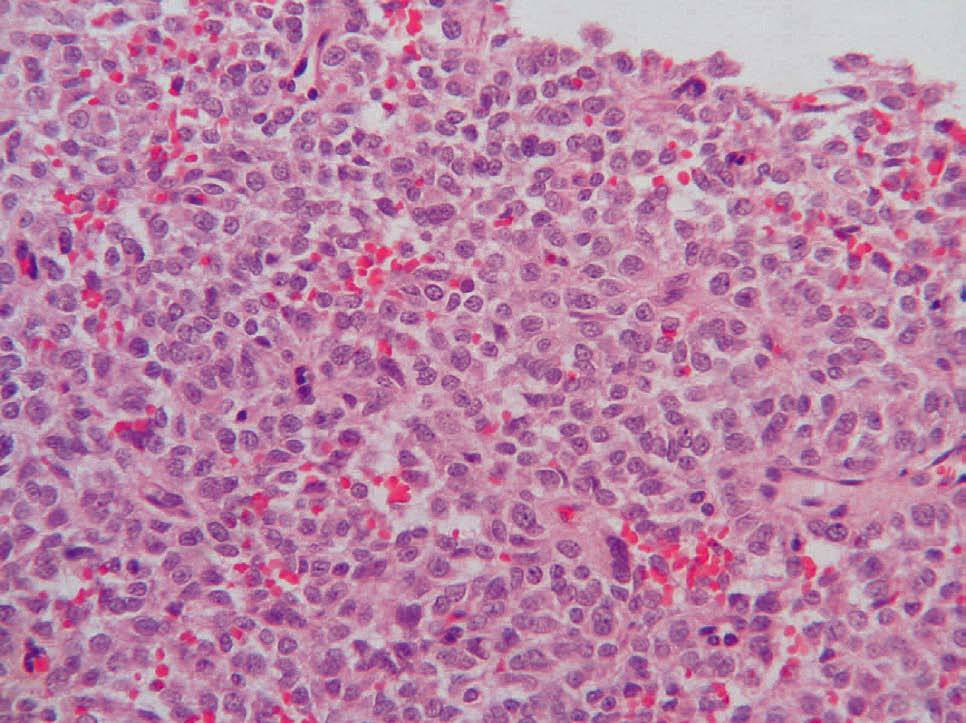
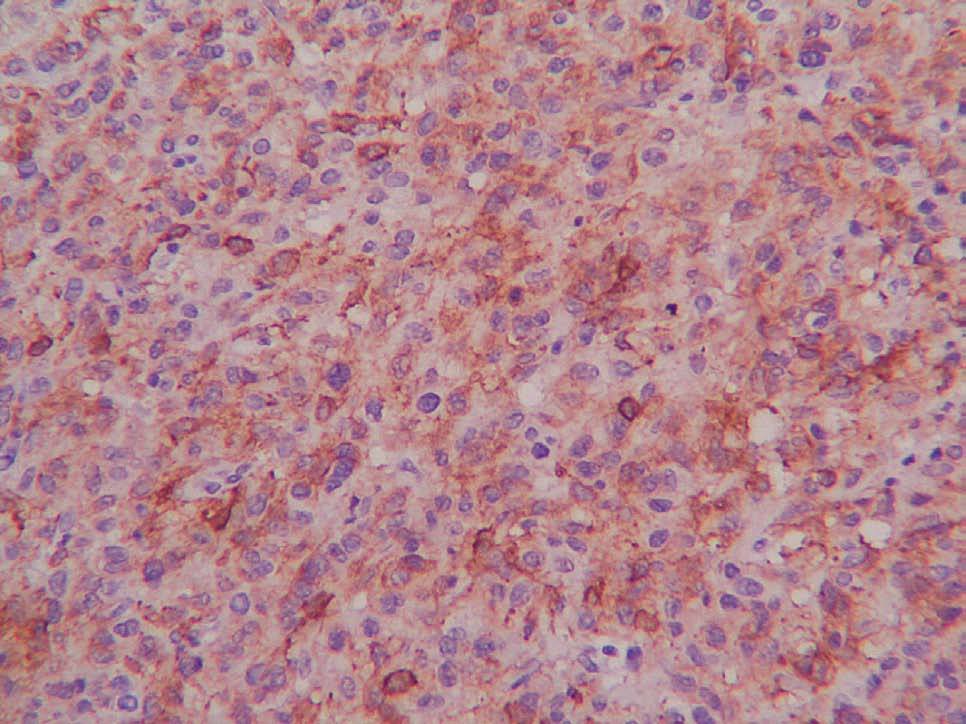
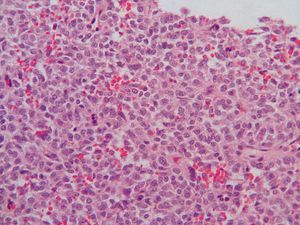
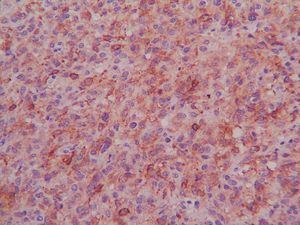
La mayoría de los GIST primarios del omento y el mesenterio presentan características histológicas (fig. 2) indistinguibles de los GIST de otras localizaciones5. La expresión de CD117 (fig. 3) suele ser una constante, pero la de CD34 es variable. El hecho de que se encuentren tumores CD117 positivos fuera del tracto digestivo va en contra de que se originen a partir de un clon de las células intersticiales de Cajal y va más a favor de que su predecesor sea un ancestro común a estas células y a los GIST. La ausencia de CD34 en los GIST indicaría un mayor grado de diferenciación y sugeriría un comportamiento menos agresivo, pero lo cierto es que los tumores CD34 negativos exhiben un comportamiento maligno. En nuestras 2 pacientes, el CD34 fue negativo y el CD117, positivo. No existen marcadores séricos específicos de los GIST, pero una de nuestras pacientes (caso 2) presentaba, en el momento del diagnóstico, cifras elevadas de Ca 125, que se normalizaron tras la cirugía2-4,9.
Fig. 2. Tinción de hematoxilina-eosina de un tumor del estroma gastrointestinal.
Fig. 3. Tinción inmunohistoquímica para CD117 en un tumor del estroma gastrointestinal.
Valorar el potencial maligno de los GIST es difícil. Son criterios ampliamente aceptados de mal pronóstico: a) el tamaño mayor de 3-5 cm, según los autores; b) el índice mitótico elevado: más de 5 mitosis por campo indican malignidad y 20-50 mitosis por campo indican alto grado de malignidad, y c) la presencia de metástasis y/o recidiva local.
Otros autores señalan, como factores de mal pronóstico, la mala diferenciación tumoral, la localización (mejor pro nóstico para los gástricos) y la cirugía incompleta y/o la rotura tumoral en el acto quirúrgico. En 2002 se publicó una propuesta de consenso respecto a los criterios de riesgo de malignidad de los GIST, con la idea de unificar la evaluación de estas lesiones y poder comparar series10.
En el primer caso que hemos presentado se daban los siguientes factores de mal pronóstico: rotura tumoral, alto grado histológico, tamaño mayor de 10 cm y elevado índice mitótico y enfermedad diseminada en el momento del diagnóstico. En el segundo caso, se apreciaba un tamaño de 25 cm como único factor de mal pronóstico.
El oncogén c-kit es una glucoproteína transmembrana de 145 Da con actividad tirosincinasa que, inmunológicamente, se identifica por el epítopo antigénico CD117. Actúa como receptor para el stem cell factor, cuya unión induce la homodimerización del receptor c-kit e inicia su actividad tirosincinasa dentro de la célula. Esto desencadena una cascada de señales intracelulares que culminan con la inducción de procesos de mitogénesis y diferenciación celular6.
Los GIST se caracterizan por la activación de la actividad tirosincinasa del c-kit independiente de la unión de su ligando. Esta activación constitutiva se debe a diversas mutaciones con "ganancia de función" del gen c-kit, la más frecuente de las cuales se produce en el exón 11 del cromosoma 4, donde se halla ubicado el gen11. También se han descrito mutaciones en los exones 9, 13 y 17, que codifican los aminoácidos necesarios para constituir distintos dominios de la proteína c-kit12.
Hasta hace pocos años no se disponía de tratamientos efectivos en pacientes con enfermedad metastásica, sin posibilidad de cirugía radical. En el año 200013-15 apareció el imatinib mesilato, que actúa como inhibidor competitivo de algunas tirosincinasas, incluida la asociada a c-kit7. Se absorbe bien por vía oral y se comercializa en cápsulas (Glivec). Se metaboliza en el hígado por el sistema citocromo P450 (CYP3A4) y sus metabolitos se eliminan por vía biliar. Su vida media es de 20 h, por lo que se puede administrar 1 vez al día.
En la enfermedad diseminada, diversos estudios16,17 han obtenido respuestas parciales en el 43-54% de los pacientes tratados con supervivencias libres de progresión, del 80-82% y el 64-69% a 6 meses y 1 año, respectivamente. La tasa de supervivencia global ha sido del 54-57% y el 91-92%, respectivamente. Las respuestas se objetivan entre 1 y 6 meses después de iniciado el tratamiento, con una media de 13 semanas. La prueba diagnóstica más comúnmente utilizada para valorar la respuesta al tratamiento es la TC, pero hay indicios18 para pensar que la tomografía por emisión de positrones es más sensible y rápida, en este sentido. Por tanto, su papel podría ubicarse en la distinción entre sangrado y progresión tumoral cuando se aprecia un aumento de tamaño de la masa tumoral.
La dosis recomendada de imatinib es de 400-600 mg/día. Dosis más elevadas no han demostrado mayores beneficios13,14. La duración del tratamiento es desconocida, pero lo habitual es mantenerlo hasta la progresión. El imatinib es un fármaco bien tolerado, y sus efectos adversos más comunes son náuseas, edema, calambres musculares, diarrea, cefalea, dermatitis, astenia, anemia y neutropenia. La mayoría son leves-moderados y manejables, y menos del 30% de los pacientes presenta toxicidad de grados 3-4, que obliga a suspender el tratamiento definitivamente.
En ASCO 200419,20 se han presentado datos que instauran una base para aumentar la dosis de imatinib a 800 mg/día en el momento de la progresión. Se obtuvieron respuestas en un 3-7% de los casos y estabilizaciones en un 30%, aproximadamente.
Existe un ensayo fase I con otro inhibidor de la tirosincinasa (SU11248), en pacientes con GIST refractario al imatinib, que ha conseguido respuestas en 11 de 18 pacientes tratados21.