Las neoplasias quísticas primarias del páncreas son unos tumores raros, con una prevalencia aproximada del 10% de las lesiones quísticas del páncreas. La gran mayoría de estas lesiones están constituidas por tres entidades: el cistoadenoma mucinoso, el cistoadenoma seroso y el tumor papilar mucinoso intraductal (TPMI). El TPMI se caracteriza por una dilatación difusa del conducto pancreático principal y/o sus colaterales, con defectos de repleción correspondientes a globos de mucina o tumor, y salida de mucina a través de una papila patulosa. Posee un bajo potencial maligno, una baja tasa de crecimiento, de extensión metastásica y de recurrencia posquirúrgica. En los últimos años se ha producido un importante avance en su manejo, tanto diagnóstico como terapéutico.
Primary cystic pancreatic neoplasms are rare tumors, with an approximate prevalence of 10% of cystic pancreatic lesions. Most of these lesions correspond to mucinous cystic neoplasm, serous cystoadenoma and intraductal papillary mucinous tumor (IPMT). IPMT is characterized by diffuse dilatation of the main pancreatic duct and/or side branches with inner defects related to mucin or tumor, or mucin extrusion from a patent ampulla. IPMT has a low potential for malignancy, with a low growth rate, a low rate of metastatic spread and postsurgical recurrence. Over the last few years, major advances have been made in the diagnostic and therapeutic management of this tumor.
Las neoplasias quísticas primarias del páncreas son unos tumores raros, con una prevalencia aproximada del 10% de las lesiones quísticas que asientan sobre dicho órgano, constituidas principalmente por el cistoadenoma mucinoso, el cistoadenoma seroso y el tumor papilar, mucinoso e intraductal (TPMI)1,2.
El TPMI fue descrito por primera vez por Ohashi et al3, en 1982, y desde entonces el número de publicaciones que hacen referencia a esta entidad ha ido paulatinamente en aumento. Son múltiples los nombres que ha recibido a lo largo de su historia, pero se ha establecido como definitivo el de TPMI. Se trata de una dilatación difusa del conducto pancreático principal y/o sus colaterales con defectos de repleción constatados por técnicas de imagen (correspondientes a globos de mucina o tumor), y salida de moco a través de una papila patulosa. Si bien es cierto que el aumento en el número de casos comunicados podría deberse a una mejora en los métodos diagnósticos, hay una tendencia generalizada entre los gastroenterólogos a considerarla como una entidad en auge.
En un primer momento se consideró como una entidad derivada del cistoadenoma mucinoso. Hay ciertas similitudes entre estas dos neoplasias: el origen en el epitelio ductal pancreático, la producción de mucina y las frecuentes proyecciones papilares son hechos comunes a ambos. No obstante, también presentan importantes diferencias4,5 (tabla I) que han conducido a que en el año 1996 se produjese la separación definitiva de estas dos entidades por la Organización Mundial de la Salud6.
Diferencias fundamentales entre los principales tumores mucinosos pancreáticos, el cistoadenoma mucinoso y el tumor papilar, mucinoso e intraductal
| TMPI | Cistoadenoma mucinoso | |
| Edad media | Sexta-séptima décadas de la vida | Más jóvenes |
| Sexo | Similar entre | Principalmente mujeres |
| Localización | Cabeza | Cuerpo/cola |
| Cápsula fibrosa | Raro | Presente |
| Estroma ovárico | Ausente | Presente |
| Dilatación del CPP | Presente | Ausente |
| Comunicación con el CPP | Presente | Ausente |
CPP: conducto pancreático principal; TPMI: tumor papilar mucinoso intraductal.
El TPMI posee un bajo potencial de malignidad, una baja tasa de crecimiento, de extensión metastásica y de recurrencia posquirúrgica7. Se puede clasificar en tres tipos: los que emergen principalmente del conducto pancreático principal (main duct type [MDT]), los que asientan primordialmente sobre las colaterales del conducto de Wirsung (branch duct type [BDT]), y una combinación de ambos7. Los primeros constituyen hasta un 75% de los casos, y conllevan un peor pronóstico, con una tasa de malignidad del 67-100%. Los segundos son más característicos de gente joven, con un potencial menos agresivo, y una tasa de malignidad inferior al 50% (rango, 0-47)8–10. Se ha descrito la afectación microscópica del conducto de Wirsung en el subtipo BDT, y se desconoce el riesgo real de malignización en estos casos10.
Microscópicamente, el componente epitelial está representado por células columnares productoras de mucina, con frecuentes proyecciones papilares, que pueden presentar modificaciones hiperplásicas o displásicas. De hecho, se trata de una lesión premaligna, y se clasifica como adenoma, tumor borderline y carcinoma según su estadio. Se ha sugerido una secuencia similar a la de los pólipos del colon para explicar el comportamiento de este tumor11. A pesar de ello, como posteriormente veremos, su pronóstico es excelente si se compara con el de otras neoplasias pancreáticas.
EPIDEMIOLOGÍA Y ETIOLOGÍATeniendo en cuenta que se trata de un tumor con escasos años de vida, resulta bastante difícil establecer su prevalencia real. Las series quirúrgicas sugieren que ésta se encuentra entre el 8 y el 20% de las resecciones pancreáticas por procesos malignos12.
La etiología del TPMI es incierta. Se ha propuesto el hábito tabáquico y el consumo de alcohol como factores de riesgo para el desarrollo de malignidad en el TPMI13. Algunos estudios con modelos animales confieren a las nitrosaminas un papel importante en el desarrollo de este tumor14. No se ha identificado ningún patrón de herencia ni predisposición genética; sin embargo, su frecuente asociación con otros tumores extrapancreáticos, la poliposis adenomatosa familiar y el síndrome de Peutz-Jeghers sugieren esta posibilidad15. Se ha publicado la presencia de monosomías de los cromosomas 6 y 17, como las alteraciones genéticas más frecuentes del TPMI. También ha sido descrita la pérdida del cromosoma 18, relacionado con la transición del TPMI borderline a un subtipo maligno. Finalmente, se ha sugerido la inactivación del gen STK11/LKB1 (causante del síndrome de Peutz-Jeghers) en la patogenia de la enfermedad16. Del mismo modo, mutaciones en el gen K-ras presentan una alta prevalencia en pacientes con TPMI, con una frecuencia del 44-100%17.
Un estudio presentado por Kamisawa et al18, en el año 2005, mostraba una alta incidencia (de un 35%, similar a lo publicado con anterioridad), de asociación del TPMI con otras neoplasias extrapancreáticas, principalmente de origen gástrico y colónico, lo que indica la necesidad de realizar un cribado de éstas en el momento del diagnóstico del TPMI o durante su seguimiento, ya que podrían ensombrecer el buen pronóstico que caracteriza a este tumor. Una de las teorías postuladas es que esta neoplasia asienta en pacientes de edad avanzada y, por tanto, con un mayor riesgo individual de degeneración neoplásica. Recientemente, se ha publicado un estudio donde se relaciona el TPMI con otras neoplasias pancreáticas, como cistoadenomas mucinosos, adenocarcinomas y tumores endocrinos, y se ha llega a asociar hasta en el 10% de los TPMI19.
MANIFESTACIONES CLÍNICASEl TPMI se presenta con una frecuencia similiar en varones y mujeres, aunque quizás con una mayor prevalencia en los primeros. Suele presentarse a una edad avanzada y situarse en la cabeza y el proceso uncinado del páncreas7, fundamentalmente con signos iniciales de malestar abdominal y una leve elevación de las enzimas pancreáticas. Es muy común identificar en estos pacientes episodios previos de pancreatitis aguda (en el 30-80% de los casos), o síntomas que recuerdan a una pancreatitis crónica (PC) obstructiva (debido a obstrucciones intermitentes del conducto pancreático principal por el exceso de mucina). Otros síntomas, como la pérdida de peso, la anorexia y la ictericia, pueden aparecer en el transcurso de la enfermedad20, y llegar a producirse una verdadera insuficiencia pancreática endoexocrina7. En ocasiones, cursa de manera asintomática, identificándose de forma incidental en las pruebas de imagen.
Se trata de un tumor de crecimiento lento, cuyo intervalo entre la aparición de los síntomas y el diagnóstico se estima en 40 meses de media21,22. El principal diagnóstico diferencial debe establecerse con la PC obstructiva, lo cual, en estadios iniciales del tumor, es realmente difícil, lo que puede provocar un retraso en el diagnóstico y el inicio del tratamiento y, lo que es más relevante, favorecer su transformación maligna. Hay una serie de características clinicoepidemiológicas que nos orientan en el diagnóstico diferencial entre ambas entidades. La edad media de diagnóstico del TPMI se sitúa entre la sexta y la séptima décadas de la vida, mientras que en los pacientes con PC el diagnóstico suele realizarse en personas más jóvenes. La PC es más frecuente en varones que en mujeres (8:1), y la prevalencia por sexos es similar en el TPMI. Por último, la presencia de un consumo excesivo de alcohol y tabaco es más frecuente en pacientes con PC23.
DIAGNÓSTICOPor todo ello, la historia clínica es fundamental en el diagnóstico del TPMI. Los tests de laboratorio sistemáticos no son de gran utilidad, y es posible encontrar elevaciones de las transaminasas y las enzimas pancreáticas. Los niveles séricos de Ca 19.9 y CEA se encuentran elevados en un 20 y un 15% de los casos, respectivamente, tanto en lesiones benignas como malignas, por lo que carecen de eficacia a la hora de determinar su malignidad24.
Estudios radiológicosLa ecografía abdominal y la tomografía computarizada (TC) abdominal convencional muestran cambios inespecíficos indistinguibles de una PC, o de lesiones quísticas, como el seudoquiste pancreático y el cistoadenoma mucinoso. No obstante, ciertos autores11 preconizan la realización de una TC como primera técnica de imagen, basándose en la experiencia del radiólogo para diferenciar tales entidades. Estas técnicas suelen poner de manifiesto la presencia de una masa quística unilocular o multilocular, con o sin dilatación del conducto de Wirsung. La presencia de nódulos murales, septos, gran tamaño del tumor, rápido crecimiento, adenopatías o extensión extrapancreática sugieren una degeneración maligna.
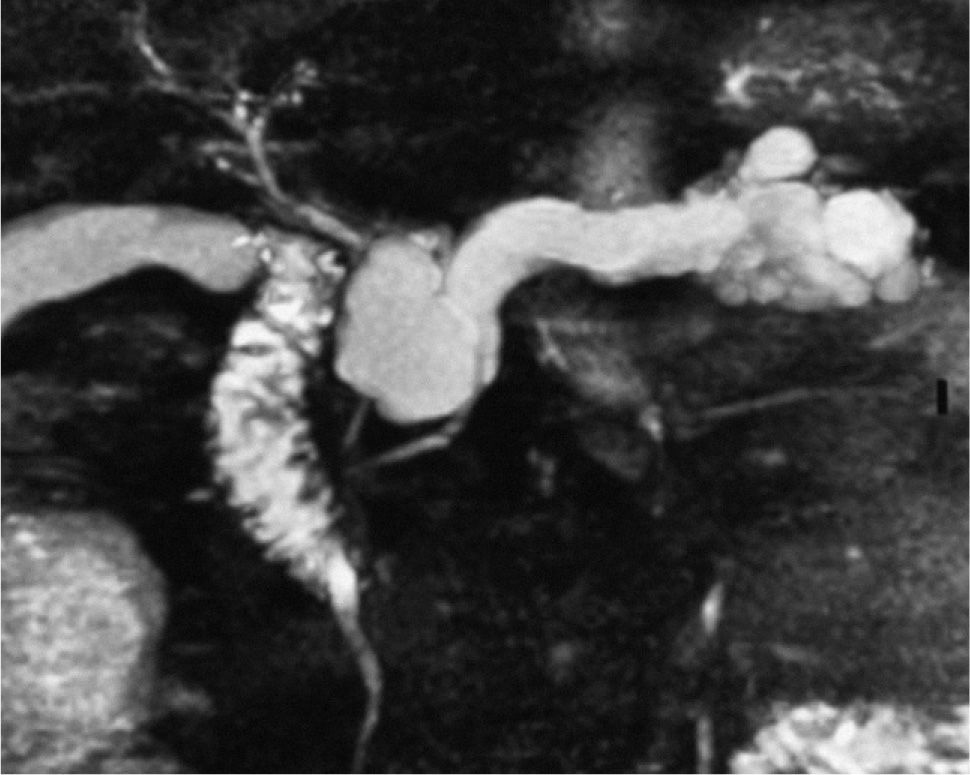
La colangiopancreatografía por resonancia magnética (CPRM) es comparable a la colangiopancreatografía retrógada endoscópica (CPRE) en demostrar anormalidades del conducto pancreático principal, y algunos autores la consideran superior a ésta en la detección del TPMI25. Sin embargo, se centra más en evaluar anormalidades pancreáticas periductales y en determinar la comunicación entre el TPMI y el conducto de Wirsung (fig. 1). El problema de la CPRM es que no permite obtener muestras para el estudio citológico o el análisis de líquido intraquístico ni aplicaciones terapéuticas26. Sin embargo, Sugiyama et al27, en un estudio publicado en 2003, señalan que la CPRM es el método de elección para el seguimiento posquirúrgico de los TPMI, en la in- vestigación de un tumores residuales o recurrentes en el remanente pancreático y en el estudio de complicaciones posquirúrgicas, ya que ha demostrado ser superior a los métodos endoscópicos, debido a las alteraciones anatómicas posquirúrgicas.
Estudios endoscópicosDurante mucho tiempo la CPRE constituyó el patrón de referencia para el diagnóstico del TPMI. Los hallazgos característicos incluyen la dilatación del conducto de Wirsung y/o colaterales en ausencia de estenosis previa, la presencia de una papila patulosa, un exceso de mucina (con la posibilidad de observarla saliendo a través de la papila, hecho casi patognomónico) y/o defectos de repleción ductal28,29. La CPRE también nos permite la obtención de muestras para el estudio citológico y/o la biopsia, que son de gran utilidad en la evaluación de la lesión.
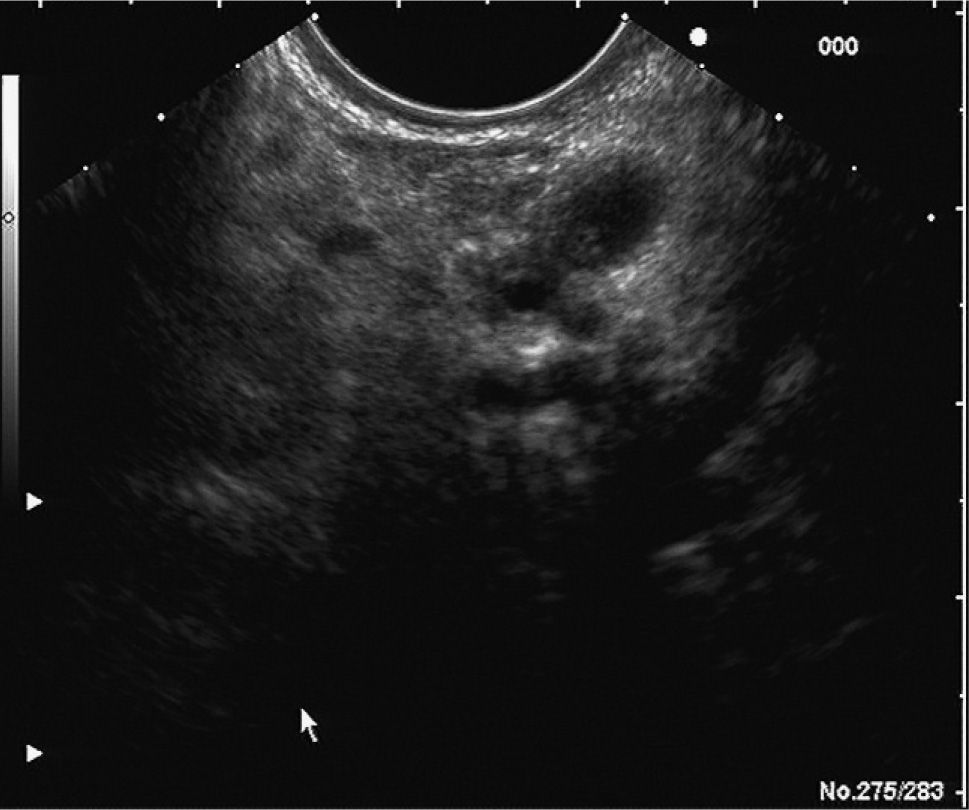
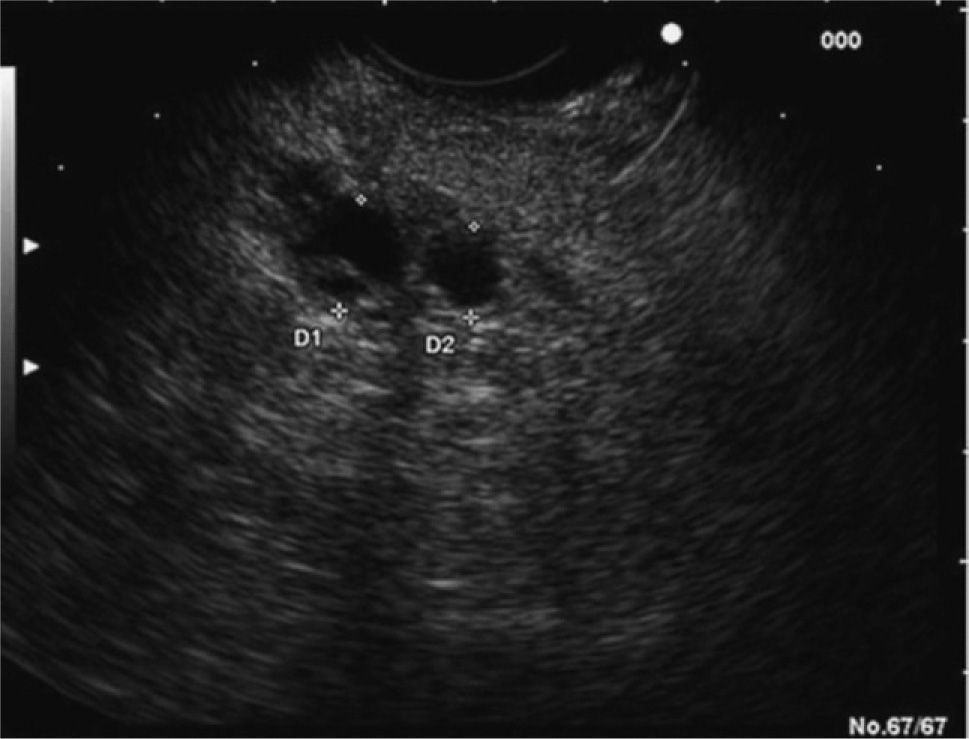
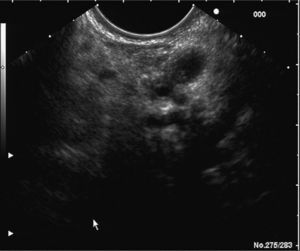
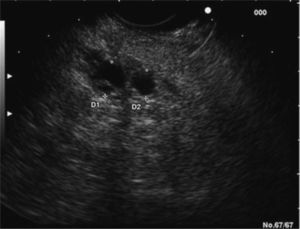
En los últimos años la ultrasonografía endoscópica (USE) ha adquirido una mayor relevancia en la evaluación diagnóstica del TPMI. Habitualmente, se aprecia una dilatación del conducto de Wirsung, la presencia de nódulos murales en su interior, atrofia del parénquima pancreático o múltiples quistes con apariencia de «racimos de uva» en el subtipo que afecta a las colaterales (figs. 2 y 3). Muchos estudios han evaluado y comparado esta técnica con las previas. En uno de ellos30, la USE demuestra tener una eficacia global superior a la ecografía abdominal convencional y a la CPRE en la detección de estas lesiones y en la determinación de su tamaño, el subtipo y su extensión. Diversos autores consideran la USE como la técnica más eficaz para detectar el grado de malignidad21,31. Sugiyama et al31 determinan la utilidad de la USE para diferenciar lesiones benignas y malignas, y concluyen que hay una serie de variables morfológicas indicativas de malignidad: presencia de tumores con un tamaño mayor de 30 mm, notable dilatación del conducto pancreático principal (> 10 mm) o nódulos murales.
La punción guiada por USE ha permitido obtener muestras de lesiones para el estudio citológico y de diversos marcadores tumorales, con el fin de aumentar la eficacia diagnóstica preoperatoria del tumor. La citología permite observar células epiteliales «flotando» en abundante material mucoso, lo que permite diferenciar las lesiones benignas y malignas, aunque no puede precisar su grado de invasividad. En un estudio32 en el que se evaluaba la eficacia de la citología pancreática obtenida por CPRE para determinar la malignidad tras una estimulación con secretina, se obtuvo una eficacia global del 93%; no obstante, a la hora de diferenciar entre adenoma intraductal y cáncer, ésta descendía hasta el 31%. Por otra parte, diversos estudios evalúan la utilidad de diferentes marcadores en el jugo pancreático, como las mutaciones en el K-ras, el p53 y la telomerasa33,34. El mayor inconveniente es que las mutaciones de p53 y k-ras no son específicas del TPMI; sin embargo, la actividad de la telomerasa en el jugo pancreático ha servido para mejorar la eficacia de la citología en el diagnóstico de malignidad35.
Las técnicas más novedosas, como la pancreatoscopia y la USE intraductal, pueden ayudar de forma significativa en la evaluación de estas lesiones y en la detección de su grado de malignidad10,36,37.
PRONÓSTICO Y TRATAMIENTOA pesar de su condición de lesión premaligna, el TPMI presenta un pronóstico excelente en comparación con otras neoplasias pancreáticas. Es un tumor de crecimiento lento, que puede presentar zonas de malignidad hasta en el 50% de los casos en el momento del diagnóstico, con una tasa de transformación maligna del 30-60%, de los cuales el 17-43% son cánceres invasivos en el momento del diagnóstico38. Sus cifras de supervivencia a los 5 años, aunque están influenciadas por el momento del diagnóstico y la resecabilidad quirúrgica, se sitúan en torno al 88%38. Otros estudios20,39 han publicado tasas de supervivencia similares, variables en función de la existencia o no de infiltración de tejido pancreático circundante (el 74 y el 85%, respectivamente40). No obstante, cuando el cáncer invasivo se detecta durante la cirugía, la supervivencia a 3 años desciende hasta un 21%20. En los últimos años se han tratado de determinar diversos parámetros clinicorradiológicos que indiquen la presencia de una degeneración maligna o un peor pronóstico del TPMI7,9,41,42. Entre ellos podemos destacar los mencionados en la tabla II.
Parámetros clinicorradiológicos que sugieren la presencia de una degeneración maligna o un peor pronóstico del tumor papilar, mucinoso e intraductal
| Tamaño del tumor |
| > 30 mm |
| Diámetro del conducto pancreático principal |
| > 10 mm (BDT) |
| > 15 mm (MDT) |
| Contenido quístico heterogéneo |
| Nódulos murales |
| > 5 mm |
| Septos y paredes engrosadas |
| Visualización del conducto de comunicación con el conducto pancreático principal (BDT) |
| CEA del jugo pancreático |
| > 110 ng/dl |
| Crecimiento rápido |
| Presencia de diabetes mellitus |
| Linfadenopatías |
| Extensión peripancreática |
| Extensión extrapancreática (duodenal, peritoneal, hepática) |
BDT: branch duct type, dependiente de colaterales del conducto pancreático principal; MDT: main duct type, dependiente de conducto pancreático principal.
La cirugía continúa siendo el pilar fundamental del tratamiento del TPMI. Globalmente, la tasa de resecabilidad de estas neoplasias se sitúa en torno al 87%40. No obstante, debido a la posible afectación multifocal y difusa del conducto pancreático principal, es difícil la obtención de un margen quirúrgico libre de tumor9. Los TPMI subtipo MDT presentan una alta tasa de malignidad (> 80%) en comparación con el subtipo BDT (20%), por lo que la planificación terapéutica es diferente40. En función de los subtipos MDT/BDT o grado histológico (benigno, maligno), se han propuesto diferentes opciones de tratamiento. En los BDT, la cirugía se reserva tan sólo para unos casos concretos –pacientes sintomáticos, en los que el tumor presenta un tamaño > 30 mm (o < 30 mm, pero con un crecimiento rápido), presencia de nódulos murales, dilatación del conducto pancreático principal o invasión extraductal–, ya que indicarían la presencia de una degeneración maligna del propio tumor10,43,44. En estos casos, y para los subtipos MDT que no presentan datos de degeneración maligna, se han descrito cirugías menos agresivas, como la pancreatectomía cefálica con preservación duodenal, la duodenopancreatectomía cefálica con preservación pilórica, la resección parcial del proceso uncinado, la pancreatectomía ventral o dorsal, y la pancreatectomía distal con preservación del bazo. Sata et al44 han descrito una técnica quirúrgica innovadora para el subtipo BDT, la resección simple de la rama afectada, que presenta una menor tasa de complicaciones debido a que mantiene intacto el conducto pancreático principal y la vía biliar. Por el contrario, Lee et al6 han sido los únicos que han propuesto un tratamiento agresivo para este último subtipo en función del análisis que realizan de la supervivencia y la recurrencia de los subtipos MDT y BDT, y defienden un tratamiento quirúrgico igualmente agresivo para el BDT y el MDT en relación con el riesgo de transformación maligna en el seguimiento y la presencia de recidiva posquirúrgica. En los casos de TPMI subtipo MDT y los TPMI invasivos, es decir, los que presentan infiltración del tejido pancreático circundante, con riesgo de metástasis ganglionares regionales y afectación de los tejidos circundantes, debe adoptarse una actitud quirúrgica agresiva mediante pancreatectomía total o duodenopancreatectomía cefálica con resección linfática regional45.
El tipo de seguimiento de estos pacientes debe valorarse en función de la edad, la presencia de comorbilidades y el tipo de TPMI. El Internacional Consensus Guidelines for Manangement of IPMN, recientemente publicado10, sugiere un protocolo de seguimiento de estos tumores (tabla III).
Protocolo de seguimiento propuesto en el Consenso Internacional para el manejo del tumor papilar, mucinoso e intraductal
| Riesgo de malignización/recurrencia | Intervalo de seguimiento | Método diagnóstico | |
| BDT no resecado | A los 12-36 meses de seguimiento: bajo riesgo | Anual | USE |
| Si < 10 mm | |||
| 6-12 meses | |||
| Si 10-20 mm | |||
| 3-6 meses | |||
| Si > 20 mm | |||
| TPMI benigno resecado | En relación con bordes quirúrgicos: libres/infiltrados | No hay consenso | TC |
| RM | |||
| TPMI invasivo resecado | Alto riesgo | 6 meses | TC |
| RM | |||
BDT: branch duct type, dependiente de colaterales del conducto pancreático principal; MDT: main duct type, dependiente de conducto pancreático principal; RM: resonancia magnética; TC: tomografía computarizada; TPMI: tumor papilar mucinoso intraductal; USE: ultrasonografía endoscópica. (Tomada de Tanaka et al10.)