Los fenómenos tromboembólicos venosos y arteriales son una complicación extraintestinal infrecuente de la enfermedad inflamatoria intestinal (EII) potencialmente prevenible.
Caso clínicoVarón de 62 años, con diagnóstico de enfermedad de Crohn (EC) (A3, L1+L4, B3) que durante su ingreso para drenaje percutáneo de absceso retroperitoneal presenta episodio de tromboembolia arterial periférica de miembro superior derecho, que requirió embolectomía urgente. Tras anticoagulación con heparina de bajo peso molecular (HBPM), se realiza estudio etiológico con hallazgo en la resonancia magnética vascular de un trombo arterial de gran tamaño en la aorta descendente, por lo que se realizó cirugía aórtica y se pautó anticoagulación indefinida con acenocumarol.
ConclusiónLa trombosis arterial periférica es una complicación poco común de la EII que debe ser considerada en pacientes con enfermedad activa y prevenida adecuadamente con HBPM. El tratamiento habitual es la cirugía combinada con anticoagulación y optimización de la terapia farmacológica.
Inflammatory Bowel Disease (IBD) usually affects the gastrointestinal tract, although some patients can also develop extraintestinal manifestations, such as vascular symptoms both venous and arterial ones. The former being more frequent than the latter.
Clinical reportWe report the case of a 62-year-old male, diagnosed of Crohn¿s disease (CD) (A3,L1+L4,B3), admitted to hospital for treatment of a retroperitoneal abscess. He presented a peripheral arterial thromboembolism during his stay, which required urgent embolectomy. After anticoagulation with low-molecular-weight heparin (LMWH), vascular magnetic resonance imaging revealed a large thrombus involving the descent aorta, which was solved with surgery and long-term anticoagulation.
ConclusionPeripheral arterial thrombosis is a rare extraintestinal manifestation of IBD. Nevertheless it is always important to consider it in patients with IBD. Prophylactic treatment should be made with low-molecular-weight heparin (LMWH) and definitive treatment with a combination of LMWH and surgery.
La enfermedad inflamatoria intestinal (EII) afecta fundamentalmente al tubo digestivo. Sin embargo, entre un 21 y 36% de los pacientes presentan manifestaciones extraintestinales1. Las más prevalentes son la sacroilitis (14%) y la artritis periférica (10,7%). Menos frecuentes son las complicaciones oculares (8%), cutaneomucosas (2,7%) o vasculares (2%)2. Estas últimas son bien conocidas, sobre todo las trombosis venosas (1,2%)3. Las trombosis arteriales son mucho menos frecuentes4. La incidencia de este fenómeno varía en las diferentes series entre el 1,2 y el 7,5%3.
Las complicaciones vasculares se asocian con una gran morbimortalidad por lo que la prevención y el tratamiento precoz deben contemplarse en el manejo de la EII5.
Se expone el caso de un paciente con enfermedad de Crohn complicada con un absceso retroperitoneal que presentó una trombosis arterial periférica de miembro superior derecho.
Caso clínicoSe presenta el caso de un varón de 62 años, de raza caucásica, diagnosticado a los 50 años de EC con afectación ileal y duodenal, con patrón fistulizante. Entre sus antecedentes personales solo destaca el hecho de ser ex fumador desde hace 25 años. En relación con su EC, hay que señalar que la evolución fue tórpida desde su comienzo. Durante el primer año tras el diagnóstico presentó una fístula enterocutánea (íleon-región crural), que precisó cirugía (ileocolectomía derecha). Tras la resección y a pesar de tratarse de un patrón fistulizante, el paciente no fue tratado con tiopurinas. Posteriormente presentó afectación perianal que fue tratada mediante fistulectomía y drenaje en varias ocasiones. A los 5 años del diagnóstico se detectó una estenosis duodenal en relación con afectación proximal de su EC, la cual fue tratada mediante gastrectomía tipo Billroth II. Tras la cirugía presentó fistulización hacia zona crural derecha y retroperitoneo con formación de un absceso, en relación con cierre precario del muñón duodenal. El absceso fue tratado mediante drenaje percutáneo bajo control radiológico y con tratamiento antibiótico (ciprofloxacino y metronidazol), con repetidas recidivas, precisando varios drenajes percutáneos. Inició entonces tratamiento con azatioprina en monoterapia y un año después se decidió añadir tratamiento anti-TNF con infliximab (5mg/kg) cada 8 semanas. Tras el inicio del tratamiento inmunosupresor, el paciente se mantuvo sin signos clínicos ni analíticos de actividad inflamatoria.
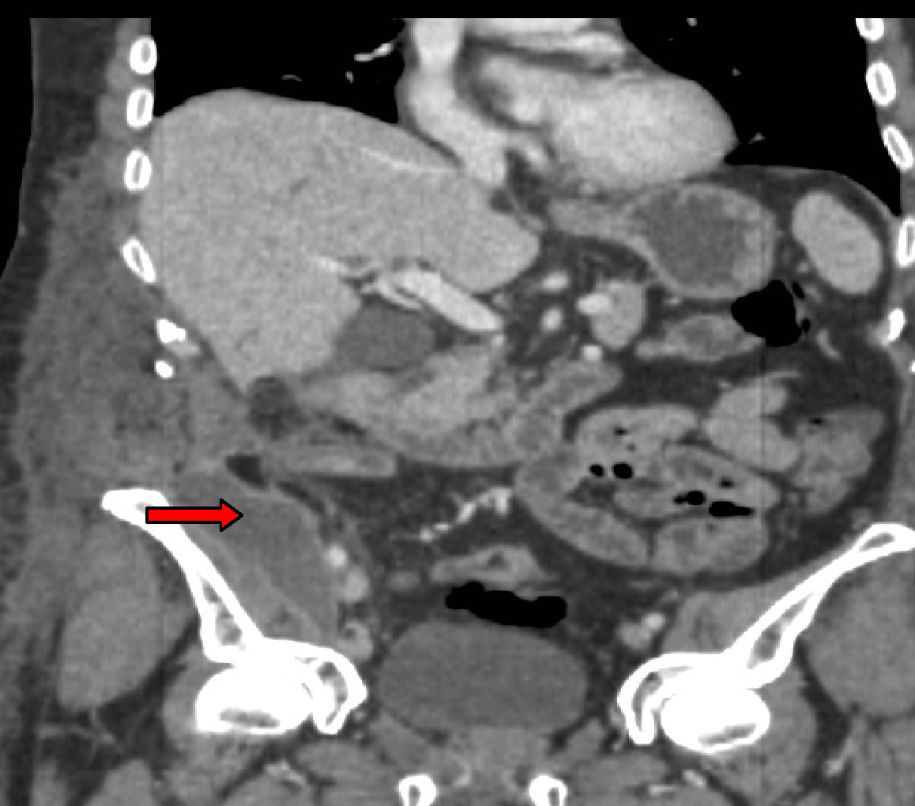
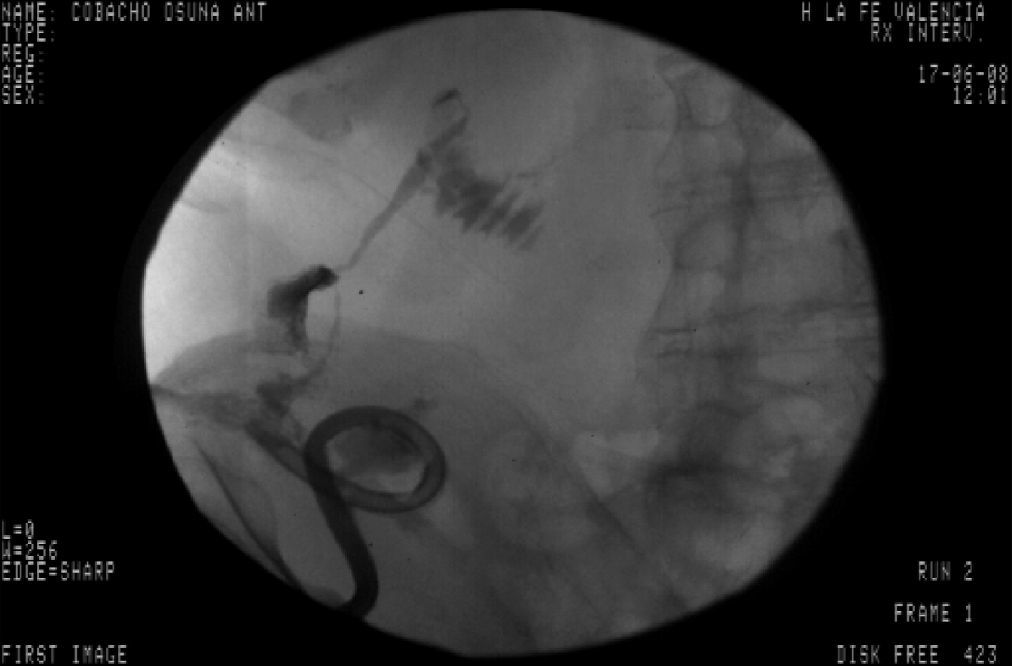
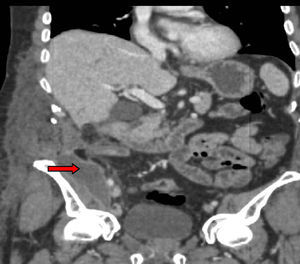
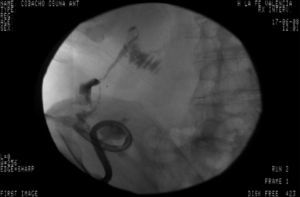
Tres años después de iniciar el tratamiento biológico con infliximab el paciente ingresó por presentar dolor y tumoración en zona inguinal derecha. Se realizó una TC donde se visualizó un trayecto fistuloso desde el íleon distal hasta el retroperitoneo formando un absceso lobulado (fig. 1) que se drenó por vía percutánea (fig. 2) y se trató adicionalmente con antibióticos (imipenem 500mg/6h por vía intravenosa [i.v.], tobramicina 100mg/12h/i.v. y metronidazol 500mg/8h i.v.) y corticoides (hidrocortisona 100mg/12h i.v. con pauta descendente). Tras el drenaje percutáneo el paciente evolucionó satisfactoriamente con mejoría del dolor y desaparición de la fiebre. En el sexto día del ingreso, el paciente presentó un cuadro de dolor de inicio súbito y parestesias en el brazo derecho, junto con palidez distal y abolición de los pulsos radial y bicipital derechos. Se realizó un diagnóstico de presunción de isquemia arterial de miembro superior derecho por lo que se realizó de forma urgente una embolectomía, sin secuelas isquémicas en el brazo. Tras la cirugía comenzó tratamiento con enoxaparina 60mg/12h por vía subcutánea.
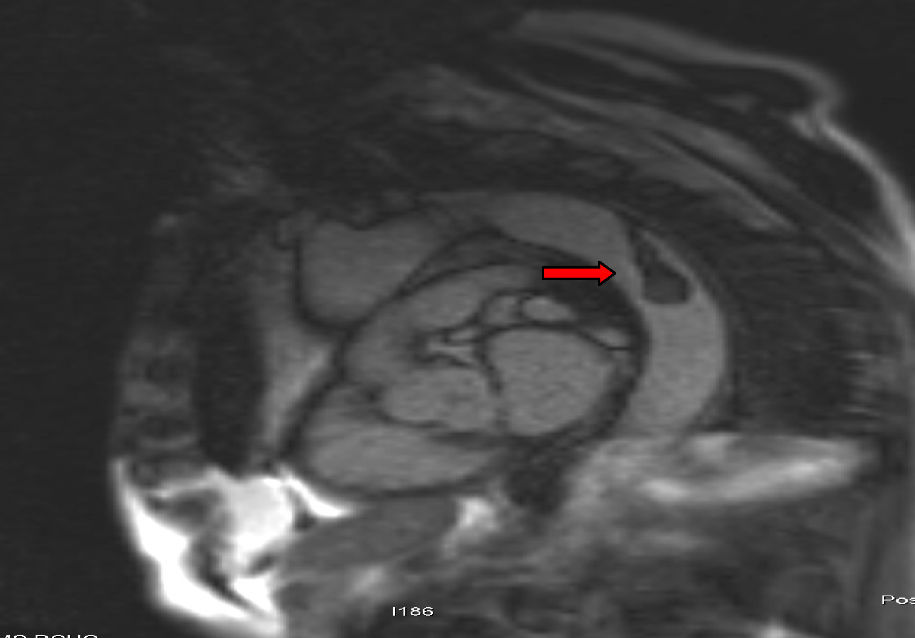
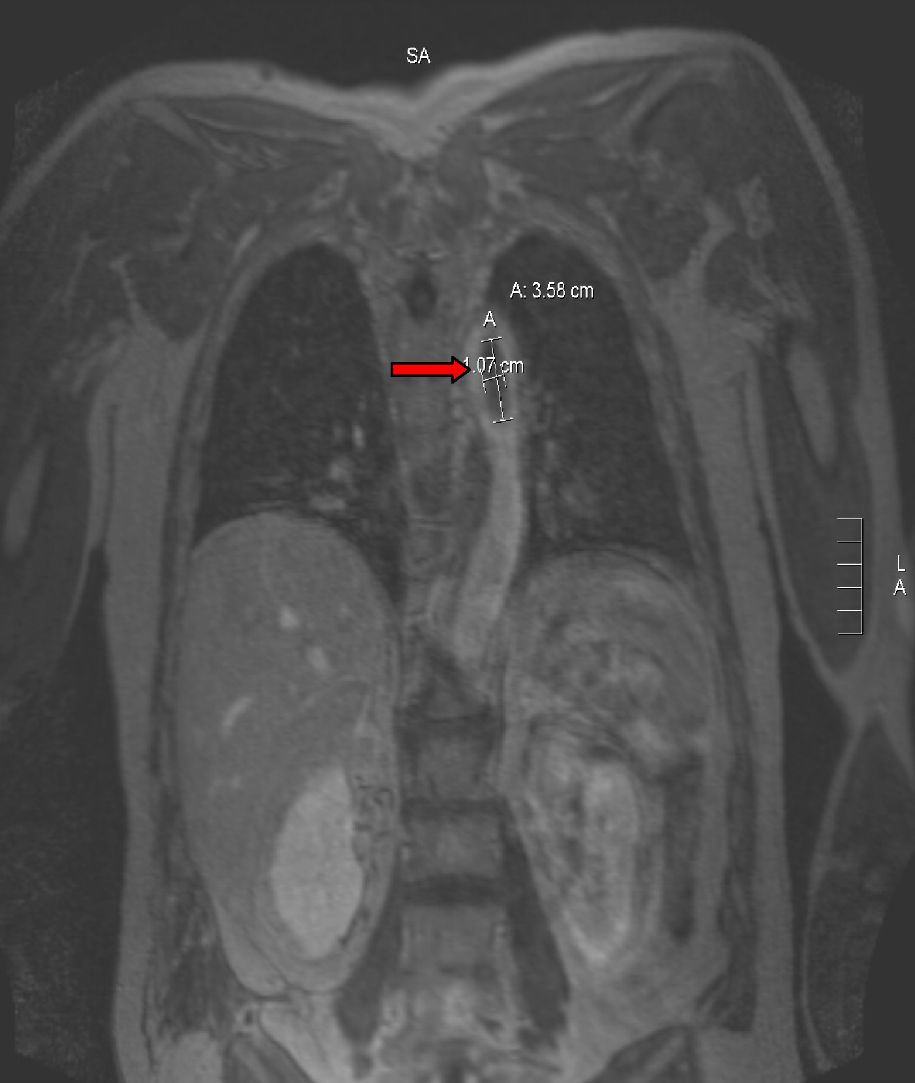
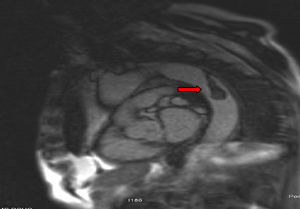
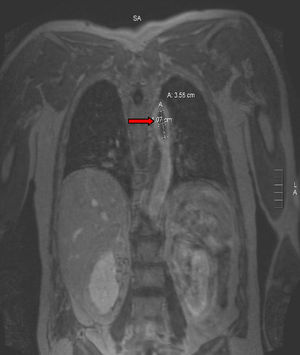
Para completar el estudio de isquemia arterial aguda se realizó ecocardiografía, sin encontrar hallazgos patológicos, y una angiorresonancia magnética (figs. 3 y 4), que mostró un trombo mural en aorta descendente. Con este hallazgo se programó nueva intervención quirúrgica que consistió en aortotomía transversa de arco aórtico distal y aorta torácica descendente, sin observarse trombo intraaórtico. Durante la intervención se apreció placa arteriosclerótica, probable responsable del trombo aórtico pediculado, que se resecó, sin incidencias. Finalmente, se procedió al alta con anticoagulación indefinida (acenocumarol, Sintrom®) y se retiraron tanto los antibióticos como los esteroides pautados.
DiscusiónPresentamos un paciente con EC, ingresado por la aparición de un absceso intraabdominal, con complicación intrahospitalaria de trombosis arterial que se trató mediante cirugía y anticoagulación terapéutica con enoxaparina con éxito.
Las complicaciones tromboembólicas se presentan en la EII con una frecuencia entre un 1,2 y un 7,2% según las distintas series4,6. Mieshler et al. demostraron en 2004 que los pacientes con EII presentan un riesgo 4 veces mayor que la población sana de presentar complicaciones tromboembólicas6, y el riesgo aumenta a 15 veces durante los brotes de actividad inflamatoria7. La mayoría de los casos descritos han ocurrido durante la fase activa de la enfermedad y añaden un mal pronóstico a ésta3. Este riesgo puede reducirse mediante una profilaxis anticoagulante con HBPM. A día de hoy el número de pacientes incluidos en los estudios relativos al riesgo protrombótico en pacientes con EII es demasiado bajo para poder extraer una conclusión sólida de manera específica. No obstante, de manera general sí se recomienda profilaxis anticoagulante en pacientes con enfermedad activa grave y/o fulminante o enfermedad fistulizante activa, sobre todo si hay inmovilización prolongada6. En este caso no se realizó profilaxis con HBPM que probablemente debería haber recibido, pero al no presentar un brote grave ni haber actividad inflamatoria quizás se pudo subestimar el riesgo protrombótico.
Los fenómenos trombóticos suelen ser venosos localizándose de manera más frecuente en el sistema venoso profundo de las extremidades inferiores (84,2%) y, en segundo lugar, en el pulmón. Las tromboembolias arteriales son menos frecuentes (1/1.000)2. Suelen afectar en primer lugar a las arterias de la retina y cerebrales, y, en segundo lugar, a las arterias de las extremidades superiores e inferiores con una significativa morbimortalidad asociada5,8,9. El caso clínico expuesto presenta cierta atipicidad por 2 motivos: a) por presentar tromboembolia arterial aórtica (pues lo común es la afectación periférica), relacionado habitualmente con enfermedad aórtica previa (aneurisma, arteriosclerosis, disección aórtica)8–10; b) por tratarse de embolia arterial periférica y central de manera sincrónica2.
La aparición de complicaciones tromboembólicas puede verse asociada a un estado procoagulativo en los pacientes con EII, y con respecto a ello se han postulado varías teorías, entre las que destacan: la enfermedad vascular de base (aneurisma, arteriosclerosis), que ya hemos comentado anteriormente; estados de trombofilia (hereditaria o adquirida); y la actividad de la propia enfermedad inflamatoria7,11,12. Los estados de trombofilia hereditaria estudiados (el aumento del factor V de Leiden, la deficiencia de antitrombina o la mutación del gen de la protrombina (G20210A)), así como los valores de proteína C y S no se han visto diferentes a los niveles de los controles y, por tanto, no se han establecido como factores de riesgo asociados a la propia EII, aunque sí se comportan como factores de riesgo de trombosis5,7,13,14. Respecto a las trombofilias adquiridas, una posible causa en estos pacientes es la hiperhomocisteinemia, ya que los pacientes con EII presentan una mayor prevalencia de esta alteración respecto a la población sana15; este estado de hiperhomocisteinemia puede ser debido a múltiples causas, las más frecuentes son: el déficit de folatos ligado a alteraciones metabólicas de malabsorción de vitamina B12; y el déficit de folatos secundario a medicación (metotrexato o sulfasalacina)7.
El mecanismo por el cual la inflamación incrementa el riesgo de fenómenos trombóticos no está claro16. Bargen y Barker describieron en 1936 una afectación de la hemostasia primaria, la coagulación y la fibrinólisis3. La relación inflamación-procoagulabilidad también viene apoyada por el hecho de que algunos de los tratamientos antiinflamatorios utilizados en la EII (azatioprina, 6-mercaptopurina, biológicos) producen una disminución de los factores protrombóticos (agregación plaquetaria, citocinas); por el contrario, otros fármacos utilizados pueden tener efecto trombogénico: los corticoides utilizados de forma prolongada pueden tener efecto procoagulante, aunque su efecto antiinflamatorio supera el riesgo protrombótico; y la ciclosporina, que tiene efecto trombogénico, aunque los estudios actuales no permiten concluir si tiene efecto protrombótico en el contexto de la EII7.
La mayoría de pacientes con EII no presentan ningún tipo de alteración que favorezca los estados protrombóticos2, y las complicaciones tromboembólicas son compatibles con el llamado estado de hipercoagulabilidad secundario asociado al proceso inflamatorio crónico17–19, junto con otros factores de riesgo como son inmovilidad, cirugía, catéteres venosos, deshidratación, malnutrición, tabaquismo y uso de anticonceptivos orales. Además se ha observado que los pacientes con EII presentan la misma prevalencia de trombofilias (33%) que la población sin EII7. Por este motivo, no se recomienda un estudio de trombofilia de forma sistemática, excepto en pacientes con antecedente de trombosis personal o familiar, trombosis de gran tamaño, trombosis simultánea del sistema venoso y arterial, o trombosis de repetición7,20. En el caso de nuestro paciente, estaría indicado realizar dicho estudio por objetivarse doble trombo arterial (periférico y aórtico).
En relación con el manejo de las complicaciones tromboembólicas arteriales en el contexto de la EII, hay muy poca información disponible, y no existen guías de práctica clínica que orienten en el manejo de estas complicaciones4. El tratamiento de la trombosis aguda se divide en 3 opciones: tromboembolectomía quirúrgica, anticoagulación sistémica y trombólisis por cateterismo directo (TCD). Nuestro paciente fue tratado mediante cirugía y anticoagulación con heparina de bajo peso molecular. Tabibian et al.21, en una revisión sistemática reciente sobre el tratamiento de la tromboembolia en la fase aguda en el paciente con EII, recomiendan el uso de anticoagulación sistémica (acenocumarol o heparina) en aquellos pacientes con tromboembolia leve-moderada y/o alto riesgo de complicaciones hemorrágicas; por el contrario, se recomienda el uso de trombólisis por cateterismo directo (TCD) en los pacientes más graves y con riesgo de muerte, pues la TCD produce una reducción más rápida y efectiva del daño isquémico, y una mejor resolución de los síntomas, a costa de un riesgo de hemorragia levemente mayor que la anticoagulación sistémica. En cuanto al manejo posterior al episodio de trombosis, no hay tampoco guías clínicas formales. Se recomienda la evaluación de cada caso de manera individual, con uso de anticoagulación sistémica, al menos en los meses posteriores al evento agudo, mientras persista el estado de hipercoagulabilidad en relación con la inflamación subyacente de la enfermedad. En nuestro caso, el paciente llevó tratamiento anticoagulante con acenocumarol durante los meses posteriores a la tromboembolia, con posterior retirada, y sin recidivas.
En conclusión, este caso clínico refuerza la necesidad de tener en cuenta la posible aparición de fenómenos trombóticos en los pacientes con EII. Debemos valorar la profilaxis antitrombótica en todos los pacientes que ingresan con un brote, fundamentalmente grave, de EII y/o tengan abscesos intraabdominales. Es importante un diagnóstico precoz junto con una intervención terapéutica temprana para solucionar el problema y evitar complicaciones mayores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.