El tratamiento actual de los pacientes con hepatitis C crónica es el interferón pegilado y la ribavirina. La aplicación de la cinética viral está permitiendo optimizar el tratamiento variando Ia pauta de 24 semanas para genotipos 2 y 3, y 48 para los demás genotipos. Así, los pacientes con genotipo 1 con una carga viral baja y una rápida respuesta virológica obtienen una alta respuesta viral sostenida con 24 semanas de tratamiento. Por el contrario, los pacientes respondedores lentos pueden beneficiarse de 72 semanas de tratamiento. Los pacientes con genotipo 2 y 3 también pueden beneficiarse de las pautas según la cinética viral. En los pacientes no respondedores al tratamiento actual se ha ensayado dosis más altas y tiempos más prolongados, aunque para gran número de ellos no tenemos otra opción que esperar una nueva generación de fármacos. El tratamiento de mantenimiento con dosis bajas de interferón para prevenir la cirrosis y/o el hepatocarcinoma está siendo evaluado.
Current treatment of patients with chronic hepatitis C consists of pegylated interferon and ribavirin. The application of viral kinetics is currently allowing treatment to be optimized by varying the length of treatment to 24 weeks for genotypes 2 and 3 and 48 weeks for the remaining genotypes. Thus, patients with genotype 1, with a low viral load, and rapid virological response (RVR) obtain a high RVS with 24 weeks’ treatment. In contrast, slow responders may benefit from 72 weeks’ treatment. Patients with genotypes 2 and 3 can also benefit from regimens designed according to viral kinetics. Higher doses and more prolonged periods have been tested in non-responders to current treatment, although for many, the only option is to wait for a new generation of drugs. Maintenance therapy with low-dose interferon to prevent cirrhosis and hepatocarcinoma is currently being evaluated.
El tratamiento de la hepatitis crónica por el virus C ha experimentado cambios notables desde que Hoofnagle inició el tratamiento de la hepatitis crónica no A no B con interferón (IFN)1 en 1986. Las tasas de respuesta han experimentado una progresión importante, pasando de un 6% a principios de los años noventa con la monoterapia al IFN en tratamientos de 6 meses, hasta un 15% en los tratamientos de 12 meses. La aprobación del tratamiento combinado con ribavirina en 1998 elevó la tasa de respuesta hasta un 40% al disminuir la tasa de recidivas por ribavirina2.
La disponibilidad desde 2001 de los interferones pegilados fue otro paso importante, que sentó las bases del tratamiento actual de la hepatitis C, con tasas de respuesta viral sostenida (RVS) del 55-60%3,4. El manejo del paciente con hepatitis C debe responder a una gran heterogeneidad de situaciones clínicas, como son los pacientes con cifras de alanina-aminotransferasa (ALT) persistentemente normales, hepatitis leve, moderada o grave, cirrosis compensada, cirrosis descompensada, manifestaciones extrahepáticas del VHC, coinfectados por el virus de la hepatitis B (VHB) o por el virus de la inmunodeficiencia humana (VIH), pacientes con comorbilidades que suponen contraindicaciones relativas para poder recibir tratamiento, pacientes que siguen programas de metadona y otros que no han abandonado su drogadicción, pacientes todos ellos que requieren una dedicación especial para conseguir sobre todo una buena adhesión al tratamiento una vez decidido éste. La última Conferencia de Consenso Americana sobre hepatitis C concluyó que todos los pacientes deben ser candidatos a tratamiento5. Si bien las circunstancias asociadas hacen que más de la mitad de los pacientes con hepatitis C no sean candidatos al tratamiento por determinados factores, como la edad, la cirrosis descompensada, las comorbilidades o la negativa del paciente al conocer los efectos adversos del tratamiento. En un estudio retrospectivo de 5.701 pacientes con hepatitis C crónica se han analizado los factores predictivos para recibir el tratamiento actual y se han hallado unas tasas de administración del tratamiento entre el 6 y el 29%. Los pacientes tenían una menor posibilidad de tratamiento si eran mayores de 60 años, solteros, presentaban unas cifras normales de ALT, disfunción hepática, tenían genotipo 1 o eran afroamericanos. La experiencia del médico era también un factor muy importante, ya que el paciente tenía un 77% menos de posibilidades de recibir tratamiento si era evaluado por un médico con poca experiencia en el manejo de la hepatitis C6. En la medida en que los tratamientos sean mejor tolerados y con superior tasa de eficacia, mayor será el porcentaje do pacientes elegibles para tratamiento.
OBJETIVOS DEL TRATAMIENTO Y DEFINICIÓN DE RESPUESTAConseguir la erradicación del VHC es el objetivo primario con la finalidad de detener la progresión de la enfermedad crónica hepática y disminuir el número de personas infectadas. Se han postulado otros objetivos, como frenar la evolución de la fibrosis y, en definitiva, la cirrosis, y prevenir la aparición de hepatocarcinoma, observaciones sugeridas a raíz de algunos estudios japoneses, que por el momento no están demostrados y están siendo evaluadas en dos grandes estudios de tratamiento con IFN pegilado a largo plazo: el HALT-C y el EPIC.
El objetivo del tratamiento de la hepatitis C crónica es conseguir una RVS definida como la ausencia de ARNVHC detectable en el suero por un método con gran sensibilidad 6 meses después del cese del tratamiento. Se ha comprobado que la RVS se asocia con la mejora en la calidad de vida del paciente y el mantenimiento de la erradicación viral a largo plazo, ya que la posibilidad de estar libre de infección 5 años más tarde es superior al 99%7. Asimismo, la RVS se sigue de una mejora histológica hepática evidente8 y de una tasa baja de complicaciones de la enfermedad hepática. Si bien el riesgo de hepatocarcinoma disminuye con la RVS, no se anula totalmente (pasa de 1,88 a 0,66/100 pacientes/año)9, por lo que estos pacientes, sobre todo si tienen fibrosis avanzada, deben ser controlados indefinidamente, aun teniendo una RVS. En un estudio realizado en 400 pacientes con RVS se detectó el ARN-VHC sólo en el 2% de las biopsias tomadas 24 semanas después del fin del tratamiento10. Las tasas de RVS han ido aumentando de forma clara con los sucesivos tratamientos, situándose actualmente en un 50% de pacientes con genotipo 1 y superior al 70% en genotipos favorables. Estas cifras referidas a datos de los estudios de registro han sido cuestionadas en algunos estudios que encuentran menores tasas de RVS11, en razón de los seleccionados, que son los pacientes incluidos en ensayos, pero un estudio multicéntrico español de práctica habitual ha mostrado idénticos resultados a los de los estudios de registro con RVS superior al 50%12.
PAUTA Y DURACIÓN DEL TRATAMIENTOEn la práctica clínica, una vez el paciente es evaluado y diagnosticado de hepatitis C crónica, se establece la indicación de tratamiento y se atiende fundamentalmente al genotipo para indicar la pauta de tratamiento que, tras el estudio de Hadziyannis et al13, es el siguiente: a) para los genotipos 1 y 4, IFN pegilado en dosis semanal y ribavirina en dosis diaria ajustada al peso durante un período de un año, y b) para genotipos 2 y 3, IFN pegilado en una dosis semanal y ribavirina en dosis de 800 mg diarios durante un período de 6 meses.
La duración del tratamiento ha ido variando según el tipo, desde los 6 meses en los tratamientos iniciales de monoterapia con IFN alfa estándar, para pasar posteriormente a un año en un intento de mejorar Ia tasa de respuesta viral sostenida (RVS). Con el tratamiento de combinación con IFN estándar y ribavirina la duración del tratamiento quedó establecida en 6 meses para las hepatitis causadas por genotipos favorables (2 y 3) y genotipo 1 con carga inferior a 2 millones de copias/ml, y de 12 meses las causadas por el genotipo 1 con carga viral alta. En los 2 primeros ensayos clínicos amplios publicados con IFN pegilado alfa-2a y alfa-2b los pacientes fueron tratados durante un año. El citado estudio de Hadziyannis et al13 estableció la pauta actual. Algunos autores, apoyándose en la observación de que en los pacientes no respondedores a IFN también se obtiene una mejora histológica (no sólo en los parámetros de inflamación sino también en los de fibrosis), postulan la no interrupción del tratamiento si hay una buena tolerancia. Con los IFN pegilados la mejora histológica es aún más evidente. Así, con IFN pegilado alfa-2b la mejora histológica se obtiene en el 90% de los pacientes con RVS, pero también en el 38% de los pacientes no respondedores. De manera similar, con IFN pegilado alfa- 2a se observó una mejora histológica en el 89% de los pacientes con RVS, pero también en el 63% de los pacientes no respondedores. En función de esta mejora histológica, en la actualidad se está evaluando la administración a largo plazo de IFN pegilado en pacientes no respondedores para constatar si ello se acompaña de una reducción en la progresión de la fibrosis y, por tanto, disminuye la aparición de complicaciones de la cirrosis, el desarrollo de hepatocarcinoma y aumenta la supervivencia de los pacientes.
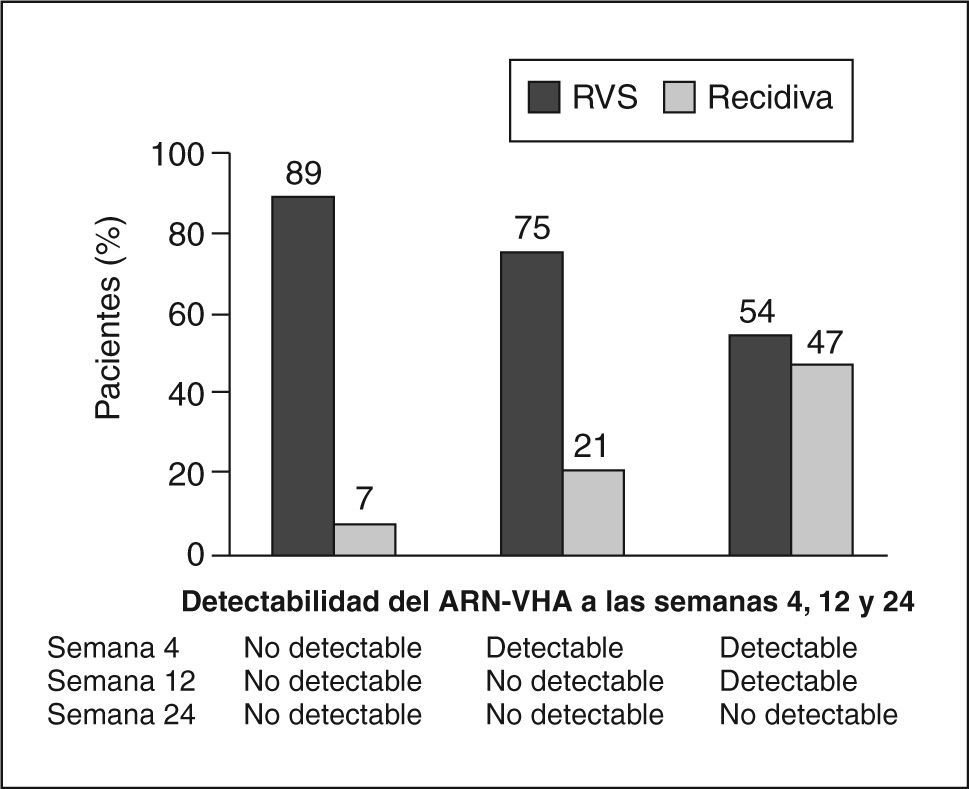
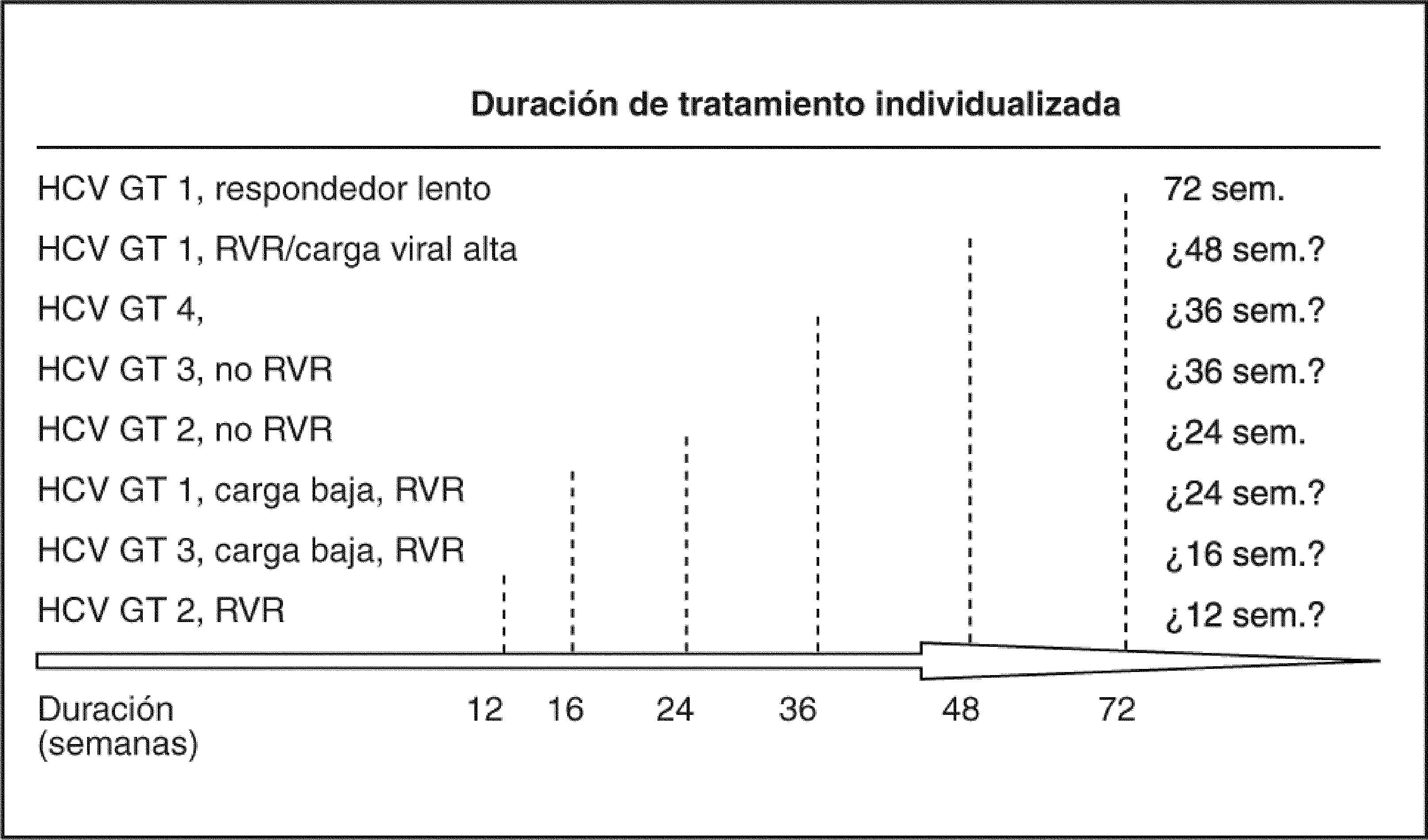
Importancia actual de la cinética viral en la pauta de tratamientoLa respuesta durante el tratamiento está permitiendo identificar a los pacientes que pueden ser tratados con pautas más cortas, y también a otros en los que debemos alargar el tratamiento; en definitiva, es el «tratamiento a medida ». La cinética viral durante el tratamiento indica que la tasa de RVS se relaciona inversamente con el tiempo de tratamiento necesario para que el ARN-VHC sea indetectable en el suero, y directamente con la duración del tratamiento después de la ausencia del ARN-VHC en el suero. La respuesta virológica en la semana 4 y en la semana 12 predice la probabilidad de conseguir o no respuesta sostenida. Cuanto más temprana es la respuesta virológica, mayor es la posibilidad de RVS14. El 90% de los pacientes con genotipo 1 y una respuesta virológica rápida (RVR) (ARN indetectable en la semana 4) tendrán una RVS, y algunos de ellos pueden beneficiarse de recibir sólo 24 semanas de tratamiento. Pacientes con una respuesta virológica temprana (RVT) (ARN indetectable o con un descenso superior a 2 log en la carga viral en la semana 12) tienen un 70% de posibilidades de lograr una RVS, mientras que los pacientes sin RVT la posibilidad de RVS es inferior al 3%, por lo que la mayoría de guías aconsejan la suspensión del tratamiento en tal caso. En el grupo de pacientes con RVT podemos distinguir dos situaciones: a) pacientes en que no se detecta virus RVT, y b) pacientes que han tenido un descenso de 2 log en la carga viral pero el virus es detectable en la semana 12 –es lo que se llamaría RVT parcial–, en los cuales la probabilidad de alcanzar una RVS es inferior que en los pacientes con RVT completa (fig. 1).
Respuesta viral sostenida (RVS) según el momento del ARNVHC indetectable en pacientes tratados con interferón alfa-2a y ribavirina. Modificada de Ferenci et al14.
La determinación de la carga viral en la semana 12 tiene un gran valor para predecir la respuesta, sobre todo Ia no respuesta en caso de positividad en dicha semana. La RVR (en la semana 4) está adquiriendo un gran valor y varios estudios se han centrado en establecer modificaciones en el tratamiento estándar según la aparición de respuesta o no en dicha semana. Así, algunos estudios han intentado acortar el tratamiento en los pacientes «superrrespondedores », con la ventaja de evitar efectos adversos y costes, en tanto otros han alargado el tratamiento en caso de no respuesta en dicha semana, en un intento de mejorar la tasa de respuesta virológica.
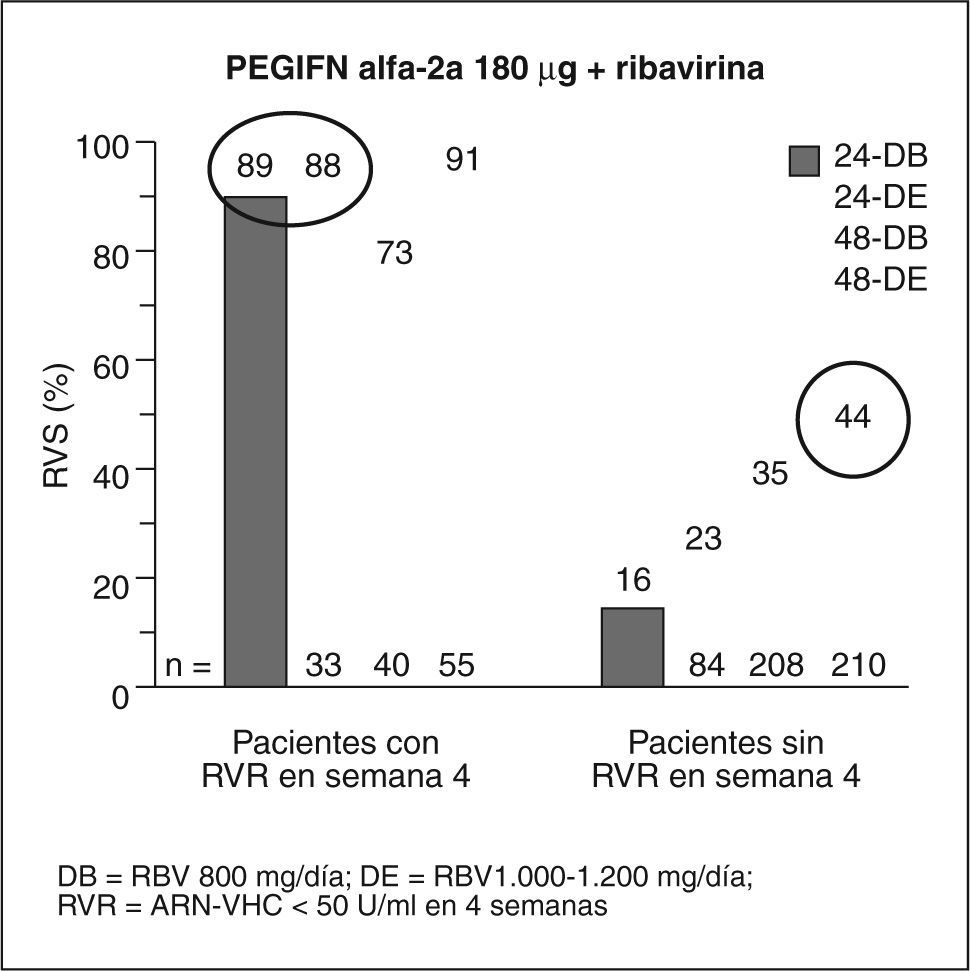
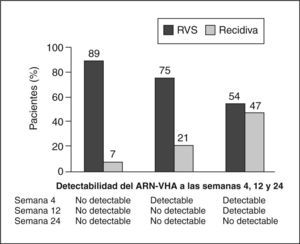
Pacientes con genotipo 1Aunque las guías actuales recomiendan para estos pacientes 48 semanas y una dosis estándar de ribavirina13, algunos investigadores han intentado identificar a los pacientes con genotipo 1 que responden a 24 semanas de tratamiento sin recidiva posterior. Esta disminución mejoraría los costes y la calidad de vida de los pacientes. Un estudio de Zeuzem et al15, realizado en pacientes con genotipo 1 y carga baja (< 600.000 U), tratados con IFN pegilado 2b más ribavirina 800-1400 mg durante 24 semanas, obtuvo una respuesta del 50% con el régimen corto, y del 89% en los pacientes que tenían una respuesta virológica en la semana 4. No se trata de un estudio aleatorizado y no queda claro si pueden extrapolarse los resultados a los pacientes con fibrosis avanzada15. Otro estudio de Jensen et al16 analiza retrospectivamente en los pacientes del estudio de Hadziyannis et al13 el impacto de la respuesta en la semana 4, con la posibilidad de conseguir una RVS, y halla que un 24% de pacientes con genotipo 1 tratados con IFN pegilado 2a más ribavirina consigue una RVS en la semana 4. Con 24 semanas de tratamiento, el 89% de los pacientes con RVR tienen respuesta sostenida (fig. 2). Ello sugiere que una duración más corta puede ser aceptable en pacientes con ARN indetectable en la semana 4 y una baja carga viral basal. En pacientes sin RVR la mejor tasa de respuesta se consigue con 48 semanas de tratamiento. Estos resultados hay que considerarlos con cautela, ya que no sabemos si son extrapolables a los pacientes con fibrosis avanzada y no disponemos do un estudio comparativo prospectivo que examine el beneficio de las 24 semanas, frente al estándar de 48 semanas.
Respuesta viral sostenida (RVS) según la respuesta virológica rápida (RVR) o ausencia de ésta. Modificada de Jensen et al16.
La extensión del tratamiento podría aumentar la tasa de RVS en pacientes que no muestran una RVR. Esta hipótesis ha sido explorada en un estudio multicéntrico español de Sánchez Tapias et al17. Se incluyó a 517 pacientes, que fueron tratados con IFN pegilado alfa-2a y ribavirina 800 mg/día. A las 4 semanas, 184 pacientes (el 36%) presentaban ARN-VHC negativo y se trataron de forma estándar, pero 326 (el 64%) que presentaban ARN-VHC positivo se aleatorizaron a proseguir tratamiento hasta completar 48 semanas (165 pacientes) o 72 semanas (161 pacientes).
La administración de IFN pegilado alfa-2a y ribavirina durante 72 semanas disminuyó significativamente la tasa de recidivas y aumentó significativamente la RVS (de un 32 a un 45%) en pacientes que no presentan una RVR. La frecuencia y la gravedad de efectos adversos fueron similares entre los pacientes que recibieron 48 o 72 semanas; sin embargo, los pacientes aleatorizados a 72 semanas tuvieron una tasa superior de abandonos (el 36 frente al 18%). Hay que resaltar que la dosis de ribavirina en este estudio fue inferior a la recomendada actualmente (800 mg).
Otro estudio de Berg et al18 exploró también el tratamiento durante 72 semanas frente al estándar de 48 semanas, y halló en un análisis retrospectivo que los pacientes con RVT (semana 12 negativo) consiguen altas tasa de RVS (75-80%) tanto con 48 como con 72 semanas de tratamiento, y que los respondedores lentos (semana 12 positivo y semana 24 negativo) muestran mejores tasas de RVS cuando se tratan 72 semanas al disminuir la recidiva. Un análisis retrospectivo de diferentes ensayos ha mostrado una RVS mejorada con 72 semanas frente a 48, sobre todo en pacientes con RVT parcial.
Pearlman et al19 realizan un estudio prospectivo y aleatorizado de 48 frente a 72 semanas con IFN pegilado 2b más ribavirina ajustada al peso (800-1.400 mg/día) en pacientes con RVT parcial y ARN indetectable en la semana 24. Aunque la respuesta final al tratamiento fue similar en ambos grupos, la RVS fue superior en los pacientes tratados durante 72 semanas (el 38 frente al 18%), ya que reducía la tasa de recidiva.
Parece quedar claro que la RVR permite acortar el tratamiento en los pacientes con genotipo 1 y carga viral baja. No está claro si la identificación de los pacientes respondedores lentos debe hacerse en la semana 4, como en el estudio de Sánchez Tapias et al17, o en la semana 12, como el estudio de Pearlman et al19, para alargar el tratamiento a 72 semanas.
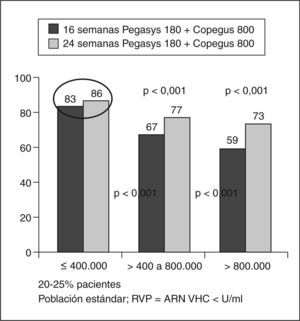
Pacientes con genotipos 2 y 3La pauta actual para estos pacientes es de 24 semanas de tratamiento y dosis bajas de ribavirina, pero se ha estudiado si se puede reducir más la duración sin comprometer la eficacia. Dalgard et al20 tratan con IFN pegilado 2b más ribavirina (800-1.400 mg) a pacientes con genotipo 2 y 3, y hallan en los que presentan RVR una RVS del 90% con un tratamiento de 14 semanas, más alta que los que no tienen RVR tratados durante 24 semanas (RVS del 56%). Von Wagner et al21 tratan a pacientes con IFN pegilado 2a más ribavirina y observan una RVS del 82% en pacientes con genotipo 2 y 3 tratados durante 16 semanas, similar al 80% cuando se tratan durante 24 semanas. Sugiere también que los pacientes con genotipo 3 y una carga viral alta podrían requerir un tratamiento más largo, de 24 semanas. Mangia et al22 señalan que los pacientes con genotipo 2 y 3 que tienen ARN-HVC indetectable tras 4 semanas de terapia pueden recibir tratamiento durante 12 semanas, ya que es tan efectivo como el de 24 semanas.
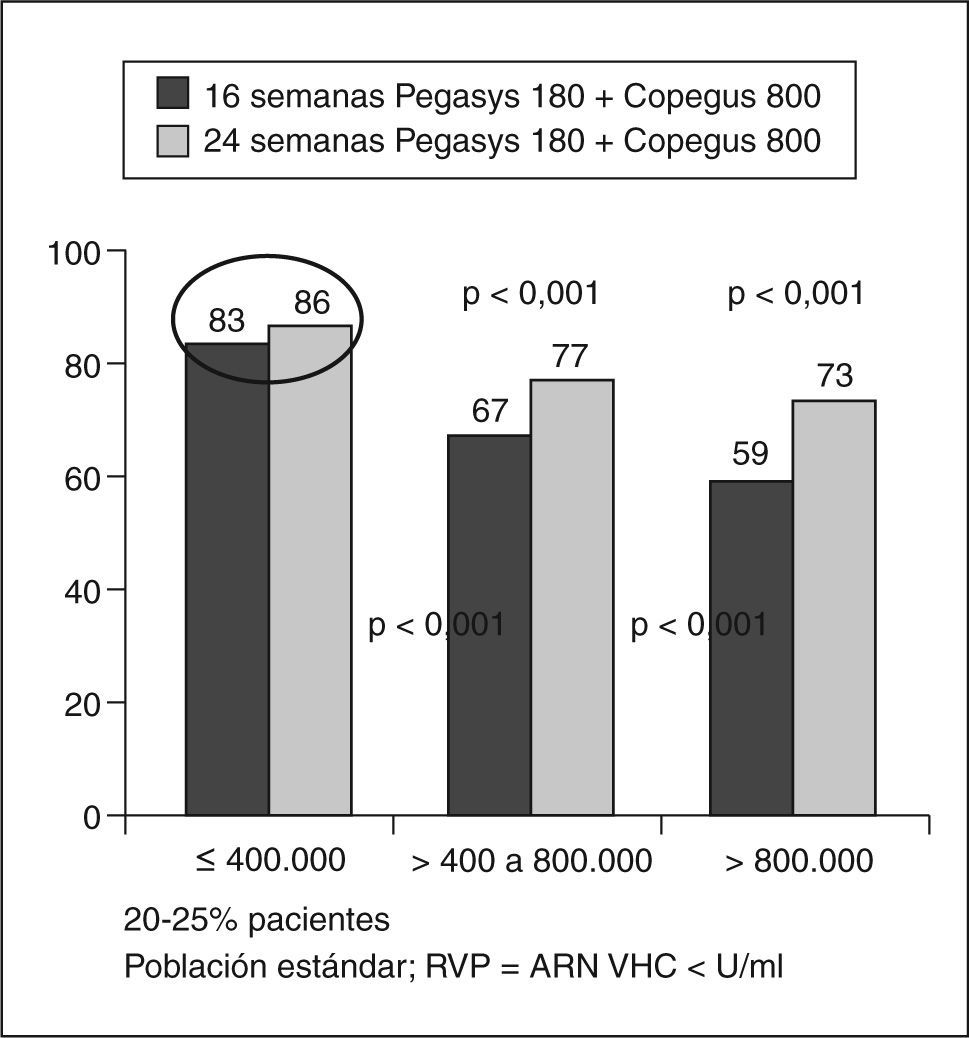
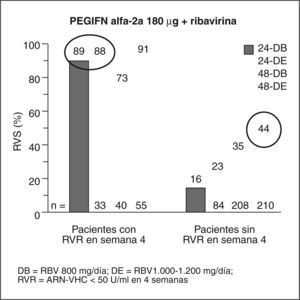
Un estudio multicéntrico, liderado por Shiffman et al23, incluyó a 1.469 pacientes para estudiar si es posible tratar a los pacientes con genotipos 2 y 3 sólo durante 16 semanas sin comprometer la eficacia. Los pacientes se trataron con IFN pegilado 2a 180 μg/semana más 800 mg de ribavirina y fueron aleatorizados para recibir 16 o 24 semanas de tratamiento. LA RVS fue más baja en los pacientes tratados durante 16 semanas que durante 24 (el 62 frente al 70%). La tasa de recidiva fue superior en el grupo tratado durante 16 semanas. La RVS en pacientes con carga inferior a 400.000 U/ml era del 82% con 16 semanas de tratamiento y del 81% con 24 semanas. En los pacientes con RVR (ARN indetectable en la semana 4) la RVS era del 79% en el grupo de 16 semanas y del 85% en el grupo de 24 semanas. En pacientes sin RVR la RVS fue del 30% si se trataban durante 16 semanas y del 49% en los de 24 semanas). Este grupo de pacientes con genotipo 3 y sin respuesta virológica en la semana 4 sólo obtenía un 42% de respuesta, lo que debería llevar a plantearse una pauta diferente para ellos.
En conclusión, en los pacientes con carga viral basal baja (400.000 U) o RVR puede acortarse la duración del tratamiento a 16 semanas, ya que con este régimen se consiguen altas tasas de RVS (fig. 3).
Respuesta viral sostenida (RVS) según la carga viral basal y la duración del tratamiento. Modificada de Shiffman et al23.
La consideración de genotipo 4 como un genotipo fácil de curar llevaría aparejada la posibilidad de reducir la duración del tratamiento. Esto ha sido explorado en dos publicaciones. Un análisis retrospectivo24 incluía a los 49 pacientes con genotipo 4 de los estudios de Fried et al y Hadziyannis et al, que habían sido tratados con diferente pautas de tiempo (24 o 48 semanas) y dosis de ribavirina (800 o 1.000-1.200 mg). Los pacientes tratados durante 48 semanas y con una dosis de ribavirina de 1-1,2 g tenían una RVS del 79%, y del 63% si la dosis de ribavirina era de 800 mg. Con 24 semanas y una dosis plena de ribavirina la respuesta era del 67%, pero no respondió ningún paciente tratado con ribavirina 800 mg durante 24 semanas.
Un estudio reciente de Kamal et al25 ha estudiado la duración óptima del tratamiento en pacientes con genotipo 4. Incluye a 287 pacientes que son tratados con IFN pegilado alfa-2b 1,5 μg/kg y ribavirina 1.000-1.200 mg/día y se aleatorizan en 3 grupos: el primero de ellos tratado durante 24 semanas, el segundo durante 36 y el tercero durante 48. Las RVS fueron del 29, 66 y 69%, respectivamente. El análisis multivariante mostró que eran factores predictivos de respuesta la carga viral basal (< 2 millones de copias), la edad (< 40 años) y la duración del tratamiento (48 y 36 semanas frente a 24). También se describe en el estudio que los pacientes con RVS muestran una mayor eficacia antiviral y una disminución más rápida en la semana 4 que los no respondedores.
FACTORES PREDICTIVOS DE RESPUESTACon todos los tratamientos aplicados se han estudiado los factores que se asocian a una RVS. El genotipo es el factor más importante para predecir la respuesta (un 55% para el genotipo 1 y un 80% para los genotipos 2 y 3), y también la carga viral, si bien con menor impacto, factores ambos que no son modificables. El estadio de la enfermedad, como la ausencia de cirrosis o de fibrosis en puentes, supone una mayor tasa de RVS. Otros factores dependientes del huésped (raza, menor edad, menor peso y superficie corporales y menor resistencia a la insulina) se asocian con mejores tasas de RVS. Algunos de ellos son modificables, si se reduce el peso corporal, se disminuye la resistencia a la insulina o se trata al paciente lo antes posible. Durante el tratamiento, un mayor cumplimiento terapéutico y una RVT también se asocian a una mayor tasa de RVS.
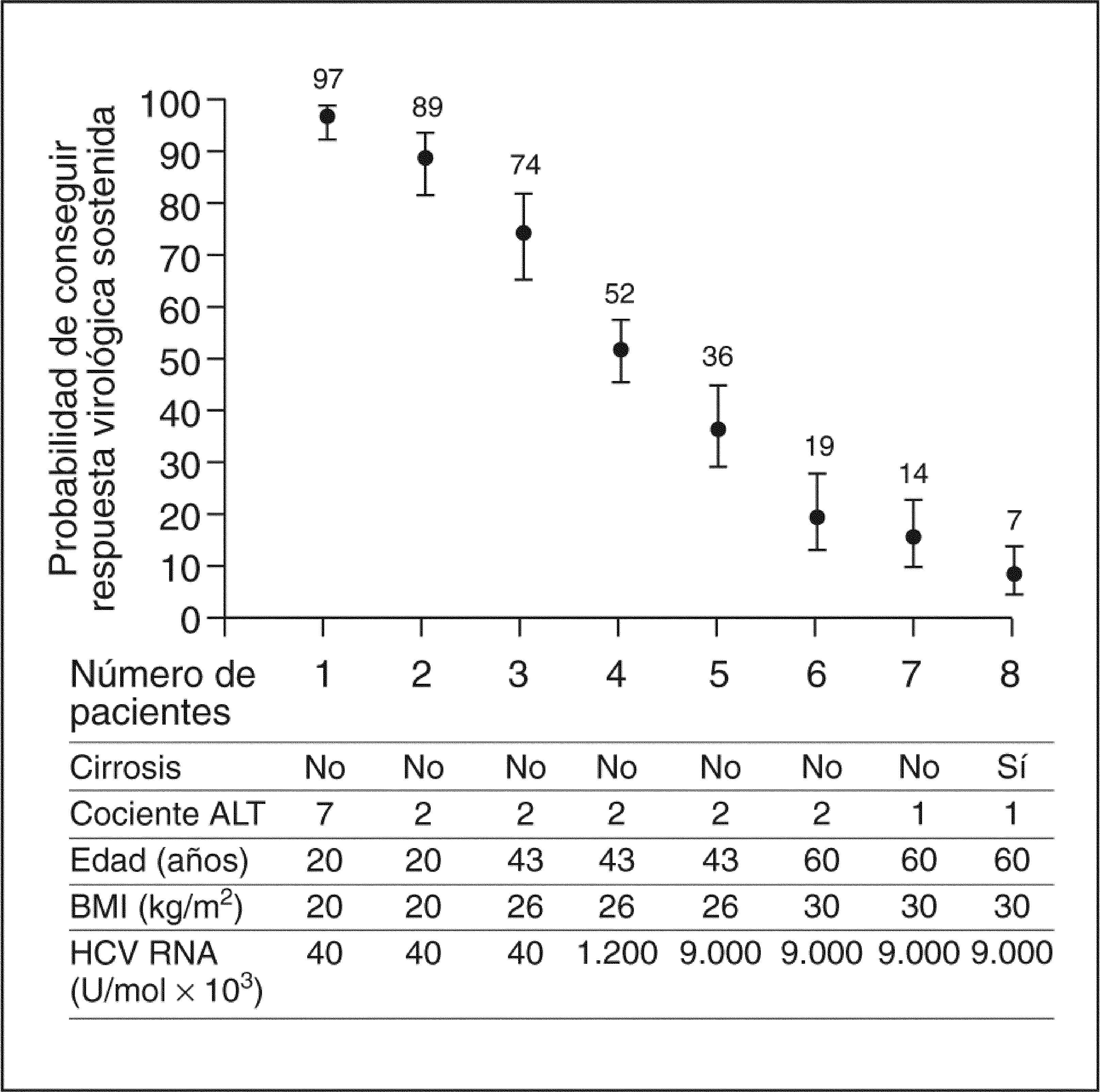
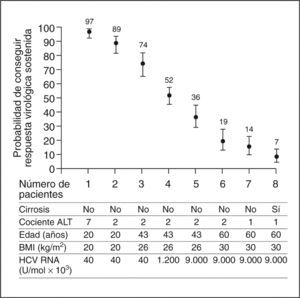
Foster et al26, en un estudio reciente, analizaban los factores predictivos de respuesta con los datos de los estudios de Fried et al y Hadziyannis et al, mediante un modelo de regresión logística para pacientes con genotipo 1, que incluye la edad, la carga viral, la histología, el cociente ALT/AST, el índice de masa corporal, la duración de tratamiento, la dosis de ribavirina y el cumplimiento terapéutico. Variando 5 factores basales se obtienen grandes diferencias en la RVS; así, el mejor caso sería tratar a un paciente de 20 años, sin cirrosis, con un cociente ALT/AST de 7, un índice de masa corporal de 20 y una carga viral de 40.000 U, con un 97% de RVS, y el peor un paciente de 60 años, con cirrosis, cociente ALT/AST de 1, índice de masa corporal de 30 y carga viral do 9 millones (fig. 4). Establecido como objetivo del tratamiento el conseguir la RVS y, con ello, la erradicación del VHC, los estudios también han evaluado la posibilidad de establecer la predicción de respuesta lo más precozmente posible con la intención de determinar los pacientes que van a presentar una RVS y los que van a ser no respondedores. Con la monoterapia con IFN se estableció que la positividad del ARN-VHC al tercer mes de tratamiento podía predecir la ausencia de RVS en el 98% de los casos, con lo cual era recomendable el cese del tratamiento en ese momento. Con el tratamiento combinado de IFN estándar y ribavirina, la ausencia de respuesta virológica en la semana 12 tenía un valor predictivo negativo del 90%, que aumentaba al 98% en la semana 24, por lo que se recomendó determinar el ARN-VHC a los 6 meses y cesar el tratamiento en caso de que fuera positivo. Con el tratamiento actual, la ausencia de respuesta virológica en Ia semana 12 del tratamiento con IFN pegilado alfa-2a tiene un valor predictivo negativo del 97%27. Un 67% de los pacientes tratados con IFN pegilado 2a y ribavirina con respuesta en la semana 12 tiene RVS. La probabilidad de RVS aumenta con la rapidez en la supresión viral. Las tasas de RVS más altas se consiguen en pacientes con respuesta en la semana 4, pero el valor predictivo negativo en este punto es del 74%, demasiado bajo para tornar la decisión de no proseguir el tratamiento. En este estudio también se comprueba la importancia del cumplimiento terapéutico. La tasa de RVS era un 20% más baja en pacientes que habían recibido menos de un 80% de la dosis prevista de ribavirina frente a los que habían recibido una dosis mayor. El mejor conocimiento de la cinética viral durante el tratamiento va a contribuir, sin duda, a mejorar la posibilidad de predicción precoz de la RVS. Un estudio japonés realizado con IFN beta ha sugerido la posibilidad de predecir la RVS en función de los resultados tras las primeras 24 h de administración del fármaco28.
Impacto de los diferentes factores predictivos de respuesta. Modificada de Foster et al26.
El impacto que el cumplimiento terapéutico ha tenido sobre la RVS también se ha investigado. Mientras que la RVS con IFN pegilado alfa-2a más ribavirina había sido globalmente del 56%, y del 67% en los pacientes con respuesta virológica temprana, este porcentaje alcanzaba el 75% en el subgrupo que había cumplido correctamente el tratamiento, definido como el haber tomado más del 80% de la medicación prescrita y haber efectuado más del 80% de la duración establecida del tratamiento. En caso de intolerancia al tratamiento, es preferible reducir las dosis que interrumpirlo, dado que con la reducción la tasa global de la RVS en los pacientes con RVT se mantiene en el 67%, mientras que desciende al 12% si se interrumpe14. Con IFN pegilado 2b también se ha demostrado la importancia del cumplimiento, consiguiendo una tasa de RVS mucho más elevada cuando el grado de cumplimiento es superior al 80% (el 63 frente al 34%) que cuando la éste es inferior29.
IMPORTANCIA DE LA RIBAVIRINALa adición de ribavirina al tratamiento supuso una notable disminución de las recidivas. Mantener una dosis adecuada de ribavirina es importante para conseguir una tasa de respuesta sostenida alta, sobre todo en los pacientes con genotipo 1. En situaciones como la hepatitis C aguda, en que la acción antiviral del IFN es más eficaz, la presencia de ribavirina parece menos necesaria. Igual sucede con los pacientes con genotipos 2 y 3, en los que es necesaria una menor dosis de ribavirina.
Un estudio realizado en 1.732 pacientes analizó la probabilidad de RVS según la dosis de ribavirina por kg de peso, y se indica que los pacientes con genotipo 1 incrementan de forma notable Ia respuesta a partir de 10 mg/kg de ribavirina (RVS del 45%) hasta 20 mg/kg, con lo que consiguieron un 80% de respuesta30. Bronowcki et al31 demostraron que la supresión de ribavirina una vez conseguida la negativización del ARN-VHC se sigue de una tasa aumentada de recidiva, y concluyen que es importante mantener la administración de ribavirina durante todo el tratamiento. La ribavirina debe administrarse en dosis óptimas durante todo el tratamiento, aunque puede ocasionar una anemia hemolítica dependiente de la dosis, muy frecuente si se superan los 15 mg/kg de peso. Una dosis inicial de 15 mg/kg ha mostrado una mayor tasa de RVS en un estudio de Shiffman et al32. La eritropoyetina puede mejorar la anemia inducida por ribavirina y hay que conseguir administrar una dosis completa de ésta, si bien no es un tratamiento que esté aprobado en pacientes con hepatitis C crónica.
Otra posibilidad de mejorar resultados es la utilización de dosis más elevadas de ribavirina, que se ha mostrado eficaz en los pacientes no tratados. Así, Lindahi et al33, en un estudio piloto con 10 pacientes, obtienen una RVS del 90% utilizando dosis doble de ribavirina, lo que requería el uso de eritropoyetina y transfusiones por la anemia. No se ha encontrado por el momento ningún análogo de ribavirina con igual eficacia y menos efectos secundarios. En resumen, el tratamiento actual de los pacientes con hepatitis C crónica debería adaptarse, además de al genotipo 1, a la cinética viral, y aplicar a cada paciente según la respuesta, que podría variar en cuanto a duraciones de tratamiento entre 72 semanas en los pacientes con genotipo 1 y respondedores lentos y 12 semanas en los pacientes con genotipo 2 con rápida respuesta virológica.
PACIENTES PREVIAMENTE TRATADOSLos pacientes diagnosticados de hepatitis C crónica que han recibido tratamiento sin conseguir erradicar el virus son un colectivo cada vez más numeroso, que constituye en la actualidad más del 50% de los pacientes que atendemos en las consultas. Los mecanismos de no respuesta al tratamiento con IFN no son bien conocidos y, por tanto, no sabemos cómo modificarlos. Se han implicado los siguientes:
- –
Las proteínas del virus C pueden antagonizar la actividad antiviral del IFN definida.
- –
Factores genéticos. Se han identificado varios genes en los pacientes no respondedores.
- –
La resistencia a la insulina induce resistencia al IFN. Sabemos actualmente que la resistencia a la insulina provoca menor respuesta al IFN. En un reciente estudio se ha obtenido una respuesta al IFN pegilado y ribavirina en pacientes genotipo con 1 del 60% en pacientes sin resistencia a la insulina y de un 20% en pacientes con resistencia a la insulina elevada (test de HOMA > 4)34. La resistencia a la insulina está aumentada en todos los grupos de pacientes «difíciles de curar», como los coinfectados por el VIH, los afroamericanos, los pacientes obesos y los pacientes con cirrosis. Una menor resistencia a la insulina puede mejorar la respuesta terapéutica. Así, en un estudio italiano, Tarantino et al35 trataron a 32 pacientes con síndrome metabólico y genotipo 1. La mitad de ellos realizaron una pauta de ejercicio y dieta, hasta bajar un 10% el índice de masa corporal, con lo que se obtuvo una respuesta significativa en estos pacientes. Modificar la resistencia a la insulina podría mejorar sensiblemente la tasa de RVS.
Se han aducido varias razones para el fallo en el tratamiento: factores relacionados con el virus, como el genotipo y la carga viral, otros derivados del paciente, como la raza, la edad, el grado de fibrosis, el peso o la resistencia a la insulina, y otros derivados del tratamiento, como un escaso cumplimiento o los efectos adversos. Posiblemente, no todos los pacientes no respondedores deben ser tratados con IFN pegilado y ribavirina, ya que en algunos de estos pacientes la evolución de la fibrosis puede ser lenta y hay que esperar a una nueva generación de fármacos más eficaz, pero en otros (cociente AST/ALT > 1, fibrosis basal > 1, disminución de plaquetas), en los que observamos una progresión a cirrosis a corto o medio plazo, tendría un mayor interés la posibilidad de un retratamiento. También hay que considerar que no todos los pacientes no respondedores son iguales, y es necesario clasificarlos según el tipo de tratamiento previo, la respuesta a éste y el genotipo.
Los intentos de retratamiento se basan en emplear pautas con mayores dosis y duración, o añadir nuevos fármacos a los ya utilizados. Los parámetros que debemos analizar para tomar una decisión de retratamiento son el tipo de tratamiento previo (IFN en monoterapia, IFN estándar más ribavirina o IFN pegilado más ribavirina), el tipo de respuesta (respuesta y recidiva posterior, respuesta virológica parcial o no respuesta), el genotipo y los factores del paciente (gravedad de la lesión histológico y grado de cumplimiento, y tolerancia del tratamiento previo). Si el paciente no siguió correctamente el tratamiento o se interrumpió prematuramente por efectos adversos, puede intentarse un retratamiento con un control más estricto y mayores medidas de soporte para que pueda cumplirse plenamente. Si ha habido reducciones importantes de la dosis, sobre todo en las primeras semanas de tratamiento por efectos adversos, puede intentarse el retratamiento en dosis plenas (p. ej., administrar eritropoyetina para evitar la reducción de ribavirina ante una anemia intensa y precoz en el primer tratamiento).
En la actualidad, están en marcha 2 grandes ensayos para conocer la tasa de RVS con la combinación de IFN pegilado y ribavirina en los no respondedores a tratamientos previos, y también si es posible detener la evolución de Ia fibrosis con el mantenimiento de IFN pegilado a largo plazo. Son el HALT-C (Hepatitis C Long Term Treatment Against Cirrhosis) con IFN pegilado alfa-2a35 y el EPIC (Evaluation of PEG-Introm in Control of Hepatitis C Cirrosis) con IFN pegilado alfa-2b36.
El objetivo primario del HALT-C es determinar si la terapia con IFN pegilado a largo plazo puede reducir el riesgo de progresión a cirrosis, de descompensación y hepatocarcinoma, y la necesidad de trasplante en pacientes no respondedores a la terapia antiviral. Se está realizando en Estados Unidos con el soporte de los Institutos Nacionales de Salud (NIH). El diseño consiste en tratar a los pacientes no respondedores a IFN, o IFN más ribavirina, con IFN pegilado alfa-2a más ribavirina en dosis estándar. Los pacientes que responden en la semana 20 prosiguen el tratamiento hasta completar 48 semanas, en tanto si no hay respuesta, son aleatorizados para recibir IFN pegilado 2a (90 μg por semana durante 3,5 años) o someterse a observación. En los primeros 604 pacientes incluidos en el estudio HALT-C se ha obtenido una respuesta global sostenida del 18%, en los pacientes que habían recibido previamente monoterapia con IFN del 28%, y en el grupo que no había respondido al tratamiento de combinación de IFN estándar y ribavirina de un 12%.
Los factores de una mayor RVS fueron el tratamiento previo con monoterapia con IFN, tener un genotipo 2 o 3, un cociente AST/ALT bajo, ausencia de cirrosis y no ser afroamericano. En caso de presentar varios factores desfavorables, la tasa de respuesta era de un 6%. Éstos son los factores que también conocemos como de pobre respuesta al tratamiento inicial. En dicho estudio también se manifiesta la importancia del cumplimiento terapéutico, ya que reducir la dosis de ribavirina del 80 al 60% en las primeras 20 semanas de tratamiento suponía reducir la RVS de un 21 a un 11%; sin embargo, unas reducciones de ribavirina o IFN pegilado después de la semana 20, cuando el virus C es ya indetectable, no afectaban significativamente a la RVS.
El estudio EPIC está en marcha e incluye pacientes recidivantes o no respondedores a IFN más ribavirina, por lo que son tratados con IFN pegilado 2b más ribavirina. Si en la semana 12 se aparece una respuesta virológica, se prosigue el tratamiento hasta completar un año y, en caso de no respuesta, los pacientes son aleatorizados para realizar observación o administración de monoterapia con IFN pegilado 2b (0,5 μg/kg/semana). En abril de 2005 se presentaron los resultados parciales de la respuesta sostenida, que fue del 14% en los no respondedores y de un 41% en los recidivantes, tasas superponibles a las publicadas por Shiffman et al con IFN pegilado alfa-2a. Un análisis multivariado mostró que las variables predictivas de RVS eran el genotipo, la respuesta previa, y tener menos fibrosis y menor carga viral basal.
Queda claro que en el retratamiento con IFN pegilado y ribavirina de un paciente no respondedor a monoterapia con IFN, la posibilidad de respuesta es del 28% (demostrado con IFN pegilado 2a y 2b), en tanto que si el paciente era no respondedor a la combinación, la respuesta será del 12-14% (demostrado con IFN pegilado 2a y 2b), y de un 38-53%% si el paciente era recidivante. Estos resultados son aceptables para pacientes recidivantes y no respondedores a monoterapia, pero son escasos para los no respondedores a tratamiento de combinación, para los cuales deben buscarse otras opciones. Para optimizar el tratamiento actual las alternativas pasan por utilizar dosis de IFN superiores a la estándar, una mayor duración del tratamiento o añadir fármacos al tratamiento previo.
Con el objetivo de mejorar las tasas de respuesta en los pacientes no respondedores a IFN estándar y ribavirina, se evaluó el uso de dosis más elevadas de IFN pegilado 2a en estos pacientes con genotipo 1 en un estudio piloto multicéntrico español37. Se incluyó a 72 pacientes que se aleatorizaron para recibir 180, 270 o 360 μg por semana de IFN pegilado 2a más ribavirina en dosis de 1.000- 1.200 mg/día durante las 12 primeras semanas (período de inducción), para seguir con dosis estándares hasta completar 48 semanas. Las RVS fueron del 38% en el grupo tratado con inducción de 360, del 30% en el grupo de 270 y del 18% en el de 180 μg. Los efectos adversos fueron similares en los 3 grupos (diferentes dosis) y no diferían de lo observado en la práctica habitual. Asimismo, fueron similares las reducciones de dosis. Otro aspecto destacable era que una no respuesta en la semana 12 suponía un 95% de posibilidades de no respuesta, por lo que podía establecerse una predicción clara en dicha semana. Así pues, la inducción durante 12 semanas con 360 μg de IFN pegilado 2a y ribavirina en dosis estándares podría suponer una opción para los pacientes no respondedores a la combinación estándar.
Otra posibilidad de mejorar los resultados es la utilización de dosis más elevadas de ribavirina, que se ha mostrado eficaz en los pacientes no tratados. Así, Lindahl et al33, en un estudio piloto con 10 pacientes, obtienen una RVS del 90% utilizando dosis dobles de ribavirina, lo que requería el uso de eritropoyetina y transfusiones para corregir la anemia. Esta alternativa no ha sido explorada en los no respondedores pero cabe tenerla en cuenta.
Actualmente, hay un grupo de pacientes no respondedores a IFN pegilado y ribavirina para los cuales no disponemos de opciones terapéuticas, salvo la participación en ensayos clínicos. El estudio REPEAT (RE-treatment with PEginterferon alfa-2a [40 kD] in pATients not responding to prior peginterferon alfa-2b [12 kD]/ribavirin combination therapy) de tratamiento con IFN pegilado 2a (en diferentes dosis) para pacientes no respondedores a IFN pegilado 2b, ha comunicado recientemente sus resultados38. Éstos mostraron que más que utilizar dosis de inducción de interferón, podía conseguirse una mejor RVS prolongando el tratamiento a 72 semanas. Así, se obtuvieron RVS del 7-16% en pacientes no respondedores a IFN pegilado 2b más ribavirina. El tratamiento de inducción también ha sido explorado con IFN de consenso diario en no respondedores a IFN pegilados, con respuestas del 6-11%39.
A pesar de estos datos alentadores, no parece que la inducción ni el cambiar de tipo de IFN pegilado en el retratamiento vaya a rescatar un número significativo de pacientes no respondedores, ya que sigue quedando un importante número de pacientes sin respuesta, con los cuales tenemos que esperar a nuevas generaciones de fármacos con las que conseguir un 100% de curaciones. Otros ensayos nos indican que no tendremos una opción diferente de IFN pegilado y ribavirina antes de 2010 en el mejor de los casos, por lo que el corto y medio plazo pasan por optimizar el tratamiento con IFN pegilado y ribavirina.
TERAPIAS DE MANTENIMIENTOEn los pacientes en que no se consigue la respuesta virológica ya se ha mencionado la posibilidad de tratamiento de mantenimiento para evitar la progresión de la fibrosis y, en definitiva, de la enfermedad, lo cual está basado en el hecho de que incluso en no respondedores se ha observado una regresión de la fibrosis. Este aspecto está siendo evaluado en los estudios HALT-C y EPIC, ya mencionados, y en un tercer estudio denominado COPILOT, diseñado a 4 años de terapia de mantenimiento (0,5 μg/kg/semana de IFN pegilado alfa-2b en un grupo comparado con otro grupo tratado con colchicina). Un análisis preliminar del estudio actualmente en marcha ha mostrado que el grupo tratado con IFN presenta menos eventos clínicos que el tratado con colchicina40. Esto ha hecho que en Francia se admita esta posibilidad de tratamiento de mantenimiento, y así lo recoge su conferencia de consenso acerca de la hepatitis C celebrada en París en 200241. El tratamiento antiviral parece que disminuye la presión portal y ésta podría ser la responsable de la disminución de los episodios de hemorragia digestiva encontrados en el estudio COPILOT.
Sin embargo, los resultados preliminares del estudio HALT-C, comunicados en el Congreso de la Asociación Americana para el estudio de las Enfermedades del Hígado de 2007, no han mostrado que el tratamiento de mantenimiento con IFN reduzca la tasa de progresión de la enfermedad42. También se ha evaluado la terapia de mantenimiento con ribavirina en pacientes no respondedores a la combinación de IFN alfa y ribavirina. En un estudio reciente de Hoofnagle et al43, realizado en 17 pacientes no respondedores a los que se les mantuvo monoterapia con ribavirina, éstos mostraron mejoría en la ALT y en la necroinflamación en la biopsia, sin que se observara cambios en la carga viral C ni en la fibrosis, lo que indica la necesidad de más estudios para evaluar una posible acción beneficiosa de la ribavirina, que probablemente sería necesario asociarla a algún otro inmunomodulador44.
PERSPECTIVAS DE NUEVOS TRATAMIENTOSNo disponemos por el momento de opciones diferentes de IFN pegilado y la ribavirina para erradicar el virus de la hepatitis C, si bien hay un gran número de sustancias en fase I-Il que están siendo ensayadas y de las que aportaremos algunos datos. El BLN 2061 es un inhibidor de la NS3 serinproteasa que reduce la carga viral de forma significativa administrado durante 48 h en 2 dosis diarias en pacientes con genotipo 145, si bien ha mostrado efectos adversos que han frenado su desarrollo.
La valopicitabina ha mostrado que en combinación con IFN pegilado en una dosis óptima produce una mayor supresión viral que la combinación de IFN pegilado más ribavirina, y la eficacia antiviral es proporcional a Ia dosis de valopicitabina46. El desarrollo de esta sustancia ha sido recientemente suspendido por presentar efectos secundarios, como la pancreatitis aguda.
EI VX-950 es un inhibidor de la proteasa del VHC que ha mostrado una gran eficacia antiviral en combinación con IFN pegilado 2a47. Su administración en monoterapia, al igual que otras sustancias de este tipo, induce mutantes resistentes que afortunadamente son sensibles a la combinación de IFN pegilado y ribavirina48, lo que pone de manifiesto que el tratamiento futuro de la hepatitis C será, con mucha probabilidad, una triple combinación.
El boceprevir es un inhibidor de la proteasa que, en combinación con interferón pegilado 2b, ha mostrado una eficacia antiviral en el tratamiento de los pacientes con genotipo 1 no respondedores a IFN pegilado alfa-2b49 y también en pacientes no tratados.
El R1626, un inhibidor de la polimerasa VHC análogo de nucleósido, ha mostrado una importante reducción de la carga viral. Se está estudiando en fase II la dosis y la seguridad de R1626 en combinación con IFN pegilado alfa- 2a y ribavirina50.
Otros ensayos nos indican que no tendremos una opción diferente del IFN pegilado y la ribavirina antes de 2010 en el mejor de los casos, por lo que queda claro que los inhibidores de la polimerasa y la proteasa deberán administrarse en una triple terapia asociándose a IFN pegilado y ribavirina, por los problemas de resistencias y de eficacia.
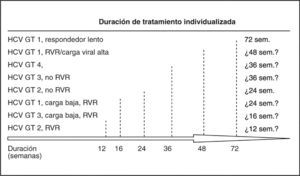
Por todo ello, el tratamiento de la hepatitis C actualmente y a medio plazo (3-5 años) para los pacientes previamente no tratados pasa por el uso de IFN pegilado y ribavirina, optimizando el tratamiento y haciéndolo a medida según la cinética viral (fig. 5) según un estricto cumplimiento del tratamiento. Para los pacientes no respondedores a tratamientos previos una actitud de observación y seguimiento a la espera de nuevos fármacos parece la más adecuada, si el tratamiento previo se llevó a cabo correctamente y no hay factores corregibles en el paciente que puedan determinar una mayor RVS. En cuanto al tratamiento de mantenimiento, no tenemos datos concluyentes acerca de su posible beneficio.