INTRODUCCION
La hepatitis crónica B (HCB) es un grave problema de salud en el mundo. Es una de las primeras causas de cirrosis hepática y carcinoma hepatocelular, sobre todo en regiones de Asia y el Pacífico1. En la actualidad sólo 3 medicamentos han sido aprobados por la Food and Drug Administration (FDA) para el tratamiento de la infección crónica por el virus de la hepatitis B (VHB). Entre los medicamentos aprobados se encuentran el interferón alfa, el cual se asocia a un gran número de eventos adversos que afectan de forma notable la calidad de vida del paciente y limitan su uso, y 2 nuevos antivirales: la lamivudina, que requiere utilizarse durante largos períodos y se asocia con el desarrollo de mutantes resistentes al tratamiento antiviral, y el adefovir dipivoxil, que ha demostrado ser efectivo no sólo para el virus salvaje, sino también para las mutantes que se derivan del tratamiento con lamivudina a largo plazo1,2. Sin embargo, la eficacia antiviral de estos fármacos está limitada por los bajos porcentajes de seroconversión del antígeno e del virus de la hepatitis B (HBeAg) que no sobrepasan el 40%3-5. La combinación de antivirales e inmunomoduladores ha sido evaluada en la práctica clínica. La combinación de ambos puede tener efectos biológicos aditivos y sinérgicos sobre el control de la replicación viral, así como en el aclaramiento de la fracción ADNccc-VHB que explica la recidiva de muchas de las infecciones. A pesar de que estas combinaciones parecen muy superiores desde el punto de vista biológico, los resultados en la práctica clínica han sido algo contradictorios. Los resultados de la combinación de interferón más lamivudina no han mostrado diferencias significativas en las tasas de seroconversión del HBeAg comparado con la administración de lamivudina en monoterapia6.
La terapia de inmunosupresión con esteroides, previa a la administración de interferón o lamivudina, se ha evaluado en ensayos clínicos7,8. Los resultados han demostrado un 30-60% de seroconversión del HBeAg, sobre todo en pacientes con una notable elevación de las transaminasas después de la suspensión del esteroide.
Perrillo et al9 han encontrado que la administración de prednisona 6 semanas antes del interferón es más efectiva que el interferón en monoterapia, sobre todo en pacientes con valores de alanina transferasa (ALT) normales o discretamente elevados.
Liaw et al8 han presentado recientemente los resultados de un estudio en que evalúan un esquema de tratamiento inicial con prednisona seguido de lamivudina durante 52 semanas, en pacientes con HCB HBeAg positivo. Estos autores encontraron que en el 67% de los casos se produjo un rebote de ALT, lo que refleja activación del sistema inmune secundario a la suspensión del esteroide. La seroconversión del HBeAg y aclaramiento del ADN en suero, determinado por hibridación directa, fueron observados en el 60% de los pacientes tratados con inmunosupresión previa.
Estos hallazgos sugieren que la manipulación de la respuesta del sistema inmune contra el virus, en combinación secuencial con antivirales o inmunomoduladores, puede mejorar la respuesta al tratamiento.
La introducción del interferón en la terapia de combinación con lamivudina, previa inmunosupresión con prednisona, podría modular la respuesta inmune hacia el incremento del aclaramiento viral. Éste actuaría potenciando la acción inmunomoduladora propiciada por la reactivación del sistema inmune secundaria a la supresión brusca del esteroide, lo que permitiría inferir una mayor tasa de aclaramiento viral, dado por el incremento de la actividad citotóxica sobre los hepatocitos infectados. Este efecto podría ser más beneficioso en pacientes con una escasa respuesta inmunológica contra el virus, especialmente en los que presentan valores bajos de aminotransferasa.
La espectacular respuesta observada con la inmunosupresión previa a la administración de lamivudina o interferón nos condujo a diseñar un estudio piloto para evaluar la eficacia y la seguridad de una combinación secuencial con prednisona, previa a la administración de lamivudina e interferón alfa-2b, comparado con una combinación de lamivudina e interferón alfa-2b, en pacientes con HCB y HBeAg positivo.
MÉTODOS
Diseño del estudio
Se realizó un estudio piloto, aleatorizado, controlado y paralelo con evaluación de los resultados a ciegas para el investigador. Se reclutó a 44 pacientes con HCB y HBeAg positivo, provenientes de la consulta de Hepatología del Instituto Nacional de Gastroenterología de La Habana (Cuba). Los pacientes fueron aleatorizados en 2 grupos de 22 pacientes cada uno. A un grupo se le administró prednisona en dosis de 40 mg diarios durante 4 semanas, seguido de 2 semanas sin tratamiento, después se suministró lamivudina, 150 mg diarios durante 4 semanas, y a continuación se asoció a ésta el interferón alfa-2b recombinante (Heberón®, CIGB, Cuba), en dosis de 10 MU en días alternos y durante 24 semanas. A partir de este momento se continuó con lamivudina en monoterapia en la misma dosis hasta completar las 58 semanas de tratamiento. Al otro grupo se le administró lamivudina 150 mg diarios durante las primeras 4 semanas. Luego se mantuvo lamivudina asociada a interferón alfa-2b, 10 MU, en días alternos y durante 24 semanas, momento en que se suspendió el interferón y se continuó con lamivudina hasta alcanzar la semana 52. Ambos grupos de pacientes continuaron el tratamiento con lamivudina después de concluir la terapia de combinación y hasta el final del tratamiento, independiente de alcanzar o no la seroconversión del HBeAg. El tratamiento fue interrumpido en los pacientes en que se alcanzó negatividad del antígeno de superficie asociado a su seroconversión.
El estudio ha sido conformado de acuerdo con los propósitos éticos de la declaración de Helsinki de 1995, además de ser aprobado a priori por el comité científico y de ética médica de nuestra institución. Todos los pacientes rellenaron por escrito el consentimiento informado.
Selección de pacientes
Se seleccionó a los pacientes entre 18 y 65 años con HCB, HBeAg positivo, sin antecedentes de tratamientos previos o no respondedores al interferón. La hepatitis crónica fue definida por la presencia del antígeno de superficie del virus de la hepatitis B (HBsAg), unos valores séricos de ADN-VHB superiores a 100.000 copias/ml, valores séricos de ALT persistentemente elevados y biopsia hepática compatible con hepatitis crónica. Las biopsias fueron evaluadas a ciegas por un patólogo, quien desconocía la asignación de los pacientes.
Se definieron los siguientes criterios de exclusión: evidencia clínica o humoral de enfermedad hepática descompensada, coinfección por el virus de la inmunodeficiencia humana (VIH), virus de la hepatitis C (VHC) o el virus de la hepatitis D (VHD), historia activa de ingestión de alcohol, drogodependencia, otras causas de hepatopatías, enfermedades sistémicas graves que no pudieron ser controladas con tratamiento médico, enfermedades neuropsiquiátricas, antecedentes de tratamiento antiviral o inmunomodulador en los últimos 6 meses antes de comenzar el estudio, valores de alfafetoproteína superiores a 50 ng/ml, embarazo o lactancia, pacientes con contraindicaciones absolutas al consumo de esteroides, alergia conocida a algunos de los fármacos utilizados, recuento de células blancas ¾ 3.000 µl, de granulocitos ¾ 1.500 µl y de plaquetas ¾ 100.000 µl.
Seguimiento durante el estudio
Los pacientes fueron evaluados desde el punto de vista clínico (interrogatorio y examen físico) y a través de estudios humorales (exámenes para medir el perfil bioquímico y hematológico) antes de comenzar el tratamiento y cada 4 semanas hasta concluir el período de seguimiento. Se interrogó sobre la aparición de reacciones adversas durante el transcurso del ensayo clínico. Los estudios virológicos (HBeAg, anti-HBe, HBsAg, anti-HBs y cuantificación del ADN-VHB en suero [Roche Amplicor Monitor PCR assay, con límite mínimo de detección de 1.000 copias/ml]) fueron realizados al inicio, a las 24 semanas, al final del tratamiento y 24 semanas después de concluido. El análisis histológico fue realizado al inicio y 24 semanas después de concluir la administración de los fármacos.
Criterios que miden la eficacia del tratamiento (end point)
Eficacia primaria
Se consideró un tratamiento eficaz si se logró alcanzar la combinación de seroconversión del HBeAg (HBeAg negativo/anti-HBe positivo) y disminución de los valores de ADN-VHB en suero inferior a 105 copias/ml, 24 semanas después de concluido el tratamiento (respuesta virológica sostenida).
Eficacia secundaria
Ésta incluyó la normalización de los valores de ALT y la mejoría histológica, definida como la reducción en al menos 2 puntos en el índice de actividad histológica (IAH) modificado de Ishak, 24 semanas después de finalizar el tratamiento.
Los resultados del análisis histológico al finalizar el período de seguimiento se compararon con los iniciales y fueron clasificados en mejoría (definido anteriormente), progresión (incremento de, al menos 2, puntos en la actividad necroinflamatoria y 1 punto en la fibrosis) y sin cambios histológicos.
Seguridad (reacciones adversas)
En el análisis de seguridad se incluyó a todos los pacientes que recibieron al menos una dosis de los medicamentos y los eventos adversos producidos durante el tratamiento y 8 semanas después de concluirlo. La gravedad de los eventos adversos y de las alteraciones en los análisis de laboratorio (bioquímico y hematológico) fue establecida según los criterios de toxicidad del Instituto Nacional de Alergia y Enfermedades Infecciosas10.
Análisis estadístico
En el diseño del estudio se tuvo en cuenta a 40 pacientes (20 en cada grupo). Dicho cálculo de muestra estuvo basado en un poder del 90% para detectar una diferencia absoluta del 46% (el 29% para la terapia lamivudina e interferón y el 75% para el grupo de inmunosupresión previa), con un error tipo I de 0,05 y tipo II de 0,10. Consideramos además un 10% de pérdidas por reacciones adversas, violaciones y abandonos, lo que obligó a calcular la muestra ajustada a las pérdidas (MAP) según la siguiente formulación: n (1/1 r), donde r es el número de pérdidas calculado en porcentaje. La muestra total ajustada fue de 44 pacientes.
Todos los pacientes incluidos en el estudio que tomaron al menos una dosis de los medicamentos fueron considerados para el análisis estadístico (análisis por intención de tratar). Los pacientes que no terminaron la investigación fueron considerados como no respondedores al tratamiento. Los resultados obtenidos se analizaron mediante la prueba exacta de Fisher con un nivel de significación alfa de 0,05. La relación entre algunas variables pretratamiento y la respuesta virológica sostenida observada se examinó mediante la prueba estratificada de Cochran-Mantel Haenszel. Todos los valores de p fueron bilaterales.
RESULTADOS
Características de los pacientes
Un total de 60 pacientes fueron evaluados desde febrero de 2001 hasta marzo de 2002, y 44 de ellos fueron asignados aleatoriamente al estudio. De los 6 pacientes aleatorizados que abandonaron el estudio (3 de cada grupo), en 4 (9%) se debió a la aparición de eventos adversos y en 2 (4,5%) a la pérdida del seguimiento; 38 (86%) de los casos completaron el período de seguimiento de 24 semanas. No hubo diferencias significativas en las características basales entre ambos grupos (tabla I). Sólo el estadio de fibrosis y los valores de ALT presentaron diferencias muy pequeñas, que no fueron estadísticamente significativas.
Respuesta virológica
La seroconversión del HBeAg más disminución del ADN-VHB < 105 copias/ml fue observada en el 68% de los pacientes (15 de 22) del grupo de inmunosupresión previa (PLI), comparado con el grupo control, que fue del 54% (intervalo de confianza [IC] del 95%, 0,45-7,33; p = 0,26). Las tasas de seroconversión del HBeAg en las semanas 24 y 48 del tratamiento fueron similares para ambos grupos (el 68 frente al 77%); 15 pacientes de cada grupo (68%) habían alcanzado la seroconversión del HBeAg al finalizar el período del tratamiento combinado.
Al finalizar el tratamiento combinado (24 y 30 semanas), 15 pacientes (65%) de cada grupo mostraron valores de ADN-VHB en suero inferiores al límite de detección < 1.000 copias/ml. De la misma manera, al finalizar el tratamiento, 17 pacientes (74%) de ambos grupos habían logrado negativizar el ADN-VHB en suero.
Seis pacientes (27%) en el grupo sin inmunosupresión (LI) y 3 (14%) en el PLI lograron aclarar el HBsAg 24 semanas después de concluir el estudio (IC del 95%, 0,51-11,05; p = 0,26). Tres de 6 (50%) lograron seroconversión del HBsAg (aparición del anticuerpo contra el HBsAg) en el grupo LI frente a 3 pacientes (100%) del grupo PLI. Los datos sobre la respuesta virológica están resumidos en la tabla II.
Variables asociadas a la respuesta virológica sostenida
Un análisis estratificado de Mantel-Haenzsel reveló una mínima asociación estadística entre la respuesta virológica sostenida (RVS) y un grupo de variables pretratamiento, aunque algunas diferencias en porcentajes fueron clínicamente significativas (tabla III).
Respuesta bioquímica
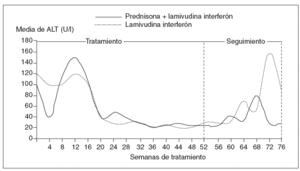
Al finalizar la semana 24 del período de seguimiento no hubo diferencias significativas en la normalización de las ALT entre ambos grupos (el 59% para el grupo de prednisona y el 55% para el grupo control). En las primeras 16 semanas del tratamiento se observó un brusco incremento de los valores de ALT, 5 veces sobre el valor normal (SVN), en 5 (23%) de los pacientes tratados con interferón y lamivudina frente a 11 (50%) de los tratados con PLI (p = 0,05); 5 de 7 pacientes (71%) en el grupo de PLI, que experimentaron cifras elevadas de ALT > 5 veces SVN, lograron la seroconversión. Algo similar ocurrió en 4 de 5 pacientes (80%) del grupo control. En un elevado número de casos se observó un incremento de los valores de ALT, de al menos 2 veces SVN (el 73% en el grupo PLI, y el 64% en el grupo LI). De los 16 casos del grupo PLI y 14 del grupo LI, en que se evidenció un incremento de los valores de ALT 2 veces SVN, 12 (75%) y 9 (65%) lograron la seroconversión del HBeAg, respectivamente. Entre los pacientes que presentaron notables elevaciones de aminotransferasa, 3 de 3 (100%) del grupo PLI y 4 de 5 (80%) del grupo LI alcanzaron la seroconversión.
Similares elevaciones de transaminasa fueron observadas durante la etapa de seguimiento. Dichas exacerbaciones se produjeron en 2 (9%) y 7 (32%) de los casos tratados con y sin inmunosupresión, respectivamente (p = 0,06). La respuesta bioquímica se resume en la figura 1.
Fig. 1. Concentraciones medias de alanina transferasa (ALT) durante el tratamiento y el período de seguimiento. Comparación entre ambos grupos.
Respuesta histológica
El análisis de la respuesta histológica se realizó 24 semanas después de concluir el tratamiento. Incluyó un total de 30 (14 [LI] y 16 [PLI]) pacientes (el 68% de la muestra). En 7 pacientes no se pudo realizar la biopsia al final del estudio (6 de ellos por abandono del estudio y uno por no desearlo), y en 4 la muestra de tejido hepático fue insuficiente para el análisis. La mejoría en el índice de actividad histológica (IAH), definido por la reducción de al menos 2 puntos, sin empeoramiento de la fibrosis, fue observada en el 45% (10/22) de los pacientes del grupo de PLI frente al 23% (5/22) del grupo LI (p = 0,10). Además del análisis del IAH, la respuesta histológica fue evaluada de forma independiente para la inflamación y la fibrosis (sólo en las biopsias pareadas). La mejoría en la inflamación, definida como una disminución de al menos 2 puntos, fue del 45% (10/22) para el grupo PLI y del 23% (5/22) para el grupo LI (p = 0,10). Se observó una mejoría en la fibrosis en 11 de 22 (50%) y en 5 de 22 (23%) para el grupo PLI y LI, respectivamente (p = 0,05) (fig. 2).
Fig. 2. Comparación de la respuesta histológica* entre ambos grupos.
*La respuesta histológica fue evaluada para la actividad necroinflamatoria y fibrosis mediante la puntuación de Ishak et al28, que fue dividida en mejoría, estabilidad o progresión de la enfermedad.
Eventos adversos
La frecuencia de eventos adversos clínicos y de laboratorio se resume en la tabla IV. Sólo se comunicó un evento adverso grave (requirió hospitalización) en el grupo LI, que correspondió con un síndrome de Guillain-Barré. No hubo muertes durante el estudio. Los eventos más frecuentes fueron los síntomas dependientes del síndrome seudogripal (astenia, fatiga y fiebre) y los neuropsiquiátricos (irritabilidad, insomnio y depresión), que fueron similares en ambos grupos. La presencia de dolor epigástrico se observó en el 20% de los casos tratados con prednisona frente a sólo el 5% del grupo control, aunque su frecuencia fue similar después de suspendido el esteroide. No se comunicó la presencia de descompensación hepática en ningún paciente. Las anormalidades de los resultados de laboratorio, como la anemia, la trombocitopenia y la neutropenia se indicaron como ligeras, y su frecuencia de aparición fue similar en ambos grupos tratados. Dos pacientes de cada grupo fueron separados del estudio por presentar reacciones adversas. Las causas del abandono del tratamiento fueron: reacciones adversas de moderada intensidad en el grupo con inmunosupresión, y una reacción adversa grave (Guillain-Barré) y una moderada en el grupo sin inmunosupresión. En sólo 2 pacientes (uno de cada grupo) hubo necesidad de reducir o ajustar las dosis del interferón por presentar una notable trombocitopenia.
DISCUSION
La introducción en los últimos años de recursos tecnológicos que permiten un mejor seguimiento serológico del VHB, así como el advenimiento de nuevos fármacos antivirales e inmunomoduladores, han marcado pautas muy importantes sobre nuevas estrategias de tratamiento. El objetivo fundamental en el seguimiento de la respuesta al tratamiento en la HCB con HBeAg positivo es la seroconversión del antígeno e, algo que se logra en un reducido número de pacientes con los esquemas actuales de tratamiento1. Las tasas de seroconversión alcanzadas con el empleo de los actuales antivirales varían entre el 15 y el 40%, incluso cuando se emplea la terapia de combinación11. Recientemente, el interferón pegilado se ha evaluado en el tratamiento de la HCB12,13. Los resultados demuestran que las tasas de seroconversión alcanzadas con peginterferón en monoterapia son similares o superiores a la lamivudina, al interferón convencional e incluso a la combinación de peginterferón más lamivudina; aunque el mayor porcentaje conseguido no sobrepasa el 32% (peginterferón).
Una alternativa de tratamiento para la infección crónica por el VHB ha constituido la inducción de un breve período de inmunosupresión antes de la administración de un inmunomodulador o antiviral. Durante la supresión farmacológica con esteroides se produce un estadio de «calma» en la respuesta inmune contra el virus, que va asociado a una normalización de las aminotransferasa y un incremento de los valores de ADN séricos. Al suspender el esteroide se genera un rebote inmunológico (readaptación del sistema inmune) que explica el incremento brusco de las concentraciones de ALT y el descenso de los valores de ADN14,15.
En nuestro estudio los porcentajes de seroconversión del antígeno e fueron muy altos en ambos grupos (el 68% para el grupo con inmunosupresión frente al 54% para el de interferón más lamivudina) frente a los registrados por otros estudios4-6. Quizás estos elevados porcentajes de seroconversión podrían explicarse en parte por algunos de los siguientes factores: la naturaleza u origen de la infección es bien conocida la escasa respuesta al tratamiento que tienen los pacientes que adquieren la infección en el período perinatal (no hubo ningún caso en el estudio; todos contrajeron la infección por vía sexual o parenteral) y la elevada proporción de pacientes (el 41% del grupo PLI y el 45% del grupo LI) con valores de ALT 3 veces SVN, en el que la respuesta al tratamiento es superior16. Otro factor contribuyente podría ser la administración continua de lamivudina hasta el final de tratamiento. Ésta se suministró durante todo el período de tratamiento, independientemente del aclaramiento y/o seroconversión o no del HBeAg. Treinta de 44 pacientes (68%) lograron la seroconversión en los primeros 6 meses de la terapia.
Recientemente, se ha sugerido que la extensión del tratamiento con lamivudina, después de alcanzar la seroconversión del HBeAg, evita recaídas al finalizar el tratamiento17.
Otro factor que puede influir teóricamente en las elevadas tasas de seroconversión es la administración de lamivudina 4 semanas antes del tratamiento combinado; sin embargo, en la práctica no hay sustento para esta teoría, pues los estudios con esta modalidad de tratamiento18,19, así como los ensayos en que el tratamiento combinado se establece al inicio, han logrado similares tasas de eficacia antiviral20,21.
No hubo diferencias estadísticas significativas en las tasas de seroconversión del HBeAg, ni en las pérdidas del HBsAg entre ambos grupos, aunque en el grupo de inmunosupresión la seroconversión clínica del HBeAg fue un 14% superior. Estos resultados deben analizarse con mucha cautela por el pequeño tamaño de la muestra y por el carácter piloto del estudio. Este último aspecto ha sido una limitación notable para el análisis de los resultados.
Aunque el análisis estratificado de Mantel-Haenszel reveló una escasa asociación estadística entre el porcentaje de seroconversión del HBeAg y algunas variables pretratamiento, la ausencia de tratamiento previo, los valores de ALT < 3 veces SVN y la ausencia de una fibrosis significativa o cirrosis reveló una superioridad clínica en el grupo de inmunosupresión previa con esteroides. Los resultados del análisis estratificado deben considerarse con cautela por el pequeño tamaño de la muestra, lo que atribuye una disminución del poder estadístico al analizar los subgrupos.
Numerosos ensayos indican una fuerte asociación entre los valores de ALT pretratamiento y la respuesta al tratamiento antiviral, inmunomodulador o la combinación de ambos9,16,19,22.
Los resultados con el empleo de interferón, lamivudina o la combinación de ambos indican que la seroconversión del HBeAg se incrementa a medida que los valores de ALT son más elevados antes de comenzar el tratamiento. Sin embargo, cuando los valores de ALT se encuentran dentro de la normalidad o discretamente elevados, la respuesta virológica no sobrepasa el 20%. Nuestros resultados indican que la RVS fue alta en este grupo de pacientes, ya que en el grupo de inmunosupresión previa la seroconversión fue un 27% superior al grupo control. Dichos resultados, a pesar de no ser estadísticamente significativos, demostraron que la supresión brusca del esteroide seguido por una terapia inmunomoduladora y antiviral puede aportar beneficios clínicos para este subgrupo de pacientes.
Desde el punto de vista biológico, hay algunas razones que podrían explicar el mecanismo por el cual el esteroide ejerce su acción inmunomoduladora. Recientemente, se ha comunicado que el genoma viral del VHB contiene sitios de respuesta al esteroide, que son responsables del grado de replicación viral y de una producción aumentada de transcriptos virales (antígenos de la nucleocápside)23,24. Estos antígenos de la nucleocápside (péptidos del core) se localizan en la superficie de los hepatocitos infectados. En este sitio, se unen a las moléculas del sistema de histocompatibilidad (HLA) de clase I que sirven como dianas para la respuesta de los linfocitos T citotóxicos. Al efecto anterior se suma la inmnomodulación que produce el interferón en la respuesta inmune celular (predominantemente citotóxica), que potencia el efecto endógeno de los interferones naturales.
La supresión viral sostenida y la mejoría o prevención de la progresión de la fibrosis son las estrategias más usuales de tratamiento25. Este último razonamiento sitúa al análisis histológico como uno de los objetivos más importantes, sobre todo en los pacientes que no logran el aclaramiento viral sostenido.
La evaluación de la respuesta histológica en nuestro estudio demostró una clara evidencia de mejoría en el IAH para el grupo con inmunosupresión previa (el 45% en el grupo PLI frente al 23% en el grupo LI) cuando se compararon las biopsias antes y después del tratamiento. La diferencia, aunque no estadísticamente significativa, fue clínicamente superior en el 22% para la inflamación y el 27% para la fibrosis.
Los resultados de evaluación histológica en los ensayos clínicos con lamivudina, interferón o la combinación de ambos han sido muy discutidos y contradictorios. En general, hay gran disparidad o heterogeneidad en los análisis histológicos de los estudios, que impide extrapolar los resultados de un ensayo a otro.
Algunos de los ensayos clínicos realizados con lamivudina han comunicado altas tasas de mejoría (el 52 y el 56%) y bajos porcentajes de progresión (el 0 y el 5%) en el IAH26,27. Algo diferente ha sucedido con el interferón en monoterapia y la terapia de combinación: se han comunicado tasas más bajas de mejoría histológica (el 46% para el interferón y el 37% para la combinación de interferón más lamivudina) y porcentajes más altos de empeoramiento del IAH (el 30% para la terapia de combinación de interferón más lamivudina y el 31% para interferón en monoterapia)19. Estas observaciones concuerdan con los resultados de nuestro estudio en el grupo control, no así en el grupo con previa administración de esteroides, en que tanto la mejoría de la inflamación como de la fibrosis fue superior.
La tolerancia y la seguridad de los fármacos utilizados en ambos grupos fue, en general, satisfactoria. Sólo se observó un evento adverso inesperado, un síndrome de Guillain-Barré, el cual al parecer coincidió con una respuesta inmune exagerada, dada por la presencia de cifras muy elevadas de aminotransferasa (> 30 veces SVN). En general, la presultados de este ensayo clínico piloto sugieren que, a pesar de no haber diferencias estadísticas significativas, la terapia de combinación de interferón más lamivudina previa inmunosupresión con esteroides mostró una superioridad clínica, en cuanto a seroconversión del antígeno e y mejoría histológica, cuando se comparó con el grupo sin inmunosupresión. Obviamente, estos resultados tienen que analizarse con cautela y deberán ser confirmados a través de otros ensayos clínicos controlados, antes de ser recomendados para su uso en la práctica clínica diaria. La inmunosupresión, previa administración de antivirales o inmunomoduladores, continúa siendo una estrategia interesante para futuras investigaciones.