El tratamiento de la reservoritis es un escenario complejo que requiere una estrecha colaboración médico-quirúrgica. El tratamiento de elección de la reservoritis aguda es el ciprofloxacino o el metronidazol. Ante un primer episodio de reservoritis se recomienda la profilaxis de recidiva con una mezcla de probióticos; sin embargo, no está tan clara su utilidad como profilaxis primaria para prevenir un primer episodio de reservoritis tras la cirugía. El tratamiento de la reservoritis crónica refractaria debe iniciarse con una combinación de antibióticos, y si esta fracasa el siguiente escalón terapéutico es la budesonida oral. Algunas formas refractarias necesitarán terapias biológicas, siendo los anti-TNF α la primera opción, reservándose otros biológicos para pacientes refractarios. La ileostomía definitiva puede ser una opción final en los pacientes más graves.
Pouchitis treatment is a complex entity that requires a close medical and surgical relationship. The elective treatment for acute pouchitis is antibiotics. After a first episode of pouchitis it is recommended prophylaxis therapy with a probiotic mix, nevertheless it is not clear the use of this formulation for preventing a first episode of pouchitis after surgery. First-line treatment for chronic pouchitis is an antibiotic combination. The next step in treatment should be oral budesonide. Selected cases of severe, chronic refractory pouchitis may benefit from biologic agents, and anti-TNF α should be recommended as the first option, leaving the new biologicals for multi-refractory patients. Permanent ileostomy may be an option in severe refractory cases to medical treatment.
El tratamiento de la reservoritis, especialmente de la reservoritis crónica, es uno de los escenarios más complejos de la enfermedad inflamatoria intestinal. En primer lugar, por la falta de estudios controlados dado el escaso número y la heterogeneidad de los pacientes con esta entidad. Por otra parte, algunos pacientes ya han recibido tratamientos previamente a la cirugía, lo cual puede condicionar la elección terapéutica en el caso de desarrollar una reservoritis crónica. Por lo tanto, debido a esta complejidad y su frecuencia elevada, es lógico que se hayan planteado además del tratamiento, posibles estrategias de prevención de esta entidad. Este documento recoge las recomendaciones sobre el tratamiento y prevención de esta complicación, como continuación del documento previo sobre su epidemiología, diagnóstico y pronóstico1.
¿Se puede prevenir un primer episodio de reservoritis?Dado el alto riesgo de aparición de reservoritis en los pacientes con colitis ulcerosa (CU) intervenidos mediante la realización de un reservorio ileoanal (riesgo del 40-50% a los 10 años de la intervención2,3), es necesario plantear actitudes preventivas que eviten en lo posible la aparición de esta complicación4. Existen diversos estudios que han valorado la eficacia de distintos tratamientos en este escenario clínico.
El único estudio de alta calidad metodológica realizado es el liderado por Gionchetti y publicado en el año 20035. En dicho ensayo se aleatorizó, a pacientes en los que se había realizado un reservorio, a recibir tratamiento con una mezcla de cepas probióticas, en su momento conocida como formulación de De Simone 3g/día o placebo, una vez había transcurrido una semana desde el cierre de la ileostomía. Un total de 20 pacientes recibieron tratamiento con la fórmula probiótica y 20 con placebo. Hubo una diferencia estadísticamente significativa en la aparición de reservoritis al cabo de 12 meses entre el grupo que recibió tratamiento con la mezcla probiótica (2/20, 10%) frente al grupo que recibió tratamiento con placebo (8/20, 40%; riesgo relativo [RR] 1,5; intervalo de confianza [IC] 95% 1,02-2,1).
Es importante en este punto aclarar la posible confusión que hay en la actualidad por la existencia de más de un producto en el mercado apelando a los estudios originales para esta indicación. Todos los estudios en reservoritis fueron realizados con la «antigua» formulación de De Simone que es una mezcla de cepas probióticas que contiene una alta concentración de bacterias (300.000 millones/g) de un conjunto de 8 especies bacterianas distintas: 4 cepas de Lactobacillus (L. casei, L. plantarum, L. acidophilus y L. delbrueckii subesp. bulgaricus), 3 de Bifidobacterium (B. longum, B. breve y B. infantis) y una de Streptococcusthermophilus. La mezcla está ya fuera de patente, de modo que puede fabricarse y distribuirse libremente. Existe disputa en cuanto a la calidad del producto final producido por los distintos fabricantes6, pero no hay evidencia independiente y sólida que demuestre diferencias en cuanto a su eficacia clínica. Este tratamiento tiene el inconveniente de no estar financiado en nuestro sistema público de salud, pudiendo suponer una carga económica significativa su uso a largo plazo para los pacientes.
Cabe destacar que otro estudio (abierto y aleatorizado) realizado también con el mismo producto no encontrara diferencias en la tasa de aparición de reservoritis al cabo de 12 meses, comparado con un grupo de pacientes que no recibió tratamiento7. No hubo ningún caso de reservoritis en el grupo tratado con la mezcla probiótica (0/16, 0%) frente a solo un caso en el grupo sin tratamiento (1/12, 8%; RR 1,10; IC 95% 0,89-1,36).
En otro estudio, aleatorizado y doble ciego, publicado solo en forma de abstract8, se estudió en 12 pacientes la eficacia de los probióticos (en este caso con Bifidobacterium longum BB-536 frente a placebo) y se valoró como objetivo primario el Pouchitis Disease Activity Index (PDAI) tras 6 meses de tratamiento. No hubo diferencias en la proporción de pacientes que presentaron un episodio de reservoritis aguda durante los 6 meses de seguimiento (1/7, 14% vs. 2/5, 40% en el grupo de tratamiento y en el grupo placebo, respectivamente; RR 1,43; IC 95% 0,66-3,11).
En un análisis retrospectivo de una serie histórica unicéntrica, se estudió, comparando con una cohorte histórica, el efecto de la administración del probiótico Lactobacillus rhamnosus GC (una cepa bacteriana usada como probiótico en diversas enfermedades digestivas) sobre la evolución clínica tras la realización de un reservorio ileoanal en pacientes con CU9. El riesgo acumulado de desarrollo de reservoritis en los pacientes que recibieron el tratamiento con probiótico fue del 7% a los 3 años frente al 29% en los que no lo habían recibido (p=0,011).
Un estudio japonés, aleatorizado pero con un número limitado de pacientes (n=17), comparó Clostridium butyricum MIYAIRI con placebo10. Tras un seguimiento de 24 meses, el 11% (1/9) de los pacientes tratados con Clostridium butyricum MIYAIRI y el 50% (4/8) de los participantes tratados con placebo desarrollaron reservoritis aguda (RR 0,22; IC 95% 0,03-1,6).
Con el resto de fármacos evaluados, no se ha demostrado la eficacia del alopurinol11 ni el tinidazol (este último valorado en un estudio publicado solo en forma de abstract)12 en el escenario de la prevención del primer episodio de reservoritis en pacientes con CU intervenidos. Recientemente se ha publicado un estudio retrospectivo, de baja calidad metodológica, donde el empleo de sulfasalazina (a dosis de 2g/día) parece ofrecer protección frente al desarrollo de la reservoritis13. De todas formas, estos datos deben ser tomados con cautela mientras no sean validados por ensayos clínicos aleatorizados que los apoyen.
Recomendamos que el único tratamiento que podría ser eficaz para la prevención de la reservoritis es la mezcla probiótica utilizada en los estudios originales. No obstante, debemos ser cautos respecto de la solidez de los datos que sustentan este tratamiento, ya que el número de pacientes incluido en el estudio de mayor calidad metodológica es muy bajo, siendo también escaso el número de casos de reservoritis descrito en dicho ensayo. Además, ningún ensayo posterior de calidad ha replicado dichos hallazgos. Por lo tanto, no podemos recomendar su uso generalizado en todos los pacientes operados para la prevención de la reservoritis.
¿Cómo tratamos la reservoritis aguda?Los antibióticos son el tratamiento más empleado de primera línea, siendo efectivos hasta en el 78% de los pacientes14. En pacientes con reservorio ileoanal en los que se sospecha un primer brote de reservoritis, tras descartar sobreinfección en un coprocultivo, se puede indicar una pauta empírica de antibióticos con ciprofloxacino o metronidazol sin ser obligatorio, aunque sí recomendable si se dispone sin demora, realizar una endoscopia con toma de biopsias, ya que la mayoría de los pacientes mostrarán una respuesta rápidamente15.
El primer ensayo clínico fue realizado en 13 pacientes y fue un estudio doble ciego con un diseño cruzado en el cual se comparaba la eficacia de 400mg de metronidazol 3 veces al día vs. placebo durante 2 semanas16. El metronidazol fue más efectivo que el placebo en reducción del número de deposiciones (73 vs. 9%; p<0,05). Sin embargo, hasta un 55% de los pacientes presentaron efectos secundarios, siendo la disgeusia y las náuseas los más frecuentes.
En un ensayo clínico aleatorizado donde se incluyeron 16 pacientes, se ha mostrado una mayor eficacia del ciprofloxacino (remisión en 7/7, 100%) frente al metronidazol (en 3/9, 33%) (p<0,05) tras 2 semanas de tratamiento, con un mejor perfil de seguridad, por lo que probablemente el ciprofloxacino pueda ser considerado el tratamiento de elección17.
Otro de los antibióticos propuestos para el tratamiento de la reservoritis aguda es la rifaximina. En un ensayo controlado con placebo realizado en 18 pacientes donde se les administraba 400mg de rifaximina/8h vs. placebo durante 4 semanas, no se observaron diferencias estadísticamente significativas18.
En cuanto a otras alternativas terapéuticas, se ha evidenciado que dosis elevadas de la misma mezcla probiótica referida anteriormente son efectivas en la reservoritis aguda leve, aunque son datos poco sólidos y que provienen de series abiertas no comparadas con placebo19.
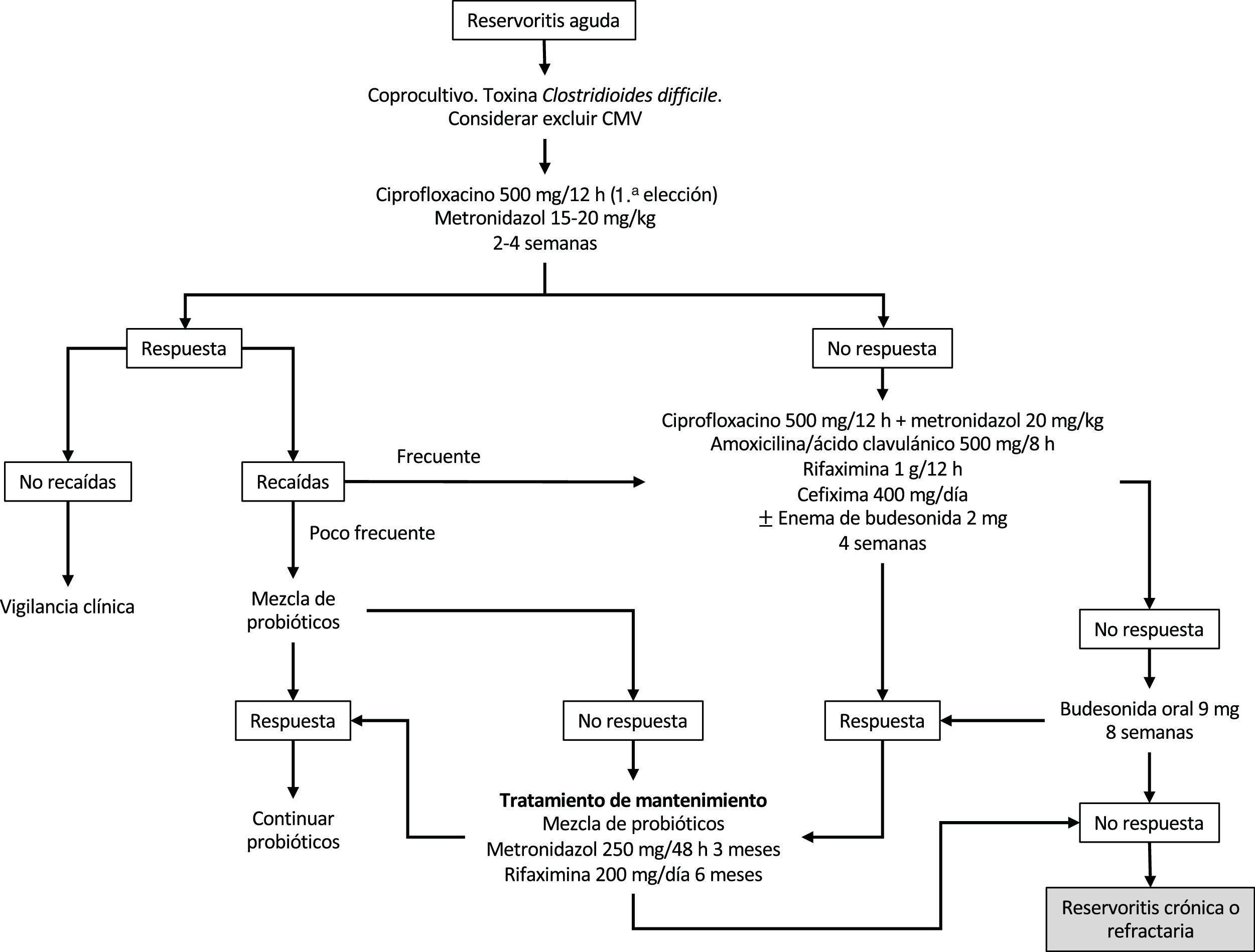
La budesonida ha sido evaluada, tanto en forma de enemas como por vía oral, en el tratamiento de la reservoritis aguda. En un estudio prospectivo de 26 pacientes, se comparó los enemas de budesonida (2mg/100ml por la noche) vs. metronidazol (500mg 2 veces al día) durante 6 semanas; se concluyó que eran similares en eficacia clínica, endoscópica e histológica sin mostrar diferencias entre ambos grupos20. También existen series abiertas que han mostrado eficacia de los aminosalicilatos tanto por vía oral como tópica en la reservoritis aguda, por lo que estos fármacos podrían ser tenidos en cuenta en los casos que no toleren antibióticos21. En la figura 1 se resume el algoritmo sugerido de tratamiento de la reservoritis aguda.
Se recomienda como tratamiento de la reservoritis aguda el uso de antibioterapia con ciprofloxacino o metronidazol durante 2-4 semanas, preferiblemente el ciprofloxacino por su mejor perfil de seguridad y probable mayor eficacia, reservando otras opciones como probióticos, budesonida o mesalazina para pacientes con intolerancia a los antibióticos.
Tras un primer episodio de reservoritis, ¿podemos prevenir nuevos episodios?Tras un episodio inicial de reservoritis, los pacientes pueden desarrollar nuevos episodios, pero esto no ocurre en todos los casos1. Aquellos pacientes con al menos 3 episodios anuales de reservoritis a pesar de recibir tratamiento antibiótico, son considerados como antibiótico-dependientes. En estos casos, es razonable plantear algún tipo de tratamiento con intención profiláctica, dado el importante deterioro clínico y de la calidad de vida que estos episodios pueden producir en la vida de los pacientes22.
Disponemos de datos sobre la eficacia de la mezcla probiótica en este contexto clínico: tanto en el estudio de Gionchetti et al.23 (dosis única de 6g/d) como en el de Mimura et al.24 (dosis de 3g 2 veces/día) se demostró que el tratamiento con esta formulación probiótica reducía de forma significativa el riesgo de reaparición de reservoritis en este tipo de pacientes. Un análisis conjunto de ambos estudios (que incluía a un total de 76 pacientes) demostró que existía una diferencia estadísticamente significativa en la proporción de pacientes que mantenían la remisión al cabo de 9-12 meses25. El 85% de los pacientes del grupo tratado con la mezcla probiótica (34/40) no desarrolló episodios de reservoritis, en comparación con el 3% (1/36) de aquellos que fueron tratados con placebo; (RR 20,24; IC 95% 4,28-95,81). Este tratamiento fue bien tolerado, sin apenas efectos adversos en ambos estudios en el brazo asignado a tratamiento con la mezcla probiótica. De todas formas, estos resultados deben ser tomados con cautela, dado que el análisis GRADE de ambos estudios los clasifica como de baja calidad debido al pequeño tamaño muestral de los mismos.
Se ha estudiado la eficacia de otros probióticos para este tipo de pacientes, encontrando resultados menos favorables22. El empleo de Lactobacillus rhamnosus GC en un ensayo clínico doble ciego, que incluyó a 20 pacientes, no encontró diferencias en variables clínicas ni endoscópicas, a pesar de demostrarse un cambio en la composición de la flora bacteriana del reservorio26.
También disponemos de los resultados de un estudio que evaluó la eficacia del tratamiento con rifaximina oral para este tipo de pacientes27. En este estudio abierto los pacientes recibieron tratamiento con rifaximina (a una dosis media de 200mg/día) después de 2 semanas de tratamiento antibiótico convencional. El 65% de los pacientes (33/51) mantuvo la remisión al cabo de 3 meses, y el 58% la mantuvieron tras 12 meses de tratamiento.
La mejor alternativa actual para el mantenimiento de la remisión de aquellos pacientes con episodios previos de reservoritis es la mezcla probiótica de los estudios originales. A pesar del bajo grado de evidencia que sustenta esta actitud, debido al pequeño tamaño muestral de los estudios realizados. Este tratamiento tiene el inconveniente de no estar financiado en nuestro sistema público de salud, pudiendo suponer una carga económica significativa su uso a largo plazo para los pacientes.
¿Qué tratamientos emplearemos en la reservoritis crónica refractaria a un antibiótico?A pesar del tratamiento antibiótico en las reservoritis agudas, hasta un 10-20% desarrollarán una forma de reservoritis crónica antibiótico-dependiente o refractaria. Estos pacientes se beneficiarán de nuevos ciclos de antibioterapia o en combinación.
En una revisión sistemática la odds ratio para inducir la respuesta en reservoritis crónica con metronizadol vs. placebo fue de 12 (IC 95% 2,3-65)28. El tratamiento combinado se ha comprobado que es efectivo con diferentes tipos de antibióticos. En un estudio se incluyeron 16 pacientes a los que se les administró ciprofloxacino 1g/día y tinidazol 15mg/kg/día durante 4 semanas y se comparó con una cohorte de 10 pacientes con mesalazina oral o tópica29. La tasa de remisión del grupo que recibió antibiótico fue del 88 vs. 50% y se observó una mejoría estadísticamente significativa tanto del PDAI como de la calidad de vida. En otro estudio se incluyeron 18 pacientes sin respuesta a metronidazol, ciprofloxacino o amoxicilina/clavulánico durante 4 semanas y que fueron tratados con rifaximina 2g/día junto con ciprofloxacino 1g/día durante 2 semanas30. Aproximadamente un 90% obtuvieron respuesta y un 33% (6/18) consiguieron remisión clínica. En este estudio no se detectaron efectos secundarios. En otro estudio prospectivo, 44 pacientes recibieron 1g de metronidazol junto con 1g de ciprofloxacino diarios durante 4 semanas, y de ellos, 36 pacientes (82%) obtuvieron remisión clínica31.
Otro estudio reciente ha evaluado el uso de antibióticos a largo plazo. En él se incluyeron 39 pacientes que recibieron antibióticos durante al menos un año (ciprofloxacino o metronidazol en monoterapia o combinados, y como alternativas rifaximina y cefalosporinas). Se observó remisión en un 21% de los pacientes pero con un 28% de efectos secundarios, sobre todo la toxicidad neurológica producida por el metronidazol32.
En pacientes con reservoritis crónica dependiente de antibiótico se recomienda la combinación de 2 antibióticos como ciprofloxacino junto con metronidazol o rifaximina durante al menos 4 semanas, aunque debe tenerse en cuenta que el riesgo de efectos adversos es elevado. Es fundamental que en pacientes con reservoritis en los que se emplea el metronidazol, se advierta a los pacientes del riesgo de toxicidad neurológica y se evite la automedicación sin un control médico estricto.
Tratamiento de la reservoritis crónica refractaria¿Podemos emplear corticoides?Los corticoides orales de acción tópica han demostrado eficacia en la reservoritis crónica refractaria. En un estudio se administró budesonida oral en 20 pacientes en los que el tratamiento antibiótico durante 4 semanas con metronidazol o ciprofloxacino había fracasado en la resolución de la inflamación del reservorio33. La dosis empleada en este estudio fue de 9mg/día durante 8 semanas, disminuyendo posteriormente la dosis en 3mg/mes hasta su suspensión. El 75% de los pacientes presentaron remisión, definida según un PDAI total≤4. En este estudio, los autores observaron que el número de deposiciones al día descendía de forma significativa en los pacientes (de 10 deposiciones a 6; p<0,01). Se evaluó el impacto del tratamiento sobre la calidad de vida y observaron una mejoría significativa en el Inflammatory Bowel Disease Questionnaire (IBDQ) con respecto a la puntuación basal de los pacientes (180 vs. 105; p<0,001). En nuestro medio, el grupo de Galdakao ha publicado una serie abierta de 5 pacientes con reservoritis refractaria, en la que tras 8 semanas de tratamiento con 9mg de budesonida, 4 de ellos (80%) lograron remisión medida con PDAI34. Existe otro estudio abierto llevado a cabo en un grupo de 10 pacientes refractarios a antibióticos, que fueron tratados durante 8 semanas con dipropionato de beclometasona, alcanzándose la remisión (PDAI≤4) en el 80% de los pacientes35.
Es recomendable intentar el tratamiento con esteroides orales de acción tópica en los pacientes con reservoritis en los que han fracasado los antibióticos.
¿Es recomendable el uso de fármacos inmunosupresores en la reservoritis crónica refractaria?No existen datos disponibles que apoyen el uso de inmunomoduladores tiopurínicos en monoterapia para obtener la remisión en reservoritis crónica refractaria. Probablemente el mayor beneficio de estos fármacos en este contexto se obtenga de su asociación con biológicos antifactor de necrosis tumoral (TNF-α) para aumentar su eficacia y la tasa de respuesta. No obstante, cabe destacar que no se hayan publicado estudios específicos en la reservoritis crónica con un fármaco tan extendido en nuestro medio. Además, en algunas de las series de pacientes tratados con anti-TNF α como la del grupo belga36 y la propia de GETECCU37, más del 50% de los pacientes habían recibido azatioprina para su reservoritis previamente al uso del anti-TNF α.
En base a la hipótesis de que la proctitis ulcerosa y la reservoritis pueden compartir algún mecanismo fisiopatológico, la ciclosporina A, en su presentación en enemas de 250mg aplicados una vez al día, podría representar un tratamiento útil en algunos casos de reservoritis refractaria aunque los datos que apoyan sus resultados beneficiosos son escasos38.
No se recomienda el uso de fármacos inmunosupresores en la reservoritis crónica refractaria.
¿Debemos emplear las terapias biológicas en las reservoritis crónicas refractarias?Los primeros datos de eficacia con infliximab (IFX) provienen de pacientes que desarrollaron hallazgos compatibles con enfermedad de Crohn (EC) tras someterse a una colectomía y la reconstrucción con un reservorio en J, tras un diagnóstico inicial de CU39. Los primeros resultados sobre el uso de biológicos en pacientes con reservoritis en CU son de 2 grupos italianos que evaluaron la eficacia de IFX en 2 series independientes, con unas tasas de remisión muy altas40,41. En 2010 se publicaron los resultados de un estudio multicéntrico belga en el que 28 pacientes con reservoritis refractaria fueron tratados con IFX siguiendo un esquema clásico de inducción y mantenimiento posterior cada 8 semanas. En la semana 10, el 88% presentaron respuesta clínica, siendo en el 56% parcial y en el 32% completa. Paralelamente, el PDAI descendió de 9 a 4,5 puntos (p<0,001). Después de un seguimiento medio de 20 meses, el 56% de los pacientes mostraron respuesta clínica sostenida mientras que 5 (17%) pacientes tuvieron que ser sometidos a ileostomía permanente36. La serie publicada con un mayor número de pacientes (n=33) es la de GETECCU, observando que el 21% de los pacientes habían alcanzado respuesta clínica completa y el 63% respuesta clínica parcial en la semana 837. A la semana 26 y 52, el 33% y el 27% habían alcanzado respuesta clínica completa, y un 33% y un 18% presentaban respuesta clínica parcial, respectivamente. Se interrumpió el tratamiento en 13 pacientes, en 4 de ellos por falta de eficacia, en 4 por pérdida de respuesta y en 5 (15%) por efectos adversos.
Al igual que con el IFX, los primeros datos con adalimumab (ADA) provienen de reservoritis de pacientes con EC que habían sido colectomizados. El principal estudio es del grupo de Cleveland, que evaluó la eficacia de ADA en 17 pacientes que desarrollaron hallazgos compatibles con EC habiendo sido diagnosticados previamente de CU y sometidos a colectomía con reservorio ileoanal en J. Los autores observaron que tras 8 semanas de seguimiento, 8 pacientes (47%) mostraban respuesta clínica completa y 4 de ellos (24%) presentaban respuesta parcial42. Entre los escasos estudios disponibles que evalúan la eficacia de ADA en la reservoritis tras colectomía en CU, está uno de GETECCU que analizó de forma retrospectiva la eficacia de ADA en 8 pacientes con reservoritis crónica refractaria, todos ellos previamente tratados con IFX43. Se valoraron los resultados a corto plazo (semana 8) y se observó que el 13% de los pacientes habían alcanzado la remisión y el 38% mostraban respuesta clínica. En cuanto a la eficacia a largo plazo (semana 52), el 50% de los pacientes evitaron la ileostomía permanente aunque solo el 25% presentaban remisión. Sin embargo, recientemente se ha publicado un estudio que comparaba ADA con placebo en 13 pacientes refractarios a antibióticos y no se observaron diferencias significativas entre ambos grupos44.
Una reciente revisión sistemática, que no solo incluyó artículos publicados de forma completa (aunque no el de Kjaer et al.44) sino también comunicaciones a congresos, concluyó que ambos fármacos anti-TNF α son eficaces a corto y a largo plazo en el tratamiento de la reservoritis crónica, aunque los autores recalcan que los resultados son mejores en los pacientes en los que su diagnóstico final es de EC45.
Con respecto a otras terapias biológicas como vedolizumab, se han publicado series recientemente. La de mayor valor es un estudio abierto multicéntrico alemán que evaluó la eficacia del fármaco en 20 pacientes con reservoritis crónica refractaria (la mayoría de los pacientes refractarios a anti-TNF α) y observaron un descenso en el PDAI de 10 a 3 puntos en la semana 1446. En otro estudio realizado en la Cleveland Clinic, se trataron 19 pacientes con reservoritis crónica refractaria con vedolizumab (más del 50% refractarios a anti-TNF α)47. El 74% de ellos experimentó una mejoría tanto clínica (PDAI modificado) como endoscópica. Este mismo año han sido publicados los primeros datos con ustekinumab, demostrándose en 24 pacientes con reservoritis crónica refractaria una mejoría clínica y endoscópica, por lo que este fármaco podría ser también una alternativa eficaz en casos multirefractarios48.
Se recomienda plantear el tratamiento con terapias biológicas en los pacientes con reservoritis en los que han fracasado los antibióticos y budesonida. En primer lugar anti-TNF, y si no respuesta, fracaso previo o intolerancia, se recomiendan vedolizumab o ustekinumab.
Otros tratamientosProbablemente el sobrecrecimiento bacteriano en el reservorio en J desempeñe un papel en la inflamación del mismo por lo que, dado el efecto tóxico del bismuto sobre los sistemas enzimáticos bacterianos, se ha postulado que podría suponer algún beneficio (administrado en forma de enemas o vía oral) en el tratamiento de la reservoritis crónica refractaria. En un ensayo clínico aleatorizado de 3 semanas de duración, en el que 20 pacientes recibieron enemas de 270mg de carbómero de bismuto y 20 pacientes recibieron placebo, ningún paciente alcanzó la remisión, pero 9 pacientes en cada grupo (45%) alcanzaron la respuesta clínica con un descenso de 3 puntos respecto de su PDAI basal49. Los autores de este estudio atribuyeron la ausencia de diferencias en ambos grupos de tratamiento a la baja concentración de bismuto en los enemas, la corta duración del tratamiento o las propiedades terapéuticas de la resina aplicada como placebo.
Alicaforsen es una molécula que inhibe la molécula de adhesión intracelular ICAM-1 (CD54). Se ha postulado que en pacientes con reservoritis activa la expresión de ICAM-1 está incrementada50, por lo que se realizó un estudio abierto en el que se trató a 12 pacientes con reservoritis crónica refractaria con un enema diario de 240mg de alicaforsen aplicado por la noche durante 6 semanas51. En la semana 6 todos los pacientes presentaban una reducción significativa del PDAI con respecto a su valor basal (11,4 vs. 6,8; p=0,001). Datos de otra serie no controlada de 13 pacientes, que recibieron la misma pauta de tratamiento, muestran que una proporción elevada presentan mejoría clínica (85%), aunque la recidiva es frecuente52. Dada la evidencia muy limitada, se necesitan estudios capaces de aportar datos más sólidos y con potencia estadística suficiente para validar su empleo de forma regular.
En cuanto a las técnicas de aféresis en las reservoritis crónicas, se han reportado únicamente casos clínicos aislados que reportan la eficacia de estas técnicas en estos pacientes53.
A pesar de que el trasplante fecal, dada la patogénesis de la reservoritis, podría considerarse una alternativa de tratamiento razonable, la evidencia actual sobre su uso es todavía muy limitada. Los datos disponibles se basan en series de casos aislados con una buena respuesta inicial, pero sin un seguimiento a medio-largo plazo54,55.
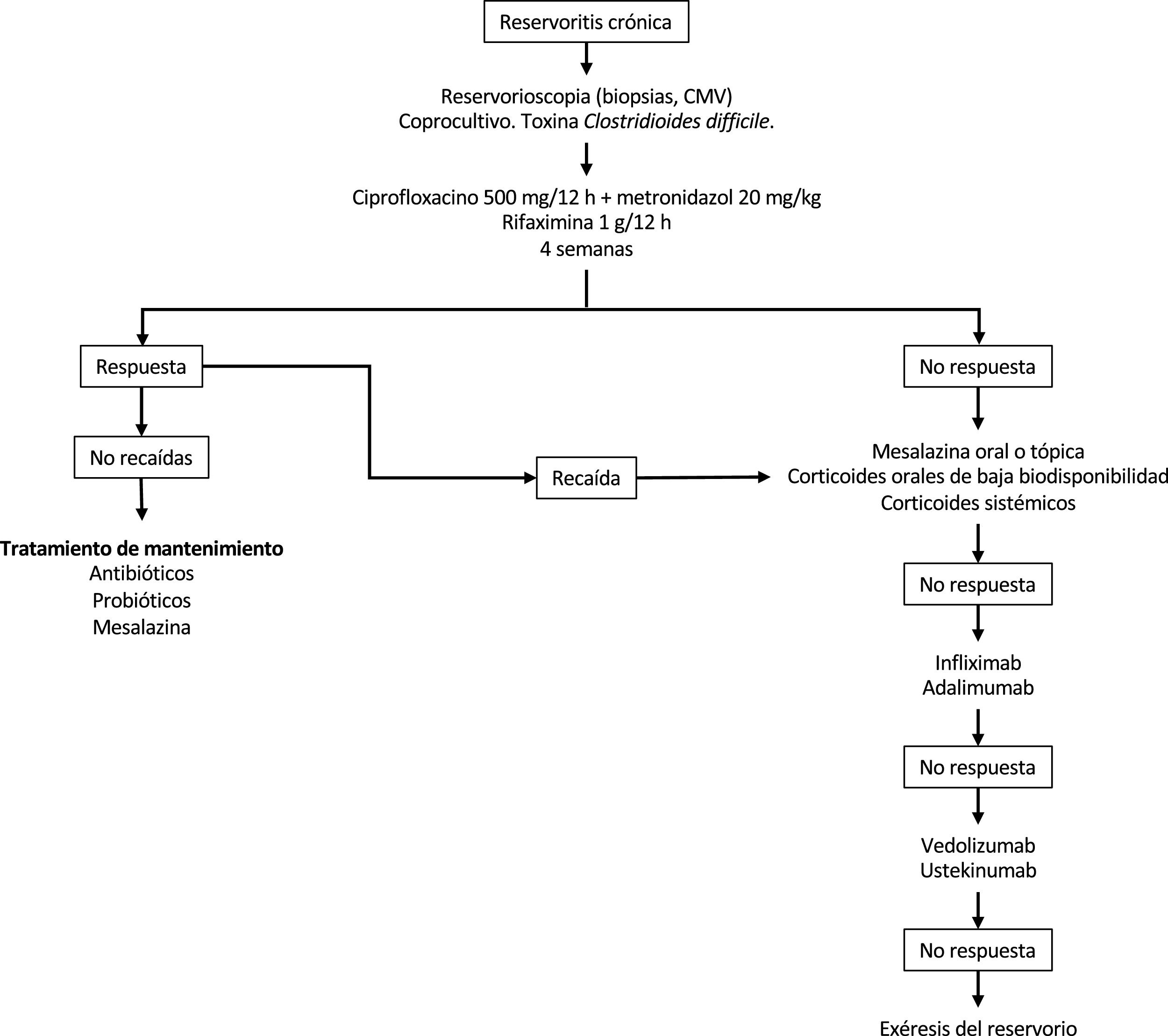
En la figura 2 se presenta un posible algoritmo de tratamiento de las reservoritis crónica.
Tratamiento quirúrgico: Ileostomía definitivaLa cirugía de rescate del reservorio es una opción cuando fracasa el tratamiento médico56. Sin embargo, la cirugía en el tratamiento de la reservoritis no comprende la realización de un nuevo reservorio o de parte de este, sino su desfuncionalización mediante una ileostomía de derivación, o su resección con una reservoriectomía con ileostomía definitiva.
La incidencia de pérdida del reservorio por reservoritis crónica refractaria a tratamiento médico es difícil de estimar por la evolución de los tratamientos y por el poco volumen de publicaciones al respecto, pero esta supone cerca del 25% de las indicaciones de resección del reservorio57. De hecho, en la serie con más experiencia a nivel mundial como es la de la Cleveland Clinic con cerca de 1.000 reservorios realizados, el 10% de los pacientes precisa una ileostomía definitiva. Estas cifras son superiores cuando se analizan los pacientes de esa serie que desarrollaron reservoritis crónica refractaria, pues en estos la tasa de ileostomía definitiva fue del 24%58.
La desfuncionalización temporal se realiza en pacientes de alto riesgo y con el objetivo de disminuir las complicaciones derivadas de la resección del mismo. Sin embargo, los pacientes a los que se les realiza esta derivación deben ser advertidos de la fuga persistente por parte del reservorio retenido y de los síntomas remanentes en algunos de ellos. Hay 2 estudios publicados comparando los resultados a corto y largo plazo entre la derivación vs. la resección del reservorio59,60. A corto plazo no hay diferencias, pero sin embargo a largo plazo los estudios de calidad de vida son mejores en los pacientes con resección del reservorio, por lo que siempre que sea posible se recomienda esta última técnica en lugar de la derivación del reservorio.
La resección del reservorio ileal puede completarse con una ileostomía terminal o con la realización de una ileostomía continente (tipo Kock). La reservoriectomía es un procedimiento con un índice de morbilidad perioperatoria del 60% y una mortalidad de 1,5%61. Las complicaciones son habitualmente sépticas en el periodo agudo (10%). Las más comunes son las crónicas, con déficit de cicatrización de la herida perineal (sinus perineal crónico) hasta en el 40%, oclusión intestinal (15%), dolor perineal o disfunción sexual o urinaria. Es importante recordar que en una revisión sistemática se concluyó que no existen diferencias en cuanto a calidad de vida entre los pacientes operados portadores de reservorio y los pacientes con ileostomía definitiva62
Tratamiento de la cuffitisAunque esta entidad no es inusual en los pacientes operados, apenas existen datos ni estudios sobre su manejo, si bien se recomienda solo el tratamiento de los pacientes sintomáticos. En una serie de 14 pacientes tratados con supositorios de mesalazina se observó una mejoría tanto clínica como endoscópica63. En otra serie donde se incluyeron 120 pacientes con cuffitis que se siguieron durante 6 años, se observó que 40 de ellos (33%) respondieron adecuadamente a mesalazina y esteroides. Cincuenta y ocho (48%) fueron refractarios a ambos tratamientos, de los cuales se observó que 19 realmente tenían una EC del reservorio y en 14 complicaciones posquirúrgicas (fístulas y sinus)64. Por tanto, a día de hoy la mesalazina tópica es el tratamiento de elección, aunque en algunos pacientes puede ser necesaria la escalada terapéutica a corticoides e incluso ser necesarias terapias biológicas.
Debemos distinguir entre los pacientes con cuffitis convencional, que suelen responder a los tratamientos mencionados, y un subgrupo de pacientes con cuffitis refractaria a estos tratamientos. La histología en estos casos refractarios puede ser diferente a la de la CU y mostrar en ocasiones datos de isquemia64 o incluso existe algún caso descrito de cuffitis colágena65. Las cuffitis crónicas refractarias sin respuesta a terapia médica se deben considerar para mucosectomía transanal con avance del reservorio o escisión del reservorio en casos intratables66.
Conflicto de interesesMBA: Asesoramiento científico, soporte para investigación y/o actividades formativas: MSD, Abbvie, Hospira, Pfizer, Kern Pharma, Biogen, Takeda, Janssen, Sandoz, Celgene, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Tillotts Pharma, Chiesi, Gebro Pharma, Otsuka Pharmaceutical, Vifor Pharma.
IM-J: Asesoramiento científico, soporte para investigación y/o actividades formativas: MSD, Abbvie, Hospira, Pfizer, Biogen, Takeda, Janssen, Sandoz, Celgene, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Tillotts Pharma, Chiesi, Gebro Pharma, Otsuka Pharmaceutical, Vifor Pharma.
IR-L: Asesoramiento científico y/o actividades formativas MSD, Pfizer, Abbvie, Takeda, Janssen, Tillotts Pharma, Roche, Faes Farma, Kern Pharma, Shire Pharmaceuticals, Ferring, Dr. Falk Pharma, Adacyte y Otsuka Pharmaceutical.
FG: Asesoramiento científico, soporte para investigación y/o actividades formativas: Instituto Danone, Biocodex Foundation, Pfizer Consumer Healthcare, Clasado, Sanofi, Ferring, Farmasierra Research/Clinical Trials: Abbvie, Takeda, Clasado, Novartis, Biocodex, Sanofi, Chiesi, Danon.
AG: Asesoramiento científico, soporte para investigación y/o actividades formativas: MSD, Abbvie, Takeda, Janssen, Ferring, Faes Farma, Otsuka Pharmaceutical, Vifor Pharma.
MCh: Asesoramiento científico, soporte para investigación y/o actividades formativas: MSD, Abbvie, Hospira, Pfizer, Takeda, Janssen, Ferring, Shire Pharmaceuticals, Dr. Falk Pharma, Tillotts Pharma.
JPG: Asesoramiento científico, soporte para investigación y/o actividades formativas: MSD, Abbvie, Hospira, Pfizer, Kern Pharma, Biogen, Takeda, Janssen, Roche, Sandoz, Celgene, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Tillotts Pharma, Chiesi, Casen Fleet, Gebro Pharma, Otsuka Pharmaceutical, Vifor Pharma.
BB: Asesoramiento científico, soporte para investigación y/o actividades formativas: MSD, Abbvie, Pfizer, Takeda, Ferring, Otsuka, Amgen.
PN: Soporte para investigación y/o actividades formativas: MSD, Abbvie, Pfizer, Takeda, Janssen, Kern, Faes, Ferring, Tillots, Otsuka.