La enfermedad inflamatoria intestinal (EII) es una afección crónica de etiología no esclarecida cuya incidencia aumenta en nuestra sociedad1,2. En un porcentaje elevado de casos su diagnóstico se realiza en edades tempranas y precisa de un tratamiento continuado3, requiriendo en muchos casos politerapia medicamentosa con fármacos que presentan potenciales efectos adversos4, por lo que es necesario tras su indicación realizar un seguimiento y una monitorización que valore la adhesión y la tolerancia en estos pacientes y que permita la detección precoz de sus posibles efectos adversos4,5. En los últimos años se ha producido un incremento en el número de unidades de atención integral (UAI) dirigidas al manejo de la EII. Su actuación se basa en un trabajo en equipo mediante el desarrollo de protocolos estandarizados en los que se detallan las acciones de cada miembro del equipo con la finalidad de conseguir un orden y una continuidad en el cuidado de los pacientes6. Un pilar básico de estas unidades la constituye el personal de enfermería, entre cuyas labores se encuentra el seguimiento de los pacientes en remisión con el fin de potenciar la educación sanitaria, valorar la calidad de vida, realizar el control de los tratamientos crónicos para incentivar la adhesión y detectar la aparición de posibles efectos adversos7–11.
El objetivo de este trabajo ha sido la elaboración de un protocolo de manejo y monitorización del tratamiento inmunomodulador y biológico, teniendo en cuenta la información actual al respecto, así como la organización y planificación del trabajo entre los distintos componentes del equipo de una UAI en EII.
Material y métodosSe ha realizado una búsqueda de la literatura médica mediante la revisión de las guías de práctica clínica y documentos de consenso del Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa (GETECCU)4,12,13, la Organización Europea de Colitis y Crohn (ECCO)14,15, la Organización Mundial de Gastroenterología (WGO)16, la Sociedad Británica de Gastroenterología (BSG)17 y la Asociación Americana de Gastroenterología (AGA)18,19, así como de recomendaciones de expertos nacionales20. También se han revisado las fichas técnicas de los distintos fármacos, habiendo efectuado una búsqueda bibliográfica en la base PubMed orientada a trabajos de revisión, metanálisis y guías clínicas publicados entre 1980-2011, empleando como filtros: población adulta mayor de 18 años e idiomas inglés y español, utilizando las palabras clave MESH «inflammatory bowel diseases/drug therapy or inflammatory bowel diseases/therapy» and «drug toxicity» junto con «thiopurines or metotrexate and inflammatory bowel diseases» and «adverse events».
A partir de todos los documentos evaluados se ha elaborado un protocolo de manejo para los pacientes que reciben tratamiento inmunosupresor y/o biológico, incluyendo en éste los fármacos tiopurínicos (azatioprina y 6-mercaptoputina), metotrexato, infliximab y adalimumab por ser los más utilizados en la EII. También hemos analizado la información publicada por las diversas sociedades científicas respecto a las recomendaciones de estudios previos al inicio de estos fármacos.
Para llevar a cabo este protocolo contamos en nuestra UAI de EII con el soporte de 3 facultativos y un diplomado en enfermería con conocimientos y entrenamiento específicos en EII. A través de este profesional se establece un contacto bidireccional con los pacientes y con el personal facultativo responsable de estos, así como se facilita la relación con otras unidades vinculadas a la UAI como el hospital de día, la sala de aféresis leucocitaria, etc.
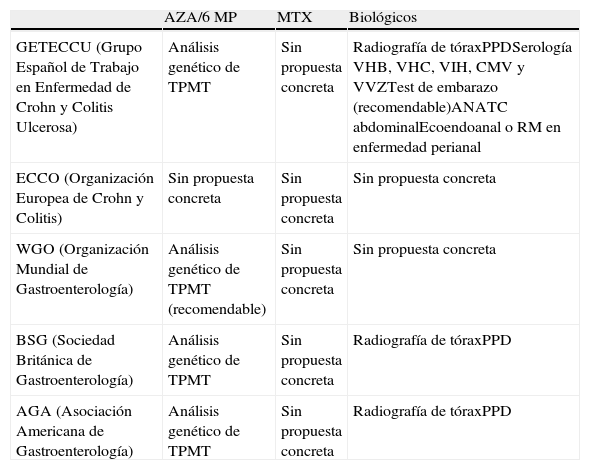
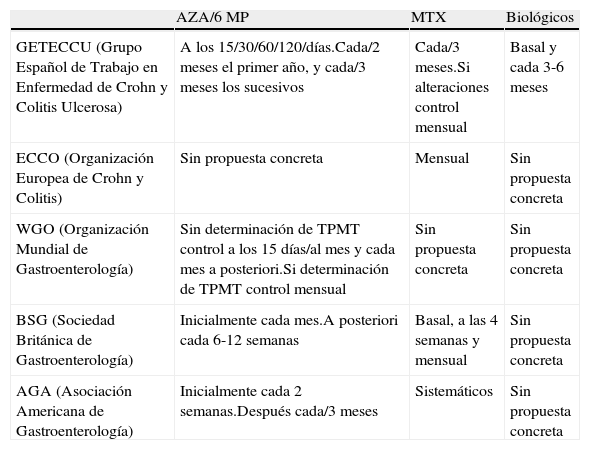
ResultadosSe han revisado 35 documentos de los cuales 5 corresponden a fichas técnicas de los fármacos incluidos en el protocolo y 9 son artículos o documentos de consenso de ECCO, GETECCU, WGO, BSG y AGA12–14,14–19. En las tablas 1 y 2 se resumen respectivamente los estudios recomendados previamente al empleo de estos fármacos y los esquemas de seguimiento y monitorización dictados por las diferentes sociedades científicas consultadas.
Estudios previos al tratamiento con fármacos inmunosupresores o biológicos propuesta por las distintas sociedades
| AZA/6 MP | MTX | Biológicos | |
| GETECCU (Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa) | Análisis genético de TPMT | Sin propuesta concreta | Radiografía de tóraxPPDSerología VHB, VHC, VIH, CMV y VVZTest de embarazo (recomendable)ANATC abdominalEcoendoanal o RM en enfermedad perianal |
| ECCO (Organización Europea de Crohn y Colitis) | Sin propuesta concreta | Sin propuesta concreta | Sin propuesta concreta |
| WGO (Organización Mundial de Gastroenterología) | Análisis genético de TPMT (recomendable) | Sin propuesta concreta | Sin propuesta concreta |
| BSG (Sociedad Británica de Gastroenterología) | Análisis genético de TPMT | Sin propuesta concreta | Radiografía de tóraxPPD |
| AGA (Asociación Americana de Gastroenterología) | Análisis genético de TPMT | Sin propuesta concreta | Radiografía de tóraxPPD |
ANA: anticuerpos antinucleares; CMV citomegalovirus; PPD: prueba cutánea para diagnóstico de tuberculosis; RM: resonancia magnética; TC: tomografía computarizada; TPMT: tiopurina-metiltransferasa; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VIH: virus de la inmunodeficiencia humana; VVZ: virus varicela zóster.
Monitorización de tratamientos propuesta por las distintas sociedades
| AZA/6 MP | MTX | Biológicos | |
| GETECCU (Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa) | A los 15/30/60/120/días.Cada/2 meses el primer año, y cada/3 meses los sucesivos | Cada/3 meses.Si alteraciones control mensual | Basal y cada 3-6 meses |
| ECCO (Organización Europea de Crohn y Colitis) | Sin propuesta concreta | Mensual | Sin propuesta concreta |
| WGO (Organización Mundial de Gastroenterología) | Sin determinación de TPMT control a los 15 días/al mes y cada mes a posteriori.Si determinación de TPMT control mensual | Sin propuesta concreta | Sin propuesta concreta |
| BSG (Sociedad Británica de Gastroenterología) | Inicialmente cada mes.A posteriori cada 6-12 semanas | Basal, a las 4 semanas y mensual | Sin propuesta concreta |
| AGA (Asociación Americana de Gastroenterología) | Inicialmente cada 2 semanas.Después cada/3 meses | Sistemáticos | Sin propuesta concreta |
En relación con los estudios previos, proponemos realizar en todos los pacientes con EII candidatos a tratamiento con fármacos inmunosupresores y/o biológicos:
- 1.
Prueba cutánea para diagnóstico de tuberculosis (PPD), efectuando Booster en aquellos pacientes que han recibido recientemente tratamiento con fármacos inmunosupresores o corticoterapia prolongada (≥ 15mg de prednisona durante más de un mes)13,21.
- 2.
Radiografía de tórax basal, dada la posibilidad de desarrollo de neumonitis o infecciones respiratorias con cualquiera de los fármacos empleados.
- 3.
Serología de del virus de la hepatitis A (VHA), virus de la hepatitis B (VHB), virus de la hepatitis C (VHC), virus de la inmunodeficiencia humana adquirida (VIH), virus de la varicela zóster (VVZ) y citomegalovirus (CMV). Algunas de estas serologías como VVZ o CMV no han sido universalmente propuestas, aunque consideramos que son útiles en la valoración evolutiva de estos pacientes ante las posibles infecciones asociadas a la inmunosupresión.
- 4.
Actualización del calendario vacunal.
En situaciones concretas se añadirá a los anteriores la determinación de anticuerpos antinucleares (ANA) y TPMT. La determinación de ANA se aconseja previo al tratamiento anti-TNF alfa, dado la posibilidad de desarrollo de estos anticuerpos a lo largo del tiempo con presentación de síndrome lupus-like22.
La valoración de la actividad TPMT previa al tratamiento con inmunosupresores tiopurínicos permite identificar a aquellos pacientes en los que no se deben utilizar estos fármacos (actividad TPMT < 5 U/ml). No obstante, esta recomendación no ha sido universalmente aceptada, siendo actualmente aconsejada por la AGA19 pero no por otras sociedades científicas como ECCO14,15 (tabla 1). En contra de su determinación sistemática está la falta de correlación entre actividad de TPMT y el desarrollo de efectos adversos inducidos por AZA-6MP23,24 y la escasa prevalencia de una actividad baja de esta enzima en los pacientes con EII (0,5%)25. No obstante, también existen datos de ser ésta una estrategia coste-efectiva al evitar una leucopenia por cada 100 pacientes tratados26, por lo que en la actualidad su determinación debe considerarse como recomendable.
Los efectos adversos de los fármacos inmunosupresores y biológicos habitualmente empleados en la EII son de muy diversa índole. Los fármacos tiopurínicos producen efectos adversos en un 9% de pacientes, pudiendo dividirse respecto al tiempo de presentación en efectos a corto-medio o a largo plazo27,28. A corto plazo pueden inducir efectos dependientes de la dosis como mielosupresión (más frecuente en pacientes que presentan mutación doble de los alelos que codifican la enzima TPMT), así como también efectos idiosincrásicos: náuseas, vómitos, pancreatitis (1-3%)29, artralgias, fiebre y hepatoxicidad (1%)30. Los efectos adversos a largo plazo incluyen un aumento de la incidencia de infecciones (7,4%) y mielosupresión no relacionada con la enzima TPMT (1,4-5%)31–34. La tasa de discontinuación de estos fármacos motivada por sus efectos adversos se sitúa en un 10-20%34,35.
La frecuencia de los controles analíticos en pacientes tratados con estos fármacos, que incluyen hemograma, GOT, GPT y fosfatasa alcalina, es diferente en las distintas sociedades consultadas recomendándose de forma habitual efectuar un seguimiento más estrecho al inicio del tratamiento y oscilando posteriormente la periodicidad de los controles entre 1 y 3 meses (tabla 2). En el caso de presentar alteraciones analíticas en el hemograma o enzimas hepatobiliares se recomienda efectuar determinaciones más frecuentes, descartar otras posibles causas y disminuir las dosis; o en caso de neutropenia inferior a 100 × 109/ml o ante elevaciones en las enzimas hepáticas asociadas a ictericia suspender definitivamente estos fármacos30,31,34.
En relación con el metotrexato, la presencia de efectos adversos se estima entre un 40-50%, obligando a la retirada del fármaco en un 10-33% de los pacientes36–40. Entre ellos, destaca el riesgo de toxicidad hepática (5-11%) con desarrollo de fibrosis y cirrosis hepática38,40, aunque menos frecuentemente también puede causar mielosupresión, enfermedad pulmonar intersticial, osteopatía, infecciones (3-12%) y toxicidad neurológica37. Las recomendaciones sobre su monitorización incluyen la realización de un hemograma y análisis de la función hepática cada 3 meses. Si existe un aumento de las transaminasas se debe efectuar un control mensual y en caso de que se produzca un incremento consecutivo durante 3 meses o si existen unos valores mayores de tres veces el límite superior de la normalidad se recomienda la interrupción del tratamiento, valorando la realización de una biopsia hepática. El papel de otras técnicas no invasivas como el fibroscán para valorar el daño hepático está todavía por evaluar41. La periodicidad del seguimiento también es dispar en los diferentes documentos consultados, variando la realización de analíticas de control entre 1 y 3 meses (tabla 2).
Con respecto a los efectos adversos relacionados con los anticuerpos anti-TNF alfa, estos incluyen reacciones infusionales (10-30%)42 con infliximab, reacciones locales en el punto de inyección con adalimumab, y otros comunes a ambos fármacos como: cefaleas, vértigos, mareos, rubor facial, erupción cutánea, prurito, urticaria, náuseas, diarrea, dolor abdominal, dispepsia, alteración de las pruebas de función hepática, infecciones (8,2%) y la posible reactivación de una tuberculosis pulmonar latente43–45. El esquema de monitorización de estos fármacos únicamente ha sido propuesto por GETECCU4,12 (tabla 2).
Tras la revisión bibliográfica realizada, la propuesta de monitorización de todos estos fármacos planteada en nuestra UAI se expone en las tablas 3 y 4, diferenciando en ella las tareas asignadas a cada miembro del equipo. Las visitas de seguimiento deben incluir un control clínico con habitual determinación del peso corporal, la realización de una analítica que incluya hemograma completo, bioquímica con perfil hepático, proteína C reactiva (PCR) y velocidad de sedimentación globular (VSG).
Protocolo de monitorización de fármacos inmunosupresores en nuestra unidad de atención integral
Existe la posibilidad de que transcurrido el primer año desde el inicio del tratamiento en aquellos pacientes que presenten estabilidad clínica y analítica, se realicen visitas presenciales alternándolas con visitas telemáticas.
DiscusiónDentro del término EII se engloban una serie de enfermedades intestinales inflamatorias crónicas de etiología desconocida, las más importantes de las cuales son la enfermedad de Crohn y la colitis ulcerosa. Ambas son enfermedades que producen un gran impacto en la salud de las personas que las padecen, debido a su curso crónico con periodos de exacerbación y remisión y a la necesidad de realizar un tratamiento prolongado con el riesgo de efectos adversos que éste conlleva, existiendo la posibilidad de desarrollar complicaciones y manifestaciones extraintestinales. Por este motivo, se recomienda su manejo por unidades de atención integral, que aborden la enfermedad desde una perspectiva biopsicosocial8,9.
Dentro del manejo terapéutico de los pacientes con EII, uno de los aspectos más importantes es lograr una adecuada cumplimentación del tratamiento farmacológico para conseguir la máxima eficacia terapéutica posible y efectuar una correcta monitorización de éste con el fin de detectar precozmente la aparición de los posibles efectos adversos. En este sentido, es esencial la labor de los profesionales de enfermería que forman parte de estas unidades, entre cuyas funciones se incluye la educación sanitaria, el apoyo al paciente y la administración y monitorización de los tratamientos8,9,46.
Los fármacos inmunosupresores y biológicos que son empleados en la EII pueden producir importantes efectos adversos que obligan en un gran número de ocasiones a su retirada, pese a lo cual no existe en la actualidad una protocolización uniforme para el manejo de estos fármacos entre las diferentes sociedades científicas. En los diversos documentos consultados se ha constatado la presencia de disparidades que afectan tanto a los intervalos de seguimiento como también a los estudios requeridos para iniciar un tratamiento o bien para efectuar la monitorización de su seguimiento. Por otra parte, múltiples trabajos han demostrado la existencia de una escasa adhesión al tratamiento por parte de estos pacientes47–49, así como también de los facultativos a las recomendaciones de seguimiento que han sido propuestas50,51. No obstante, esta heterogeneidad en las recomendaciones y su diferente grado de cumplimiento pueden ser debidas a la variabilidad existente respecto a la disponibilidad de recursos y ser así el resultado de la adaptación del seguimiento de estos pacientes a la realidad de cada centro sanitario.
Ante esta situación, se ha planteado la necesidad de elaborar en nuestro centro sanitario un protocolo de manejo para aquellos pacientes con EII que son candidatos a recibir fármacos inmunosupresores o biológicos, basado en la revisión de la literatura médica y en la documentación técnica de cada uno de los fármacos incluidos. En este documento se ha tenido en cuenta la organización de las distintas tareas y responsabilidades de cada miembro de la UAI, permitiendo este reparto de funciones homogeneizar los intervalos de seguimiento, lo que posibilita un adecuado control de los pacientes sin que esto represente una sobrecarga en la capacidad asistencial de la unidad (tabla 3).
En relación con los requerimientos de estudios previos al empleo de estos fármacos, también se pudo constatar la existencia de discrepancias en la bibliografía manejada, por lo se ha decidido unificar dichos estudios basándonos en el conocimiento de que todos los medicamentos incluidos en este protocolo puede favorecer el desarrollo de infecciones durante su empleo, y en la necesidad de establecer cuál es el estado basal de nuestros pacientes en el momento de su prescripción. Consideramos por otra parte que esta unificación es también beneficiosa al permitir mantener una simplicidad y una uniformidad dentro del protocolo, que redunde en un mayor grado de cumplimiento.
El resultado ha sido un documento en el que el profesional de enfermería asume un papel central en el seguimiento de estos pacientes siempre que se encuentren en remisión, manteniendo como funciones primordiales del médico la indicación de un tratamiento, la verificación de los requisitos previos al inicio del mismo y la valoración de su respuesta. Este modelo de seguimiento y monitorización, basado en un reparto de responsabilidades entre el personal médico y el personal de enfermería, es habitual en el manejo de otras enfermedades crónicas como diabetes, obesidad o enfermedades reumatológicas52,53, pero muy poco frecuente en la EII, y hasta donde conocemos no ha sido propuesto previamente.
El desarrollo y aplicación de este protocolo en nuestra unidad supone un avance en el tratamiento de nuestros pacientes al permitirnos conocer su situación clínico-terapéutica en cada momento, detectar precozmente la aparición de posibles efectos adversos evitando complicaciones graves y realizar una actuación más eficiente de los distintos profesionales del equipo que redunde en una mejor organización de la actividad. Por otra parte, también supone un refuerzo del papel de la enfermería como vínculo de comunicación entre el paciente y el resto del sistema sanitario sirviendo para aumentar el grado de satisfacción percibido por parte del paciente, de forma que repercuta en un mayor grado de adhesión al tratamiento y en una mejora de la calidad asistencial10,54.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.