Mientras que en el siglo xx, la meta de la nutrición humana era asegurar un aporte adecuado de energía, macro y micronutrientes, a partir del siglo xxi, además de esto, adquiere importancia la presencia de componentes funcionales en la dieta. El aporte de alimentos funcionales o con componentes funcionales, tanto naturales como procesados, en la edad pediátrica es una de las estrategias más prometedoras en el campo de la nutrición infantil. Existe evidencia cada vez más creciente de que estos alimentos tienen efectos beneficiosos en funciones específicas del organismo, que van más allá de los nutricionales habituales, en un sentido que es relevante para el estado de bienestar y salud o de reducción del riesgo de enfermedad.
El conocimiento cada vez mayor de la implicación de los alimentos funcionales en la regulación de la expresión génica, de la proliferación y función celulares, de la inmunomodulación, de la ecología intestinal, del sistema de antioxidación o del metabolismo es una muestra de la trascendencia que éstos tendrán en el futuro en los hábitos alimentarios de la población, tanto infantil como adulta o anciana1-5.
PROBIÓTICOS, PREBIÓTICOS, SIMBIÓTICOS Y SALUD INFANTO-JUVENIL
Dentro de los alimentos funcionales han adquirido un papel relevante los probióticos, prebióticos y simbióticos, con importantes funciones en la prevención y tratamiento de las enfermedades, en la regulación del metabolismo y en la calidad de vida de los niños y adolescentes. Los probióticos son microorganismos vivos, no patógenos, agentes biológicos con un impacto significativo en la composición de la microflora intestinal, tanto cualitativa como cuantitativamente que, además, pueden inhibir el crecimiento de la flora patógena. Este hecho es muy importante desde el punto de vista fisiológico, ya que la microflora intestinal tiene a lo largo de todo el ciclo vital una gran influencia en el mantenimiento de la homeostasis, de la función intestinal, de la inmunomodulación, como barrera a la colonización por patógenos intestinales y diseminación bacteriana intestinal, en la alergia, en la absorción de la lactosa, en el metabolismo, en la producción de vitaminas y factores de crecimiento, en la síntesis de antimicrobianos y en la neutralización de toxinas, mutágenos y tumorígenos y como fuentes de energía6-14 (tabla I).
Los prebióticos son ingredientes alimentarios no digeribles, fundamentalmente hidratos de carbono y en menor medida proteínas, cuya fermentación bacteriana en el colon favorece el crecimiento selectivo y la actividad de un número limitado de bacterias, principalmente bifidobacterias y lactobacilos, en detrimento del crecimiento de patógenos en la flora colónica3,15. La mayoría de las bifidobacterias está adaptada a la utilización de prebióticos, pero otras especies de bacterias son capaces también de metabolizarlos. Los componentes alimentarios que parecen ejercer el mejor efecto prebiótico son los fructooligosacáridos (FOS), como la chicoria y la inulina, y también la lactulosa. El número de bifidobacterias fecales se encuentra incrementado por la ingesta de FOS de forma dependiente de la dosis, convirtiéndose, por tanto, en una alternativa potencial a la administración directa de probióticos. Los prebióticos se ingieren a través de alimentos naturales o incorporándolos a alimentos como productos lácteos, bebidas, pastelería, cereales, etc.16-20 (tabla II).
Otro uso posible de los prebióticos es en combinación con bacterias probióticas. Esta combinación es conocida como simbiótico y puede ofrecer ventajas al mejorar la supervivencia e implantación de los probióticos en el tracto intestinal, ya que su sustrato específico está disponible desde el momento de la ingestión. Algunos posibles simbióticos son la combinación de bifidobacterias con FOS y lactobacilos con lactitiol21,22.
Las propiedades de los pre y probióticos se ponen de manifiesto desde los primeros meses de vida, ya que la composición de la microflora intestinal está muy influida por el tipo de alimentación. En el momento del nacimiento, el tracto gastrointestinal es estéril, pero a las pocas horas, las bacterias ingeridas durante el parto colonizan con rapidez el intestino neonatal y pronto alcanzarán un número que es 10 veces superior al de las células del organismo. Tras la colonización inicial, la flora intestinal se mantiene bastante constante durante la vida, siendo difícil cambiarla de forma permanente, pues el sistema inmunológico intestinal aprende a reconocer y tolerar las especies bacterianas presentes ya en las primeras etapas de la infancia.
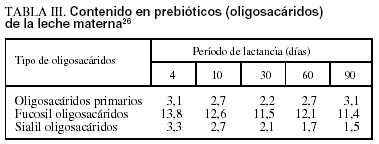
En los lactantes alimentados con leche manterna se desarrolla fundamentalmente una flora de grampositivos, lactobacilos, bifidobacterias, enterococos, destacando como gramnegativos Escherichia coli, mientras que en los alimentados con leche de fórmula (de inicio o continuación) sin suplementar con probióticos ni prebióticos la flora es más compleja, predominando E. coli, bacteroides y otros anaerobios y menos bifidobacterias, como se demuestra al usar métodos de identificación y detección molecular (FISH)23. En los alimentados con leche materna, dados los componentes específicos que ésta aporta (lactoferrina, lisozima, fibronectina, mucina, oligosacáridos, nucleótidos, N-acetilglucosamina, glucosa, galactosa, fructosa, lípidos, IgA secretora y otros factores bifidogénicos), junto a una menor cantidad de proteínas, se favorece el crecimiento selectivo de bifidobacterias y el ambiente intestinal tiene más capacidad inmunomoduladora y antimicrobiana que en los alimentados con leche de fórmula. Estas diferencias favorecen la no proliferación de patógenos y, por tanto, la menor incidencia de infecciones gastrointestinales, urinarias y respiratorias en los alimentados con leche materna24-26 (tabla III). La ingestión de leche de fórmula adicionada de bifidobacterias produce, ya al mes de vida, una prevalencia de su colonización, casi similar a la de los alimentados con leche materna y significativamente mayor a la de los alimentados con fórmula sin microorganismos. Estas leches de fórmula adicionadas con probióticos (bifidobacteria latis, BL, S. thermophilus) consumidas de forma prolongada son bien toleradas, mantienen un crecimiento normal en niños de 1-3 años, recuperan el crecimiento de malnutridos, mejoran la motilidad intestinal y el ritmo y el tipo de heces y disminuyen el riesgo de infección y de eritema del pañal27. La administración en los primeros meses de vida de leche de fórmula enriquecida con galacto y fructooligosacáridos es bien tolerada, mantiene un crecimiento y una masa mineral adecuados, e incrementa de manera significativa y con rapidez el porcentaje de bifidobacterias endógenas y la habilidad para mantener estable la flora intestinal28-30. El uso de leches de continuación, preparados lácteos de crecimiento y otros alimentos infantiles, como papillas, enriquecidos con probióticos y prebióticos promueve un incremento del número y la actividad de lacto y bifidobacterias, una mejor función intestinal y un crecimiento adecuado, como pone de manifiesto el hecho de que el suplemento de una papilla con 2-4 g/día de FOS en lactantes a partir del cuarto mes y seguidos durante 8 semanas produce un aumento altamente significativo de unidades formadoras de colonias (UFC) de bifidobacterias por gramo de heces significativamente superior al grupo control (29,8 x 109 frente a 7,3 x 109; p < 0,01) y de lactobacilos (2,8 x 109 frente a 1,3 x 107; p < 0,05)9,31,32.
ENFERMEDADES GASTROINTESTINALES
Existen claras evidencias de los efectos nutricionales, preventivos y terapéuticos de los probióticos (Lactobacillus casei rhamnosus LGG, L. casei, L. reuteri, L. plantarum, L. salivarius, L. johnsonii, B. bifidum, Streptococcus thermophilus y Saccharomices boulardii) sobre las enfermedades del tracto gastrointestinal, en la diarrea aguda viral o bacteriana, postantibióticos y quimioterápicos, del viajero, en la intolerancia a la lactosa, en la alergia a alimentos, en la colitis, en el síndrome del colon irritable, en la enfermedad inflamatoria intestinal, en la inhibición de la colonización gástrica y actividad del Helicobacter pylori, en el estreñimiento y en el cáncer7,33.
Diarrea aguda
El tracto gastrointestinal no es sólo importante en la homeostasis por su papel principal en la digestión y absorción, sino también por su función inmunomoduladora. El intestino es un importantísimo órgano linfático y la mucosa intestinal es una barrera protectora contra la colonización de patógenos y contra antígenos, ya sean microorganismos o alimentos. El control de las infecciones mediante estrategias diferentes de la antibioterapia, que lleva implícitos el riesgo de desarrollo de resistencias y la disminución de la flora no patógena, se convierte en una prioridad. El uso de probióticos representa una alternativa biometabólica prometedora en la prevención y el tratamiento de la diarrea34.
En cuanto a los mecanismos potenciales del efecto de los probióticos en la enfermedad diarreica, se debe tener presente7,14,35-47:
1. La producción de sustancias antibacterianas (bacteriocinas, lactacinas, lactocinas, helveticinas, bifidinas, etc.). La inhibición de la adhesión de patógenos y la competición por receptores en la mucosa intestinal.
2. La producción de ácidos grasos de cadena corta, que acidifican el lumen intestinal, inhibiendo bacterias, como las coliformes, y manteniendo el trofismo de la mucosa.
3. La disminución de la permeabilidad intestinal.
4. La acción competitiva de estos agentes por nutrientes luminales.
5. La inmunomodulación: el aumento de la IgA secretora, la regulación de citocinas intestinales y de la respuesta inmunitaria contra patógenos.
Se ha demostrado la inhibición de la adherencia de patógenos y actividad bacteriana utilizando un cultivo de la línea celular Caco-2 en un modelo in vitro, tras la administración de Lactobacillus casei rhamnosus (Lcr35)34. Junto al aporte de probióticos, la administración de prebióticos favorece la multiplicación de las bifidobacterias y los lactobacilos, que compiten con los receptores de los patógenos en la mucosa intestinal, favoreciendo por tanto una acción antiinfecciosa48.
Lactobacillus casei rhamnosus (Lcr 35) es un buen ejemplo de la eficacia de los probióticos contra la colonización y crecimiento de patógenos en el tracto gastrointestinal, ya que inhibe la adherencia del E. colli enteropatógeno (EPEC), E. colli enterotoxigénico (ETEC) y Klebsiella pneumoniae a la mucosa intestinal, y presenta una actividad antibacteriana con inhibición del crecimiento de K. pneumoniae, Shigella flexneri, Salmonella typhimurium, Enterobacter cloacae, Pseudomona aeruginosa, Enterococcus faecalis y Clostridium difficile34. Se ha demostrado una distinta adherencia de las diferentes cepas comerciales de probióticos a la mucosa intestinal, desplazando a los patógenos49 (tabla IV).
Prevención de la diarrea aguda
El uso de probióticos en la prevención de la diarrea en la infancia se inició al comienzo de la década de los noventa en un estudio en niños de 5-24 meses de edad con prolongada hospitalización por enfermedad extraintestinal. Los niños fueron aleatorizados, recibiendo unos una fórmula infantil estándar y otros una suplementada con Bifidobacterium y S. thermophilus durante 17 meses. Sólo el 7% de los que recibieron probióticos desarrolló diarrea, frente a un 31% del grupo control50. En un estudio en niños de 6-24 meses de edad malnutridos, pertenecientes a una población indígena peruana, que recibieron LGG o placebo 6 días/semana durante 15 meses, los que reciben probiótico presentaron significativamente menos episodios de diarrea/niño/año y la diarrea estaba menos presente en los mayores de 18 meses, en especial en los no alimentados con leche materna51.
En un estudio aleatorizado, doble ciego, controlado con placebo, en niños de 1-36 meses de edad hospitalizados por razones extraintestinales, en un grupo se administraron 6 x 109 UFC/día de LGG y en otro placebo. El grupo control desarrolló diarrea por rotavirus más frecuentemente que el que recibió probióticos, seis frente a un episodio (16,7 frente a 2,2%), así como para todos los tipos de episodios de diarrea, 12 por sólo tres (33,3 frente a 6,6%; p < 0,002). Niños menores de 2 años que asisten a guarderías, alimentados con leche enriquecida con probióticos, presentan menos episodios infecciosos y menos días de ausencia por enfermedad que los controles. Todos estos estudios ponen de manifiesto el valor de los probióticos como preventivos de infección, especialmente de diarrea por rotavirus52,53.
Tratamiento de la diarrea aguda
En 1991, Isolauri puso de manifiesto el efecto beneficioso de los probióticos en la diarrea aguda. En niños bien nutridos de 4-45 meses de edad, ingresados en el hospital por diarrea, se administró a un grupo leche fermentada enriquecida en L49 y a otro grupo placebo. En los que recibieron probiótico se redujo significativamente la duración de la diarrea (p < 0,001; en el 82% la infección es por rotavirus). Cuando se analizó sólo el grupo de infección por rotavirus, el descenso de la duración de diarrea fue más significativo. En la convalecencia, el 90% del grupo que recibió LGG desarrolló anticuerpos IgA específicos a rotavirus, frente a sólo el 45% del grupo control54. En un estudio aleatorizado y controlado, pero no ciego, el grupo de niños con deshidratación media o moderada que recibió LGG a dosis de 3 x 107 UFC presentó una duración significativamente menor de la diarrea que el grupo control. El 61% tenía rotavirus y la persistencia en heces fue también significativamente menor en el grupo que recibió probióticos (p < 0,002)55.
En un reciente estudio multicéntrico, doble ciego, controlado con placebo, que comprende a niños de 1 mes a 3 años de 11 países europeos, Egipto e Israel ingresados en el hospital por diarrea aguda causada en el 35% de los casos por rotavirus, en el 32,6% por bacterias o protozoos y en el 32,4% por etiología no determinada, se administró a un grupo LGG a dosis de 1010 UFC/250 ml de solución de rehidratación oral (SRO ad libitum) y al otro placebo. La duración de la diarrea fue de 71,9-35,8 h en los pacientes del grupo placebo y de 58,3-27,6 en el grupo LGG (p < 0,003). Los más beneficiados fueron los afectados por rotavirus, con una duración de 56,2-16,9 h, frente a 76,6-41,6 h en el grupo control (p < 0,008). Cuando se valoró el porcentaje de pacientes en que la diarrea duró más de 6 días, sólo estuvo presente en el 2,7% en el grupo LGG, frente al 10,7% en el grupo control (p < 0,001). En los niños con etiología bacteriana demostrada, las diferencias entre los dos grupos no fueron significativas56 (tabla V).
En un grupo de niños con diverso grado de malnutrición y con diarrea moderada o severa, a los que se les administró LGG, la persistencia de la diarrea acuosa a las 48 h fue significativamente más baja que en el grupo control (31 frente a 75%). Las diferencias no fueron significativas en los niños con diarrea sanguinolenta57. También en otro estudio en niños de 6-36 meses ingresados en el hospital por diarrea aguda, en los que recibieron L. reuteri a dosis de 1010-1011 UFC/día la persistencia de la diarrea acuosa al segundo día de tratamiento fue significativamente más baja que en los controles (26 frente a 81%)58.
En un metaanálisis sobre el tratamiento con lactobacilos de la diarrea infecciosa en niños, que abarca las publicaciones comprendidas entre el año 1996 y el 2000, en el que se seleccionaron aquellos estudios que estaban bien controlados con distribución aleatoria y carácter ciego, se demuestra que la duración de la diarrea se redujo a 0,7 días (IC del 95%, 0,3-1,2) y que su frecuencia disminuyó en 1,6 deposiciones al segundo día de tratamiento (IC del 95%, 0,7-2,6). Los resultados sugieren que los lactobacilos constituyen un tratamiento inocuo y eficaz en los niños afectados por diarrea infecciosa, sobre todo por rotavirus, y que la eficacia se produce sobre todo por encima de la dosis umbral de 1010 UFC durante los primeros 2 días. Aunque la mayoría de los estudios se ha efectuado en poblaciones de niños hospitalizados, cabe hacer extensivas las conclusiones del metaanálisis a las poblaciones ambulatorias con diarrea. Los beneficios de los probióticos no se limitan a la reducción y frecuencia de la diarrea, sino que también tienen implicaciones socioeconómicas favorables, como su menor coste terapéutico, menos coste en pañales, menos días de asistencia sanitaria y menos días de absentismo laboral de los padres y escolar de los niños59,60.
Es interesante destacar que no todos los probióticos tienen el mismo efecto; así, la menor duración de la diarrea y la mayor respuesta de IgA secretora se produce en niños que recibieron LGG con relación a los que recibieron L. rhamnosus o una combinación de S. thermophilus y L. delbruckii59. También que el efecto que tienen los probióticos en la prevención y el tratamiento de la diarrea por rotavirus sugiere que el mecanismo principal está más relacionado con el aumento de la defensa inmunológica local que con la multiplicación de las bacterias amigas.
Diarrea asociada a antibióticos
El uso de antibióticos puede producir diarrea al alterar el equilibrio de la flora intestinal, con un descenso de los lactobacilos y bifidobacterias, que son causantes de la resistencia a la colonización por patógenos, produciéndose infecciones por gérmenes oportunistas, fundamentalmente Clostridium difficile, que ha emergido como el mayor responsable enteropatógeno de la diarrea asociada a antibióticos. Otros agentes infecciosos causantes son Klebsiella oxytoca, C. perfringens, S. aureus, Candida spp. y Salmonella spp. Alrededor de un tercio de los niños que reciben antibióticos de amplio espectro (fundamentalmente aquellos que actúan en anaerobiosis, en especial aminopenicilinas, una combinación de aminopenicilinas y ácido clavulánico, cefalosporinas y clindamicina) puede desarrollar desde una diarrea leve hasta una colitis seudomembranosa fulminante. El uso de probióticos se ha convertido en una alternativa beneficiosa para evitar o minimizar el efecto de los antibióticos sobre la flora, y para disminuir el número de recurrencias por C. difficile. Estudios bien controlados en niños de 6 meses a 10 años tratados con antibióticos orales (amoxicilina, amoxicilina y ácido clavulánico o cefalosporinas) por infecciones agudas respiratorias (otitis, faringitis, bronquitis y sinusitis), urinarias, de tejidos blandos y piel y a los que se les administró simultáneamente LGG en cápsulas (2 x 1010 UFC/día) presentaron menor incidencia de diarrea (8 frente a 26%; p < 0,05), menor duración (4,70 frente a 5,88 días; p < 0,05) y menor intensidad (menos frecuencia de deposiciones y más consistencia de las mismas: 17 frente a 48%; p < 0,02) en relación con el grupo placebo33,61-64. En otro grupo de niños con una edad media 4-5 años en tratamiento antibiótico por enfermedad respiratoria aguda, la incidencia de diarrea fue del 5% en los que recibieron LGG a dosis de 2 x 1010 UFC/2/día, mientras que en el grupo placebo fue del 16%, una diferencia significativamente alta65.
En niños de 1-4 años con diarrea persistente por C. difficile con toxina B positiva en heces, la administración de S. boulardii a dosis de 500-1.000 mg/día hace que a la primera semana cedan los síntomas en el 95% de los niños y a los 15 días desaparezca la toxina B de las heces. El 11% tuvo una recaída, que se resolvió con un segundo tratamiento66. LGG también ha sido utilizado con éxito en el tratamiento de las recaídas por C. difficile14.
En un reciente metaanálisis de publicaciones comprendidas entre los años 1996 y 2000 que tenía como objetivo estudiar el efecto de los probióticos en la prevención de la diarrea asociada a antibióticos, se pone de manifiesto que tanto los lactobacilos como S. boulardii son beneficiosos. La ods ratio en favor del tratamiento con probióticos sobre el placebo es de 0,39 (IC del 95%, 0,25-0,62; p < 0,001) para Saccharomyces y de 0,34 (IC del 95%, 0,19-0,61; p < 0,01) para Lactobacillus. Los autores concluyen afirmando la necesidad de valorar los costes y el uso rutinario de estos agentes a través de estudios de larga duración en los que los probióticos sean usados como agentes preventivos67.
Diarrea del viajero
Un porcentaje importante de viajeros que visitan áreas geográficas de alto riesgo infeccioso desarrollan diarrea aguda, aunque en la mayoría de los casos es limitada y poco intensa. La antibioterapia es una profilaxis efectiva, pero no es recomendable su uso generalizado, por lo que la existencia de alternativas terapéuticas es importante. El uso de probióticos se ha manifestado preventivo en algunos estudios, pero en otros no. La administración de L. rhamnosus y, en especial, S. boulardii ha demostrado alguna efectividad, lo que puede indicar distintos mecanismos de acción entre la levadura y la bacteria probiótica68-70.
Diarrea como complicación de la alimentación parenteral en pacientes críticamente enfermos
Los pacientes críticamente enfermos con frecuencia presentan fallo multiorgánico, infecciones y reciben antibióticos de amplio espectro. El tipo de dieta occidental que reciben habitualmente, en muchas ocasiones favorecedora de una escasa combinación de bacterias «buenas», junto a la nutrición parenteral, hace a los pacientes más susceptibles a la infección, al alterar los procesos normales de digestión, favorecer la atrofia de la mucosa intestinal y la translocación microbiana colónica.
Sin embargo, la administración lo más temprana posible de una alimentación enteral aporta compuestos no digeribles con efecto prebiótico, favoreciendo la adherencia de las células natural killer, el número de linfocitos y la respuesta a la estimulación antigénica, el crecimiento de flora probiótica y, además, aportan nutrientes como ácidos grasos de cadena corta, ácidos grasos poliinsaturados, aminoácidos, poliaminas, vitaminas, antioxidantes, factores de crecimiento y factores de coagulación al ecosistema intestinal. Una revisión de los artículos publicados entre 1980 y 2001 sobre uso de probióticos ofrece resultados conflictivos. La insuficiente evidencia de su beneficio no aconseja de momento su uso rutinario71.
Enterocolitis necrosante neonatal (NEC)
Es un síndrome adquirido que afecta al tracto gastrointestinal, que se presenta fundamentalmente en recién nacidos pretérmino y de bajo peso al nacimiento. Es definida como una necrosis isquémica inflamatoria del intestino, en cuyo desarrollo confluyen la colonización bacteriana del tracto intestinal y la disponibilidad de un sustrato nutricional, en especial leche de fórmula, que favorecen el crecimiento bacteriano y el desarrollo de la isquemia. Esto induce una cascada inflamatoria con incremento de los valores séricos de citocinas, como IL-6, TNF-α, factor activador plaquetario (PAF) y óxido nítrico (NO), favoreciendo la apoptosis del villi intestinal72.
El menor riesgo de desarrollar NEC en recién nacidos alimentados con leche materna está en relación con su contenido de factores inmunoprotectores, inmunomoduladores, antimicrobianos y antiinflamatorios. Por el contrario, en los alimentados con leche de fórmula infantil predominan las bacterias E. coli, bacteroides y otros anaerobios y hay menos bifidobacterias. Por ello, una alternativa preventivo-terapéutica de la NEC sería evitar el crecimiento de patógenos mediante la administración de probióticos para colonizar el intestino con flora no patógena. Estudios experimentales en animales demuestran que la administración de bifidobacterias que colonizan el intestino disminuye significativamente el riesgo de NEC. En recién nacidos, la administración de LGG (6-109 UFC/día) es efectiva en la colonización intestinal y reduce el riesgo de NEC. De la misma forma, en recién nacidos de unidades de cuidados intensivos, la administración de L. acidophilus 2,5 x 107 UFC y B. infantis 2,5 x 107 UFC/día disminuye significativamente la incidencia de NEC en relación con el grupo placebo (2,8 frente a 6,6%; p < 0,0002)73,74.
Síndrome de sobrecrecimiento bacteriano en el intestino delgado
Es una complicación común del síndrome del intestino corto y también de los trastornos crónicos de la motilidad intestinal, como la seudoobstrucción intestinal, aunque puede ocurrir también en ausencia de defectos anatómicos o funcionales. El síndrome se caracteriza por distensión abdominal, diarrea intratable y malabsorción. La administración de terapia probiótica con L. plantarum 299V y LGG ha sido exitosa en estos pacientes. Pero debe tenerse en cuenta que una complicación incidente en el síndrome de intestino corto es la acidosis láctica, que es un cuadro de encefalopatía ligado a la producción de D-lactato por actividad metabólica intraluminal de algunos lactobacilos. Por ello, es importante que los lactobacilos a administrar produzcan L-lactato, como ocurre con el L-GG, que desplaza las bacterias que producen D-lactato, y en consecuencia no se desarrollan episodios de acidosis. El uso de L-GG a dosis de 2 x 1010 UFC/día durante 18 meses evitó la aparición de episodios75,76.
Colon irritable
Un estudio sugiere que la administración de lactobacilos a pacientes con colon irritable mejora su estado clínico, con una disminución del dolor y la distensión abdominal77.
Enfermedad inflamatoria intestinal (EII)
La predisposición genética, las alteraciones inmunológicas y las bacterias patógenas interactúan como agentes desencadenantes y perpetuadores de la enfermedad inflamatoria intestinal. Así, la patogenia de la EII, en especial de la enfermedad de Crohn, está relacionada con la desregulación de la respuesta inmunitaria de la mucosa intestinal a los antígenos. La tolerancia a la propia flora intestinal está disminuida, con una menor concentración de bifidobacterias y un valor más elevado de microorganismos patógenos, como Klebsiella o Bacteroides vulgatus. La administración de probióticos, como una terapia de antagonismo bacteriano, es capaz de desplazar las bacterias con potencial patógeno, con el subsiguiente aumento de bifidobacterias, modificando favorablemente la inadecuada o exagerada respuesta inflamatoria, mejorando el epitelio intestinal y disminuyendo los síntomas78. Así, mientras las bacterias patógenas inducen la expresión de citocinas proinflamatorias, como la IL-2, 6, 8, el TNF-α y el MCP-1 en las células epiteliales intestinales, algunos probióticos estimularían el factor TGF-β implicado en la regulación de la barrera intestinal39,79-83.
En animales deficientes en IL-10 y en receptores «naïve» de células T activas frente a la flora, se desarrolla espontáneamente colitis en presencia de bacterias luminales, pero no si el intestino está libre de gérmenes. En ellos se demuestra una menor concentración de lactobacilos, una mayor translocación bacteriana y un número más elevado de bacterias adheridas a la mucosa. Estos estudios demuestran que el tratamiento con Lactococcus lactis, probiótico obtenido por ingeniería genética, que secreta IL-10, actúa con éxito en la colitis84. Otros estudios observan que la administración de L. reuteri R2LC y L. plantarum DSM 9843 se asocia a una menor permeabilidad intestinal, translocación bacteriana y concentración de endotoxinas y mejoría clínica.
En niños y adultos, la administración de LGG, L. plantarum, L. brevis, E. coli no patógeno, Bifidobacterium adolescentis y S. boulardii no produce el efecto proinflamatorio de los patógenos y sí uno antiinflamatorio, que mejora los síntomas y prolonga su remisión. Esto se puso de manifiesto en un reciente estudio en niños de 10 a 18 años con enfermedad de Crohn, con un índice de actividad > 10 (PCDAI), a los que se administró durante 24 meses LGG a dosis de 107-109 UFC/g, descendiendo significativamente la permeabilidad intestinal, mejorando la clínica y disminuyendo el índice de actividad a 5. Es interesante destacar los efectos positivos de una preparación probiótica, consistente en la combinación de 3 especies de bifidobacterias, 4 cepas de lactobacilos y una cepa de estreptococos, en el mantenimiento de la remisión de la colitis ulcerosa y bursitis y en la prevención de la recurrencia postoperatoria de la enfermedad de Crohn80,81,85.
En el estudio de la EII se sugiere que el análisis del patrón de citocinas intracelulares en la sangre periférica podría diferenciar entre enfermedad de Crohn y colitis ulcerosa, con un predominio de citocinas tipo Th1 en la primera y tipo Th2 en la segunda. Estos estudios han sido realizados fundamentalmente en adultos después de varios años de enfermedad y de varias intervenciones terapéuticas, hipotetizando la posible influencia de estos factores en dichos patrones. Para valorar esta posibilidad se ha estudiado a niños en fase inicial de la enfermedad, y se han demostrado diferencias con los patrones de citocinas del adultnsar que el perfil inflamatorio en células de sangre periférica es variable, dependiendo del tiempo de evolución de la enfermedad y de las terapias utilizadas. Por tanto, sería importante determinar cuál es la mejor terapia en el momento del diagnóstico de la enfermeda d en el niño y el papel de las distintas cepas de probióticos naturales u obtenidas por ingeniería génica en la modificación del patrón inflamatorio y en la respuesta a las intervenciones terapéuticas en las dos variedades de presentación de EII86.
Infección por Helicobacter pylori
Es un patógeno gramnegativo responsable de la gastritis tipo B y la úlcera péptica. Su relación con la patogenia del cáncer gástrico no está confirmada. Tanto en experimentación animal, in vitro, como en humanos se ha demostrado que algunos probióticos son antagonistas de Helicobacter pylori, inhibiendo la colonización gástrica e impidiendo el desarrollo de la enfermedad relacionada. Así, Lactobacillus salivarius, L. johnsonii y otros inhiben la colonización por H. pylori en la mucosa del estómago y la actividad de la enzima ureasa necesaria para que el patógeno permanezca en el ambiente ácido gástrico. Por tanto, son eficaces en su erradicación en humanos70,87,88.
ENFERMEDADES EXTRAINTESTINALES
Probióticos e infecciones respiratorias en guarderías
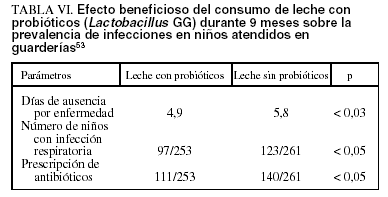
En estudios realizados en niños de 1 a 6 años que asisten a guarderías se demuestra que los niños que reciben leches con Lactobacillus rhamnosus GG presentan menor absentismo escolar por enfermedad (p < 0,05), incidencia de infecciones respiratorias (p < 0,05) y utilización de antibióticos (p < 0,05) que los niños que reciben leche sin suplementar con probióticos53 (tabla VI).
Probióticos y fibrosis quística
Lactobacillus GG administrado a pacientes con fibrosis quística parece estar en relación con la reducción de la incidencia de infecciones respiratorias graves89.
Probióticos e infecciones del tracto urogenital
Excluyendo las infecciones de transmisión sexual, la mayoría de las infecciones de la vagina y vejiga es causada por microorganismos que son originarios del intestino. Existe una clara correlación entre la presencia de comensales, particularmente lactobacilos, en la vagina y la ausencia de infección; a la inversa, el riesgo de infecciones urogenitales se relaciona con ausencia de lactobacilos90,91.
Algunos probióticos administrados en alimentos o en preparaciones tópicas pueden tener un importante papel en la prevención de las infecciones del tracto urogenital, ya que determinadas cepas de lactobacilos podrían inhibir la acción bacteriana patógena acidificando el medio. La administración oral o vaginal de lactobacilos es útil en el tratamiento de la vulvovaginitis bacteriana92. Así, la administración oral de L. rhamnosus GR-1, que coloniza el intestino y la vagina, y L. fermentum RC-14 es eficaz en la protección contra la infección del tracto urogenital por E. coli y Enterococcus faecalis, al disminuir la adhesión de los patógenos a las células uroepiteliales, competir por sus receptores y aumentar la producción de inhibidores del crecimiento de éstos90. También la aplicación vaginal de cápsulas de lactobacilos cepas GR-1 y B-54 restaura la flora dominante de lactobacilos en la vagina y reducen el riesgo de recurrencia de infección del tracto urinario93. Por tanto, el control de las infecciones extraintestinales mediante estrategias diferentes de la antibioterapia, debido al desarrollo de resistencia a cepas patógenas y la disminución de la flora protectora, como es el uso de probióticos representa una alternativa prometedora34.
ENFERMEDADES METABÓLICO-NUTRICIONALES
Protección cardiovascular: perfil lipídico, insulinemia y presión arterial
El capítulo del Dr. Ros publicado en este Suplemento especial describe en profundidad cómo la administración de prebióticos o probióticos puede tener un efecto beneficioso sobre el perfil lipídico. También se ha sugerido un efecto favorable en la glucemia e insulinemia posprandial94-98 (tabla VII).
En estudios recientes en humanos y animales, tanto normo como hipercolesterolémicos, la ingesta de probióticos como L. reuteri, L. sporogenes, S. thermophilus y E. faecium demuestra un descenso significativo de los valores de colesterol total (CT), colesterol unido a lipoproteínas de baja densidad (cLDL), lipoproteínas de muy baja densidad (VLDL) y triglicéridos (Tg) y un incremento del colesterol unido a lipoproteínas de alta densidad (cHDL), de la razón HDL/cLDL y del fibrinógeno99,100. La administración de L. helveticus y S. cerevisiae parece reducir la presión arterial sistólica y diastólica. En consecuencia, el consumo regular de probióticos y prebióticos puede proporcionar un modesto efecto profiláctico contra la enfermedad cardíaca7,101.
Intolerancia a la lactosa
Alrededor del 70% de la población mundial, siguiendo un gradiente norte-sur, presenta intolerancia a la lactosa relacionada con la disminución de la actividad de la lactasa en la mucosa intestinal, genéticamente determinada. Como consecuencia, la lactosa no digerida alcanza el intestino distal y es fermentada por la flora colónica, con producción de agua, ácidos grasos de cadena corta y gas, que dan lugar a los síntomas comunes de la intolerancia, como son el dolor abdominal, la flatulencia y la diarrea.
Nuestros estudios en niños, estudiantes de medicina y adultos de Galicia sobre intolerancia a la lactosa, mediante el test de hidrógeno espirado (BH2) con la administración de diversas cantidades de lactosa y diferentes vehículos (agua, leche y yogur), demuestran que la cantidad y el vehículo son importantes indicadores del área bajo la curva de hidrógeno y de los síntomas, pero también ponen de manifiesto que, aun con la misma cantidad de lactosa, cuando el vehículo es el yogur, desciende significativamente el área bajo la curva de hidrógeno espirado en relación con la leche, y muy especialmente con agua. En consecuencia, los alimentos lácteos fermentados, como el yogur que contiene L. bulgaricus y S. thermophilus, al favorecer la digestión de la lactosa y la absorción completa de sus monosacáridos, glucosa y galactosa hacen desaparecer o aliviar los síntomas gastrointestinales de intolerancia. Esto parece debido a que aproximadamente un 25-50% de la lactosa contenida en el yogur es hidrolizada a ácido láctico durante el proceso de fermentación, ya que los lactobacilos contienen lactasa (β-galactosidasa), que facilita la hidrólisis de la lactosa en el tracto gastrointestinal. Además, el tiempo de tránsito intestinal está disminuido tras la ingesta de yogur en comparación con el de la leche17,33,102. Es de destacar que la eficacia de la acción de los probióticos del yogur en la intolerancia a la lactosa está condicionada por la integridad de la pared bacteriana, ya que actúa como una protección mecánica de la lactasa durante el tránsito gástrico, permitiendo su liberación en el intestino delgado. Así, al comparar la eficacia de la ingesta de yogur con gérmenes viables, muertos por irradiación con pared intacta o muertos y centrifugados, con pared rota, se demuestra que ésta es similar entre gérmenes vivos y muertos con pared intacta, pero significativamente superior que cuando está rota. Además, los productos lácteos fermentados favorecen también la absorción de calcio y su biodisponibilidad103-105. La administración de leches con lactobacilos y bifidobacterias mejora también la digestión de lactosa y favorecen su tolerancia105-107 (tabla VIII).
En niños con deficiencia de sacarasa se ha observado una mejor digestión de sacarosa al consumir Saccharomyces cerevisiae, aun cuando su importancia en el tratamiento de la deficiencia de sacarasa no esté bien establecido33.
Micronutrientes, prebióticos y probióticos
La administración de prebióticos (inulina, oligofructosa, glucooligosacáridos y galactooligosacáridos como la lactulosa) parece estimular la absorción y retención de varios minerales y mejorar la mineralización ósea. La mayoría de las evidencias científicas de este efecto se obtiene en experiencias en animales, donde se demuestra una mayor absorción y biodisponibilidad, especialmente calcio y, en menor proporción, magnesio, zinc y hierro. Así, la oligofructosa previene la pérdida de estructura trabecular en ratas ovaritomizadas, especialmente cuando la ingesta de calcio es elevada y su efecto estimulante sobre el metabolismo óseo es dependiente de la dosis109-111. Estos hallazgos se demuestran recientemente en algunos, pero no en todos, los estudios en humanos. Los hallazgos contradictorios parecen debidos a que los efectos de los prebióticos sobre el metabolismo óseo podrían ser dependientes del tipo de hidrato de carbono, del índice de fermentación por la flora intestinal, de la dosis ingerida, del tiempo de administración, del contenido de calcio en la dieta, de la parte del esqueleto estudiada y de la edad del sujeto109-112.
La administración de probióticos (L. bulgaricus, B. longum, S. thermophilus) también parece tener importantes beneficios en la absorción de minerales, en la síntesis de ácido fólico, de vitamina B6 y B12 y en su biodisponibilidad, al favorecer la hidrólisis de proteínas y grasas7. Favorece también la producción de ácidos grasos de cadena corta con funciones energética, de integridad y función de la mucosa colónica y mantenimiento de pH adecuado en el marco colónico, que es crítico en la expresión de las enzimas bacterianas y el metabolismo de carcinógenos.
PROBIOTICOS, ALERGIA Y VACUNAS
La prevalencia de la enfermedad atópica se ha incrementado notablemente, afectando por lo que se refiere a la dermatitis al 15-20% de los niños de los países desarrollados, siendo urgente establecer estrategias de prevención primaria113.
La administración de leche materna, además de ser el patrón de oro de la alimentación para un óptimo crecimiento y desarrollo de los lactantes, proporciona protección inmunológica en un período crítico de la vida, donde los mecanismos de defensa son inmaduros. Así, durante los primeros meses de vida desciende la producción endógena del factor de crecimiento transformador β (TGF-β), elemento clave inmunorregulador de la promoción de la producción de IgA y la inducción de la tolerancia oral. La leche manterna constituye una fuente exógena muy importante, como demuestra el hecho de que la concentración de TGF-β en el calostro se correlaciona con la habilidad del lactante para producir anticuerpos IgA contra antígenos de la dieta y previene la enfermedad atópica durante el período exclusivo de lactancia materna114. Como la enfermedad atópica tiene un fuerte componente hereditario, la atopia materna constituye un riesgo para el lactante. La administración de probióticos a las mujeres durante el embarazo y la lactancia debe conferir una capacidad inmunomoduladora adicional en la protección de la enfermedad atópica de su hijo. Así, cuando se administra durante el último mes de embarazo y en el período de lactancia a mujeres con historia familiar de atopia, Lactobacillus rhamnosus cepa GG (ATCC 53103) a dosis diaria de 2 x 1010 UFC o placebo se demuestra un aumento significativo de la concentración del factor antiinflamatorio TGF-β2 (2.885 pg/ml en la leche de madres que reciben el probiótico frente a 1.340 pg/ml en el grupo placebo; p < 0,018), y el riesgo de que se desarrolle eccema atópico en sus hijos durante los primeros 2 años de vida se reduce significativamente (15 frente a 47%; p < 0,0098). Además, sólo el 25% de los hijos de madres que recibieron probióticos tiene recaídas del eccema, frente al 55% de los del grupo placebo (p < 0,065). Los lactantes que más se benefician son aquellos con las concentraciones de IgE más elevadas en la sangre del cordón (> 0,5 kU/l), reflejo de la sensibilización atópica en útero, como demuestra la alta concentación de TGF-β2 en la leche de las madres que reciben probiótico en relación con las del grupo placebo (5.085 frente a 1.136 pg/ml; p < 0,021). Estos hallazgos ponen de manifiesto que los probióticos ejercen sus efectos sobre los mecanismos inmunológicos implicados en el desarrollo de atopia, potenciando los efectos de la leche materna22,115-117.
En niños, la administración de LGG mejora tanto la extensión y la intensidad del eccema como la tendencia a la remisión, demostrándose un incremento de la citocina antiinflamatoria IL-10 y de TGF-β y disminución de TNFα. La administración de LGG adicionada a la fórmula hidrolizada en niños con afección inflamatoria intestinal relacionada con alergia a la leche de vaca, produce una mejoría de la sintomatología de la dermatitis atópica, acompañada de una menor concentración de TNF-α en las heces118-119.
La mayor exposición del recién nacido a organismos nosocomiales por cesárea, nido, etc., limitando por tanto el contacto con la flora de la madre, favorece el riesgo de atopia. La evidencia en niños atópicos a los 2 años de edad de una menor colonización por lactobacilos y mayor de coliformes y S. aureus, pone de manifiesto que una baja tasa en los primeros meses de la vida de bacterias probióticas en relación con los patógenos es un factor importante en el desarrollo de la atopia. La reciente demostración de una desregulación en la producción de IL-13 por células T CD4+ de la sangre de cordón, que lleva a una producción de valores elevados de la misma en lactantes que en el primer año de vida desarrollan enfermedad atópica y la asociación hallada entre el polimorfismo del gen IL-13, concentraciones séricas elevadas de IgE e incremento de riesgo de asma y dermatitis atópica, son argumentos que evidencian la necesidad de identificar precozmente a los recién nacidos y lactantes con riesgo de atopia para iniciar su prevención inmediata, en la que los probióticos, al atenuar la respuesta alérgica e incrementar la respuesta inmunitaria, pueden desempeñar un papel. La alternativa terapéutica potencial para la prevención de la enfermedad atópica que significa el uso de probióticos está, por tanto, relacionada con la precocidad de su administración116-125.
Los probióticos son agentes que potencian el efecto inmunogénico de las vacunas orales. Así, la administración de vacuna oral de rotavirus asociada a L. casei GG en lactantes de 2-5 meses de edad produce una mayor respuesta de IgM específica y una mayor seroconversión de IgA y anticuerpos IgA específicos. En experimentación animal se obtiene en crías una protecci ón pasiva mayor contra la diarrea producida por rotavirus, asociada a una concentración elevada de IgA, antirrotavirus de la leche de madres lactantes que reciben B. breve e inmunizadas con rotavirus en relación con aquellos cuyas madres reciben placebo. La modificación por ingeniería genética de probióticos y su utilización como vehículos de antígenos pueden ayudar a inducir la inmunización oral y la tolerancia inmunológica126,127.
CÁNCER DE COLON, PROBIÓTICOS Y PREBIÓTICOS
Un número importante de bacterias intestinales produce carcinógenos o compuestos estimuladores de tumores durante su metabolismo, como diacilgliceroles, fecapentaenos, nitrosaminas, 7-hidroxi IQ, etc. Burns y Rowland revisan este tema en profundidad en otro capítulo de este Suplemento.
En experimentación animal, la administración de lactobacilos y bifidobacterias disminuye el número de criptas aberrantes, un marcador de riesgo de desarrollo de cáncer, después de un tratamiento con carcinógenos químicos. En humanos, la administración de probióticos también podría tener algún beneficio en la prevención del cáncer colorrectal, por sus efectos en la disminución o supresión de la microflora productora de mutágenos y carcinógenos, la producción de antimutágenos y anticancerígenos y la estimulación del sistema inmunológico. Así, la administración de L. acidophilus, L. casei, LGG y B. longum reduciría el riesgo mutagénico y genotóxico para cáncer de colon, vejiga, etc.7,128.
También se ha demostrado en experimentación animal un efecto protector de los prebióticos, que inducen cambios en la población y características metabólicas de las bacterias gastrointestinales, modulan la inmunidad entérica y sistémica y protegen de los efectos de los carcinógenos. La administración de una dieta con oligofructosa e inulina disminuye la incidencia de criptas aberrantes en el colon distal del ratón, después de la exposición a dimetilhidracina, y la incidencia y mortalidad por infecciones entéricas y sistémicas. Los mecanismos patogénicos que justifican el aumento de la resistencia a las infecciones por la dieta con prebióticos no fueron aclarados, pero los hallazgos se explican por cambios en la función inmunológica en respuesta a modificaciones en la composición y las características metabólicas de las bacterias residentes en el tracto gastrointestinal129.
Un efecto similar para la protección del desarrollo de criptas aberrantes en el colon de ratas se demuestra con la administración de simbióticos, compuestos por una asociación de Bifidobacterium longum e inulina130.
DIETA RICA EN ALIMENTOS FUNCIONALES. DIETA MEDITERRÁNEA Y ATLÁNTICA
Hasta finales del siglo xx, la meta en la alimentación humana se relacionaba con asegurar un aporte adecuado de energía y de macro y micronutrientes en la dieta. Hoy día está naciendo un nuevo concepto de nutrición, la nutracéutica, cuyo objetivo es la prevención de la enfermedad y la promoción de la salud y el bienestar, ya desde la infancia. La dieta occidental ha llevado progresivamente a un descenso del consumo de alimentos fermentados, con lo que el aporte de microorganismos es escaso. Paralelamente, se ha experimentado también un descenso del aporte de fibra en la dieta, sustrato para la multiplicación de bacterias probióticas. Por ello, no es de extrañar que los astronautas que recibieron una dieta baja en fibra y antioxidantes al retornar a la Tierra tuvieran un número significativamente reducido de bacterias probióticas endógenas. Estos cambios en la dieta coinciden en el tiempo con un incremento notable de enfermedades inflamatorias, como alergia, obesidad, enfermedades cardiovasculares y cáncer18. El consumo de la dieta mediterránea, abundante en cereales, frutas, vegetales, legumbres y aceite de oliva, y la atlántica, rica en pescados azules y blancos, la mayoría frescos y naturales, ricos no sólo en nutrientes sino también en componentes funcionales, se convierte en un desideratum. Además, siempre que sea necesario se deben incorporar otros alimentos de elaboración industrial enriquecidos en componentes funcionales, con propiedades fisiológicas y terapéuticas específicas, es decir, con poder medicinal; una dieta cada vez más de diseño y adaptada a las particularidades fisiológicas de los individuos y las poblaciones. Un programa nutricional que favorezca desde la infancia el consumo de alimentos predominantemente de origen vegetal, combinado con la realización de ejercicio físico regular y el mantenimiento de un peso saludable, tendrá un impacto significativo y positivo en la esperanza y calidad de vida de la población del siglo xxi131-133.
SEGURIDAD Y BIOMARCADORES EN LA UTILIZACIÓN DE ALIMENTOS FUNCIONALES, EN ESPECIAL PROBIÓTICOS
La seguridad y calidad alimentaria son la gran exigencia del siglo xxi. Un buen ejemplo es el de los alimentos probióticos, por su creciente aceptación y demanda por parte de los consumidores, tanto niños como adultos o ancianos y, especialmente, en la población con un nivel socioeconómico y educacional más elevado. En este mercado emergente de probióticos en Europa (Bélgica, Dinamarca, España, Finlandia, Francia, Holanda, Reino Unido y Suecia) un 65% lo representan productos lácteos, donde España ocupa la quinta posición. Además, se observa una tendencia hacia el mayor consumo de estos componentes funcionales en productos no lácteos, sólidos y líquidos (p. ej., Lactobacillus plantarum 299v incorporado a zumos de frutas)134,135. Este elevado consumo motiva una preocupación en el mundo científico sobre la inocuidad y la seguridad de estos alimentos. La falta de regulación en la comercialización de productos probióticos, la escasez de estudios a largo plazo y de cepas de lactobacilos y bifidobacterias viables que hayan sido investigadas en profundidad, la falta del establecimiento de una ingesta máxima, segura y permisible o la escasez de biomarcadores de exposición, de respuesta biológica o funcional específica, o de mejora de salud o de reducción de riesgo de enfermedad, lo suficientemente fiables y sensibles son algunas cuestiones que deberán resolverse, para contrastar y confirmar la seguridad de cada uno de los alimentos probióticos (GRAS, generally regarded as safe) y conseguir así el máximo beneficio para la salud y el bienestar14,136.
Aunque una reciente revisión de 143 ensayos de probióticos en humanos entre 1961-1998, en los que participaron más de 7.500 personas, pone de manifiesto la inexistencia de efectos adversos o secuelas137, debe tenerse en cuenta que son microorganismos vivos y, en teoría, pueden ser responsables de efectos adversos, como infecciones, alteraciones metabólicas o transferencia de genes con otros componentes de la flora. En este sentido, se ha demostrado muy aisladamente fungemia y septicemia en pacientes inmunodeprimidos, pero incluso no inmunodeprimidos, que recibieron S. boulardii y lactobacilos, y endocarditis en pacientes con válvulas cardíacas artificiales, también con lactobacilos. Sin embargo, en un estudio en niños inmunodeprimidos se ha usado con total seguridad Lactobacillus plantarum1,138-140. Han aparecido nuevos desafíos en seguridad a largo plazo relacionados con el desarrollo, por ingeniería genética, de bacterias de diseño con dianas terapéuticas específicas para utilizar ya desde el período neonatal, favoreciendo el desarrollo de una flora saludable de por vida141-143. Todas estas circunstancias ponen de manifiesto que el riesgo cero no existe y, por tanto, la aceptación de que el concepto de probiótico puede tener no sólo efectos positivos, debe ser considerada por sanitarios y consumidores144-146. El reciente problema de la encefalopatía espongiforme es un buen ejemplo de la necesidad de un control riguroso y exhaustivo de la seguridad en alimentación147,148.