PROBIOTICOS, PREBIOTICOS Y SIMBIOTICOS
Según su definición original, un probiótico es un suplemento alimentario microbiano vivo que afecta beneficiosamente al animal huésped, mejorando su equilibrio microbiano intestinal1. Las definiciones recientes son más generales, y omiten el aspecto del equilibrio intestinal. Por ejemplo, Salminen et al2 definen un probiótico como «un ingrediente alimentario microbiano vivo que es beneficioso para la salud». Un microorganismo probiótico debe ser no patogénico y no tóxico y, asimismo, resistente a un pH bajo y a las sales biliares para mejorar sus probabilidades de sobrevivir en el tracto gastrointestinal3. La mayoría de los probióticos pertenece a dos géneros de bacterias productoras de ácido láctico (BAL), Lactobacillus y Bifidobacterium, pero también se utilizan Saccharomyces y Enterococcus. Muchas de las bacterias utilizadas para los preparados probióticos se han aislado a partir de muestras fecales humanas para maximizar la probabilidad de una compatibilidad con la microflora intestinal humana y, en consecuencia, mejorar sus posibilidades de supervivencia.
El concepto de probióticos evolucionó a partir de una teoría propuesta en primer lugar por Metchnikoff, que sugirió que la vida larga y sana de los campesinos búlgaros podría atribuirse al consumo de productos a base de leche fermentada. Diversos beneficios para la salud se han asociado a las BAL, como una mejora de la intolerancia a la lactosa, la regulación de la estasis gastrointestinal, resistencia a las enfermedades digestivas infecciosas, en especial la diarrea asociada a rotavirus en lactantes, y la inmunomodulación4.
Un prebiótico es un «ingrediente alimentario no digerible que afecta beneficiosamente al huésped estimulando de manera selectiva el desarrollo y la actividad de una o de un número limitado de bacterias del colon que tienen la posibilidad de mejorar la salud del huésped»5. En la categoría de prebióticos se incluye una serie de hidratos de carbono apenas digeridos, como ciertas fibras y almidones resistentes6, pero los prebióticos descritos más ampliamente son los oligosacáridos no digeribles (OND). Son hidratos de carbono de bajo peso molecular con 2-10 grados de polimerización, que apenas son digeridos en el intestino del ser humano, por lo que alcanzan el colon en su mayor parte sin haber sido modificados y actúan como cosustrato de la microflora colónica. Parecen estimular específicamente una serie de bifidobacterias y lactobacilos, a menudo a expensas de otros componentes de la microflora, como los bacteroides, clostridios y E. coli5,7. La combinación de probióticos y prebióticos da lugar a efectos aditivos o sinérgicos sobre la función gastrointestinal. Para esta combinación se ha propuesto el término de simbiótico. Un simbiótico se ha definido como una mezcla de probióticos y prebióticos que afecta beneficiosamente al huésped, mejorando la supervivencia y la implantación de los suplementos dietéticos microbiano vivos en el tracto gastrointestinal al estimular selectivamente el desarrollo y activar el metabolismo de una o un número limitado de bacterias que potencian la salud y, por consiguiente, mejorar el bienestar del huésped5.
PAPEL DE LA FLORA INTESTINAL EN EL CANCER
El elevado número y la diversidad de la microflora intestinal humana se reflejan en su amplia y variada capacidad metabólica, en especial en relación con la biotransformación de xenobióticos, y la síntesis y activación de carcinógenos. Las actividades metabólicas de la microflora intestinal tienen implicaciones de gran alcance para la salud del huésped, dando lugar a efectos tanto beneficiosos como deletéreos8,9.
Las pruebas a partir de una amplia serie de fuentes apoyan la opinión de que la microflora colónica interviene en la etiología del cáncer. Las pruebas principales son las que se mencionan más adelante:
1. Se ha demostrado que las heces humanas son mutagénicas, y se han aislado sustancias genotóxicas de origen bacteriano10.
2. A partir de componentes dietéticos, las bacterias intestinales producen sustancias con una actividad genotóxica, carcinogénica y estimuladora tumoral9.
3. Las bacterias intestinales convierten procarcinógenos en agentes capaces de reaccionar con el ADN.
4. En ratas libres de flora tratadas con el carcinógeno 1,2-dimetilhidracina se identifica una menor incidencia de tumores de colon que en ratas tratadas de forma similar con una microflora normal11.
5. En ratas libres de flora alimentadas con dietas humanas se detectan concentraciones menores de aductos de ADN en tejidos que en ratas convencionales12.
De lo mencionado previamente se deduce que la modificación de la microflora intestinal interferiría con el proceso de carcinogénesis, y esto abre la posibilidad de plantear modificaciones dietéticas para reducir el riesgo de cáncer de colon. En este sentido, se ha prestado una especial atención a los probióticos y prebióticos, que modifican la microflora aumentando el número de lactobacilos y bifidobacterias en el colon. Las pruebas de que los probióticos y los prebióticos influyen en la carcinogénesis se derivan de una serie de fuentes:
1. Efectos sobre las actividades enzimáticas bacterianas.
2. Efectos antigenotóxicos in vitro e in vivo.
3. Efectos sobre lesiones precancerosas en animales de laboratorio.
4. Efectos sobre la incidencia tumoral en animales de laboratorio.
5. Estudios epidemiológicos y experimentales en seres humanos.
6. Efectos de los probióticos y prebióticos sobre las actividades enzimáticas bacterianas.
Está bien documentada la capacidad de la microflora colónica para generar una amplia variedad de mutágenos, carcinógenos y promotores tumorales a partir de precursores de la dieta y producidos endógenamente8. Por ejemplo, la enzima betaglucuronidasa participa en la liberación de una serie de carcinógenos dietéticos en el colon a partir de su forma conjugada, incluyendo los hidrocarbonos aromáticos policíclicos. De forma similar, la betaglucosidasa bacteriana hidroliza el glucósido vegetal cicasina en un carcinógeno en el intestino. Sin embargo, es preciso destacar que la hidrólisis del glucósido por la microflora intestinal puede dar lugar a la generación de sustancias anticarcinógenas y antimutagénicas potenciales en forma de flavonoides, como la quercetina8. Se ha identificado un importante papel de la microflora intestinal en el metabolismo de los ácidos biliares ácido cólico y quenodesoxicólico en ácido desoxicólico y litocólico, que se considera que poseen una actividad estimuladora tumoral. Otros potenciales promotores tumorales, principalmente el amoníaco, los fenoles y cresoles, también se generan por desaminación de aminoácidos, como la tirosina, por bacterias intestinales.
La reacción del nitrito con aminas y amidas secundarias da lugar a la formación de sustancias N-nitroso, muchas de las cuales poseen actividad mutagénica y carcinogénica. A partir de estudios en ratas sin flora se dispone de pruebas de que la nitrosación se produce en condiciones de pH neutro mediante un proceso enzimático catalizado por las bacterias intestinales13. Otra reacción catalizada por bacterias que produce una sustancia reactiva capaz de provocar una lesión y mutaciones del ADN es la conversión del carcinógeno de los alimentos cocinados 2-amino-3-metil-3H-imidazo(4,5-f)quinolina (IQ) en su derivado 7-hidroxi. A diferencia de la sustancia original, este último es un mutágeno de acción directa14.
En general, las especies de Bifidobacterium y Lactobacillus se caracterizan por actividades reducidas de las enzimas que participan en la formación y el metabolismo de los carcinógenos, en comparación con otros anaerobios mayores del intestino, como bacteroides, eubacterias y clostridios15. Esto sugiere que el aumento de la proporción de BAL en el intestino modificaría, de manera beneficiosa, los valores de enzimas metabolizadoras de xenobióticos. Se han llevado a cabo estudios en animales de laboratorio y en seres humanos con el objetivo de adquirir mayores conocimientos sobre la forma en la que la administración de probióticos y prebióticos específicos afectaría al metabolismo de la microflora intestinal.
ESTUDIOS EN ANIMALES DE LABORATORIO
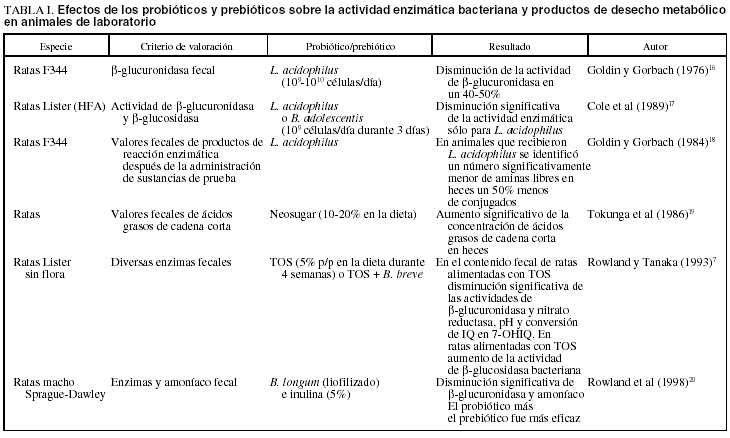
Los efectos de los probióticos y prebióticos sobre las enzimas bacterianas intestinales se han estudiado en animales con flora convencional y, asimismo, en ratas sin flora asociadas a microflora fecal humana, las llamadas ratas «asociadas a flora humana» (AFH). Estos estudios se resumen en la tabla I7,16-20 y más adelante se describen algunos ejemplos con detalle.
En un estudio en ratas convencionales, los suplementos de una dieta rica en carne (un 72% de buey) con L. acidophilus (109-1010 microorganismos/día) disminuyeron significativamente en un 40-50% la actividad de la β-glucuronidasa y nitrorreductasa fecales16. Es interesante destacar que el efecto modulador de la cepa de Lactobacillus dependió del tipo de dieta basal, y no se observaron efectos significativos cuando las ratas fueron alimentadas con una dieta basada en cereales. En un estudio análogo en ratas AFH, Cole et al17 demostraron una disminución significativa de las actividades de β-glucuronidasa y β-glucosidasa cuando fueron alimentadas con L. acidophilus durante 3 días, persistiendo el efecto durante 7 días después de interrumpir la dosis.
Estos cambios de las actividades enzimáticas observados después del consumo de BAL en teoría darían lugar a cambios en las tasas de metabolismo de sus sustratos in vivo, aunque sólo si las enzimas catalizaran el paso limitante de la velocidad en su metabolismo. Goldin y Gorbach18 lo han confirmado poniendo de manifiesto que la disminución de la actividad de las enzimas bacterianas nitrorreductasa, azorreductasa y β-glucuronidasa en ratas a las que se administraron lactobacilos orales se correspondió con una disminución (de alrededor del 50% en comparación con animales de control) en la excreción en heces de los productos de reacción de estas enzimas.
Los estudios sobre la influencia de OND en las actividades enzimáticas bacterianas intestinales en animales de laboratorio se han concentrado en los fructooligosacáridos y galactooligosacáridos. En ratas con flora convencional alimentadas con una dieta purificada que contenía tirosina y triptófano, la incorporación de un fructooligosacárido («Neosugar») en la dieta a una concentración del 0,4-10% redujo la concentración fecal de p-cresol, producto potencialmente promotor de tumores21. El efecto guardó relación con la dosis del OND. Se puso de manifiesto que concentraciones dietéticas más elevadas de Neosugar (de hasta un 20%) aumentaron los ácidos grasos de cadena corta y la excreción diaria total de esteroles neutros y ácidos22.
Se estudió el efecto del consumo de oligosacáridos transgalactosilados (TOS; 5% por partes en la dieta durante 4 semanas) con o sin B. breve en ratas AFH7. En animales alimentados con TOS se identificó un aumento del número de bifidobacterias y lactobacilos en el ciego, asociado a disminuciones significativas de las actividades de β-glucuronidasa y nitrato reductasa, del pH y la conversión de IQ en su derivado directamente genotóxico 7-OHIQ. La actividad de β-glucosidasa bacteriana aumentó supuestamente como consecuencia del elevado número de BAL con una actividad elevada de esta enzima. No se detectaron pruebas de efectos aditivos o sinergistas del consumo de B. breve sobre las actividades enzimáticas. En comparación, en un estudio reciente de Rowland et al20 en ratas a las que se administró B. longum, inulina o ambas, se describió un mayor efecto de la combinación simbiótica sobre las actividades enzimáticas y los metabolitos bacterianos fecales. Por ejemplo, la alimentación con B. longum dio lugar a una disminución del 30% de la actividad de β-glucuronidasa, mientras que en ratas a las que se administraron suplementos dietéticos con la combinación probiótico/prebiótico se identificó una disminución del 55%.
ESTUDIOS EN SERES HUMANOS
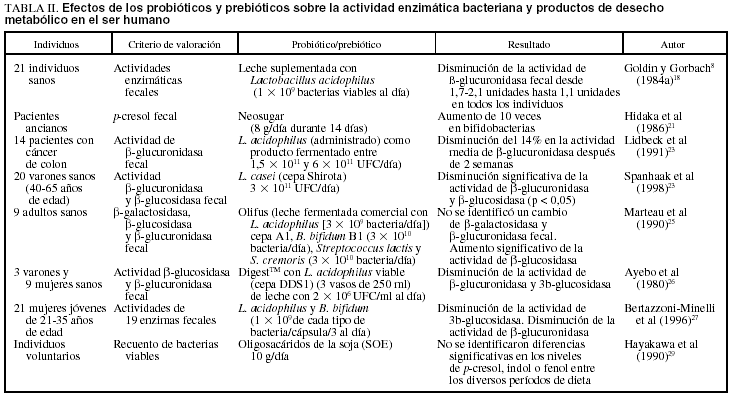
Se ha llevado a cabo una serie de estudios sobre los efectos de los probióticos, prebióticos y simbióticos en seres humanos que han incluido la determinación de las actividades enzimáticas bacterianas (tabla II)18,21,23-27,29. Goldin y Gorbach22 estudiaron a individuos voluntarios que consumieron leche suplementada con 109 lactobacilos viables al día. Antes de la alimentación con lactobacilos, la actividad fecal de β-glucuronidasa fluctuó entre 1,7 y 2,1 unidades. En los 21 individuos disminuyó después del consumo de lactobacilos hasta un valor medio de 1,1 unidades. La actividad recuperó los valores basales 10 días después de haber cesado el consumo de BAL. Lidbeck et al23 suplementaron las dietas de 14 pacientes con cáncer de colon con L. acidophilus como un producto a base de leche fermentada (aproximadamente 3 3 1011 lactobacilos al día) durante un período de 6 semanas, determinando la microflora fecal, los ácidos biliares fecales y la actividad de β-glucuronidasa. Coincidiendo con los cambios de la microflora (aumento de lactobacilos en heces y disminución del número de E. coli) se identificó una disminución del 14% de la actividad de β-glucuronidasa. También se observó una disminución de los ácidos biliares totales y de ácido desoxicólico del 15 y 18%, respectivamente. Spanhaak et al24 obtuvieron resultados similares mencionando una disminución significativa de la actividad de β-glucuronidasa y β-glucosidasa fecales en un grupo de 20 varones sanos a los que administraron L. casei (aproximadamente 1011 UFC/día durante 4 semanas como período de prueba).
Marteau et al25 estudiaron a 9 individuos voluntarios sanos antes (período 1), durante (período 2) y después (período 3) del consumo de 100 g/día de un producto a base de leche fermentada («Olifus») que contenía L. acidophilus (107 UFC/g), B. bifidum (108 UFC/g), Streptococcus lactis (108 UFC/g) y Streptococcus cremoris (108 UFC/g) durante 3 semanas. Durante los 3 períodos no se modificaron las actividades de azorreductasa y β-glucuronidasa fecales. En el período 2 disminuyó significativamente la actividad de nitratro reductasa, cuyos valores siguieron siendo bajos durante el período 3. No se identificó ningún cambio de la actividad de β-galactosidasa, pero la actividad de β-glucosidasa aumentó significativamente en el período 2 y recuperó los valores basales en el período 3. In vitro, el producto lácteo manifestó una elevada actividad β-glucosidasa que se relacionó con la presencia de B. bifidum. La disminución de la actividad de nitratro reductasa seguía persistiendo 3 semanas después de cesar el consumo del producto a base de leche fermentada, lo que sugirió modificaciones más prolongadas de la flora colónica.
Ayebo et al26 evaluaron el efecto del consumo de leche no fermentada con Lactobacillus acidophilus (2 3 106 UFC/ml) sobre β-glucuronidasa y β-glucosidasa fecales en un estudio cruzado en individuos de edad avanzada. Como control se administró leche desnatada y las dietas se siguieron durante un período de 4 semanas. Los recuentos fecales de lactobacilos aumentaron durante el período de consumo de probióticos en aproximadamente un orden de magnitud. La actividad de β-glucuronidasa disminuyó ligeramente después de 4 semanas de consumo de Lactobacillus. Se hicieron evidentes inconsistencias en la actividad de β-glucosidasa porque la actividad disminuyó desde 0,9 unidades hasta 0,45 unidades durante un período de exposición, mientras que durante el otro no se identificó ningún cambio de actividad.
En un estudio de mujeres jóvenes con síndrome de tensión premenstrual, Bertazzoni-Minelli27 puso de manifiesto que el consumo de L. acidophilus y B. bifidum liofilizados (1 3 109 de cada tipo de bacteria/cápsula) se asoció con sólo cambios menores de β-glucosidasa y ningún efecto significativo sobre β-glucuronidasa.
A partir de los estudios en seres humanos, apenas se dispone de pruebas de los efectos de los prebióticos y simbióticos sobre los metabolitos bacterianos tóxicos en heces y, en general, los estudios han producido resultados inconsistentes o negativos. Tanaka et al28 no describieron ningún efecto de TOS (3 o 10 g/día) sobre el amoníaco fecal, pero pusieron de manifiesto que el consumo simultáneo de TOS y B. breve redujo la concentración de amoníaco en 4 de 5 individuos.
Un estudio en individuos voluntarios que consumieron oligosacáridos a partir de la soja (10 g/día), con o sin el consumo simultáneo de B. breve, no demostró efectos significativos sobre el pH fecal o los productos de degradación de aminoácidos (p-cresol, fenol e indol) a pesar de los cambios en el número de bifidobacterias fecales29.
ANTIGENOTOXICIDAD DE LOS PROBIOTICOS Y PREBIOTICOS IN VITRO E IN VIVO
Evaluando la capacidad de cultivos para prevenir la lesión y mutaciones del ADN (que se considera un acontecimiento temprano en el proceso de carcinogénesis) en cultivos celulares o en animales se han obtenido pruebas más directas de las propiedades protectoras de los probióticos y prebióticos frente al cáncer (tabla III)30-36.
El efecto de BAL sobre la inducción de mutaciones mediante una amplia variedad de carcinógenos in vitro se ha estudiado utilizando la prueba de Ames. Los carcinógenos utilizados incluyen las sustancias N-nitrosas N-metil-N-nitro-N-nitrosoguanidina (MNNG) y N-metilnitrosourea (MNU), aminas heterocíclicas (p. ej., IQ y sustancias relacionadas) y aflatoxina B1. En conjunto, los resultados indican que diversas BAL inhiben la genotoxicidad de los carcinógenos dietéticos in vitro. El grado de inhibición dependió potentemente de la especie. Por ejemplo, Pool-Zobel et al31 demostraron que L. casei y L. lactis inhibieron la actividad mutagénica de las sustancias nitrosadas de la carne de buey en más de un 85%, mientras que L. confusus y L. sakei carecieron de efecto.
Parece probable que estos resultados, junto con resultados similares de otros investigadores, sean consecuencia de la unión de los mutágenos por las BAL34,37. Es cuestionable si in vivo interviene un mecanismo de este tipo, ya que la unión parece ser altamente dependiente del pH y se invierte fácilmente y no parece afectar a la captación de carcinógenos a partir del intestino, ni produciría un efecto aparente sobre la mutagenicidad in vivo en el hígado34.
Utilizando la técnica de electroforesis en microgel de célula única (prueba Cometa), Pool-Zobel et al35 investigaron la capacidad de una serie de especies de BAL para inhibir la lesión del ADN en la mucosa del colon de ratas tratadas con los carcinógenos MNNG o 1,2-dimetilhidracina (DMH). Todas las cepas de lactobacilos y bifidobacterias examinadas L. acidophilus (aisladas a partir del yogur), L. gasseri, L. confusus, B. breve y B. longum previnieron la lesión del ADN inducida por MNNG cuando se administraron a una dosis de 1010 células/kg de peso corporal, 8 h antes del carcinógeno. En la mayoría de los casos, la lesión del ADN se redujo hasta un nivel similar al de ratas no tratadas. Streptococcus thermophilus no fue tan eficaz como las otras cepas de BAL.
El efecto protector fue dependiente de la dosis: dosis de L. acidophilus que representaron un 50 y un 10% de la dosis original fueron menos eficaces en la disminución de la lesión del ADN inducida por MNNG. Y lo que es más importante todavía, el tratamiento por calor de L. acidophilus abolió su potencial antigenotóxico, lo que indica la importancia de las células viables. Se obtuvieron resultados similares cuando se examinaron cepas BAL en ratas a las que se administró DMH como agente lesionante de ADN. Una vez más, todos los lactobacilos y bifidobacterias inhibieron potentemente la lesión del ADN en la mucosa del colon, mientras que S. thermophilus fue mucho menos eficaz. Se identificaron pruebas de diferencias de cepa en los efectos antigenotóxicos: de las tres cepas de S. thermophilus, dos no fueron eficaces y una manifestó protección frente a la lesión del ADN.
La prueba Cometa también ha sido utilizada para evaluar el efecto de un prebiótico, la lactulosa, sobre la lesión del ADN en la mucosa del colon. Las ratas a las que se alimentó con una dieta que contenía un 3% de lactulosa y a las que se administró DMH manifestaron una menor lesión del ADN en las células del colon que animales tratados de forma similar alimentados con una dieta a base de sacarosa. En estos últimos animales, el porcentaje de células con una lesión severa del ADN incluyó un 33% del total, comparado con sólo un 12,6% en ratas alimentadas con lactulosa36.
Los resultados mencionados previamente proporcionan pruebas de que tanto las BAL como los prebióticos producirían efectos protectores frente a los estadios precoces del cáncer de colon.
EFECTO DE LOS PROBIOTICOS Y PREBIOTICOS SOBRE LAS LESIONES PRECANCEROSAS EN ANIMALES DE LABORATORIO (tabla IV)20,38-43
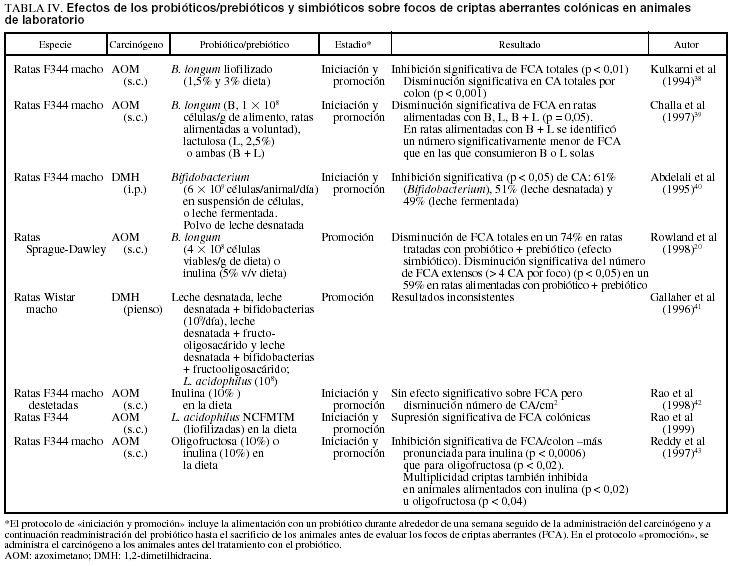
Las criptas aberrantes (CA) son lesiones preneoplásicas observadas en el colon de roedores tratados con carcinógenos. En numerosos casos se observan focos con dos o más criptas a los que se denomina focos de criptas aberrantes (FCA). Las criptas aberrantes son inducidas en la mucosa colónica de ratas y ratones mediante un tratamiento con diversos carcinógenos del colon como azoximetano (AOM), DMH e IQ. El hallazgo de un número significativamente mayor de FCA con cuatro o más criptas en ratas con tumores, comparado con los animales sin tumores, sugiere que los FCA grandes son predictores de la incidencia de tumor en un estadio más avanzado44. Los estudios han utilizado diversos regímenes de tratamiento con diferencias en la secuencia de exposición al carcinógeno y al probiótico/prebiótico, lo que permite que se extraigan conclusiones sobre el estadio afectado de la carcinogénesis. En la mayoría de los estudios, el protocolo incluyó la alimentación con el probiótico durante aproximadamente una semana, seguido de la administración del carcinógeno y acto seguido la administración continuada del probiótico hasta que se sacrificó a los animales previamente a la evaluación de los FCA. Por consiguiente, el tratamiento probiótico comprendió los estadios tanto de iniciación como de promoción precoz. En el protocolo «promoción», las ratas recibieron el carcinógeno antes del tratamiento probiótico.
EFECTO DEL TRATAMIENTO PROBIOTICO SOLO
Se han llevado a cabo diversos estudios utilizando AOM o DMH para determinar los efectos de probióticos específicos sobre la formación de FCA. Kulkarni et al38 describieron una inhibición en la formación de FCA de alrededor del 50% cuando ratas macho F344 fueron alimentadas con Bifidobacterium longum en la dieta (1,5 y 3% de un cultivo liofilizado que contenía 2 3 1010 UFC/g) durante 5 semanas y a las que se inyectó AOM s.c. una vez a la semana durante 2 semanas. Puesto que los tratamientos dietéticos se iniciaron 5 semanas antes de la administración del carcinógeno, los resultados no permiten hacer deducciones sobre el estadio afectado de la carcinogénesis. No se detectaron diferencias entre los animales alimentados con dietas con un 1,5 y 3% de B. longum.
Challa et al39 llevaron a cabo un estudio similar observando una disminución del 23% en los FCA colónicos totales y una disminución del 28% de las CA totales en ratas alimentadas con una dieta que contenía un 0,5% de B. longum (1 3 108 células viables/g de alimento). Los animales fueron alimentados con la dieta experimental antes del tratamiento con AOM y durante todo el experimento.
Abdelali et al40 compararon los efectos de Bifidobacterium spp. administrado en la dieta y, asimismo, como un producto a base de leche fermentada. Las cantidades de microorganismos consumidos fueron similares (6 3 109 células/día). Se administró DMH 4 semanas después de las BAL y los segundos tratamientos continuaron durante 4 semanas adicionales antes de la evaluación de FCA. Las bifidobacterias dietéticas fueron ligeramente más eficaces en la reducción de los FCA que la leche fermentada con bifidobacterias (disminución del 61 y el 49%, respectivamente). Sin embargo, es interesante destacar que la leche desnatada sola redujo en un 51% el número de FCA.
En un estudio sobre B. longum (6 3 109 UFC/día) en ratas Sprague Dawley tratadas con AOM, Rowland et al20 demostraron una disminución significativa del 26% en los FCA totales en comparación con animales de control. Los cambios sólo se observaron en FCA pequeños (1-3 CA por foco). Puesto que el tratamiento con probióticos se inició una semana después de la exposición al carcinógeno, los resultados indican un efecto sobre la fase promocional precoz de la carcinogénesis. No todos los estudios sobre FCA con probióticos han deparado efectos positivos. Gallaher et al41, que utilizaron un protocolo de «promoción» con B. longum y Lactobacillus acidophilus, obtuvieron resultados inconsistentes que atribuyeron a diferencias en las edades de las ratas cuando se administró DMH.
TRATAMIENTOS PREBIOTICOS Y SIMBIOTICOS EN LA PREVENCION DE FCA
Los prebióticos solos parecen producir resultados inconsistentes en la prevención de FCA inducidos por carcinógenos, que en parte serían consecuencia de diferencias en el carcinógeno y en los regímenes de tratamiento utilizados. Por ejemplo, Rao et al42 documentaron que la inulina (10% en la dieta) careció de efecto significativo sobre los FCA totales en el colon, o su multiplicidad, en ratas F344, aunque curiosamente se describió una disminución significativa de los FCA/cm2 del colon. El estudio de Gallaher et al41 sobre Bifidobacterium spp. y SOF (2% en la dieta) produjo resultados inconsistentes, demostrando sólo uno de tres experimentos una disminución de los FCA inducidos por DMH. Las diferencias en la dosis de SOF y los regímenes de tratamiento con carcinógeno serían responsables de la discrepancia entre este estudio y los de Challa et al39 y Rowland et al20.
Reddy et al43 compararon oligosacáridos de cadena corta (FOS) y cadena larga (inulina) incorporados a una concentración del 10% en la dieta en los FCA inducidos por AOM en ratas. Antes del tratamiento con carcinógenos, al igual que durante todo el experimento, se administraron OND y se describieron disminuciones significativas de aproximadamente un 25 y un 35%, respectivamente, en los FCA totales. Las disminuciones observadas correspondieron casi por completo a los FCA más pequeños (< 3 CA por foco) y la inhibición por inulina pareció más pronunciada que para FOS.
Rowland et al20 obtuvieron resultados similares describiendo una disminución del 41% en los FCA pequeños cuando se administró inulina (concentración del 5% en la dieta) una semana después de una dosis de AOM. No se observó ningún efecto de la inulina sobre FCA grandes. Challa et al39 demostraron una pequeña disminución (22%) de los FCA totales en ratas F344 tratadas con AOM cuando se incorporó a la dieta a una concentración del 2% un disacárido sintético no digerible, la lactulosa. Tanto Challa et al39 como Rowland et al estudiaron el efecto del tratamiento combinado con probióticos y prebióticos sobre el número de FCA. La combinación de B. longum y lactulosa dio lugar a una disminución del 48% de los FCA colónicos, que fue significativamente mayor que la obtenida con B. longum o lactulosa solas39. De forma similar, Rowland et al describieron una disminución de los FCA totales del 74% en ratas tratadas con B. longum e inulina (en comparación con una disminución del 29 y 21% obtenida con B. longum o inulina solas). Es importante destacar que la administración combinada de probióticos y prebióticos redujo los FCA grandes en un 5%, mientras que los tratamientos individuales carecieron de efecto20.
EFECTO DE LOS PROBIOTICOS Y PREBIOTICOS EN LA INCIDENCIA TUMORAL EN ANIMALES DE LABORATORIO (tabla V)45-48
Goldin y Gorbach45 investigaron el efecto de L. acidophilus sobre la incidencia de tumores de colon en ratas tratadas con DMH. En animales tratados con L. acidophilus después de 20 semanas fue evidente una disminución de la incidencia de cáncer de colon (40 frente a 77% en animales de control), pero no se identificó una diferencia a las 36 semanas, lo que sugiere que los lactobacilos aumentaron el período de latencia, o tiempo de inducción, para los tumores.
La administración de B. longum (0,5% de B. longum liofilizado en la dieta, 1 3 1010 células bacterianas vivas/día) inhibió significativamente la formación de tumores de colon e hígado inducidos por IQ y la multiplicidad (tumores/animal) de tumores de colon, hígado e intestino delgado en ratas macho46. La disminución porcentual de la incidencia tumoral fue del 80% en el hígado y del 100% en el colon. En ratas hembra, los suplementos dietéticos con cultivos de Bifidobacterium también disminuyeron la carcinogénesis mamaria inducida por IQ hasta un 50% y la carcinogénesis hepática hasta un 27%, en comparación con la dieta de control, pero las diferencias no fueron significativas. Sin embargo, se identificaron cambios significativos en la multiplicidad tumoral en la glándula mamaria.
Recientemente, se ha desarrollado un modelo de ratón (ratones Min) en el que los animales son heterocigotos para una mutación por inversión «anti-sense» del gen Apc, el homólogo murino de APC. Estos ratones, que desarrollan adenomas espontáneos en todo el intestino delgado y el colon al cabo de pocas semanas, se han utilizado para examinar los agentes quimioprotectores dirigidos frente a lesiones cancerosas. En uno de estos estudios se alimentó a ratones Min con diversas dietas que contenían salvado de trigo, almidón resistente o FOS (5,8% en la dieta) durante 6 semanas. El número de tumores no se modificó a partir del control (dieta sin fibra) en ratones alimentados con salvado de trigo o almidón resistente, pero se observó una disminución significativa de los tumores de colon en ratas tratadas con la dieta suplementada con FOS. Además, cuatro de los 10 animales alimentados con FOS se encontraron libres de tumores de colon47.
Goldin et al48 investigaron el efecto de Lactobacilus GG en ratas tratadas con DMH antes, durante y después de la exposición a este carcinógeno (protocolo de iniciación más promoción) o después (protocolo de promoción) del tratamiento con el carcinógeno. Utilizando el primer protocolo se observó una disminución significativa de la incidencia de tumores de colon (71 frente al 100% en ratas de control), y el número de tumores por animal portador de un tumor (1,7 comparado con 3,7 en animales de control). Sin embargo, cuando se administró Lactobacillus GG después de DMH, no se identificó una disminución de la incidencia tumoral, lo que indica que el efecto de las BAL se produjo sobre el estadio de iniciación más que sobre el estadio de promoción de la tumorigénesis. En este estudio, las ratas fueron alimentadas con dietas basales con un contenido elevado o bajo de grasa. Aunque la disminución de la incidencia de tumores de colon inducida por probióticos fue similar con ambas dietas, los efectos sobre la multiplicidad tumoral fueron más pronunciados en los animales alimentados con una dieta rica en grasas.
PROBIOTICOS Y CANCER EN LOS ESTUDIOS EPIDEMIOLOGICOS EN SERES HUMANOS (tabla VI)49-54
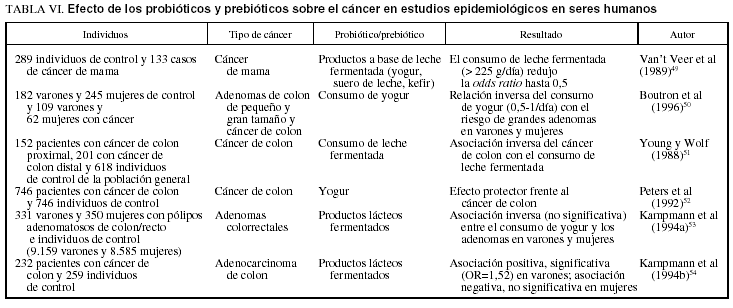
En Holanda, un estudio de caso-controles puso de manifiesto que algunos productos lácteos fermentados confieren un efecto protector frente al cáncer de mama. Los resultados del consumo de > 225 g/día de productos lácteos fermentados (yogur, suero de leche, cuajada y kefir) redujo la odds ratio hasta 0,5049.
Los resultados de un estudio de casos-controles llevado a cabo por Boutron et al50 indicaron una relación inversa significativa (p = 0,03) entre el riesgo de grandes adenomas colónicos tanto en varones como en mujeres y el consumo de cantidades moderadas (0,5-1 envase al día) de yogur. Las odds ratio fueron de 0,6 y 0,5, respectivamente, para ambos niveles de consumo de yogur. No se identificó una relación entre el riesgo de cáncer colorrectal y el consumo de yogur. Otros estudios poblacionales de casos-controles han proporcionado pruebas de asociaciones inversas del riesgo de cáncer colorrectal y el consumo de productos a base de leche fermentada51 y yogur52,53, documentaron una relación inversa no significativa entre el consumo de yogur y los adenomas de colon. No obstante, este hallazgo no se confirmó en un estudio ulterior de casos-controles en Holanda sobre riesgo de cáncer colorrectal y productos lácteos fermentados, que reveló una pequeña asociación positiva significativa en varones (OR = 1,52) y una pequeña asociación inversa no significativa en mujeres (OR = 0,77)54.
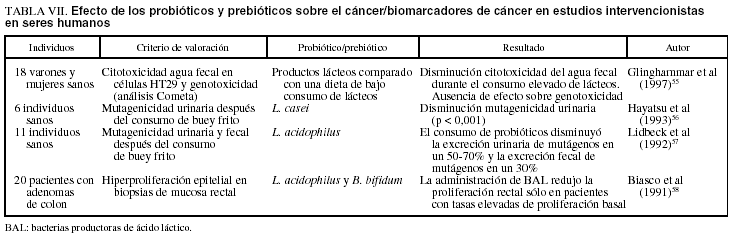
PROBIOTICOS Y CANCER EN ESTUDIOS DE INTERVENCION EN SERES HUMANOS (tabla VII)55-58
Los estudios de intervención con el objetivo de evaluar la capacidad de los probióticos para prevenir el cáncer en el ser humano se han basado en su mayor parte en la utilización de biomarcadores para evaluar el riesgo de cáncer. Debido a su naturaleza no invasiva, se han utilizado principalmente marcadores en heces y en orina. Por ejemplo, se considera que la fase acuosa de las heces humanas (agua fecal) es una importante fuente de inductores y moduladores de la carcinogénesis en el colon y están disponibles métodos para evaluar las actividades biológicas relacionadas con el riesgo de cáncer en estas muestras.
Con el objetivo de determinar si un cambio en el consumo de productos lácteos afecta a la citotoxicidad y genotoxicidad del agua fecal, en 18 varones y mujeres sanos se modificó su consumo normal de productos lácteos por una dieta sin lácteos en un estudio de diseño cruzado55. La citotoxicidad del agua fecal, analizada mediante el análisis de citotoxicidad HT29, indicó una disminución de la supervivencia celular del 34 al 20% cuando los productos lácteos fueron excluidos de la dieta de los individuos. Se considera que este análisis refleja la potencial actividad promotora tumoral y sugiere que los productos lácteos conferirían efectos beneficiosos. Para analizar la genotoxicidad del agua fecal se utilizó la prueba Cometa (electroforesis en gel de célula única), que no indicó diferencias debidas a la intervención dietética.
Hayatsu et al56 examinaron el efecto de la administración oral de L. casei durante 3 semanas en 6 individuos sanos no fumadores sobre la mutagenicidad urinaria inducida por consumo de carne picada de buey frita utilizando la prueba de Ames (Salmonella typhimurium TA98, con una mezcla de S9). Se dividió a los 6 individuos en dos grupos, un grupo al que se administró L. casei 3 3 1010 células/día y otro grupo al que se administraron suplementos de L. casei 1,5 3 1011 células/día durante 3 semanas. Se obtuvo orina antes del consumo de carne y se recogió orina a las 0-12 y 12-24 h después de la comida a base de carne. Se observó un efecto supresor de la administración de L. casei (6-67% de la mutagenicidad detectada en el grupo de control) cuando se comparó la mutagenicidad en la orina de control con los resultados de la orina obtenida durante el período de administración de L. casei. La actividad media de las 2 muestras recogidas en los períodos de 12 h fue del 47,5% en relación con el control, y la disminución fue estadísticamente significativa.
Lidbeck et al57 llevaron a cabo un estudio en 11 individuos que como parte de su dieta (0-2 días) consumieron hamburguesas fritas, que son una fuente de mutágenos de tipo pirolisato detectables en orina. Se administró leche con Lactococcus como control (1010-1011/día) 2 días antes de los suplementos dietéticos de hamburguesas fritas hasta 6 días más tarde. El segundo grupo recibió el probiótico Lactobacillus acidophilus a una dosis de 1-5 3 1011 células/día, empezando una vez más 2 días antes de la adición de la hamburguesa y hasta 6 días después. El consumo de BAL disminuyó la excreción urinaria de mutágenos en un 50-70% y la excreción de mutágenos fecales disminuyó en un 30%.
Se considera que el aumento de la proliferación celular en las criptas de la mucosa es un marcador de riesgo elevado de cáncer. En un estudio sobre el efecto de las BAL sobre la proliferación celular de la mucosa rectal, Biasco et al58 administraron 6 cápsulas/día con 109 de L. acidophilus y 109 de B. bifidum durante un período de 3 meses a 20 pacientes con adenomas de colon. Se obtuvieron 4 biopsias rectales en el período basal y después del tratamiento y se evaluó la proliferación celular en la parte superior de las criptas de la mucosa rectal mediante incorporación de timidina tritiada. En conjunto, no se identificaron diferencias significativas en la proliferación de células de las criptas antes y después del tratamiento. Sin embargo, en 8 pacientes con elevadas tasas de proliferación celular se identificó una disminución significativa de la proliferación después de BAL (0,21 ± 0,03 comparado con 0,10 ± 0,03; p < 0,03).
Aso et al59 investigaron la administración de L. casei (Biolactis en polvo, 3 g/día) en la recidiva de un carcinoma superficial de células transicionales de la vejiga después de una resección transuretral en 125 pacientes. En pacientes con tumores múltiples primarios o tumores recurrentes únicos, la proporción de pacientes sin recidiva aumentó del 54,9% en el grupo placebo hasta el 79,2% en el grupo tratado con L. casei. Sin embargo, no se identificó un efecto significativo en pacientes con tumores múltiples recurrentes que tenían muy mal pronóstico. Los autores sugieren que la estimulación del sistema inmunitario por parte de los lactobacilos constituiría un importante factor en su efecto sobre los pacientes.
MECANISMOS DE LA ANTICARCINOGENICIDAD Y ANTIGENOTOXICIDAD
Unión a los carcinógenos
Se ha publicado un elevado número de artículos que describen que las BAL y otras bacterias intestinales adsorben o se unen in vitro a diversos carcinógenos de origen alimentario, incluyendo las aminas heterocíclicas formadas durante la cocción de la carne, la toxina fúngica aflatoxina B1, benzo(a)pireno y el contaminante alimentario AF230,32,34,37,60. En varios de estos estudios se ha descrito una disminución concomitante de la mutagenicidad. El grado de unión dependió del mutágeno y de la cepa bacteriana utilizados, observándose en general una mayor unión con las aminas heterocíclicas y una menor unión con aflatoxina B1 y AF2. La absorción parece ser un fenómeno físico, principalmente debido a un intercambio de cationes.
Sin embargo, aunque la unión representa un mecanismo verosímil para la inhibición de la genotoxicidad y mutagenicidad por las BAL in vitro, no parece tener influencias in vivo. Bolognani et al34 demostraron que la administración simultánea de BAL con diversos carcinógenos a ratones careció de efecto sobre la absorción de las sustancias a partir del tracto gastrointestinal, y no afectó a la mutagenicidad in vivo de los carcinógenos en el hígado. Es preciso mencionar que estos resultados contrastan con los de Zhang y Ohta61, que pusieron de relieve que la absorción de Trp-P-1 a partir del intestino delgado de rata disminuyó significativamente mediante la coadministración de BAL congeladas-secadas. Sin embargo, este último estudio fue confuso por la utilización de ratas sometidas a ayuno durante 4 días, lo que induciría un importante estrés nutricional y fisiológico en los animales.
EFECTOS SOBRE LAS ENZIMAS BACTERIANAS Y LA PRODUCCION DE METABOLITOS
Los estudios citados en las tablas I y II demuestran que el aumento de la concentración de BAL como consecuencia del consumo de BAL y/o prebióticos da lugar a una disminución de algunas enzimas bacterianas que se considera que participan en la síntesis o activación de carcinógenos, genotoxinas y promotores tumorales. Esto parece deberse a la reducida actividad específica de estas enzimas en las BAL15. Se ha sugerido que estos cambios de la actividad enzimática o la concentración de metabolitos serían responsables de la disminución del nivel de las lesiones preneoplásicas o tumores observada en ratas tratadas con carcinógenos a las que se administran probióticos y prebióticos20,46. Aunque no se ha demostrado una relación causal, sigue siendo una hipótesis verosímil.
ESTIMULACION DE ENZIMAS PROTECTORAS
Muchos de los carcinógenos alimentarios, como las aminas heterocíclicas y los hidrocarbonos aromáticos policíclicos, son conjugados en glutatión, que parece dar lugar a una inactivación. La enzima implicada, la glutatión transferasa (GSH), se identifica en el hígado y otros tejidos incluyendo el intestino delgado. En un estudio sobre el efecto de B. longum y lactulosa sobre los FCA inducidos por AOM en el colon, Challa et al39 pusieron de manifiesto que la actividad de la GSH en la mucosa colónica se relacionó inversamente con el número de FCA. Este mecanismo de protección sería eficaz frente a una amplia serie de carcinógenos dietéticos.
AUMENTO DE LA RESPUESTA INMUNITARIA
Otro mecanismo sugerido por Perdigon et al62 mediante el que los probióticos ejercen una actividad antitumoral es la reducción de la respuesta inmunoinflamatoria. En un estudio sobre crecimiento tumoral en ratones tratados con DMH se puso de manifiesto que el yogur suprime la respuesta inmunitaria inflamatoria, con un aumento de las células secretoras de IgA y de los linfocitos T CD4+. En estos animales se identificó una disminución destacada de los tumores. También se ha propuesto un mecanismo inmunitario para explicar la prolongación del tiempo antes de la recidiva tumoral en pacientes con cáncer de vejiga tratados con L. casei59, aunque los autores no presentaron pruebas que apoyaran el mecanismo.
Estos estudios son consistentes con los de Schiffrin et al63 y Marteau et al64, que han proporcionado pruebas de una modulación del sistema inmunitario en seres humanos que consumen probióticos. Los cambios observados fueron un aumento de la actividad fagocítica de monocitos y granulocitos y aumentos de los valores de células secretoras de anticuerpos. No se ha establecido el significado de estos cambios en relación con el desarrollo tumoral.
CONCLUSIONES
En conjunto, los estudios en sistemas in vitro y en una amplia variedad de modelos animales proporcionan pruebas considerables de que los probióticos y, en menor grado los prebióticos, tienen potencial para reducir el riesgo de cáncer de colon. Las pruebas en estudios con seres humanos son menos concluyentes, pero sugieren que los alimentos con fermentos lácticos tiene un efecto preventivo del cáncer de colon. Claramente se requieren más estudios intervencionistas cuidadosamente controlados en seres humanos utilizando biomarcadores del riesgo de cáncer. Los datos de los estudios en animales sugieren que la utilización de una combinación de probióticos y prebióticos es la estrategia más eficaz para maximizar cualquier efecto anticarcinogénico.
AGRADECIMIENTO
Anthony J. Burns desea expresar su agradecimiento por la financiación de St Ivel Ltd.