INTRODUCCIÓN
El pólipo fibroide inflamatorio (PFI), descrito inicialmen te por Vanek1 en 1949 como «granuloma submucoso con infiltrado eosinofílico» y también conocido como seudotumor inflamatorio2 , es una lesión generalmente única y de aspecto polipoide que se localiza en la zona alta de la submucosa o la porción más profunda de la mucosa digestiva. Está constituido por una proliferación mal circunscrita de células fusiformes y fibras conjuntivas dispuestas concéntricamente alrededor de capilares y un grado variable de infiltrado inflamatorio con participación, a veces prominente, de eosinófilos. El fenotipo de las células fusiformes, el componente celular primordial, es objeto de controversia; se ha planteado que pudieran ser células estromales primitivas de estirpe miofibroblástica3 , fibrohistiocitaria4-7 o endotelial8,9 . El PFI se considera una reacción inflamatoria expansiva posiblemente reactiva/reparadora de una agresión local variada10 . A este respecto, se han citado los traumatismos locales10 , la cirugía11 , los antiinflamatorios no esteroideos12,13 y algún agente microbiano14 , así como lesiones específicas de ciertos segmentos del tubo digestivo como la esofagitis por reflujo15 , el divertículo de Meckel7,16 o la enfermedad de Crohn del íleon3,7 . El PFI es una lesión clásicamente descrita en el antro gástrico y yeyuno-íleon, pocas veces en el colon6,7,9,17,18 y excepcionalmente en el esófago6,19,20 , el duodeno7,21-23 o la vesícula biliar24 . Se manifiesta clínicamente tras su ulceración (hemorragia digestiva aguda o anemia ferropénica) por la obstrucción del tránsito gastrointestinal (frecuentemente por invaginación en los intestinales) y raras veces con síntomas de afectación sistémica (síndrome febril, poliartrialgias, poliartritis, aumento de la velocidad de sedimentación globular, leucocitosis, trombocitosis), que se describe en algunos PFI esofágicos o yeyunales20,25,26 . Diversos autores han señalado la asociación sincrónica del PFI y el adenocarcinoma3,5,27-30 o adenoma gástricos5,28,30 . Hasta ahora, las únicas variaciones descritas en el fenotipo clínico del PFI han sido las propias del segmento digestivo afectado y la existencia de una forma familiar en Devon31,32 . También se han descrito variaciones en el fenotipo inmunitario de la célula fusiforme respecto del marcador CD34, una glucoproteína transmembrana descrita originalmente en células progenitoras de la médula ósea, endoteliales y en los tumores estromales del tracto gastrointestinal33 . En los PFI, el marcador CD34 es mucho más prevalente en los gástricos que en los intestinales6,9,34 . El motivo del presente estudio es presentar las características clínicas y el seguimiento de los 26 pacientes incluidos en el Registro de Pólipo Fibroide Inflamatorio de Girona en el período 1985-2001.
PACIENTES Y MÉTODOTras la identificación de los 2 primeros casos, en el año 1986 se creó un registro de todos los pacientes con diagnóstico de PFI en los Servicios de Anatomía Patológica del Hospital Universitario de Girona Doctor Josep Trueta y su Centro Ambulatorio de Especialidades, el Hospital de Santa Caterina y la Clínica Girona. La fuente del diagnóstico incluye tanto material de biopsias endoscópicas como piezas de resección quirúrgica y hallazgos de necropsia. Una vez identificado, el caso se incorpora al registro, que incluye datos demográficos, tamaño del PFI y su localización en el tubo digestivo, forma clínica de presentación y diagnóstico, enfermedades asociadas y aparecidas en el seguimiento, causas de fallecimiento y técnicas de inmunohistoquímica. Para este trabajo se han analizado la edad, el sexo, el tamaño del PFI, la forma de presentación clínica, la localización en el tubo digestivo, las enfermedades asociadas y el seguimiento de los pacientes. La identificación de Helicobacter pylori en las muestras de mucosa gástrica se hizo a través de la detección de bacilos compatibles asociados al epitelio con técnicas de hematoxilina-eosina y tinción de Giemsa. Desde el año 1995, se aplicó sistemáticamente el test rápido de la ureasa en biopsias endoscópicas de la mucosa gástrica. En 4 pacientes sometidos a tratamiento erradicador (RBC, JRV, RCA y MNA), la desaparición de la infección se comprobó mediante histología, test rápido de la ureasa y test del aliento con urea-13 C. Los datos de seguimiento de los 23 pacientes vivos en el momento del diagnóstico se obtuvieron de diversas fuentes. En 17 casos se dispuso de controles clínicos actualizados, hasta el momento del estudio o su fallecimiento, en los Servicios de Hematología, Oncología, Cirugía General y Unidad de Aparato Digestivo de los centros comunicantes. Tras localización y entrevista telefónica, 4 pacientes acudieron a controles médicos (y, en 2 casos, endoscópicos). En un caso (MDR), la información obtenida fue sólo telefónica mediante una entrevista con familiares cercanos y del registro de defunciones. Sólo en 1 caso (IPS) no se dispuso de seguimiento tras el alta del Servicio de Cirugía General en el año 1989. Durante el seguimiento se realizaron controles endoscópicos (de 1 a 6 exploraciones) en 8 pacientes con PFI gástrico y en 3 pacientes con PFI intestinal. El análisis estadístico se realizó mediante el test de la χ2 para las variables cualitativas y la prueba de la t de Student y la U de Mann-Whitney para las variables cuantitativas. Los valores promedio se han expresado como media ± desviación estándar.
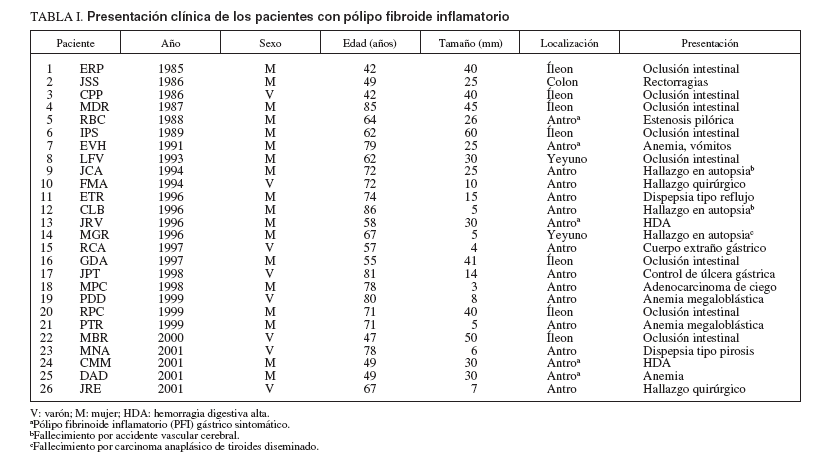
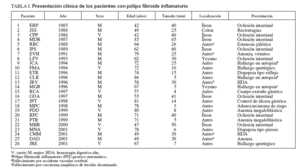
RESULTADOSHemos estudiado a 26 pacientes (9 varones y 17 mujeres) con PFI diagnosticados desde marzo de 1985 a octubre de 2001. Los datos demográficos, la localización, el tamaño y la presentación clínica de los pacientes se resumen en la tabla I. La edad media de los pacientes de la serie fue de 66 ± 13,3 años, con una mediana de 67 (rango: 42-86). La relación mujer/varón de la serie fue de 1,9. La localización de los PFI fue antral en 16 pacientes, yeyunal en 2, ileal en 7 y ángulo hepático del colon en el restante. La presentación clínica de los PFI mostró grandes diferencias según fuesen gástricos o intestinales. Sólo en 5 pacientes con PFI gástrico la clínica pudo atribuirse a esa lesión. En los 11 casos restantes, el PFI fue un hallazgo de exploraciones endoscópicas indicadas por enfermedades no vinculables al PFI (7 casos), de la resección quirúrgica (2 casos) o la autopsia (2 casos). Por el contrario, en los PFI intestinales el diagnóstico estuvo motivado por clínica directamente relacionada en 9 pacientes: 8 por oclusión intestinal (generalmente por invaginación) y por hemorragia digestiva baja en 1 caso de PFI de colon; fue un hallazgo casual de la necropsia en 1 PFI yeyunal. Sobre la base de esta presentación clínica, hubo 11 pacientes con PFI gástrico asintomático (PFIGA), 5 con PFI gástrico sintomático, 9 con PFI intestinal sintomático y 1 con PFI intestinal asintomático.
TABLA I. Presentación clínica de los pacientes con pólipo fibroide inflamatorio
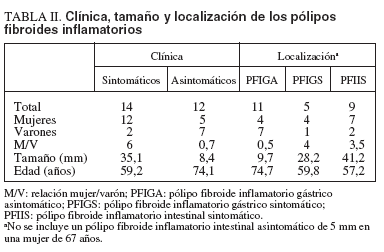
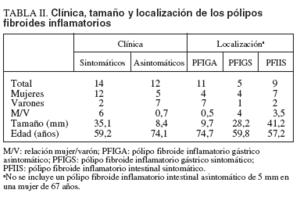
TABLA II. Clínica, tamaño y localización de los pólipos fibroides inflamatorios
Tamaño, localización y presentación clínica
El estudio histopatológico de los PFI fue homogéneo y acorde con su descripción clásica. En la tabla II se resume el análisis de los PFI según la localización, el tamaño, la existencia de síntomas y variables demográficas. Existió un predominio significativo del sexo femenino en los PFI sintomáticos (χ2 = 5,54; p = 0,019). La relación mujer/varón mostró sentidos opuestos según los PFI fuesen sintomáticos (relación: 6) o asintomáticos (relación: 0,7) y según el grupo anatomoclínico (3,5 en PFI intestinal sintomático, 4 en PFI gástrico sintomático y 0,5 en PFIGA). El tamaño de los pólipos osciló entre 3 y 60 mm de diámetro y fue significativamente superior en los sintomáticos respecto a los asintomáticos (35,1 ± 13,6 frente a 8,4 ± 6,3 mm; p < 0,001). El tamaño de los PFIGA fue inferior al de los PFI gástricos sintomáticos (9,7 ± 6,2 frente a 28,2 ± 12,5 mm; p = 0,002) y de éstos respecto de los PFI intestinales sintomáticos (28,2 ± 12,5 frente a 41,2 ± 10,2 mm; p = 0,025). La edad de los pacientes con PFI sintomáticos fue significativamente inferior a la de los asintomáticos (59,2 ± 13,6 frente a 74,1 ± 8,2 años; p = 0,007). La edad de los pacientes con pólipos sintomáticos, tanto gástricos (59,8 ± 2,5) como intestinales (57,2 ± 14,4), fue significativamente inferior a la de aquellos con PFIGA (74,7 ± 7,9) (p = 0,047 y p = 0,008, respectivamente).
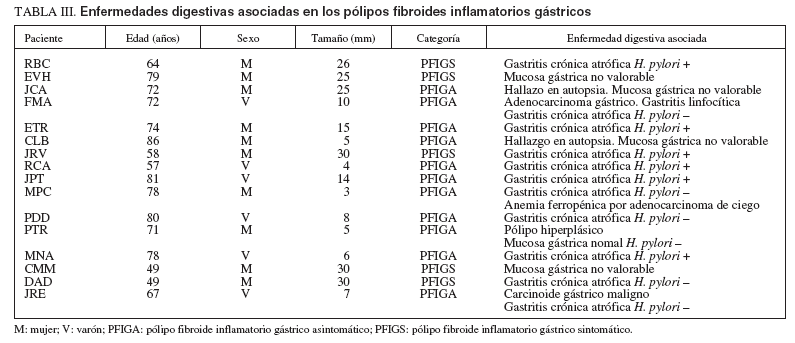
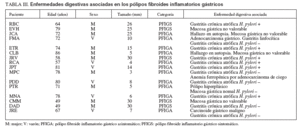
Enfermedades digestivas asociadasLos PFI gástricos tuvieron con frecuencia patología gástrica asociada en la mucosa gástrica lejana al pólipo (tabla III). Ésta consistió en gastritis crónica con grados variables de atrofia y metaplasia intestinal en 11 pacientes, 6 de ellos positivos para H. pylori y 5 negativos (uno asociado a adenocarcinoma gástrico y gastritis linfocítica y otro a carcinoide gástrico). La mucosa gástrica no fue valorable en 4 casos, entre ellos, 2 estudios post mortem por mucosa lítica (JCA y CLB). La paciente restante (PTR), negativa para H. pylori , tenía un pólipo hiperplásico en el fórnix gástrico. Sólo un PFI ileal tuvo enfermedad intestinal asociada, que consistió en un divertículo de Meckel adyacente. Otro paciente con un PFI de la misma localización seguía tratamiento por una proctitis ulcerosa.
TABLA III. Enfermedades digestivas asociadas en los pólipos fibroides inflamatorios gástricos
Tratamiento
El tratamiento de los PFI gástricos fue la resección endoscópica con asa de polipectomía en 6 pacientes, gastrotomía con resección local en 3 y gastrectomía total en los 2 PFI que acompañaban a un adenocarcinoma del cuerpo gástrico y a un carcinoide maligno antral, respectivamente. Tres PFI antrales, de 3, 5 y 6 mm, fueron resecados mediante biopsias múltiples. En el primero (MPC), sin embargo, un control endoscópico 16 meses después mostró un PFI de 8 mm en idéntica localización que se resecó con asa de polipectomía. Se expuso a tratamiento para la infección por H. pylori a 4 pacientes (RBC, JRV, RCA y MNA), bien por la enfermedad péptica (RBC) o en el contexto de un protocolo de erradicación en pacientes con dispepsia existente en el momento de la inclusión. Los motivos para no tratar fueron el mal estado general del paciente, la enfermedad asociada y la polimedicación, y sólo anecdóticamente la falta de colaboración para el tratamiento (CMM). El tratamiento erradicador inicial consistió siempre en la asociación omeprazol, claritromicina y amoxicilina durante 10 días. El paciente RBC requirió un segundo tratamiento con omeprazol, ampoxicilina, tetraciclinas y bismuto. La erradicación se comprobó tanto en biopsias endoscópicas de control como por tests del aliento con urea-13 C en los 4 casos. El tratamiento de los PFI intestinales fue la resección quirúrgica reglada del segmento intestinal afectado en 8 y la polipectomía endoscópica en el PFI de colon.
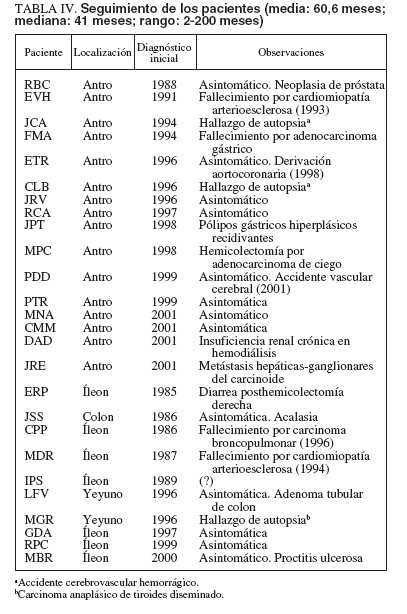
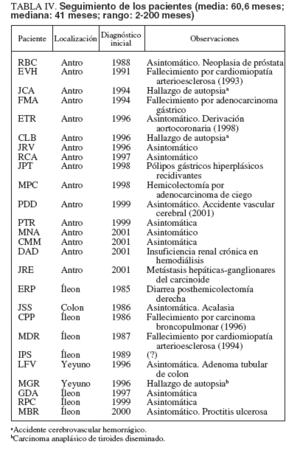
SeguimientoSe tuvo un seguimiento actualizado en 22 pacientes, 15 PFI gástricos y en 7 de 9 PFI intestinales (sólo se dispuso de 4 años de seguimiento en la paciente LFV) (tabla IV). Tras el tratamiento, todos los pacientes estuvieron asintomáticos en lo referente a clínica atribuible al PFI. El seguimiento medio fue de 60,6 meses con una mediana de 41 (rango: 2-200). El seguimiento fue siempre clínico con controles endoscópicos en 8 PFI gástricos y 3 intestinales; en salvo en un caso (MPC), nunca se evidenció recidiva de la lesión.
TABLA IV. Seguimiento de los pacientes (media: 60,6 meses; mediana: 41 meses; rango: 2-200 meses)
Cuatro pacientes presentaron una nueva enfermedad digestiva a lo largo del seguimiento: acalasia en la paciente con PFI del colon (JSS), anemia ferropénica secundaria a pólipos hiperplásicos gástricos recidivantes en un caso de PFI gástrico (JPT), diarrea crónica tras resección distal del íleon y hemicolectomía derecha por PFI ileal (ERP), y adenoma tubular de colon descendente 4 años después de la resección de un PFI de yeyuno (LFV). Se dispuso de estimaciones aproximadas del crecimiento del PFI en 3 pacientes con PFIGA (MPC, PTR y MNA). Únicamente se constató recidiva, con crecimiento importante, en un paciente (MPC) cuya resección inicial fue verosímilmente incompleta al realizarse con biopsias gástricas múltiples 16 meses antes. Otros 2 pacientes (PTR y MNA) tenían estudios endoscópicos realizados en otros centros 53 y 24 meses antes, respectivamente. En ninguno de ellos hubo un crecimiento apreciable de la formación polipoidea. Al igual que en el momento del diagnóstico, las enfermedades extradigestivas aparecidas en el seguimiento fueron sobre todo cardiovasculares y neoplásicas (próstata y pulmón). En toda la serie, 6 pacientes desarrollaron neoplasias malignas diversas, bien con el diagnóstico inicial (carcinoma anaplásico de tiroides, adenocarcinoma gástrico, adenocarcinoma de ciego y carcinoide gástrico maligno), bien a lo largo del seguimiento (adenocarcinoma de próstata y carcinoma epidermoide de pulmón). Las neoplasias malignas y las enfermedades cardiovasculares fueron, a partes iguales, la causa de las 6 muertes habidas en los pacientes de esta serie.
DISCUSIÓNLa caracterización anatómica y clínica del PFI ha sido, hasta el momento, muy fragmentaria ya que la información procede de casos clínicos aislados o de series muy cortas y heterogéneas de pacientes. Además, gran parte del interés sobre esta enfermedad se ha centrado en tratar de caracterizar el fenotipo inmunitario del elemento celular central, las células fusiformes, mientras que otros aspectos se han considerado de menor interés. Nuestra serie es la mayor de las publicadas con una representación sustancial de PFI, tanto gástricos como intestinales, bien sintomáticos o bien hallazgos inesperados de la necropsia, la resección quirúrgica y la fibrogastroscopia. Ello ha permitido relacionar variables demográficas, tamaño y localización del PFI y forma de presentación (sintomáticos y asintomáticos). Algunos autores ya habían señalado que los PFI intestinales eran, de promedio, mayores que los PFI gástricos30 . Nuestro estudio muestra que la presencia de síntomas no solamente se correlaciona con el tamaño del pólipo, sino que además los PFI sintomáticos y asintomáticos pertenecen a poblaciones diferentes por edad y sexo. Los sintomáticos, que incluyen la práctica totalidad de los intestinales, se agruparon alrededor de los 60 años con un predominio muy importante del sexo femenino. Los asintomáticos se agruparon alrededor de los 75 años con un leve predominio del sexo masculino. Conocer la influencia del sexo en el PFI requiere, por lo tanto, series de pacientes equilibradas sobre la base de variables como el tamaño y la localización del PFI en el tubo digestivo. Del presente estudio se deduce que el sexo y la edad de los pacientes están asociados al tamaño y la localización del PFI. El hecho de que la mayoría de los PFI gástricos se den sobre una mucosa con gastritis crónica atrófica puede no ser una asociación casual. Además, que los PFI gástricos sintomáticos, perteneciendo a la misma población por edad y sexo que los PFI intestinales sintomáticos, tengan un tamaño intermedio entre éstos y los más pequeños gástricos asintomáticos podría indicar: a) que en el estómago los PFI son sintomáticos con tamaños inferiores, o b) que el desarrollo de los pólipos gástricos puede estar inhibido en el entorno de la inflamación crónica y/o la atrofia de la mucosa gástrica. El seguimiento de esta serie de pacientes es el más largo de los hasta la fecha publicados3,6,7,21 y confirma la experiencia general de la benignidad del PFI y la ausencia de recidiva tras la exéresis. El único caso de recidiva detectado en esta serie (MPC) pudo ser el resultado de una exéresis incompleta al hacerse con biopsias endoscópicas. Curiosamente, este PFIGA multiplicó su tamaño inicial 2,6 veces en 16 meses, lo que indicaría que, tal como han comentado otros autores29 , el traumatismo agudo que supone la biopsia pudo haber reactivado su desarrollo. Por el contrario, 2 PFIGA identificados en fibrogastroscopias previas, pero no biopsiados, no mostraron crecimientos sensibles en períodos mayores. Las enfermedades asociadas más relevantes de esta serie, coincidentes con lo descrito en la bibliografía médica, son el adenocarcinoma gástrico3,5,27-30 y los pólipos gástricos hiperplásicos29 para los PFI gástricos, y el divertículo de Meckel en el PFI intestinal7,16 . Solamente hemos encontrado en la bibliografía médica otro paciente que, como uno de los aquí referidos, mostrase la asociación de PFI y carcinoide gástrico27 . El alto porcentaje de enfermedades neoplásicas detectado (26%), bien sincrónicamente con el diagnóstico (4 casos), bien a lo largo del seguimiento (2 casos), es un hallazgo de difícil interpretación. Sin embargo, el fallecimiento de 6 pacientes por enfermedades neoplásicas y cardiovasculares a partes iguales coincide con las causas habituales de mortalidad de una población de edad similar. En resumen, el PFI es una entidad heterogénea no sólo en virtud del factor etiológico inicial, la localización, las manifestaciones clínicas y la predisposición genética del sujeto, sino también de la edad y el sexo de los pacientes afectados. Estas últimas variables se asocian de forma significativa con el desarrollo alcanzado por el PFI y, por lo tanto, con la aparición de manifestaciones clínicas. La frecuente asociación de los PFI gástricos con la gastritis crónica atrófica podría indicar que, además del resto de los factores, las condiciones de la mucosa donde el PFI se desarrolla pueden influir en la modulación del proceso reparador que el PFI supondría.
Correspondencia: Dr. D. Acero . Unidad de Aparato Digestivo. Hospital Universitario Doctor Josep Trueta. Avda. de França, s/n. 17007 Girona. España. Correo electrónico: digestiu@htrueta.scs.es
Recibido el 12-3-2004; aceptado para su publicación el 21-10-2004.