Los inmunosupresores tiopurínicos (IST), azatioprina (AZA) o 6-mercaptopurina (6MP), son fármacos fundamentales en el tratamiento de la enfermedad inflamatoria intestinal (EII)1. Inicialmente se utilizaron para situaciones especiales, como la corticodependencia o la corticorresistencia, si bien su uso se ha ampliado al tratamiento de la enfermedad perianal (EPA), el mantenimiento de la remisión tras un brote grave y la prevención de la recurrencia posquirúrgica de la enfermedad de Crohn (EC). A pesar de que su uso es cada vez mas generalizado, estos fármacos no son útiles en un porcentaje no despreciable de pacientes, ya sea por su ineficacia clínica o bien porque deben retirarse por sus efectos secundarios. Se ha descrito un perfil diferente de efectos secundarios entre distintos grupos de pacientes, con un incremento de la toxicidad hepática y de la pancreatitis aguda en pacientes con EII en contraste con otras enfermedades en las que se utilizan IST2. Estas diferencias en la incidencia podrían reflejar un fenómeno de susceptibilidad genética o atribuirse a que determinada medicación concomitante favoreciera la toxicidad. La información disponible sobre la seguridad a largo plazo de este grupo terapéutico es escasa. Recientemente, se han publicado datos que indican un posible incremento de la incidencia de linfomas en pacientes tratados con IST, lo que ha vuelto a reactivar la polémica sobre su seguridad a largo plazo y sobre la necesidad de conocer la duración óptima del tratamiento con IST3. Actualmente disponemos de agentes biológicos y de nuevas terapias que comparten indicaciones con los IST, o que se pueden utilizar como puente hasta que éstos sean eficaces, dado que requieren cierto período de latencia4. Por tanto, el conocimiento de los factores asociados a la respuesta a los IST, su toxicidad a corto y a largo plazo y su comportamiento en las distintas situaciones clínicas nos puede ayudar a individualizar el tratamiento. Con ello, se podrá maximizar su rendimiento al ofrecer tratamientos alternativos o combinados con agentes biológicos (cotratamiento) a los pacientes que presentan efectos secundarios o una respuesta inadecuada a los IST. Los objetivos de este estudio fueron: a) valorar la efectividad real de los IST en condiciones de práctica clínica en cada una de sus indicaciones; b) valorar su perfil de seguridad a largo plazo, y c) identificar las variables clínicas asociadas a su respuesta y toxicidad.
PACIENTES Y MÉTODOSSelección de pacientes
De una base de datos informatizada específica para pacientes con EII (EC y colitis ulcerosa [CU]), se seleccionaron retrospectivamente los pacientes a los que se indicó tratamiento con IST, AZA o 6-MP. La base de datos es propia de dos de los autores (P.N. y J.P.), está inscrita en el Registro de la Propiedad Intelectual (V-11028) y cumple las leyes vigentes de protección de datos. Todos los pacientes seguían controles analíticos e intervalos de visitas preestablecidos según el protocolo: a las 0, 2, 4 y 12 semanas y, posteriormente, cada 3 meses. El diagnóstico se había establecido según los criterios clásicos de Lennard-Jones5. Se excluyeron los pacientes que iniciaron tratamiento en otro centro y los que no habían acudido a la visita clínica en un período superior a un año. La EC se caracterizó según la edad de presentación, la localización y el patrón evolutivo, de acuerdo con la clasificación de Viena6. En la CU se consideró la extensión: proctosigmoiditis, colitis izquierda, colitis extensa o pancolitis.
Tanto en la CU como en la EC se consideraron las siguientes indicaciones de tratamiento: corticodependencia (imposibilidad de retirar los corticoides por reaparición de sintomatología o necesidad de más de dos tandas de corticoides al año)7 e inducción de la remisión. En la EC se añadieron las de enfermedad fistulizante y la prevención de la recurren-cia posquirúrgica. Otras indicaciones, como la enfermedad extensa o el tratamiento de mantenimiento tras un brote grave, no se analizaron individualmente y se consideraron como «otras». Además de la caracterización de la enfermedad y de la indicación del tratamiento, se documentaron las variables demográficas, la edad al diagnóstico, el tiempo de evolución de la enfermedad, la presencia de manifestaciones extraintestinales y el tratamiento concomitante al inicio del tratamiento: aminosalicilatos orales o tópicos, antibióticos, corticoides, ciclosporina o antifactor de necrosis tumoral (anti-TNF). El estudio fue presentado a la Comisión de Investigación del Hospital La Fe, fue aprobado para su realización y cumplió los requisitos éticos exigidos por ésta.
Tratamiento con azatioprina o 6-mercaptopurinaTodos los pacientes fueron tratados inicialmente con AZA. En la prevención de la recurrencia posquirúrgica se inició tratamiento inmediatamente tras la cirugía en caso de una segunda resección; el resto de pacientes fueron sometidos a una colonoscopia al año de la cirugía y sólo en los que presentaban un índice de Rutgeerts µ 2 se inició tratamiento. El tratamiento con AZA se inició incrementando paulatinamente la dosis hasta conseguir dosis plenas en el plazo de un mes, o bien con dosis plenas (2,5 mg/kg) en función del médico que lo prescribió y según la disponibilidad de valores de la actividad de la tiopurina metiltransferasa (TPMT), que no estuvieron disponibles habitualmente. En los pacientes en que se dispuso de la cuantificación de la actividad de la TPMT se inició con dosis plenas en caso de valores superiores a 5 U/ml. La dosis total de AZA inicialmente se fraccionó en 2 o 3 tomas en todos los pacientes. En caso de intolerancia gastrointestinal se inició tratamiento con dosis más bajas (25 mg/día) incrementándola lentamente (25 mg cada 57 días); en caso de persistir la sintomatología se inició tratamiento con 6-MP. Se documentaron todos los efectos secundarios que se produjeron durante el tratamiento con IST y la actitud tomada en el momento de su aparición: retirada del tratamiento (temporal o definitiva) y modificación de la dosis (distinguiendo si la disminución de la dosis fue superior o inferior al 50%). La leucopenia se consideró a partir de cifras de leucocitos inferiores a 3.500/µl y su gravedad en función de la cifra de neutrófilos: leve si era superior a 1.200/µl, moderada si estaba comprendida entre 1.200 y 500/µl y grave si descendía por debajo de 500/µl. Se consideró elevación de las enzimas hepáticas si se produjo en su determinación un incremento superior al 50% del límite superior de la normalidad. Algunos síntomas, como náuseas, vómitos o epigastralgia, se documentaron como intolerancia gastrointestinal. Las determinaciones de amilasa y lipasa sólo se solicitaron en caso de sospecha clínica de pancreatitis.
Definiciones y medidas de eficacia clínicaLas valoraciones las realizaron dos especialistas de forma independiente. En caso de discordancia, se consideró la opinión del especialista que había prescrito el tratamiento.
Remisión clínicaPara la corticodependencia se consideró como remisión clínica la retirada definitiva de los corticoides sistémicos (incluida la budesonida) durante al menos 3 meses consecutivos, y para la corticorresistencia la ausencia de diarrea, dolor abdominal o fiebre, y la innecesaria realización de tratamiento con corticoides al menos durante un período de 3 meses consecutivos. Se permitió el tratamiento tópico con 5-ASA o con esteroides y también con aminosalicilatos orales. En la EPA se consideró como remisión el cierre completo de las fístulas, valorado de forma clínica (exploración visual y examen físico). Se permitió el tratamiento concomitante inicial con antibióticos (metronidazol y/o ciprofloxacino). En la prevención de la recurrencia posquirúrgica todos los pacientes estaban en remisión en el momento de la inclusión. Los resultados fueron analizados por intención de tratar y por protocolo, considerando sólo los pacientes que siguieron al menos 3 meses de tratamiento (los pacientes a quienes se retiró el tratamiento durante el primer trimestre por efectos adversos se incluyeron como no responde-dores).
Recidiva clínicaEn los pacientes que alcanzaron la remisión completa, la recidiva se consideró si había exacerbación clínica, acompañada de la introducción de corticoides sistémicos, infliximab o la resección quirúrgica.
Análisis estadísticoLas variables cualitativas se expresan como frecuencias (n) y porcentajes. Las variables cuantitativas se especifican con su mediana y límites. Se comprobó el ajuste de las variables cuantitativas a la distribución normal mediante la prueba de Kolmogorov-Smirnov; en caso de no ajustarse, se realizó una transformación logarítmica de la variable para reducir la variabilidad. Para las comparaciones entre variables cualitativas se utilizó la prueba de la µ2 o el test exacto de Fisher en caso de ser necesario. Las variables cuantitativas se analizaron mediante la prueba de la t de Student o la prueba de la U de Mann-Whitney, en caso de no cumplir el supuesto de normalidad. En todos los casos se consideró significativo un valor de p < 0,05. Para identificar las variables asociadas con la respuesta o la toxicidad, se incluyeron en el análisis multivariante las más relevantes clínicamente y las que obtuvieron en el análisis bivariante un valor de p < 0,10. Las probabilidades de recidiva se calcularon mediante tablas de supervivencia. La influencia de las variables concomitantes sobre el tiempo de recidiva se examinaron mediante regresión de Cox.
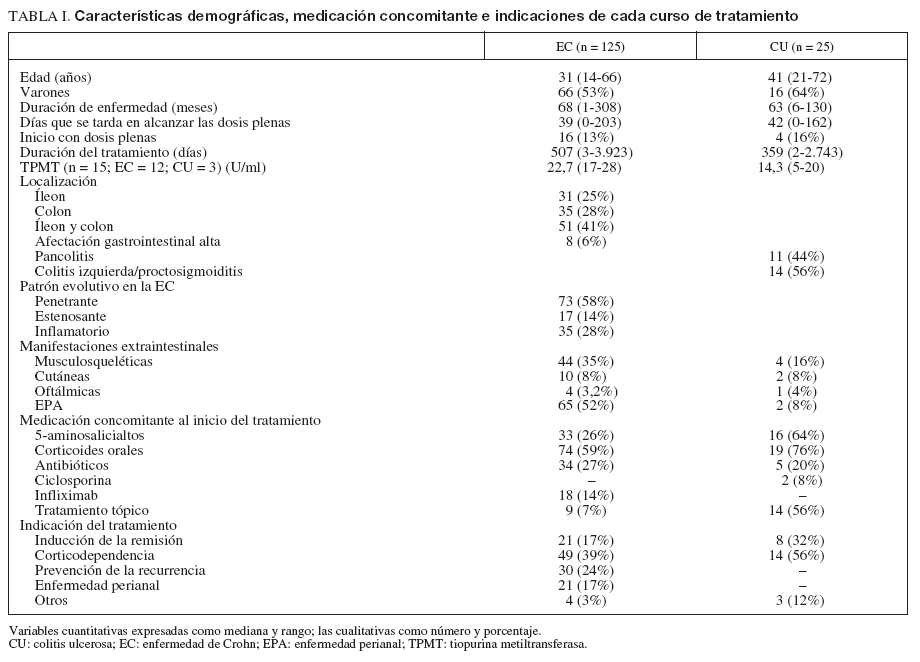
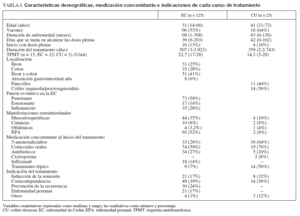
RESULTADOSDe 560 pacientes incluidos en la base de datos, 168 recibían IST y, de ellos, 126 cumplían criterios de inclusión. Se iniciaron 150 cursos de tratamiento en estos 126 pacientes. Veinticuatro pacientes recibieron un segundo curso de tratamiento: 18 lo hicieron por una segunda indicación diferente tras el fracaso de la primera, en la mayoría de los casos para prevención de la recurrencia posquirúrgica (n = 14), y 6 iniciaron un segundo curso de tratamiento con 6-MP tras la retirada de AZA por la aparición de un efecto secundario. Cada curso de tratamiento se mantuvo durante una mediana de 494 días (rango, 2-3.921). De los 150 cursos de tratamiento, 125 fueron en pacientes con EC y 25 en pacientes con CU. Dos pacientes fueron diagnosticados inicialmente de colitis indeterminada, si bien en el transcurso de la enfermedad uno fue catalogado como EC y otro como CU, y como tales fueron analizados. Las características demográficas, la medicación concomitante y las indicaciones de cada curso de tratamiento se recogen en la tabla I.
TABLA I. Características demográficas, medicación concomitante e indicaciones de cada curso de tratamiento
Inducción de la remisión
De los 150 cursos de tratamiento indicados, la inducción de la remisión clínica fue evaluada en 118 (93 EC y 25 CU). Los 32 cursos restantes no fueron evaluados porque la indicación de tratamiento fue la prevención de la recurrencia posquirúrgica. Por intención de tratar, la remisión clínica completa se alcanzó en 73 pacientes de 118 (62%), 54/93 (58%) en pacientes con EC y 20/25 (80%) en pacientes con CU. Por protocolo, la remisión se alcanzó en 73 (68%) de 107 casos, 54/85 (64%) en pacientes con EC y 20/22 (91%) en pacientes con CU. En la EC la remisión se alcanzó en el 73% de los cursos cuando la indicación fue por corticodependencia (n = 33) y en el 76% (n = 13) cuando se indicó por corticorresistencia; el porcentaje fue significativamente menor en la EPA (33% [n = 5]). En la CU el 100% de los casos (n = 12) alcanzó la remisión cuando la indicación fue la corticodependencia y el 71% (n = 5) cuando fue la corticorresistencia. En las indicaciones analizadas como «otras», 3 en pacientes con EC y 2 en pacientes con CU, se alcanzó la remisión clínica en todos los casos. En el análisis univariante, la remisión (por intención de tratar) se asoció significativamente con estar afectado de CU, seguir tratamiento tópico y la ausencia de EPA. En el análisis multivariante, estratificando los resultados en función de la indicación del tratamiento, la remisión se asoció negativamente de forma significativa a la EPA como indicación del tratamiento.
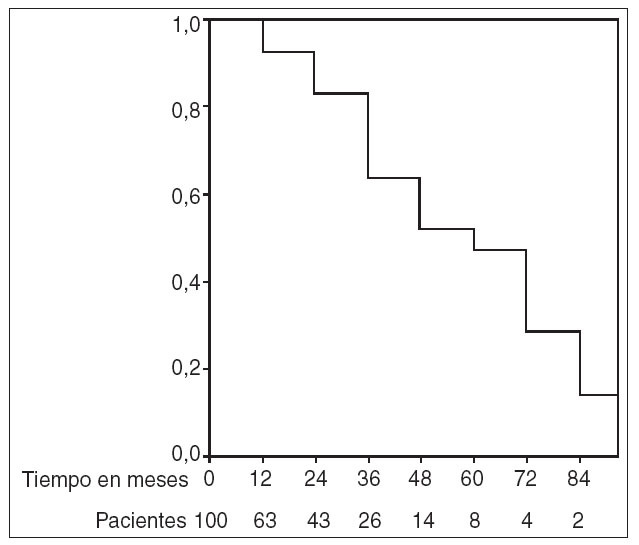
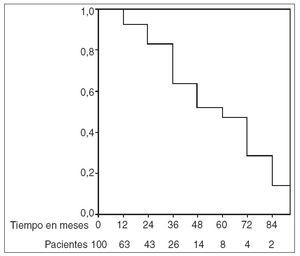
Mantenimiento de la remisiónLa remisión se mantuvo una media de tiempo de 637 días (rango, 30-2.743) y la proporción de pacientes en remisión a los 12, 24, 36, 48 y 60 meses fue de 0,93, 0,83, 0,64, 0,52 y 0,48, respectivamente (fig. 1). Las tasas de recidiva según la indicación en pacientes con CU o EC fueron similares. En los pacientes con CU la remisión se mantuvo una media de 556 días (rango, 30-2.596) y en los casos con EC la remisión se mantuvo una media de 791 días (rango, 134-2.743). El mantenimiento de la remisión no se asoció significativamente con ninguna de las variables estudiadas.
Fig. 1. Curva de supervivencia (actuarial) de los pacientes en remisión.
Retirada del tratamientoCausas de retirada del tratamiento
El tratamiento se retiró en 51 (34%) cursos de tratamiento tras una mediana de 232 días (rango, 2-2.129), en 16 (11%) pacientes durante los 3 primeros meses. La causa principal de la retirada del tratamiento fue la aparición de efectos adversos (n = 26 [17%]). Otras causas por las se retiró el tratamiento fueron: la ineficacia clínica en 3 (2%), resección quirúrgica en 11 (7%), decisión del paciente en 10 (7%) e inactividad prolongada mantenida en uno (0,6%).
Efectos secundarios
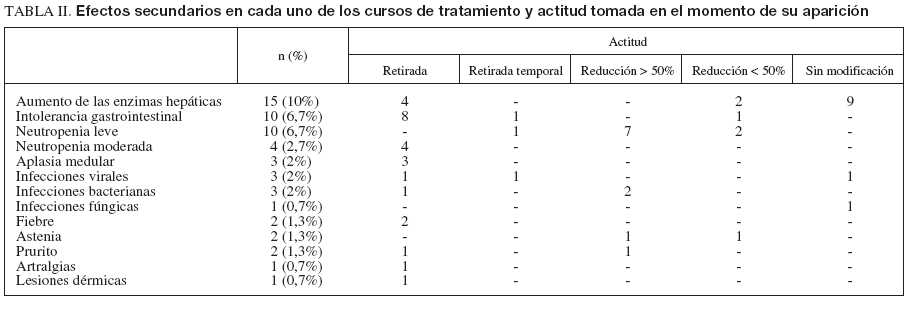
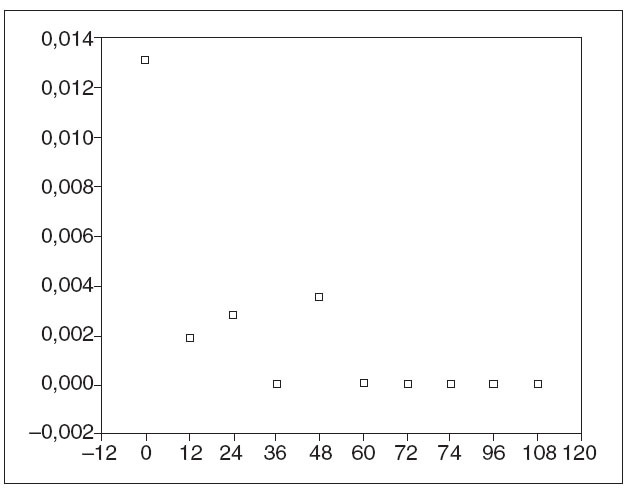
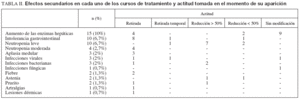
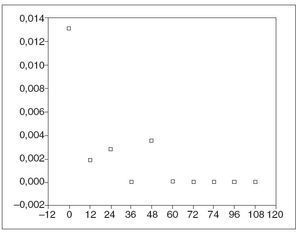
El listado con los efectos secundarios se muestra en la tabla II. En total se produjeron 57 (38%) efectos secundarios en 49 cursos, que motivaron el ajuste de la medicación en 17 (11%), la retirada temporal en 3 (2%) y la retirada definitiva en 26 (17%) pacientes. En la mayoría (n =13 [9%]) la retirada se produjo durante los 3 primeros meses de tratamiento. En este período el efecto secundario más frecuente fue la intolerancia gastrointestinal (n = 6 [4%]). La densidad de incidencia de retirada por efectos secundarios se recoge en la figura 2. El efecto secundario más frecuente fue la alteración de las enzimas hepáticas (n = 15 [10%]), que apareció tras una mediana de 214 días (rango, 2-919 meses). Diecisiete pacientes (11,3%) presentaron leucopenia (10 leve, 4 moderada y 3 en el contexto de una aplasia medular), lo que obligó a modificar la dosis de tiopurínicos en todos los casos. En dos ocasiones la leucopenia se asoció a un cuadro infeccioso: un paciente presentó fiebre sin foco, que cedió con antibióticos, y otro una infección de partes blandas. La aplasia medular se presentó a los 2, 7 y 29 meses de tratamiento, respectivamente; en los 3 fue retirado el tratamiento. En estos pacientes se solicitó la determinación de TPMT. Todos ellos presentaron valores normales. En 5 pacientes se produjeron episodios infecciosos sin relación con la neutropenia: mononucleosis infecciosa, varicela, herpes labial recidivante, infección de partes blandas y candidiasis. Ninguna de estas causas infecciosas obligó a la retirada del fármaco de forma definitiva. Diez pacientes presentaron intolerancia gastrointestinal tras una mediana de 14 días (rango, 0-223). Un paciente fue diagnosticado de pancreatitis aguda. La aparición de intolerancia gastrointestinal obligó a la retirada de la medicación en 9 pacientes y a reducir la dosis en 2 (menos de un 50%). Seis pacientes con efectos secundarios previos con AZA (5 casos de intolerancia digestiva y uno de fiebre) fueron tratados en un segundo curso con 6-MP. De ellos, 4 (67%) toleraron un segundo curso con 6MP (todos con intolerancia digestiva previa). La retirada precoz del tratamiento por efectos secundarios se asoció significativamente con el inicio del tratamiento con dosis plenas de AZA (odds ratio [OR] = 4,26; intervalo de confianza [IC] del 95%, 1,12-16,32) y con el uso concomitante de infliximab (OR = 5,6; IC del 95%, 1,17-27,1). Esta asociación fue independiente del tipo de enfermedad, la edad, el sexo o el uso de otros tratamientos concomitantes.
TABLA II. Efectos secundarios en cada uno de los cursos de tratamiento y actitud tomada en el momento de su aparición
Fig. 2. Densidad de incidencia de retirada de tiopurínicos por efectos secundarios. En abscisas se expresa el tiempo en meses hasta la aparición del efecto adverso.
DISCUSIÓNEl presente estudio nos ayuda a conocer mejor la historia natural de los pacientes con EII tratados con AZA o 6MP. Es destacable la elevada efectividad de los IST en condiciones de práctica clínica diaria, tanto para inducir como para mantener la remisión. Este efecto es independiente de la enfermedad (CU o EC) y de la indicación del tratamiento, a excepción de su utilización en la EPA. También muestra que aunque su perfil de seguridad es elevado, incluso a largo plazo, los efectos secundarios son la causa más relevante de su abandono y, por tanto, la principal limitación de su utilización. La incidencia de efectos secundarios en esta serie es similar a la referida en otras8-10. Uno de los principales hallazgos de nuestro estudio y el de mayor implicación clínica es el hecho de que el inicio del tratamiento con dosis plenas de IST se asocia con una retirada precoz debida a efectos secundarios. Pese que no hay ningún estudio al respecto, muchos autores han defendido en artículos de revisión el inicio con dosis plenas de IST11 para intentar acelerar su eficacia, ya que si el mecanismo de toxicidad a la AZA fuera alérgico, al no depender de la dosis, no se prevendría por comenzar con dosis bajas, y si la toxicidad fuera mediada por un mecanismo no alérgico, requeriría la acumulación de una dosis relativamente elevada para que se produjera, bastante más alta que los 50 mg que se utilizan en los pacientes con pauta de ascenso progresivo. Sin embargo, según nuestros resultados, escalonar la dosis al inicio del tratamiento puede ser útil para optimizar la efectividad de los IST en pacientes con EII, sobre todo en los que se utiliza conjuntamente con infliximab. Los hallazgos de este estudio deben ser ratificados en un estudio dirigido específicamente a valorar el impacto de un escalonamiento en la dosis sobre la tolerancia y la efectividad de los IST. En nuestra serie hay un elevado número de pacientes con valores anormales de transaminasas. Una incidencia similar se ha descrito en una serie española de pacientes con CU12. Hay que señalar que en este estudio se consideraron todas las elevaciones de las transaminasas aunque no tuviesen el rango de hepatotoxicidad, que no se descartaron otras causas de toxicidad hepática y que no se consideraron criterios de causalidad13. En todo caso, se observa que la elevación de las transaminasas es relativamente frecuente durante el tratamiento con IST y que no siempre implica una modificación en la dosis, como hemos demostrado recientemente14. El conocimiento de este hecho contribuye también a optimizar el tratamiento con IST, ya que algunos autores han sugerido la retirada del fármaco en caso de elevación de las transaminasas15. No se detectó ninguna neoplasia sólida ni linfomas durante el seguimiento. Este punto es relevante, ya que se ha descrito recientemente un incremento teórico en la incidencia de linfomas en los pacientes tratados con IST4. Nuestros resultados están en concordancia con otras observaciones que ponen en duda la relevancia clínica del teórico incremento de esta incidencia16. La determinación de la TPMT no estuvo siempre disponible y ésta fue normal en todos los pacientes que presentaron aplasia medular. Un fenotipo normal de TPMT asociado a leucopenia grave ya se ha descrito previamente17. El manejo realizado en la mayoría de nuestros pacientes refuerza la seguridad del uso de IST en condiciones de práctica clínica sin disponer de la TPMT, como se propone en algunas guías de práctica clínica18, aunque su determinación esté recomendada por otras instituciones4. El porcentaje de respuesta presentado en este estudio es mayor que en otras series similares. La tasa de respuesta por protocolo en la serie retrospectiva publicada por Fra-ser et al8, con 622 pacientes y criterios de respuesta similares a los empleados en este estudio, fue de un 58% en pacientes con CU y de un 45% en pacientes con EC. Sanromán et al12, en pacientes con CU corticodependiente, describen unos resultados más parejos, con un porcentaje de remisión del 71% por intención de tratar y de un 73% por protocolo. Nuestros resultados tan positivos en pacientes con CU deben interpretarse con cautela por el escaso número de pacientes incluidos. Conviene destacar que el porcentaje de respuesta no fue el mismo para todas las indicaciones. En los pacientes en quienes se utilizó para el tratamiento de una EPA, el porcentaje de respuesta fue significativamente menor y, de hecho, supuso, en este estudio, el único factor independiente asociado a una respuesta desfavorable. Este hecho es coherente con los resultados previos del metanálisis de Person et al19, en el que se refería un porcentaje de respuesta inferior en la EPA en comparación con la enfermedad luminal. Sin embargo, conviene hacer algunas consideraciones a este respecto. El porcentaje de remisión tan bajo en nuestra serie está en relación con la definición estricta de respuesta que utilizamos, ya que se considera remisión el cierre completo de las fístulas. Este objetivo terapéutico no se utiliza universalmente, y en ensayos clínicos recientes con fármacos biológicos el objetivo primario fue la disminución del 50% de las fístulas o el descenso en un 50% del drenaje de éstas20,21. Actualmente, se ha aprobado el uso de infliximab para la inducción y el mantenimiento de la EPA20,21. Nuestros resultados refuerzan que, sobre todo en fístulas complejas, el tratamiento de la EPA con IST no sea suficiente y además de un abordaje multidisciplinario conjuntamente con el cirujano, el cotratamiento de IST con infliximab mejore el porcentaje de pacientes con cierre completo de las fístulas. En este estudio no encontramos factores predictivos de respuesta. Previamente se ha descrito que la leucopenia podría ser útil para predecir la respuesta, e incluso se ha propuesto como marcador indirecto de una correcta do-sificación22,23. Estos datos no los han corroborado otros autores24, por lo que se refuerza la idea de que una cifra normal de leucocitos no excluye una correcta dosificación. Es conveniente para la adecuada interpretación de este estudio comentar varios aspectos metodológicos. Es importante señalar que el estudio es retrospectivo, pese a la inclusión consecutiva y uniformemente programada en la base de datos. Como contrapartida, hay que señalar que sólo este tipo de estudios nos pueden ayudar a valorar ciertos aspectos que requieren un elevado número de pacientes y un período de seguimiento prolongado, como puede ser la seguridad a largo plazo. En este estudio no utilizamos un índice de actividad clínica para valorar la respuesta, ya que creemos que la elección de criterios simples, aunque metodológicamente más incorrectos, facilita la interpretación de los datos expuestos. También hay que puntualizar que se ha utilizado la clasificación de Viena en vez de la clasificación de Montreal25, ya que cuando se realizó la recogida de datos esta última no estaba vigente. Nuestros resultados ratifican la pertinencia de la clasificación de Montreal, que separa la EPA de los patrones evolutivos. La EPA, por sus peculiaridades clínicas y mala respuesta a tratamientos convencionales, debe considerarse individualmente, como ya hemos sugerido en estudios previos26. Los datos de este estudio corroboran la efectividad y el perfil de seguridad de los IST en la EII; sin embargo, también se resalta la necesidad de desarrollar estudios investigación donde se valoren algunos puntos cruciales que faltan por resolver, como la pauta de introducción de los inmunosupresores, el estudio de la duración óptima del tratamiento, el mejor conocimiento de los factores asociados a la toxicidad y la mejoría en la selección de pacientes candidatos al cotratamiento con fármacos biológicos desde el inicio.
AGRADECIMIENTOSParte de este estudio fue financiado por una beca del Instituto de Salud Carlos III (C03/03). Guillermo Bastida ha desarrollado este trabajo durante su período como becario de la Fundación de Investigación del Hospital Universitario La Fe de Valencia.
Correspondencia: G. Bastida Paz. Servicio de Medicina Digestiva. Hospital Universitario La Fe. Avda. de Campanar, 21. 46009 Valencia. España. Correo electrónico: gbastidap@sepd.org
Recibido el 18-1-2007; aceptado para su publicación el 18-6-2007.