Los pacientes cirróticos con frecuencia presentan trastornos nutricionales.
ObjetivosValorar en pacientes con hepatopatía crónica los niveles plasmáticos de ácido fólico y vitamina B12 y determinar si estos parámetros pueden ayudar al diagnóstico etiológico de esta enfermedad.
Pacientes y métodoSe estudiaron 39 pacientes que ingresan por descompensación de su hepatopatía (29 de etiología alcohólica y 10 por otras causas) y se comparan con 35 controles. Se analizaron, entre otros, los niveles plasmáticos de ácido fólico, vitamina B12, volumen corpuscular medio (VCM), aspartato aminotransferasa (AST), alanino aminotransferasa (ALT), el cociente AST/ALT, la gammaglutamiltransferasa (GGT).
ResultadosLos niveles plasmáticos de vitamina B12 en pacientes con hepatopatía crónica descompensada eran de 1.151±568pg/ml y 440±133pg/ml en los controles (p<0,05). Los niveles plasmáticos de ácido fólico fueron de 8,57±3,8ng/ml en los controles y de 6,68±2,74ng/ml en los pacientes con hepatopatía crónica descompensada (p<0,05). Los pacientes con hepatopatía crónica de etiología alcohólica tenían unos niveles plasmáticos de ácido fólico inferiores que los pacientes con hepatopatía no alcohólica (5,7±2,1 frente a 9,3±2.6; p<0,0005). El cociente entre la vitamina B12/ácido fólico discriminaba mejor la etiología alcohólica que otros parámetros analíticos como la AST, ALT, VCM, el cociente AST/ALT y la GGT.
ConclusionesLos niveles plasmáticos de vitamina B12 en pacientes con hepatopatía crónica descompensada están altos, mientras que los niveles plasmáticos de ácido fólico están bajos. El cociente entre la vitamina B12 y el ácido fólico podría ser útil en el diagnóstico diferencial de la etiología de la hepatopatía crónica.
Patients with liver disease frequently experience changes in their nutritional status.
ObjectiveTo determine changes in vitamin B12 and folic acid plasma levels in patients with chronic cirrhosis and to assess whether these parameters may be useful in the etiologic diagnosis of this disease.
Patients and methodsThirty-nine patients admitted for decompensated cirrhosis (29 with alcoholic etiology and 10 with non-alcoholic etiology) and 35 controls were prospectively studied. Plasma levels of vitamin B12, folate acid, mean corpuscular volume (MCV), aspartate aminotransferase (AST), alanine aminotransferase (ALT), AST/ALT ratio, and gamma-glutamyltransferase (GGT), among other parameters, were measured.
ResultsVitamin B12 levels were 1151±568pg/ml in patients with decompensated cirrhosis and 440±133pg/ml in controls (p<0.05). Plasma folate levels were 8.57±3.8ng/ml in controls and 6.68±2.74ng/ml in patients with cirrhosis (p<0.05). Folate levels were lower in patients with alcoholic cirrhosis (mean value, 5.7±2.1) than in those with non-alcoholic cirrhosis (9.3±2.6; p<0.0005). The vitamin B12/folate ratio discriminated alcoholic etiology better than other parameters such as AST, ALT, MCV, AST/ALT ratio and GGT.
ConclusionsPlasma levels of vitamin B12 in patients with decompensated chronic liver disease are high, whereas plasma folate levels are low. The ratio between vitamin B12 and folic acid may be useful in the differential diagnosis of the etiology of chronic liver disease.
Las enfermedades hepáticas crónicas son una causa importante de morbimortalidad en España y se sitúan entre las 10 primeras causas de muerte. Por ejemplo, aproximadamente entre un 10 y un 35% de los alcohólicos desarrollaran cirrosis1. La mortalidad ajustada por 100.0000 habitantes de la cirrosis es de 18,8 en los varones y de 5,89 en mujeres, y 8.273 defunciones en 2002. Suele incidir en individuos entre los 40 y 60 años, los más productivos de la vida, en los que constituye la cuarta causa de muerte. En los Estados Unidos, la cirrosis es la séptima causa de muerte en adultos jóvenes2. Existen diferentes causas que pueden producir enfermedad hepática y, por tanto, su tratamiento es diferente. Es prioritario determinar su etiología para iniciar precozmente tratamientos efectivos en cada una de ellas. Para el diagnóstico de la enfermedad hepática y su gravedad nos basamos, entre otros, en la historia clínica, la exploración física y en las determinaciones analíticas3.
Las determinaciones analíticas que apoyan una etiología alcohólica de la hepatopatía son fundamentalmente la gammaglutamiltransferasa (GGT), la aspartato aminotransferasa (AST) y la alanino aminotransferasa (ALT). Por lo general, en la etiología alcohólica los niveles de AST son al menos el doble que los niveles de ALT3,4. Este ratio es encontrado en más del 80% de los pacientes con enfermedad hepática alcohólica. Otro indicador analítico de consumo excesivo de alcohol son elevaciones de los niveles de GGT. De las 3 enzimas, la GGT es la que más precisión diagnóstica aporta, sin embargo, puede incrementarse en otras enfermedades o con el consumo de fármacos. Otro marcador bioquímico utilizado para determinar el consumo excesivo de alcohol es la transferrina deficiente de carbohidratos (CDT). Sin embargo, este marcador muestra un pequeño beneficio sobre la GGT como marcador del consumo excesivo de alcohol5. Los parámetros analíticos en la hepatopatía crónica alcóholica pueden estar alterados, debido a la malnutrición que presentan los pacientes, lo que además puede favorecer un aumento del daño hepático6.
La vitamina B12 o cobalamina y el ácido fólico son vitaminas muy importantes para el funcionamiento del organismo. La vitamina B12 junto al ácido fólico participa en la síntesis de DNA, por lo que el déficit de estas vitaminas se ha relacionado con alteraciones en el DNA que pueden favorecer la aparición del cáncer7.
Nuestro objetivo es determinar los niveles plasmáticos de vitamina B12 y ácido fólico en los pacientes que ingresan por descompensaciones hepáticas y valorar si estos niveles plasmáticos de vitamina B12 y ácido fólico, podrían servir para diferenciar una hepatopatía alcohólica del resto de etiologías.
Pacientes y métodosSe estudia de forma prospectiva a 39 pacientes que ingresan por descompensación de su hepatopatía crónica en el Hospital Donostia desde febrero a mayo del 2006. La edad de inclusión era entre 18 y 65 años.
Se excluyeron aquellos pacientes con hepatopatía crónica que tomaban antes del ingreso vitamina B12 u otros preparados vitamínicos, a excepción de la vitamina K; los pacientes con tumores asociados; los operados del estómago o del intestino; embarazadas; aquellos pacientes con etiologías mixtas como causa de su hepatopatía (por ejemplo, alcohol más virus de la hepatitis C); los pacientes con etiología indeterminada; aquellos que habían sido transfundidos previamente a la realización de la determinación analítica; pacientes infectados con el virus de la inmunodeficiencia humana o aquellos con enfermedades hematológicas.
Los pacientes eran diagnosticados de hepatopatía crónica si presentaban signos clínicos, alteraciones analíticas y/o hallazgos ecográficos o endoscópicos que indicasen esta enfermedad. Para el diagnóstico de hepatopatía crónica no se exigió la realización de biopsia hepática.
A todos los pacientes se les realizó una historia clínica completa y una analítica en las primeras 72h del ingreso. Los pacientes fueron seguidos durante 24 meses+/−4 meses tras su inclusión en el estudio.
Los parámetros analíticos que se determinaron fueron los siguientes: vitamina B12, ácido fólico, volumen corpuscular medio (VCM), hemoglobina (Hb), sodio, potasio, autoanticuerpos (antimúsculo liso, antimitocondriales, antinucleares, antigliadina y antitrasglutaminasa), el índice de protrombina, bilirrubina total, creatinina, urea, AST, ALT, el cociente AST/ALT, GG, fosfatasa alcalina, hierro, ferritina, transferrina, plaquetas, colesterol total, triglicéridos, alfafetoproteína, proteína C reactiva, proteínas totales, albúmina, gammaglobulina, inmunoglobulinas (A, G y M) y marcadores virales (antígeno HBs, anticuerpos HBc y VHC). Todas las determinaciones eran realizadas de forma rutinaria en el laboratorio de nuestro hospital.
La concentración sérica de ácido fólico y vitamina B12 fue determinada mediante inmunoanálisis electroquimioluminiscente (ECLIA, Roche Diagnostics, Mannheim, Alemania), siguiendo las recomendaciones realizadas por el fabricante y utilizando para ello el analizador Elecsys 2010 (Roche Diagnostics, Mannheim, Alemania). Los valores considerados como normales en nuestro laboratorio fueron entre 3,1ng/ml y 12,6ng/ml, para el ácido fólico, y entre 211pg/ml y 900pg/ml, para la vitamina B12.
Los pacientes se clasificaron en 3 grupos en función del consumo de alcohol. El grupo I, incluía a los pacientes con hepatopatía crónica alcohólica y consumo activo de alcohol. El grupo II eran pacientes diagnosticados en ingresos previos de hepatopatía crónica de etiología alcohólica y que en el ingreso negaban cualquier consumo de alcohol. El grupo III estaba formado por pacientes con hepatopatías crónicas diferentes al alcohol.
Se estableció un grupo control (grupo IV) formado por personas sin hepatopatía que ingresaban en el hospital para realizar intervenciones de cirugía menor (cirugía plástica y estética, artroscopia u operaciones oculares) y los trabajadores del propio hospital. Al grupo control se les realizó también una exhaustiva historia clínica y se recogieron los mismos parámetros analíticos que en el resto de los grupos.
Se estableció la equivalencia de 10g de alcohol con un vaso de vino o una caña o media copa de licor.
El estudio fue aprobado por el Comité de Ética de Investigación Clínica de nuestro hospital. Todos los participantes firmaron el consentimiento informado antes de iniciar el estudio.
EstadísticaPara la comparación de las medias de los parámetros analíticos entre los diferentes grupos de estudio se utilizó la prueba t de Student y ANOVA o la U de Mann-Witney, T de Wilcoxon y Kruskall-Wallis, según la distribución de las variables.
Se analizó el poder de discriminación de los parámetros analíticos entre los pacientes con hepatopatía crónica alcohólica frente a otras etiologías, mediante la construcción de curvas ROC y el contraste del área bajo la curva.
Se utilizaron los programas estadísticos SPSS 15.0 y MedCalc 6.12. Se consideró significación estadística cuando la era inferior a p>0,05.
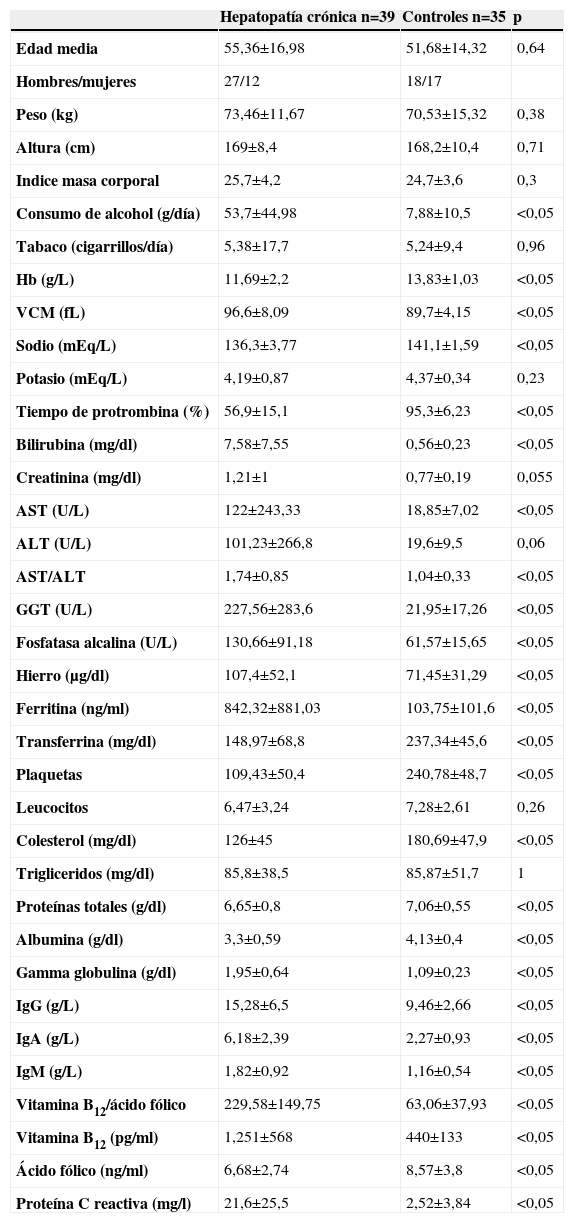
ResultadosSe seleccionaron inicialmente 48 pacientes, de los cuales se excluyeron 9; uno por recibir vitamina B12, 4 por presentar tumores durante del ingreso, uno por presentar gastrectomía, 2 por tener una edad mayor que 65 años y otro por presentar una etiología mixta (alcohol más virus de la hepatitis C). Finalmente, se incluyeron 39 pacientes con hepatopatía crónica y 35 controles (grupo IV). Las características de los pacientes y controles se exponen en la tabla 1. En el grupo I había 16 pacientes, 13 en el grupo II y 10 en el grupo III. De los 10 pacientes del grupo III, en cuatro la etiología fue el virus de la hepatitis C, en cuatro el origen fue autoinmune y en dos, cirrosis biliar primaria. Durante el seguimiento, 10 pacientes (26%) fallecieron o fueron trasplantados. Además, 5 pacientes desarrollaron hepatocarcinomas.
Características de los pacientes y de los controles
| Hepatopatía crónica n=39 | Controles n=35 | p | |
| Edad media | 55,36±16,98 | 51,68±14,32 | 0,64 |
| Hombres/mujeres | 27/12 | 18/17 | |
| Peso (kg) | 73,46±11,67 | 70,53±15,32 | 0,38 |
| Altura (cm) | 169±8,4 | 168,2±10,4 | 0,71 |
| Indice masa corporal | 25,7±4,2 | 24,7±3,6 | 0,3 |
| Consumo de alcohol (g/día) | 53,7±44,98 | 7,88±10,5 | <0,05 |
| Tabaco (cigarrillos/día) | 5,38±17,7 | 5,24±9,4 | 0,96 |
| Hb (g/L) | 11,69±2,2 | 13,83±1,03 | <0,05 |
| VCM (fL) | 96,6±8,09 | 89,7±4,15 | <0,05 |
| Sodio (mEq/L) | 136,3±3,77 | 141,1±1,59 | <0,05 |
| Potasio (mEq/L) | 4,19±0,87 | 4,37±0,34 | 0,23 |
| Tiempo de protrombina (%) | 56,9±15,1 | 95,3±6,23 | <0,05 |
| Bilirubina (mg/dl) | 7,58±7,55 | 0,56±0,23 | <0,05 |
| Creatinina (mg/dl) | 1,21±1 | 0,77±0,19 | 0,055 |
| AST (U/L) | 122±243,33 | 18,85±7,02 | <0,05 |
| ALT (U/L) | 101,23±266,8 | 19,6±9,5 | 0,06 |
| AST/ALT | 1,74±0,85 | 1,04±0,33 | <0,05 |
| GGT (U/L) | 227,56±283,6 | 21,95±17,26 | <0,05 |
| Fosfatasa alcalina (U/L) | 130,66±91,18 | 61,57±15,65 | <0,05 |
| Hierro (μg/dl) | 107,4±52,1 | 71,45±31,29 | <0,05 |
| Ferritina (ng/ml) | 842,32±881,03 | 103,75±101,6 | <0,05 |
| Transferrina (mg/dl) | 148,97±68,8 | 237,34±45,6 | <0,05 |
| Plaquetas | 109,43±50,4 | 240,78±48,7 | <0,05 |
| Leucocitos | 6,47±3,24 | 7,28±2,61 | 0,26 |
| Colesterol (mg/dl) | 126±45 | 180,69±47,9 | <0,05 |
| Trigliceridos (mg/dl) | 85,8±38,5 | 85,87±51,7 | 1 |
| Proteínas totales (g/dl) | 6,65±0,8 | 7,06±0,55 | <0,05 |
| Albumina (g/dl) | 3,3±0,59 | 4,13±0,4 | <0,05 |
| Gamma globulina (g/dl) | 1,95±0,64 | 1,09±0,23 | <0,05 |
| IgG (g/L) | 15,28±6,5 | 9,46±2,66 | <0,05 |
| IgA (g/L) | 6,18±2,39 | 2,27±0,93 | <0,05 |
| IgM (g/L) | 1,82±0,92 | 1,16±0,54 | <0,05 |
| Vitamina B12/ácido fólico | 229,58±149,75 | 63,06±37,93 | <0,05 |
| Vitamina B12 (pg/ml) | 1,251±568 | 440±133 | <0,05 |
| Ácido fólico (ng/ml) | 6,68±2,74 | 8,57±3,8 | <0,05 |
| Proteína C reactiva (mg/l) | 21,6±25,5 | 2,52±3,84 | <0,05 |
ALT: alanino aminotransferasa; AST: aspartato aminotransferasa; GGT: gamma-glutamiltransferasa; VCM: volumen corpuscular medio.
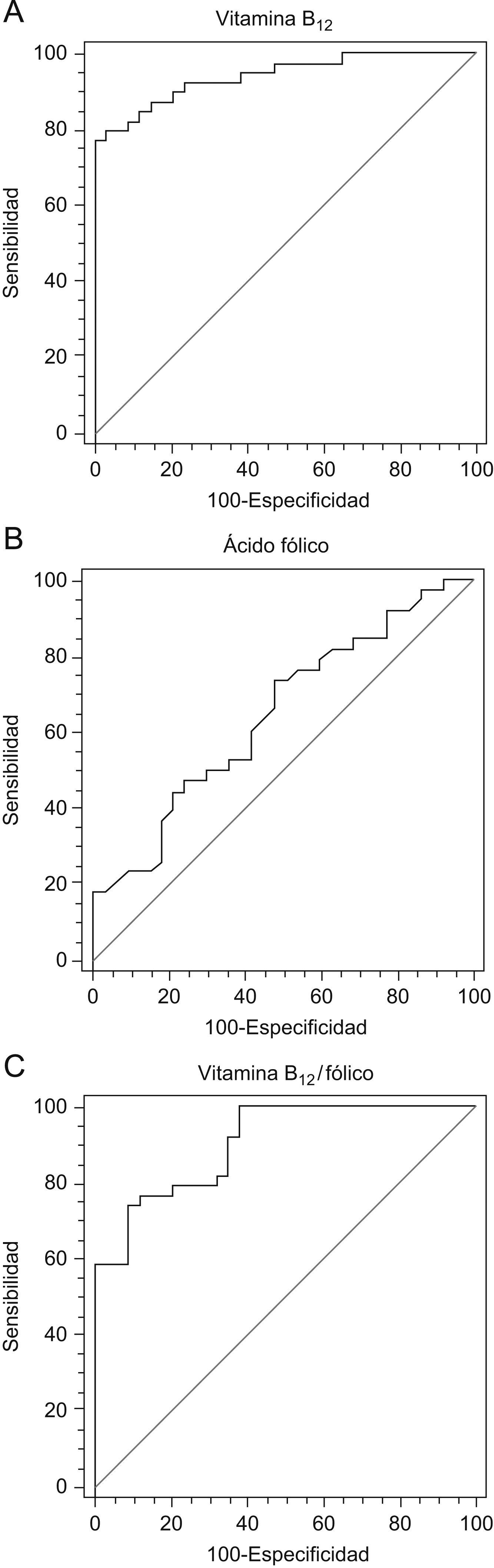
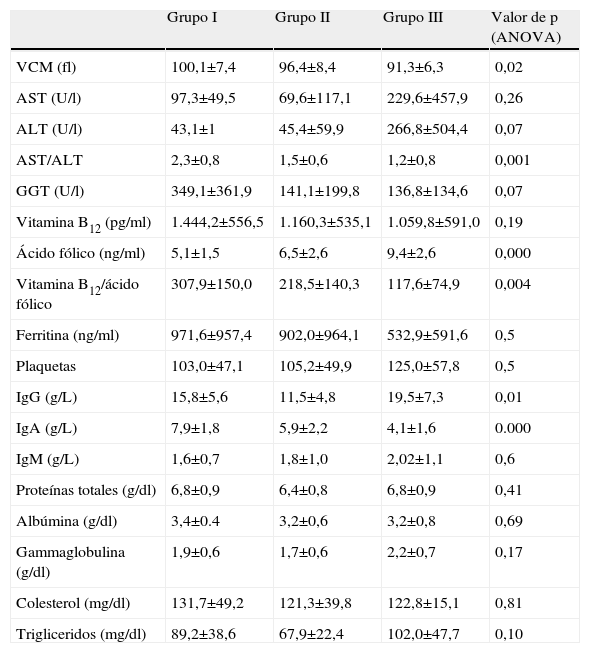
El valor de vitamina B12 en los pacientes con hepatopatía crónica fue de 1.151±568pg/ml y de 440±133pg/ml en los controles (p=0,01). Un punto de corte de vitamina B12 de 500pg/ml diferenciaba los pacientes con hepatopatía de los controles. La sensibilidad para ese punto de corte era del 92% y la especificidad del 86,5%, siendo el área bajo la curva de 0,94. El valor de vitamina B12 en el grupo I fue de 1.444±556pg/ml, 1.160±535pg/ml en el grupo II y 1.060±591pg/ml en el grupo III. No se encontraron diferencias significativas en los niveles de vitamina B12 entre los grupos I, II, III (tabla 2).
Valores plasmáticos en los diferentes grupos de pacientes con hepatopatía
| Grupo I | Grupo II | Grupo III | Valor de p (ANOVA) | |
| VCM (fl) | 100,1±7,4 | 96,4±8,4 | 91,3±6,3 | 0,02 |
| AST (U/l) | 97,3±49,5 | 69,6±117,1 | 229,6±457,9 | 0,26 |
| ALT (U/l) | 43,1±1 | 45,4±59,9 | 266,8±504,4 | 0,07 |
| AST/ALT | 2,3±0,8 | 1,5±0,6 | 1,2±0,8 | 0,001 |
| GGT (U/l) | 349,1±361,9 | 141,1±199,8 | 136,8±134,6 | 0,07 |
| Vitamina B12 (pg/ml) | 1.444,2±556,5 | 1.160,3±535,1 | 1.059,8±591,0 | 0,19 |
| Ácido fólico (ng/ml) | 5,1±1,5 | 6,5±2,6 | 9,4±2,6 | 0,000 |
| Vitamina B12/ácido fólico | 307,9±150,0 | 218,5±140,3 | 117,6±74,9 | 0,004 |
| Ferritina (ng/ml) | 971,6±957,4 | 902,0±964,1 | 532,9±591,6 | 0,5 |
| Plaquetas | 103,0±47,1 | 105,2±49,9 | 125,0±57,8 | 0,5 |
| IgG (g/L) | 15,8±5,6 | 11,5±4,8 | 19,5±7,3 | 0,01 |
| IgA (g/L) | 7,9±1,8 | 5,9±2,2 | 4,1±1,6 | 0.000 |
| IgM (g/L) | 1,6±0,7 | 1,8±1,0 | 2,02±1,1 | 0,6 |
| Proteínas totales (g/dl) | 6,8±0,9 | 6,4±0,8 | 6,8±0,9 | 0,41 |
| Albúmina (g/dl) | 3,4±0.4 | 3,2±0,6 | 3,2±0,8 | 0,69 |
| Gammaglobulina (g/dl) | 1,9±0,6 | 1,7±0,6 | 2,2±0,7 | 0,17 |
| Colesterol (mg/dl) | 131,7±49,2 | 121,3±39,8 | 122,8±15,1 | 0,81 |
| Trigliceridos (mg/dl) | 89,2±38,6 | 67,9±22,4 | 102,0±47,7 | 0,10 |
ALT: alanino aminotransferasa; AST: aspartato aminotransferasa; GGT: gammaglutamiltransferasa; VCM: volumen corpuscular medio.
El nivel plasmático de ácido fólico en los controles fue de 8,57±3,8ng/ml, frente a 6,68±2,74ng/ml en los pacientes con hepatopatía crónica (p=0,02). Los pacientes con hepatopatía crónica alcohólica (grupo I y II) presentaban niveles de ácido fólico (valor medio: 5,7±2,1) más bajos que los pacientes con hepatopatías de otra etiología (9,3±2,6; p<0,0005). También se observaron diferencias significativas en el cociente B12/fólico (p=0,003) entre los grupos I y II vs. III (tabla 2).
AST y ALTEn los pacientes con hepatopatía alcohólica se observaron incrementos en los niveles plasmáticos de AST y el ratio AST/ALT. El ratio AST/ALT era mayor a 2 en los pacientes con hepatopatia etílica activa y significativamente superior a los grupos II y III (p=0.002). Otros parámetros como el VCM también fue significativamente superior en el grupo I frente al grupo III (p=0.048). La GGT fue superior en el grupo I frente al grupo II y III (p=0.01) (tabla 2).
Alteraciones analíticas y etiología de la hepatopatía crónicaEn la tabla 2 se describen los parámetros analíticos en función de la etiología de la hepatopatía crónica. El ácido fólico, la vitamina B12, el cociente vitamina B12/ácido fólico y la IgA eran los parámetros analíticos que más se asociaban a una etiología etílica de la hepatopatía. Cuando relacionamos los valores plasmáticos de vitamina B12 en los pacientes cirróticos con otros parámetros, observamos cómo existía una correlación intensamente positiva con la IgA (0,45; p=0,035) y el VCM (0,42; p=0,042), y menos intensa con los valores de GGT (0,27; p=0,005) y el cociente AST/ALT (0,23; p=0,034). Además, la vitamina B12 se correlacionaba de forma intensa, pero negativa, con el índice de protrombina (0,38; p=0,02) y el número de plaquetas (0,27; p=0,038).
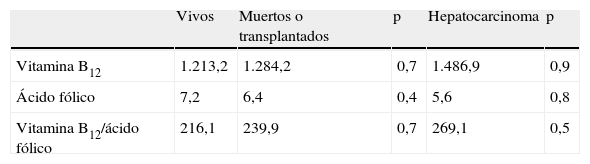
La sensibilidad y la especificidad del cociente vitamina B12/ácido fólico para el diagnóstico de la hepatopatía variaban según el punto de corte establecido (fig. 1). Cuando el punto de corte del cociente vitamina B12/ácido fólico era de 118, la sensibilidad y especificidad para detectar hepatopatía alcohólica era del 89 y 70%, respectivamente. Cuando el punto de corte se aumentaba a 231, la sensibilidad era del 50% y la especificidad del 90%.
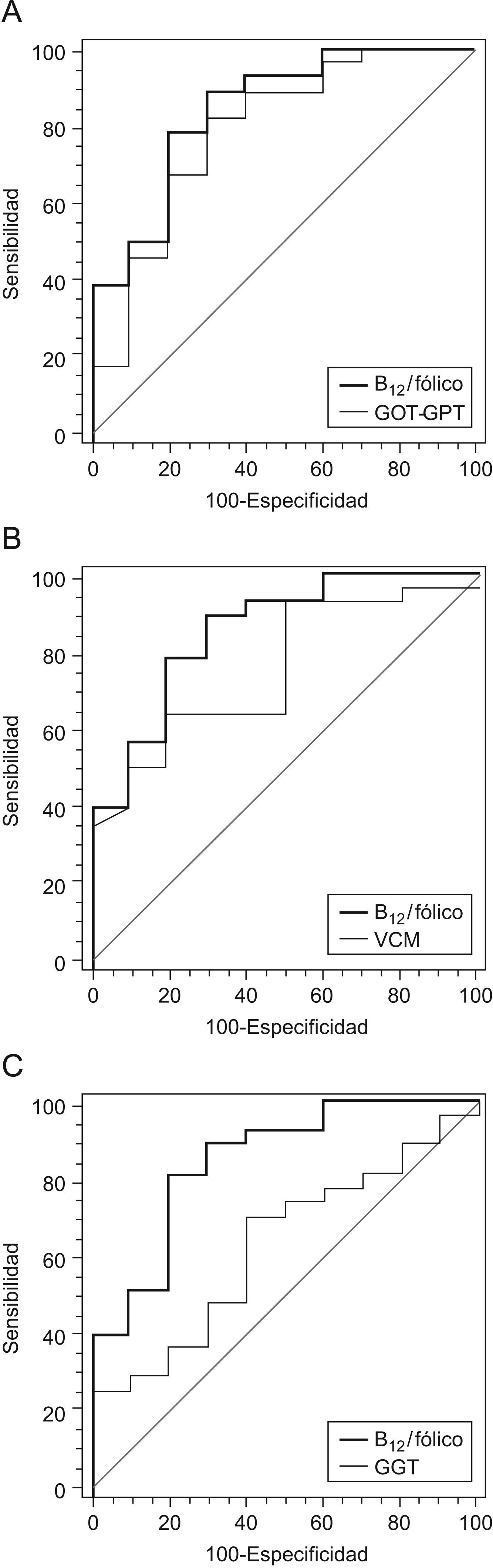
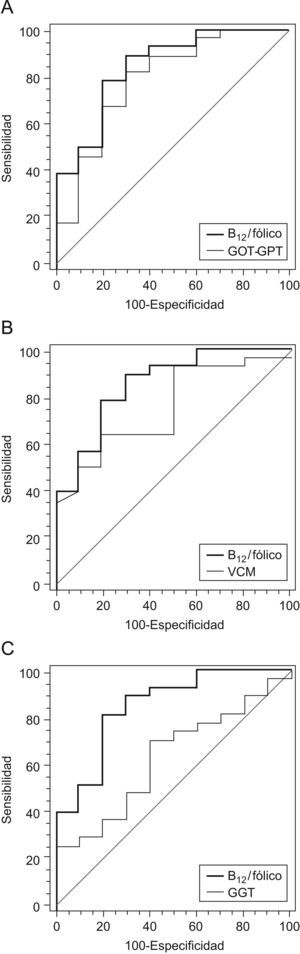
En las figura 2 se representa las comparaciones de la curva ROC del cociente vitamina B12/ácido fólico frente a las curvas del cociente AST/ALT, VCM y GGT. En los 3 casos, el área bajo la curva del cociente vitamina B12/ácido fólico era superior: 0,84 vs. 0,79 (AST/ALT), 0,84 vs. 0,76 (VCM) y 0,84 vs. 0,63 (GGT). Solo las diferencias con la GGT eran estadísticamente significativas (p=0,04).
Pronóstico y niveles plasmáticos de vitamina B12 y ácido fólicoNo se observó un peor pronóstico (fallecimiento o trasplante hepático) en función de los niveles plasmáticos de vitamina B12, ácido fólico o el cociente vitamina B12/ácido fólico (tabla 3). Tampoco objetivamos diferencias entre los pacientes con tumores frente aquellos sin tumores.
Pronóstico de los pacientes y riesgo de desarrollar tumores, según los niveles plasmáticos de vitamina B12 y ácido fólico
| Vivos | Muertos o transplantados | p | Hepatocarcinoma | p | |
| Vitamina B12 | 1.213,2 | 1.284,2 | 0,7 | 1.486,9 | 0,9 |
| Ácido fólico | 7,2 | 6,4 | 0,4 | 5,6 | 0,8 |
| Vitamina B12/ácido fólico | 216,1 | 239,9 | 0,7 | 269,1 | 0,5 |
En este estudio observamos como los pacientes cirróticos que ingresan por complicaciones presentan niveles plasmáticos de vitamina B12 altos, mientras que los niveles plasmáticos de ácido fólico eran bajos. Es conocida cómo la malnutrición es una complicación habitual de los pacientes con enfermedad hepática avanzada, sobre todo en los estadios B y C de Child8. En estos pacientes se producen déficits de diferentes macronutrientes, vitaminas y en el ácido fólico. Entre las causas que lo producen están, entre otros, una inadecuada toma de alimentos y, por otro lado, el efecto tóxico del alcohol y sus metabolitos9. Los pacientes con enfermedad hepática que, a la vez están desnutridos, tienen un mayor riesgo de complicaciones postoperatorias y de mortalidad tras la cirugía10. Nosotros no hemos observado una peor evolución en función de los niveles plasmáticos de vitamina B12 o de ácido fólico. Sin embargo, esta asociación no se puede descartar en base a nuestro estudio, se requieren futuros estudios específicos que intenten responder esta pregunta con un mayor número de pacientes.
Las concentraciones séricas de ácido fólico son más bajas en los pacientes alcohólicos que consumen más de 80g de alcohol al día11,12. Más de 2 tercios de estas personas tienen concentraciones bajas de ácido fólico13,14. En nuestro estudio observamos como los pacientes con hepatopatía alcohólica tenían niveles más bajos de ácido fólico que los pacientes con hepatopatía producida por otras causas, lo que puede ayudar a discriminar la etiología de la hepatopatía. El déficit de ácido fólico era una de las alteraciones nutricionales más frecuentes encontradas en los pacientes con hepatopatía alcohólica. Entre las posibles causas están una ingesta inadecuada de alimentos ricos en folatos, una malabsorción intestinal y, menos probable, un efecto tóxico del alcohol15–17. A pesar de que no hemos observado una peor evolución en estos pacientes, nos parece razonable suministrar suplementos de ácido fólico, sobre todo, en aquellos con una etiología alcohólica.
Por el contrario, en los alcohólicos los niveles plasmáticos de vitamina B12 están aumentados17–21. Existen menos estudios que determinen los niveles plasmáticos de vitamina B12 en pacientes con hepatopatía crónica y, menos aún, que diferencien estos niveles en función de la etiología. Blasco et al13 describen como los pacientes alcohólicos con hepatopatía de grado leve a moderado presentaban niveles plasmáticos más bajos de vitamina B12 que los controles. En nuestro estudio observamos como los pacientes con hepatopatía crónica presentaban niveles plasmáticos más elevados de vitamina B12 que los controles. Esta diferencia con el estudio de Blasco et al14 puede ser debido a que nuestros pacientes presentaban hepatopatías más avanzadas, lo que les obligaba a ingresar por descompensaciones. En las enfermedades hepáticas se produce un aumento debido a su liberación de las células hepáticas por citolisis y por una disminución en su aclaramiento, debido al mal funcionamiento hepático20,21. Kanazawa y Herbert22 observaron cómo los alcohólicos tenían concentraciones bajas de vitamina B12 en el hígado y altas a nivel plasmático, cuando se comparaba con personas abstémicas. Estos hallazgos sugieren cómo se produce una retención de cobalamina en los tejidos periféricos, seguida por una acumulación de esta vitamina en el plasma. Un punto de corte de 500pg/ml en los niveles plasmáticos de vitamina B12 diferenciaba a las personas sanas de pacientes con hepatopatía, siempre que se cumplan los criterios de exclusión referidos en nuestro estudio. Además, observamos como los pacientes con hepatopatía alcohólica tenían niveles plasmáticos más altos de vitamina B12, y, por lo tanto, este parámetro podría ayudar a diferenciar la etiología de la hepatopatía. El cociente entre la vitamina B12 y el ácido fólico discriminaba mejor la etiología alcohólica de otras causas de hepatopatía. Cuando se comparaba este cociente con otros parámetros analíticos utilizados para el diagnóstico etiológico de la hepatopatía etílica como la GGT, VCM o el cociente AST/ALT, se observaba cómo el poder de discriminación del cociente entre la vitamina B12 y el ácido fólico era mayor.
El ácido fólico y la vitamina B12 son coenzimas del metabolismo homocisteína-metionina y sus déficits se relacionan con un incremento de la homocisteína en suero. Cuando hay deficiencia de alguna de estas vitaminas, los niveles de homocisteína en sangre aumentan. Los niveles altos de homocisteína se han relacionado con la arteriosclerosis y la cardiopatía isquémica. Los alcohólicos tienen niveles elevados de homocisteina y un incremento de su riesgo vascular14,23,24. La asociación entre la homocisteina total y la cardiopatía isquémica ha sido fuertemente relacionada por diferentes metaanálisis25. El déficit de ácido fólico altera el metabolismo de la metionina, el cual se asocia a una alteración del DNA y un incremento de la apoptosis hepatocelular en modelos animales a los que se administra dietas deficientes en ácido fólico o con una exposición crónica excesiva de etanol26,27. También el ácido fólico y la vitamina B12 intervienen en la síntesis de proteínas que son esenciales en la integridad y función de las membranas celulares, así como en el trasporte de metabolitos y transmisión de señales28. Estudios epidemiológicos y de cohortes muestran discrepancias en relación al efecto que puedan tener las concentraciones de ácido fólico y vitamina B12 en la aparición de tumores29 o con un aumento de la mortalidad por este motivo30,31. Podría ocurrir que, las alteraciones plasmáticas de vitamina B12 y ácido fólico en los pacientes cirróticos tuvieran relación con un peor pronóstico (hepatocarcinoma, trasplante y mortalidad). En nuestro estudio no hemos encontrado un peor pronóstico en pacientes cirróticos según los niveles plasmáticos de vitamina B12 y ácido fólico. No obstante, pensamos que es necesaria suplementar la dieta de los cirróticos con ácido fólico para prevenir posibles daños derivados de su déficit. Nuestro estudio cuenta con varias limitaciones, como son la no realización de biopsia hepática en los pacientes con hepatopatía o el pequeño número de pacientes con hepatopatía no alcohólica.
En conclusión, observamos cómo los pacientes cirróticos presentan niveles plasmáticos altos de vitamina B12 y bajos de ácido fólico. Los niveles plasmáticos de vitamina B12 pueden diferenciar población sana de pacientes con hepatopatías crónicas. El cociente vitamina B12/ácido fólico podría ser útil en el diagnóstico de la cirrosis de etiología alcohólica. Se necesitan más estudios que verifiquen estos hallazgos.
FinanciaciónCIBEREHD Y CIBERESP están financiados por el Instituto de Salud Carlos III.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.