INTRODUCCIÓN Y DEFINICIÓN
Sir Heneage Ogilvie describió por primera vez este síndrome en 1948 como «cólico» intestinal asociado a la presencia de enfermedad retroperitoneal maligna1. Desde entonces ha recibido diversas denominaciones, como «íleo»2,3, «íleo adinámico»4, «íleo paralítico»5 o «seudoobstrucción aguda» intestinal6 o colónica7, que es la que se usa actualmente. El uso intercambiable de estos términos en la bibliografía ha dado lugar a cierta confusión, puesto que el vocablo «íleo» indica inactividad motora, mientras que la seudoobstrucción intestinal puede presentarse con contracciones incoordinadas que dan lugar a la alteración del tránsito intestinal característica de este síndrome.
La seudoobstrucción intestinal se define básicamente por la existencia de una propulsión intestinal anómala en ausencia de causas mecánicas, aunque su presentación clínica puede asemejarse a la de la obstrucción intestinal. Puede afectar al intestino delgado o grueso y presentarse de forma aguda, subaguda o crónica. El hecho de que esta entidad se defina en términos clínicos es debido al desconocimiento de los procesos fisiopatológicos que la causan. En la definición de seudoobstrucción intestinal se podría incluir una amplia gama de procesos clínicos, desde el simple estreñimiento hasta el síndrome más grave y complejo de seudoobstrucción crónica intestinal. Esta última entidad se manifiesta en forma de episodios recurrentes que hacen pensar en una obstrucción intestinal y requieren con frecuencia la hospitalización del paciente, pero sin que se identifiquen causas mecánicas después de un estudio exhaustivo8.
En esta revisión discutiremos la forma aguda de seudoobstrucción asociada a dilatación intestinal, también conocida como síndrome de Ogilvie. Éste se presenta como íleo intestinal con marcada dilatación, generalmente en pacientes quirúrgicos o con algún proceso mórbido subyacente. Nuestro objetivo es revisar las causas, la fisiopatología, las manifestaciones clínicas, el pronóstico y tratamiento recomendado basándonos en la evidencia publicada hasta el momento. El megacolon tóxico, como complicación de la enfermedad inflamatoria intestinal, y el megacolon secundario a la infección por Tripanosoma cruzi no se comentarán en esta revisión.
ETIOPATOGENIA
En la descripción original, Ogilvie1 describió 2 casos de dolor abdominal agudo, estreñimiento y dilatación colónica no obstructiva en presencia de enfermedad maligna metastática que afectaba a las ramas nerviosas esplácnicas, ganglio mesentérico superior y plexo celíaco. Ogilvie señaló que la interrupción de la inervación simpática del colon era la que causaba, debido a la acción parasimpática sobre el colon sin oposición, el «enteroespasmo» y la consiguiente dilatación del colon en dirección oral1.
Veinte años más tarde, Catchpole2 propuso todo lo contrario, el aumento de la activación simpática intestinal, como mecanismo principal del íleo paralítico poslaparotomía. En animales, la estimulación de eferentes esplácnicos (simpático) disminuye el tono y los movimientos intestinales9, mientras que la sección esplácnica previene la aparición de íleo posquirúrgico en animales10 y humanos5,11. Catchpole probó su hipótesis en un grupo de pacientes a quienes administró guanetidina o fentolamina (simpaticolíticos), seguidos de neostigmina, un inhibidor de la enzima colinesterasa (parasimpaticomimético)2. En el experimento de Catchpole, en el que no hubo grupo control, tras la administración de simpaticolíticos no hubo respuesta terapéutica, mientras que ésta fue aparente tras la administración de neostigmina. Sin embargo, el autor concluyó que la causa del íleo posquirúrgico era el predominio de control simpático sobre el intestino2.
La seudoobstrucción intestinal aguda se ha descrito en el contexto de numerosas entidades médicas, uso de ciertos fármacos12, isquemia intestinal13,14, hipoxia o inflamación sistémica o local en el peritoneo, intestino, tracto urinario o tórax15-17. Estos estímulos nocivos, localizados en el mismo intestino o no, dan lugar a un reflejo inhibitorio a través de los nervios esplácnicos que resulta en íleo intestinal9,18,19.
La manipulación de los intestinos, en cirugía experimental, origina una infiltración inflamatoria masiva de la pared intestinal. Mediadores inflamatorios como son las moléculas de adhesión intercelular 1, proteína quimiotáctica de monocitos 1, óxido nítrico sintetasa inducible y ciclooxigenasa 2 están sobreexpresados durante las primeras 18 h poscirugía20, y el grado de íleo posquirúrgico se correlaciona con la respuesta inflamatoria intestinal21.
Varios estudios han mostrado la liberación de opioides endógenos tras la cirugía y su asociación con la respuesta inflamatoria a ésta22,23. El uso frecuente de narcóticos para tratar el dolor tras la cirugía puede agravar el íleo posquirúrgico «fisiológico» y precipitar un episodio de seudoobstrucción intestinal12. In vitro los opioides inhiben la liberación de óxido nítrico por parte de las motoneuronas intestinales inhibitorias24 y retrasan el tránsito intestinal in vivo25. La L-arginina, molécula precursora del óxido nítrico, revierte el estreñimiento inducido con morfina en modelos animales26,27.
En la tabla I se resumen los mecanismos fisiopatológicos propuestos hasta la fecha.
MANIFESTACIONES CLÍNICAS
En 2 revisiones sistemáticas de casos de seudoobstrucción intestinal aguda descritos entre 1948 y 1980 en una15 y de 1970 a 1985 en la segunda17, se hallaron comorbilidades asociadas en el 88 y el 95% de un total de 351 y 400 casos, respectivamente.
La seudoobstrucción intestinal aguda se presenta normalmente en pacientes con patología aguda de base, como accidente vascular cerebral, infarto de miocardio, peritonitis, sepsis o después de intervenciones quirúrgicas, entre ellas la cesárea, cirugía ortopédica, cirugía cardiovascular o pulmonar15-17,28-30.
Enfermedades sistémicas que afectan al componente neuromuscular del tracto gastrointestinal, como la amiloidosis o el lupus eritematoso sistémico, pueden comenzar, aunque raramente, con un episodio agudo de seudoobstrucción intestinal31,32.
Aparte de las características del trastorno clínico acompañante, la característica clínica típica que define a la seudoobstrucción intestinal es la presencia de distensión abdominal marcada, lo que la diferencia del íleo posquirúrgico «fisiológico», que no se tratará en esta revisión. Habitualmente se presenta sin expulsión de gas y heces; sin embargo, puede haber expulsión de gas hasta en un 41% de los casos o, incluso, presentarse con diarrea4,33-35. Puede haber náuseas y vómitos, pero no son necesarios para el diagnóstico; su presencia varía desde el 0 al 71% en las diversas series publicadas15-17,29,33-40, y la aspiración nasogástrica no suele ser productiva4,33,37. El abdomen, aunque distendido, es habitualmente depresible e indoloro16,17,29. De hecho, la presencia de dolor y defensa abdominal acostumbra ser un signo de perforación o isquemia15,28,37,40-42, aunque estos signos se han descrito en pacientes con intestino viable17,35. Los sonidos intestinales varían desde ausentes hasta hiperactivos, y en muchos casos son de características metálicas, como los descritos en la obstrucción mecánica16,17,28.
PRUEBAS DE LABORATORIO
No existen alteraciones analíticas específicas de esta entidad. Las pruebas de laboratorio pueden mostrar diselectrolitemias, u otras alteraciones en relación con la patología de base, y leucocitosis. En una serie de 400 casos de seudoobstrucción intestinal aguda, el 100% (18/18) de los pacientes con perforación intestinal presentaban leucocitosis, mientras que ésta sólo estuvo presente en el 27% (16/382) de los pacientes sin isquemia o perforación intestinal17.
RADIOLOGÍA
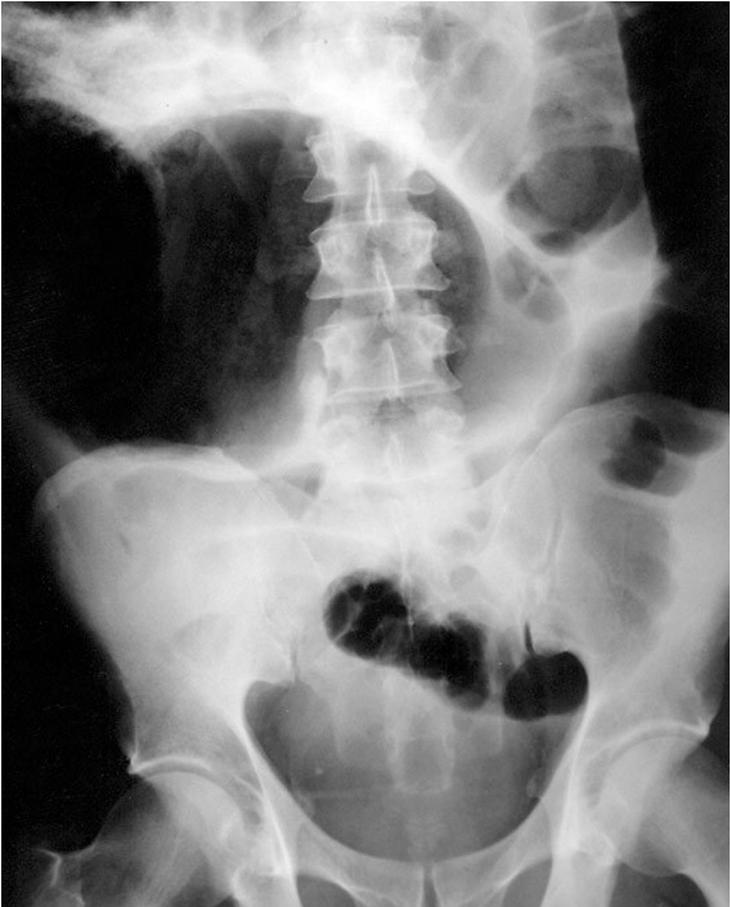
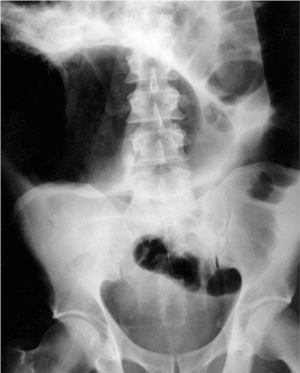
La característica radiológica de esta entidad es la presencia de dilatación colónica en la radiografía abdominal simple. En la figura 1 se muestra un ejemplo de dilatación colónica en un paciente con seudoobstrucción intestinal aguda. La dilatación afecta preferentemente al ciego, colon ascendente y transverso15,17, pero el colon izquierdo, incluido el recto, puede estar también dilatado16. El intestino delgado también se halla afectado en algunos casos16,17,35.
El diámetro cecal máximo observado en la radiografía abdominal simple en pacientes con seudoobstrucción intestinal aguda varía en las diferentes series desde 7 a 25 cm3,17,29,35,44-47. El diámetro cecal puede ser de importancia pronóstica y tiene implicaciones en los análisis de decisión del manejo de esta entidad (véase sección «Tratamiento»).
La presencia de aire libre abdominal en la radiografía simple suele indicar perforación intestinal, aunque se ha descrito también en casos en los que se ha comprobado su ausencia17,44.
DIAGNÓSTICO DIFERENCIAL CON LA OBSTRUCCIÓN MECÁNICA
En 2 análisis retrospectivos de 56 y 46 pacientes cada uno, con sospecha de seudoobstrucción aguda de colon referidos para descompresión endoscópica, 3 (5%) y 8 (9%), respectivamente, presentaban obstrucción mecánica29,44. Parece pues que, cuando la historia y exploración física hacen sospechar una seudoobstruccción en pacientes después de cirugía o en la unidad de cuidados intensivos, la probabilidad de obstrucción mecánica es baja. Sin embargo, si se considera la posibilidad de obstrucción mecánica, ésta deberá descartarse.
Radiografía simple de abdomen
Cuando el aire intestinal en la radiografía simple de abdomen se distribuye a lo largo de todo el colon, incluido el rectosigma, este trastorno es fácilmente diferenciable de la obstrucción mecánica48. Sin embargo, cuando no se puede apreciar aire en el rectosigma, lo que ocurre frecuentemente15,17, la diferenciación entre ambas entidades es más problemática48. Se ha señalado que signos radiológicos tales como la alteración de los haustros o la presencia de niveles hidroaéreos pueden ayudar a realizar el diagnóstico diferencial. Sin embargo, estos signos se ven también muy frecuentemente en casos de seudoobstrucción16,17, de modo que es necesaria la práctica de otras pruebas para el diagnóstico diferencial.
Enema de contraste
El enema con bario se ha usado ampliamente en estos pacientes ante la sospecha de obstrucción mecánica3,16,35,44. En un estudio prospectivo, la valoración ciega por parte del radiólogo de las placas radiográficas de 110 pacientes con dilatación colónica mostró una alta rentabilidad diagnóstica del enema de contraste. La sensibilidad y especificidad y los valores predictivos positivo y negativo para el diagnóstico de obstrucción mecánica fueron del 96, el 98, el 98 y el 96%, respectivamente48.
Los enemas de contraste pueden precipitar la perforación intestinal en el 1,2% de los casos17. Por este motivo se rea-lizan con baja presión de insuflado o se usa gastrografín como sustancia de contraste. Se han comunicado algunos casos de resolución terapéutica tras la administración de enemas de gastrografín15,17,49. Los enemas están contraindicados si existen signos de perforación intestinal38.
Colonoscopia
Una alternativa a los enemas de contraste es el examen endoscópico del colon, normalmente del recto y sigma, que puede tener un valor terapéutico además de diagnóstico; no obstante, la colonoscopia en estos pacientes no está ausente de complicaciones17 (véase el apartado «Tratamiento»).
Tomografía computarizada abdominal
Su rentabilidad diagnóstica no se ha evaluado en pacientes con sospecha de seudoobstrucción aguda colónica. En un estudio prospectivo de 75 pacientes con sospecha de obstrucción y dilatación colónica en la radiografía abdominal simple, la tomografía computarizada abdominal dio un diagnóstico de obstrucción con una sensibilidad del 96%, una especificidad del 93%, un valor predictivo positivo del 96% y un valor predictivo negativo del 93%50.
Ante la ausencia de comparación directa de la rentabilidad diagnóstica del enema con contraste, endoscopia y tomografía computarizada para el diagnóstico diferencial entre obstrucción y seudoobstrucción en pacientes con intestino dilatado, el clínico deberá decidir entre una técnica u otra según su propio criterio y la accesibilidad de cada una de ellas.
PRONÓSTICO
Tasa de mortalidad
El pronóstico de los pacientes con seudoobstrucción intestinal aguda varía según la patología clínica de base o las comorbilidades asociadas15,17. La tasa de mortalidad en las diversas series es muy variable, desde el 0 al 32%15,17,29,35,43,51, lo que puede reflejar la inclusión de distintos tipos de pacientes en cada una de las series. Por ejemplo, en el estudio de Geller et al29, en el que sólo se incluyó a pacientes remitidos para descompresión endoscópica por fracaso del tratamiento conservador, la mortalidad fue del 32%. En cambio, Vanek y Al-Salti17, que revisaron 400 casos no seleccionados de seudoobstrucción aguda intestinal, comunicaron 83 muertes (21%).
Factores de riesgo de mortalidad
La edad avanzada, una pobre situación clínica y el tratamiento quirúrgico del episodio de seudoobstrucción aumentan el riesgo de muerte en estos pacientes17,43. No existen estudios aleatorizados que comparen los tratamientos quirúrgico y médico para aclarar si el aumento de mortalidad asociado al primero es debido al mismo tratamiento o a la selección sesgada de pacientes en peor estado o con otros factores de riesgo asociados.
La isquemia o perforación intestinal, presentes en el 15-16% de los pacientes que se presentan con esta entidad15,17, se asocian con un incremento del riesgo de muerte del 50%3,15,17.
Se ha intentado identificar factores clínicos y radiológicos predictivos de perforación y muerte que permitan seleccionar a los pacientes que podrían beneficiarse de maniobras de descompresión urgente, con lo que se evitarían procedimientos asociados a una alta morbilidad, como la cirugía, en quienes que no los necesitan.
El diámetro máximo del ciego es de 9 cm cuando es distendido con aire, en ausencia de obstrucción mecánica52. Cuando se practica descompresión quirúrgica en pacientes con obstrucción mecánica y diámetros cecales mayores de 9 cm, se produce una importante reducción de la tasa de perforación y mortalidad52. Ésta es la base para el uso de 9 cm como «umbral» de perforación en pacientes con seudoobstrucción colónica aguda.
En la revisión de Vanek y Al-Salti17, la tasa de perforación intestinal fue del 0, el 7 y el 23% para diámetros cecales menores de 12 cm, de 12 a 14 cm y mayores de 14 cm, respectivamente. Sin embargo, existe un gran solapamiento entre los diámetros cecales de pacientes con perforación y sin ella. En el mismo estudio, la mortalidad se asociaba también con el retraso en la descompresión. La mortalidad fue del 15% en los pacientes a quienes se practicó la descompresión dentro de los primeros 4 días que siguieron a la instauración del cuadro, del 27% cuando la descompresión tuvo lugar entre 4 y 7 días después de la primera consulta, y del 73% después del séptimo día. Otros autores también han mostrado la importancia del tiempo de distensión, independiente del diámetro cecal44.
PREVENCIÓN
En pacientes sometidos a cirugía, el uso de técnicas que minimizan la inflamación peritoneal, como la laparoscopia, y la administración de anestesia regional pueden reducir el íleo posquirúrgico5,11,53-56.
La disfunción intestinal en pacientes que requieren narcóticos es más grave si se usa codeína comparada con otros opioides57. La administración de opioides de forma transdérmica produce menos estreñimiento que la administración oral o parenteral y puede prevenir la aparición de íleo posquirúrgico complicado en estos pacientes58. Nuevos agentes opioides sin estos efectos secundarios, como los agonistas del receptor kappa periférico, están actualmente en estudio59. Antagonistas opioides periféricos, que antagonizan los efectos inhibitorios gastrointestinales de los opioides sistémicos sin disminuir su efecto analgésico, pueden tener un papel en la prevención del íleo posquirúrgico o asociado al uso de narcóticos (véase el apartado «Tratamiento»).
TRATAMIENTO
El primer paso en el tratamiento de la seudoobstrucción aguda intestinal debería ser la corrección de las alteraciones subyacentes reversibles, por ejemplo, infecciones, hipovolemia, hipoxemia, diselectrolitemias o la retirada de medicaciones que puedan inducir íleo. Con el tratamiento de los posibles desencadenantes, el íleo normalmente se resuelve en 2-6 días en el 83-96% de los casos17,35.
Debido a la falta de tránsito intestinal y la posibilidad de cirugía urgente, se recomienda cesar la ingesta oral o enteral. El uso de soluciones salinas y glucosiladas por vía intravenosa es suficiente en la mayoría de los casos dados el carácter reversible y la corta duración del cuadro. Sin embargo, en pacientes con episodios prolongados la nutrición parenteral45 o enteral60 puede ser necesaria. Aunque la aspiración nasogástrica se ha empleado ampliamente17,35,61, si no existen vómitos clínicamente significativos, la intubación nasogástrica no parece ser necesaria16,62,63, puesto que el estómago y el duodeno raramente se hallan afectados.
Las sondas rectales no son útiles17,33,34,64 a no ser que exista afectación del rectosigma39,65. Los enemas pueden facilitar la «limpieza» del colon, pero no han demostrado eficacia clínica en otro sentido, a excepción de casos anecdóticos con gastrografín15,17,49, y además pueden precipitar la perforación colónica17.
Cuando el diámetro cecal es mayor de 9 cm y la descompresión no se obtiene en el plazo de 72 h a pesar de la corrección de las posibles causas o alteraciones subyacentes, otras medidas descompresivas están indicadas para disminuir el riesgo de muerte6,17,38,66,67.
Descompresión farmacológica
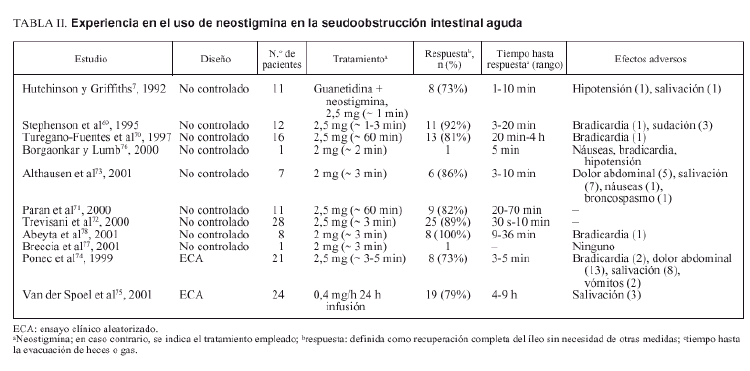
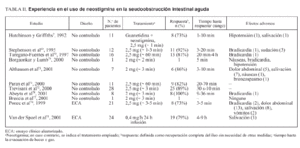
Neostigmina
Catchpole describió una serie de casos tratados «con éxito» con antiadrenérgicos y el inhibidor de la acetilcolinesterasa, neostigmina2,68. En la tabla II se presenta un resumen de la experiencia con estos agentes farmacológicos. En una de las series, 8 de 11 pacientes (73%) presentaron evacuación de gas o heces tras la administración de la «receta» de Catchpole, mientras que 3 no respondieron al tratamiento farmacológico y, sin embargo, presentaron resolución del íleo tras medidas conservadoras7. Otros estudios no controlados indicaron que la administración de neostigmina sin necesidad de combinarla con antiadrenérgicos podía descomprimir el colon en pacientes con seudoobstrucción aguda69-73. Un estudio aleatorizado, controlado con placebo y doble ciego comparó neostigmina por vía intravenosa (2,5 mg infundida en 3-5 min) y placebo en pacientes con íleo colónico (diámetro cecal ≥ 10 cm) persistente después de 24 h de medidas conservadoras74. Se valoraron la respuesta clínica inmediata (paso de gas o heces y disminución de la distensión abdominal en la exploración física dentro de los 30 min tras la administración de neostigmina) y la necesidad de descompresión colónica o cirugía durante la hospitalización. Aunque hubo evacuación inmediata de gas o heces con reducción de la distensión abdominal en 10 pacientes (91%) del grupo de neostigmina y ninguna en el grupo placebo, 3 pacientes presentaron recidiva y requirieron otros tratamientos y uno de ellos precisó finalmente colectomía subtotal. La comparación de resultados más allá de la respuesta clínica inmediata con el grupo placebo no fue posible puesto que a este grupo se le ofreció tratamiento abierto con neostigmina. Es interesante destacar, sin embargo, que en 2 de los 3 pacientes que rechazaron el tratamiento abierto con neostigmina el íleo se resolvió espontáneamente en 48-72 h74, y el tercer paciente requirió finalmente colectomía subtotal.
En otro estudio aleatorizado, controlado con placebo y doble ciego se comparó la respuesta clínica después de una infusión de 24 h de neostigmina (0,4-0,8 mg/h) o placebo, en pacientes ingresados en una unidad de cuidados intensivos con fallo multiorgánico e íleo colónico asociado, definido como ausencia de peristalsis y de deposiciones75. Como en el estudio de Ponec et al74, la evacuación de heces durante las primeras 24 h fue notablemente superior en el grupo de neostigmina que la del grupo placebo. Los que no respondieron al primer tratamiento asignado recibieron un segundo tratamiento, placebo o neostigmina, de forma cruzada y a doble ciego. Por lo tanto, no fue posible comparar los resultados después de las primeras 24 h de la infusión. Hubo, en este estudio, 6 muertes y 2 casos de colitis isquémica entre los 19 que respondieron a la neostigmina y 2 muertes y una perforación intestinal entre los 5 que no respondieron a ella (p = NS)75.
Se han descrito diversos efectos adversos después de la administración intravenosa de 2 a 2,5 mg de neostigmina. De un total de 146 pacientes tratados con neostigmina por seudoobstrucción aguda de colon descritos en la bibliografía7,69-79, los efectos adversos más frecuentes fueron dolor abdominal tipo «retortijón» en el 17% de los pacientes, salivación excesiva en el 13%, sudación profusa en el 4%, náuseas o vómitos en el 4% y bradicardia transitoria en el 6%. La bradicardia requirió tratamiento en el 50% de los casos. Algunos centros empiezan con una dosis de 1 mg en lugar de 2 mg con la intención de disminuir las posibilidades de bradicardia, pero los resultados de esta dosis no se han publicado.
Aunque la evacuación de heces o gas es obvia tras la administración de neostigmina, no está claro que esto reduzca el riesgo de perforación y la mortalidad de estos pacientes. Sin embargo, en ausencia de respuesta a medidas conservadoras, el uso de neostigmina parece una opción segura en pacientes seleccionados. Cuando el diámetro del ciego se mantiene por encima de 9 cm durante 72 h a pesar de medidas conservadoras y no hay contraindicaciones para su uso (tabla III), la neostigmina se debería considerar la siguiente opción terapéutica. Una segunda administración de neostigmina debería considerarse si la primera dosis no es efectiva o si se produce recurrencia tras una respuesta inicial, puesto que algunos pacientes responden a una segunda dosis sin necesidad de más tratamientos69,70,74,78.
Antagonistas opioides
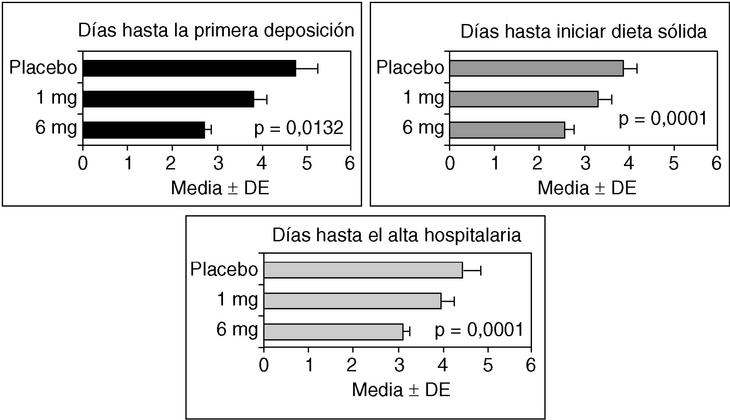
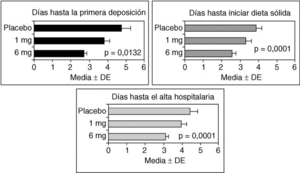
La seudoobstrucción aguda de colon puede estar asociada al uso de narcóticos o a la liberación de opiáceos endógenos en respuesta a la cirugía. Los receptores opioides μ(r-μ) periféricos son los responsables de la inhibición gastrointestinal motora de los opioides80. Antagonistas de los r-µ periféricos, como la metilnaltrexona y el alvimopan (ADL 8-2698), pueden disminuir el íleo posquirúrgico o asociado al uso de opioides, sin disminuir el efecto analgésico ni inducir abstinencia81-84. En el estudio de Taguchi et al84, se incluyó a pacientes tratados con morfina o meperidina tras cirugía, mayoritariamente histerectomía abdominal. En este estudio, el alvimopan (6 mg) redujo significativamente el período de disfunción intestinal, las náuseas, los vómitos y el tiempo hasta el alta hospitalaria comparado con placebo (fig. 2). Aunque estos resultados pueden no ser aplicables a pacientes con seudoobstrucción aguda de colon, el uso de antagonistas de lo r-µ periféricos parece una alternativa razonable a estudiar en el tratamiento de la seudoobstrucción.
Fig. 1. Radiografía de abdomen simple de un paciente que desarrolló seudoobstrucción aguda intestinal tras reparación quirúrgica de fractura escapular. Nótese la acusada distensión colónica. (Reproducida con permiso de Tenofsky et al43.)
Fig. 2. Efectos del alvimopan, un antagonista opioide periférico, sobre el íleo posquirúrgico en pacientes que recibían narcóticos para el tratamiento del dolor. Nótese que el alvimopan mejoró de forma dependiente de la dosis el íleo abdominal y redujo el tiempo de estancia hospitalaria. (Datos reproducidos con permiso de Taguchi et al84.)
Otros tratamientos farmacológicos
Se han comunicado casos anecdóticos de recuperación de íleo intestinal tras la administración de eritromicina45,85,86, aunque, al igual que ocurre con la metoclopramida, su utilidad en el tratamiento del íleo posquirúrgico no se ha demostrado en estudios clínicos aleatorizados87-89. La cisaprida intravenosa se ha usado también en algunos casos aislados de seudoobstrucción intestinal aguda45,90,91 y disminuyó el tiempo de íleo posquirúrgico comparada con placebo en un estudio aleatorizado y doble ciego92. Ninguno de estos fármacos se ha estudiado formalmente en enfermos con seudoobstrucción colónica aguda.
Descompresión endoscópica
La descompresión endoscópica es técnicamente posible en pacientes que presentan seudoobstrucción aguda colónica93. Sin embargo, no se ha demostrado que mejore la evolución de estos pacientes. Además, la aspiración de aire endoscópicamente en un colon sin preparar evitando una mayor distensión de éste es técnicamente difícil y no está exenta de complicaciones como la perforación17.
No existen estudios controlados y aleatorizados; las tasas de resolución del íleo, perforación y mortalidad cuando se practica descompresión endoscópica son similares a las observadas con tratamiento conservador solo. Así, en pacientes no seleccionados, la descompresión endoscópica se siguió de resolución de la seudoobstrucción aguda en el 82-85% de los casos17,94-99, de perforación en el 0,2-2%17,65,94,100 y las tasas de mortalidad fueron del 13 al 32%. Estos datos son comparables a los observados con sólo medidas conservadoras, un 83% de resolución, un 2,5% de perforaciones y un 14% de mortalidad17. Las tasas de respuesta con la descompresión colónica son incluso menores28,101 y la mortalidad, superior29 en aquellos estudios donde se seleccionó a los pacientes sobre la base del diámetro cecal o la falta de respuesta a las medidas conservadoras.
Comparaciones directas del tamaño cecal antes y después de la colonoscopia muestran que el diámetro cecal no varía o incluso aumenta después del procedimiento94,99. Es más, la disminución del diámetro cecal, cuando se produce, no es predictiva de resolución clínica94,99.
Los datos disponibles apuntan, pues, a que la descompresión endoscópica debería considerarse como tercera opción terapéutica en pacientes con seudoobstrucción aguda de colon y alto riesgo de perforación cecal, cuando las medidas conservadoras y las maniobras farmacológicas de descompresión han fallado.
Cecostomía no quirúrgica
Debido a la alta tasa de mortalidad asociada a la descompresión quirúrgica en pacientes con seudoobstrucción aguda de colon, se han propuesto diversas técnicas alternativas para descomprimir el colon y evitar la cirugía en estos pacientes. Se han descrito varios casos en los que se practicó cecostomía percutánea con resolución del cuadro47,102,103, pero esta técnica se asocia a una alta morbilidad104,105. La cecostomía percutánea se puede realizar también con guía endoscópica usando la misma técnica que se utiliza para la gastrostomía percutánea endoscópica106,107.
Descompresión quirúrgica
La descompresión quirúrgica, que incluye cecostomía, colostomía o resección, se asocia con unos resultados muy pobres17, posiblemente porque se practica por lo general en pacientes que no han respondido a ensayos terapéuticos previos y con una mayor morbilidad asociada. Se recomienda como última medida terapéutica o cuando se sospecha perforación o peritonitis.
CONCLUSIÓN
La seudoobstrucción intestinal aguda se caracteriza por una dilatación masiva del intestino, principalmente del colon, en ausencia de obstrucción mecánica. Los datos de que se dispone en la actualidad indican que este síndrome es el resultado de una respuesta refleja inhibitoria a diversas lesiones intestinales o sobre otros órganos. Se han implicado mecanismos nerviosos, inflamatorios y humorales en su fisiopatología, pero aún no se conocen bien. El uso de laparoscopia y anestesia regional, cuando es posible, puede ayudar a prevenir el cuadro posquirúrgico. El uso de antagonistas periféricos del receptor opioide μ o el uso de agonistas opioides exentos de efectos inhibitorios motores parecen prometedores para la prevención de la seudoobstrucción asociada a opioides. El diagnóstico está basado en la presencia de signos clínicos o radiológicos de distensión intestinal. Es necesario descartar obstrucción mecánica, normalmente con enema opaco. El tratamiento incluye la corrección de las alteraciones subyacentes tratables, retirada de fármacos que pueden exacerbar el íleo abdominal, evaluación clínica frecuente con radiografías simples de abdomen y analítica con recuento leucocitario. Cuando el diámetro cecal se mantiene persistentemente por encima de 9-12 cm después de 72 h de aplicar medidas conservadoras, está indicado iniciar neostigmina por vía intravenosa para inducir descompresión colónica rápida. Si no hay respuesta o hay recurrencia del cuadro, está indicado un segundo ensayo terapéutico con neostigmina. Si no hay respuesta a la descompresión farmacológica, la descompresión endoscópica se recomienda como el próximo paso. Si esto falla, se indica cecostomía percutánea si la cirugía está contraindicada. La presencia de dolor, defensa abdominal y leucocitosis se asocian con una alta probabilidad de perforación colónica. La cirugía es el tratamiento apropiado cuando existen signos de perforación.
Recomendaciones
Diagnosticar seudoobstrucción aguda intestinal cuando exista dilatación intestinal, normalmente del colon (diámetro cecal ≥ 7 cm en la radiografía abdominal simple) en ausencia de obstrucción mecánica
Nada por vía oral, hidratación intravenosa y sonda nasogástrica si existen náuseas o vómitos
Sonda rectal si el colon sigmoide está afectado
Tratar todas las patologías reversibles asociadas (infección, shock, etc.) y corregir diselectrolitemias
Radiografía abdominal y analítica sanguínea diaria
La presencia de dolor y defensa abdominal asociada a leucocitosis indica perforación intestinal
Cirugía urgente si se sospecha perforación abdominal
Si tras 72 h de medidas conservadoras el diámetro cecal continúa siendo mayor de 9 cm y no hay contraindicaciones para el uso de neostigmina, infundir 2 mg de ésta por vía intravenosa en 3-5 min (monitorizar signos vitales y electrocardiografía del paciente, que debe estar en posición supina durante la inyección y hasta 60 min después). Usar atropina para revertir cualquier efecto adverso. Repetir después de 4 h si no hay respuesta o el cuadro recurre
Descompresión endoscópica si no hay respuesta a la neostigmina
Cecostomía percutánea/cirugía si falla el resto de medidas para disminuir la distensión cecal