La radioterapia se basa en el empleo de las radiaciones ionizantes y su interacción con la materia viva. Las radiaciones más usadas en la terapéutica se describen en la tabla I.
El objetivo de la radioterapia en el tratamiento del cáncer es la erradicación del tumor con la preservación de las funciones del tejido sano que lo rodea. El tratamiento con radioterapia de las neoplasias abdominales, pélvicas o retroperitoneales conlleva un riesgo de complicaciones agudas y crónicas en el tracto gastrointestinal descritas hace más de 80 años. Walsh1 describió el primer paciente con enteropatía radioinducida 2 años después de que Roentgen descubriera los rayos X en 1895.
INCIDENCIA
La incidencia exacta de enteritis actínica crónica en pacientes que han recibido radioterapia sobre el área abdominopélvica no se conoce, y los datos varían en las diferentes publicaciones2. En las evaluaciones recientes, se observa que cuando la irradiación se aplica con técnicas modernas de radioterapia conformada tridimensional, modulación de intensidad y planificación inversa disminuye la toxicidad. Dearnaley et al3, en un estudio aleatorizado con 225 pacientes con cáncer de próstata tratados con radioterapia radical, demuestran que con dosis similares de 64 Gy, aplicadas a 2 Gy/día, el tratamiento conformado disminuye el número de efectos secundarios tardíos, valorado en función de la escala del Radiation Therapy Oncology Group (RTOG)4 (tabla II), pasando de un 50% (un 37% en grado 1 + un 12,6% >= grado 2) en el grupo de tratamiento convencional a un 32% (un 28% grado 1 + un 4,4% >= grado 2) en el grupo de radioterapia conformada. Hanks et al5, en pacientes con cáncer de próstata tratados con radioterapia radical con una dosis media de 70 Gy, registran una toxicidad aguda >= grado 2 de la RTOG del 34% en el tratamiento conformado frente a un 57% con la técnica convencional.
A pesar de la mejora en las técnicas de radioterapia externa, el progresivo aumento de la dosis de irradiación que se aplica, buscando una mayor eficacia, y la combinación con otros tratamientos, principalmente citostáticos, son factores que aumentan la toxicidad de la radioterapia. Todo ello justifica el estudio de la fisiopatología y la búsqueda de mejoras en la prevención y tratamiento de las complicaciones intestinales de la radioterapia.
FISIOPATOLOGIA
Los efectos biológicos de la radiación dependen básicamente de dos mecanismos: uno inmediato, provocado por el daño sobre el ADN, y otro tardío, relacionado con la aparición de una respuesta inflamatoria en el tejido irradiado. El daño sobre el ADN puede ser directo, provocando la muerte celular inmediata, o indirecto, como consecuencia de la formación de radicales libres por la radiolisis del agua.
Avances en la investigación de los mecanismos moleculares que intervienen en la respuesta del tejido normal a la irradiación permiten modificar el concepto clásico de la teoría de la diana celular única (single target cell) para explicar los acontecimientos que tienen lugar tras la administración de una dosis de irradiación, por la interacción de múltiples sistemas celulares entre los que encontramos gran variedad de células, que incluyen las epiteliales, las endoteliales, los fibroblastos y las células inflamatorias6.
En estudios histológicos de intestino irradiado se observa una infiltración y acumulación de leucocitos en el intersticio7. El reclutamiento de leucocitos circulantes hacia las áreas de inflamación es un proceso finamente regulado que consta esencialmente de tres fases. Inicialmente, los leucocitos circulantes entran en una interacción débil con las células endoteliales mediante un movimiento de rodamiento a lo largo de la pared de los vasos. Posteriormente, se produce la adhesión firme de los leucocitos a las células endoteliales y, por último, la migración hacia el intersticio8. Estudios con microscopia intravital demuestran a) que la irradiación abdominal induce un aumento en las interacciones leucocito-endotelio en vénulas de intestino delgado de ratón; b) que esta interacción es dependiente de la dosis, y c) que se inicia ya a las 2 h de la irradiación9. Esta respuesta inflamatoria está implicada en las alteraciones vasculares de la irradiación, ya que la inhibición de la adhesión leucocitaria evita la disfunción microvascular10. Las moléculas de adhesión endotelial son cruciales en el paso de leucocitos desde los vasos a los tejidos. Existen evidencias de que ICAM-1 tiene un papel central en el reclutamiento de leucocitos en respuesta a la irradiación, ya que el bloqueo de esta molécula con anticuerpos previene el reclutamiento leucocitario radioinducido11, y el uso de ratones deficientes en ICAM-1 previene la inflamación pulmonar resultante de la irradiación12. La irradiación abdominal provoca, asimismo, un aumento en la expresión de P-selectina, una de las principales moléculas responsables del rodamiento leucocitario. El bloqueo de P-selectina con anticuerpos o la deficiencia genética de esta molécula reduce de forma significativa el rodamiento leucocitario, pero no evita la adhesión firme ni el daño intestinal radioinducido9,10. Las investigaciones basadas en el conocimiento de los mecanismos moleculares que median la infiltración leucocitaria podrían permitir el desarrollo de estrategias terapéuticas preventivas del daño intestinal por irradiación.
Los efectos tardíos de la irradiación son el resultado de cambios progresivos en el tejido vascular y conectivo. Este proceso está acompañado de un aumento de mediadores inflamatorios y fibrogénicos. El compromiso microvascular es el factor etiológico más importante de la enteritis crónica por irradiación, ya que la vasculitis oclusiva progresiva y los depósitos difusos de colágeno ocasionan fibrosis. Estos cambios fibróticos suelen ser progresivos y, finalmente, pueden desarrollar alteraciones morfológicas con disrupción de la superficie mucosa y ser también causa de alteraciones en la motilidad intestinal. El resultado final es una mucosa crónicamente inflamada, ulcerada, que puede finalmente perforarse. Estudios experimentales recientes implican el factor de crecimiento de transformación (TGF)-b1 en la patogenia de la fibrosis radioinducida, ya que el tratamiento con un receptor soluble del TGF-b tipo II mejora la enteropatía por irradiación13. Si estos datos experimentales se corroboran con estudios clínicos podrían abrirse nuevas prespectivas terapéuticas para estos pacientes.
Las alteraciones que la radiación produce en el tejido normal dependen, fundamentalmente, de factores relacionados con: a) las características de la irradiación; b) el tejido irradiado, y c) las características del paciente.
Características de la irradiación
Los efectos de una determinada dosis absorbida de irradiación dependen del volumen irradiado, la dosis total, la tasa de dosis (definida como dosis absorbida por unidad de tiempo) y el fraccionamiento. El número de células que sobreviven a la exposición de radiación sigue una función decreciente respecto a la dosis total14. El concepto de administrar la dosis total de irradiación en múltiples pequeñas dosis diarias supuso un importante avance en la historia de la radioterapia. Regaud15 observó que al irradiar los testículos de animales de experimentación con pequeñas dosis diarias daba como resultado una esterilización sin descamación de la piel del escroto, a diferencia de la administración en dosis única. Esto es debido a que la radiosensibilidad de la célula varía en función de la fase de división del ciclo celular en que se encuentra. Las células en fase de mitosis y G2 son más radiosensibles, probablemente porque la célula no tiene tiempo de reparar el daño radioinducido, y las células en fase S son más radiorresistentes, probablemente por la conformación del ADN en ese momento.
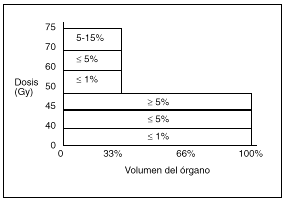
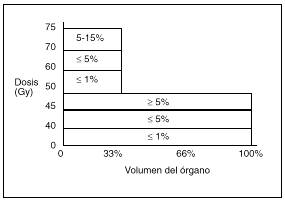
La tolerancia al tratamiento con irradiación disminuye al aumentar el volumen incluido en el campo de tratamiento; así, mientras que dosis de 45 Gy sobre la pelvis para el tratamiento del cáncer de cérvix son bien toleradas, cuando el volumen incluye los ganglios paraaórticos la toxicidad intestinal es del 15-25%16. En la figura 1 se observa la incidencia de complicaciones intestinales en función de la dosis y el volumen.
Fig. 1. Histograma dosis-volumen intestinal. Relación entre volumen y tolerancia intestinal tardía. (Tomada de Pérez CA. Principles and practice of Radiation Oncology, 1998.)
El concepto de tasa de dosis hace referencia a la administración de una dosis total específica en un tiempo de exposición más corto o más largo. Una misma dosis total administrada de forma rápida tiene más efectos perjudiciales que si se administra de forma lenta. Este hecho se basa en la reparación celular prácticamente completa a tasas bajas, en la progresión de las células en el ciclo celular y en la reoxigenación. Un estudio reciente demuestra que la reacción inflamatoria, la permeabilidad vascular y la sobreexpresión de ICAM-1 son mayores cuando la misma dosis de irradiación se administra a una tasa de dosis elevada10.
Factores relacionados con el tejido irradiado
Dependen principalmente de la actividad proliferativa. Los tejidos de proliferación lenta, como cartílago, oligodendrocitos, etc., responden lentamente a la irradiación, y el daño en el tejido sano se manifiesta en meses o años postratamiento, mientras que en los tejidos de proliferación rápida el daño se observa en días o semanas. La mucosa intestinal se caracteriza por ser un tejido de respuesta rápida a la radiación, ya que las células que lo componen se dividen de forma rápida y continua (elevado recambio celular)17.
Características del paciente
Las condiciones que predisponen al paciente a sufrir complicaciones, principalmente crónicas, son la hipertensión, la diabetes mellitus y las enfermedades inflamatorias intraabdominales o pélvicas. En un estudio reciente en pacientes con enfermedad inflamatoria intestinal que han recibido irradiación abdominal o pélvica, la toxicidad aguda y crónica es muy superior a la de los pacientes sin enfermedad intestinal previa, y los autores recomiendan que en estos pacientes se defina cuidadosamente la localización y la actividad de la enfermedad inflamatoria intestinal con la intención de usar técnicas específicas de radioterapia que permitan el tratamiento con la mínima morbilidad18. Otro factor que predispone al paciente a sufrir complicaciones es la existencia de cirugía previa. Cosset et al19, en una serie de 516 pacientes afectados de enfermedad de Hodgkin en estadios I y II que recibieron tratamiento con irradiación infradiafragmática, detectaron 36 casos (7%) con complicaciones tardías gastrointestinales, 25 con úlceras en el estómago o el duodeno, dos con gastritis grave, seis con obstrucción o perforación del intestino delgado y tres con úlcera y perforación intestinal. Los pacientes laparotomizados presentaron un índice de complicaciones gastrointestinales significativamente mayor que los no intervenidos quirúrgicamente (el 11,5 frente al 2,7%).
Otro factor que se debe tener en cuenta es la administración de quimioterapia concomitante, que puede incrementar el riesgo de presentar enteritis por irradiación. En el estudio del grupo de tumores gastrointestinales (GITSG) sobre el tratamiento postoperatorio en el cáncer avanzado de recto con quimiorradioterapia20, la incidencia de complicaciones intestinales fue superior en el brazo de tratamiento combinado (35%), respecto al brazo de quimioterapia sola (15%) o radioterapia sola (16%). Cuando se usan técnicas de irradiación con 4 campos en lugar de dos, la incidencia de complicaciones disminuye.
PATOLOGIA
El número de stem cell por cripta que sobreviven a la radiación es uno de los determinantes de la morbimortalidad de la radioterapia, pero no el único. Los factores humorales, la distinta radiosensibilidad de las diferentes partes del intestino y la reacción inflamatoria también influyen. El íleon terminal es la porción de intestino más sensible a la irradiación, debido al elevado recambio de las células epiteliales que lo constituyen21.
Los cambios histopatológicos sobre el intestino provocados por la irradiación se dividen en agudos, subagudos y crónicos. Los cambios agudos se producen durante o inmediatamente después de la irradiación y se caracterizan por la afección de las células epiteliales en proliferación y maduración. A las pocas horas de la exposición, la actividad mitótica de la porción proliferativa de la cripta se detiene. La necrosis celular, caracterizada por picnosis, cariorrexis y cariolisis, ocurre de forma progresiva y es máxima a las 6-8 h. Las células restantes sufren un intento de división que tiene como resultado numerosas mitosis, normalmente atípicas; esto suele ocurrir a las 8 y 24 h. A partir de las 24 h, la proliferación cesa y el número de células va disminuyendo, ya que la pérdida celular supera la capacidad de reproducción de las células de las criptas. En consecuencia, se acorta la altura de las vellosidades con la progresiva disminución de la superficie epitelial, y se produce un engrosamiento de la mucosa, junto con edema, activación de la proliferación de las stem cells restantes e infiltración de células inflamatorias. El infiltrado celular es predominantemente de leucocitos polimorfonucleares y de células plasmáticas, con la formación eventual de microabscesos en las criptas. Estos mecanismos pueden compensar parte del daño. Si el intestino recibe 10 Gy o menos, el epitelio intestinal se recupera de forma progresiva en unos 3 días. Sin embargo, si el intestino recibe dosis superiores a 15 Gy, la pérdida celular no se detiene y a los 10 días tiene lugar la muerte por pérdida de electrolitos, agua y proteínas y por infección (síndrome intestinal agudo). Durante la fase subaguda y crónica se producen los cambios vasculares con isquemia y fibrosis. Los capilares sufren una proliferación de células endoteliales anormal que ocasiona protrusiones en la luz vascular, fenómenos trombóticos y obliteración de los vasos. Asimismo, se observan cambios degenerativos en arterias y arteriolas con depósitos de colágeno en la íntima y media, con la consiguiente disminución de la luz vascular (fig. 2a). Finalmente, aparecen áreas de fisuras y úlceras, zonas necróticas y fístulas (fig. 2b). Las úlceras son predominantemente transversales, similares a las que tienen lugar en la vasculitis obliterante de otros orígenes. Las fístulas y perforaciones son focales y transmurales, y representan la pérdida geográfica de un fragmento de mucosa y músculo liso2,22.
Fig. 2. Secciones de colon. A) Hematoxilina-eosina (×200). Se observan cambios fibroobliterativos de estructuras vasculares. B) Hematoxilina-eosina (×100). Se observa una mucosa ulcerada, junto con áreas de hemorragia, zonas de fibrosis y atrofia glandular.
MANIFESTACIONES CLINICAS
Los síntomas pueden aparecer durante o pocos días después de la radioterapia, o a los meses o años de finalizar el tratamiento.
La radiación en el intestino afecta primeramente al colon. Aunque el intestino delgado es más radiosensible que el colon, su movilidad lo protege hasta cierto punto de los efectos adversos de la radiación. En cambio, el colon, al encontrarse fijo y en la proximidad de zonas que se irradian, como por ejemplo el cérvix, la vejiga o la próstata, es más susceptible a la lesión por radiación. Cierto grado de reacción intestinal debe aceptarse como contrapartida de un tratamiento radioterápico con intención curativa, pero cambios más graves pueden provocar necrosis y perforación, con formación de fístulas, mostrando una marcada semejanza con la diverticulitis aguda. La curación de estos cambios puede provocar fibrosis y estenosis que generalmente aparecen años después del tratamiento.
La proctocolitis aguda radioinducida se manifiesta como tenesmo, diarrea y mucosidad rectal. El sangrado rectal se observa si existe ulceración mucosa. Cuando el tratamiento con irradiación incluye el intestino delgado, se produce dolor abdominal, náuseas y diarrea líquida. El daño sobre la mucosa ileal se manifiesta como malabsorción, que habitualmente revierte a las pocas semanas de finalizar la irradiación. El hecho de no presentar síntomas en la fase aguda no indica una protección frente a la aparición de síntomas tardíos. La relación entre la morbilidad aguda y crónica es controvertida, aunque diversas evidencias sugieren que los efectos gastrointestinales tardíos se podrían correlacionar con la gravedad de los efectos agudos23,24. En cuanto a los efectos secundarios tardíos de la irradiación, los síntomas que más comúnmente presentan los pacientes con afección crónica del intestino delgado son dolor abdominal de tipo cólico debido a una obstrucción parcial del intestino delgado, así como náuseas, vómitos y síntomas de malabsorción, que también pueden estar presentes. La obstrucción suele ser localizada pero puede perjudicar la motilidad en segmentos intestinales amplios con interrupción del peristaltismo. También pueden producirse fístulas entre intestino y otros órganos de la pelvis. Los cuadros de peritonitis por perforación o abcesos son excepcionales. Si el intestino delgado, particularmente el íleon, está afectado, el paciente puede presentar clínica de malabsorción (pérdida de peso, diarrea, esteatorrea). Cuando la porción de intestino dañado es el recto, el paciente presentará síntomas que incluyen tenesmo y pérdidas de moco y/o sangre por el recto. En algunas ocasiones, puede haber constipación. Las complicaciones crónicas de la radiación en el intestino y los síntomas que produce tienen una tendencia a progresar en el tiempo y constituyen un grave problema terapéutico.
PRUEBAS DE IMAGEN Y ENDOSCOPIA
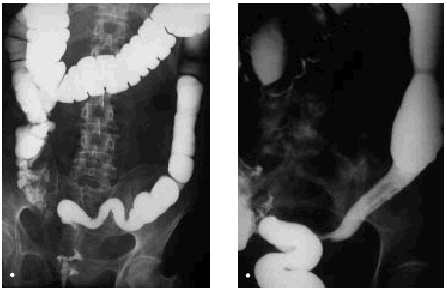
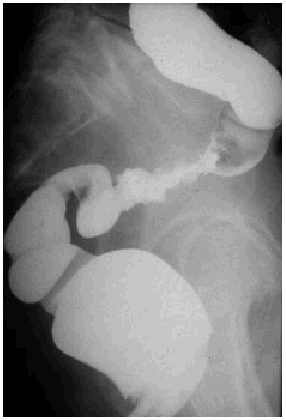
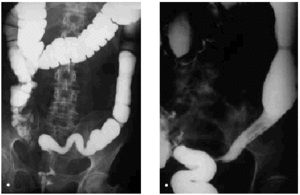
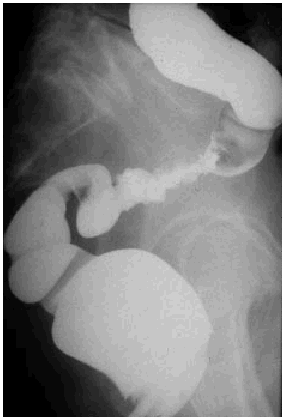
Los cambios que se producen en el intestino delgado y grueso incluyen edema y congestión de la pared, que radiológicamente se manifiestan como un estrechamiento de la luz, engrosamiento, enderezamiento y rigidez de los pliegues mucosos, o incluso pérdida completa del patrón de pliegues mucosos y pérdida de peristaltismo. Estos hallazgos pueden hacer que el bario se vea como una acumulación redondeada causada por el apelotonamiento de muchas asas de intestino delgado. Los cambios más graves cursan con ulceraciones mucosas y hemorragia gastrointestinal. La reacción peritoneal puede originar adherencias y acodaduras de asas del intestino delgado, y ocasionar obstrucción funcional o mecánica. Posteriormente, se desarrolla una fibrosis isquémica como consecuencia de la lesión de los vasos de la pared intestinal y también se producen estenosis intestinales. En el colon, el enema opaco puede evidenciar una luz intestinal estrechada, con frecuencia asociada a un patrón mucoso liso, y su aspecto puede ser similar al de una colitis ulcerosa de larga evolución (fig. 3). En una fase más aguda puede haber un espasmo local y proyección de los bordes, aspecto más parecido al del carcinoma (fig. 4). Los cambios en el intestino delgado incluyen ulceraciones superficiales de la mucosa, adelgazamiento de los pliegues, defectos de relleno, edema submucoso y fibrosis. En el recto, se observa fibrosis y estenosis perirrectal, que radiológicamente se caracteriza por un estrechamiento generalizado del recto con pérdida del patrón mucoso. El enema de bario puede poner de manifiesto ciertos defectos nodulares en el contorno. El aspecto de la fibrosis perirrectal generalmente no proporciona indicios acerca de la causa.
Fig. 3. Visión del colon sigmoide en una fase crónica postirradiación, como consecuencia de radioterapia por carcinoma de cérvix. A) Borramiento de las austraciones del sigma, aspecto tubular. B) Estenosis y estrechamiento de la luz del sigma. En ambos casos se observa una dilatación del colon proximal.
Fig. 4. Visión del colon sigmoide en una proyección lateral en fase aguda como consecuencia de radioterapia por cáncer de cérvix. Se observan úlceras mucosas junto con áreas de asimetría.
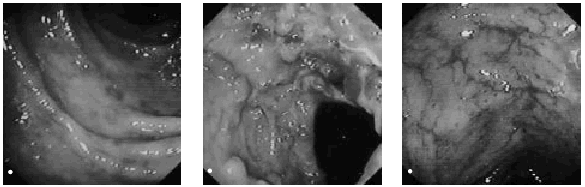
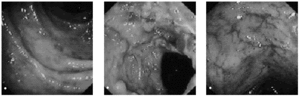
La sigmoidoscopia nos permite observar en el período agudo edema y eritema de la mucosa (fig. 5a), lo que impide la visión del patrón vascular de la luz intestinal. Si la dosis acumulada es importante, se observa friabilidad y ulceración mucosa (figs. 5b y c). Para la clasificación de la enteritis actínica mediante endoscopia, es habitual usar la gradación de Gilinsky et al25: grado I o leve, cuando se observa eritema, telangiectasias, edema o engrosamiento y palidez; grado II o moderado, cuando se observa, además, friabilidad, y grado III o grave, cuando existe ulceración y/o necrosis.
Fig. 5. Visión endoscópica del colon sigmoide. A) Imagen de proctitis leve, se observa eritema y aftas mucosas. B) Imagen de proctitis grave con úlceras y estenosis relativa. C) Imagen de lesión crónica con múltiples telangiectasias vasculares.
La tomografía axial computarizada puede evidenciar cambios inespecíficos como un ensanchamiento del espacio presacro y un adelgazamiento del tejido fibroso perirrectal.
TRATAMIENTO
El tratamiento de los pacientes con enteritis por irradiación en la fase aguda habitualmente no ocasiona problemas graves al médico. La diarrea o el dolor abdominal que ocurren durante o inmediatamente al finalizar el tratamiento con radioterapia suelen deberse a malabsorción de la mucosa intestinal y a un tránsito intestinal rápido. Estos síntomas suelen remitir con tratamiento antidiarreico convencional. Pueden requerirse anticolinérgicos y opiáceos en casos más graves, mientras que algunos pacientes refractarios a estos tratamientos responden a una dieta pobre en residuos o sin lactosa.
Los efectos tardíos de la radiación en la vasculatura constituyen un grave problema que afecta principalmente a las pequeñas arteriolas de la submucosa. La lesión de la pared del vaso ocasiona una disminución de la luz vascular suficiente para provocar isquemia en el intestino delgado26. El tratamiento médico tiene poco que ofrecer en la enteritis crónica por irradiación. La dieta y un tratamiento sintomático, junto con los esteroides, tienen un valor limitado. En ocasiones es necesario el tratamiento quirúrgico, aunque no está exento de complicaciones, debido a la isquemia del tejido y a la malnutrición, que contribuye a una elevada incidencia de dehiscencia de anastomosis y mortalidad intraoperatoria27. Existe controversia en cuanto a la técnica quirúrgica adecuada, la resección o el bypass. Las evidencias más recientes sugieren que debe efectuarse la resección siempre que sea posible2. Las teóricas objeciones a la resección son la sección de los vasos del mesenterio de un intestino que ya puede estar isquémico y la disección del intestino de las adherencias que lo rodean. El bypass está limitado por el potencial desarrollo de un síndrome del asa ciega y el mayor incoveniente es que deja el intestino enfermo que puede más adelante sangrar, perforarse y/o fistulizar.
En los últimos años se han investigado distintos fármacos para el tratamiento de la proctosigmoiditis rádica aguda y crónica sin que por el momento se haya hallado un tratamiento claramente eficaz. El sucralfato se ha utilizado, en administración tanto oral como tópica, en el tratamiento de la proctitis rádica aguda y crónica. Los estudios evidencian resultados contradictorios en cuanto a su posible efecto beneficioso28,29. El tratamiento tópico con amifostina, un tiofosfato orgánico, se aplicó durante el curso de la irradiación en 31 pacientes, sin observarse efectos beneficiosos clínicos ni endoscópicos30. Estudios experimentales sugieren que la inhibición de NF-kB31 o de la síntesis de prostaglandinas podrían ser eficaces en el tratamiento de la enteritis rádica. En este sentido, en un ensayo clínico doble ciego, la administración de enemas de 5-ASA demostró ser efectiva en la reducción de los síntomas gastrointestinales32. Sin embargo, cuando se administra de forma oral no mejora los síntomas33.
La limitada eficacia de los tratamientos de la enteritis por radiación hace que, también en esta patología, la prevención sea la mejor medida terapéutica. Por tanto, una planificación altamente precisa del volumen que se va a tratar, junto con nuevas técnicas de posicionamiento del paciente en el momento del tratamiento, puede ayudar a reducir los síntomas intestinales.