El cáncer colorrectal (CCR) es un problema importante de salud pública por su incidencia y mortalidad. La comunidad autónoma vasca aprobó en mayo de 2008 la puesta en marcha de un programa de cribado poblacional dirigido a las personas entre 50-69 años con test de sangre oculta en heces (SOH) inmunoquímica y colonoscopia con sedación en los casos positivos.
ObjetivoDescribir los principales resultados del programa de cribado de CCR con SOH en cuanto a tasas de detección y valor predictivo positivo (VPP), primera ronda (2009-11).
MetodologíaEstudio retrospectivo sobre invitaciones realizadas y hallazgos en colonoscopias con SOH positivo.
ResultadosSe incluyeron 230.505 personas invitadas, 148.249 muestras SOH procesadas. Participación media de 64,3% (IC 95%: 64,1-64,5), superior en mujeres que en hombres. Positividad media de 6,7% (IC 95%: 6,6-6,8) superior en hombres. Colonoscopia realizada al 93,1% de los casos positivos. Se observaron diferencias significativas entre mujeres y hombres en la tasa de de detección de Adenomas de Alto Riesgo (OR: 0,45 IC 95% 0,41-0,49) como en CCR (OR: 0,80 IC 95% 0,66-0,96), más frecuentes en hombres. El VPP para cualquier adenoma fue significativamente superior en hombres (72,4, IC 95% 71,2-73,5) que en mujeres (48,8%, IC 95% 47,2-50,5), con diferencias por grupo de edad y tipo de adenoma.
ConclusionesAltas tasas de participación, detección de lesiones avanzadas y CCR por el programa. Necesidad de mejorar aspectos de participación en los hombres por su mayor riesgo de desarrollar CCR. Evaluar el impacto del programa a medio-largo plazo.
Colorectal cancer (CRC) is a major public health problem due to its incidence and mortality. In May 2008, the Basque Country approved the implementation of a population-based colorectal cancer screening program, using the immunochemical fecal occult blood test (FOBT), in persons aged 50-69 years. Patients with a positive result were invited to undergo colonoscopy with sedation.
ObjectiveTo describe the main results of the first round of the CRC screening program with FOBT (2009-2011) in terms of the detection rates and positive predictive value (PPV).
MethodRetrospective study of participation rates and colonoscopic findings in persons with a positive FOBT result.
ResultsInvitations to attend screening were sent to 230.505 persons. A total of 148.249 FOBT tests were processed. The mean participation rate was 64.3% (95% CI: 64.1-64.5) and was higher in women than in men. The FOBT test was positive in 6.7% (95% CI: 6.6-6.8). Positive results were more frequent in men. Among persons with a positive result, colonoscopy was performed in 93.1%. There were significant differences between women and men in the detection rate of high-risk adenomas (OR: 0,45 95% CI 0,41-0,49), which, as with CRC (OR: 0,80 95% CI 0,66-0,96), were more frequent in men. The PPV for adenoma of any type was significantly higher in men (72.4 95% CI, 71.2-73.5) than in women (48.8% 95% CI 47.2-50.5), with differences by age group and type of adenoma.
ConclusionsParticipation rates and detection of advanced lesions and CRC were high. Because men have a higher risk of developing CRC, efforts should be made to increase their participation. The impact of the CRC screening program should be evaluated in the medium to long term.
El cáncer colorrectal (CCR) representa un problema importante de salud pública por su elevada incidencia anual y mortalidad en los países desarrollados, llegando a ser en España el más prevalente contando ambos sexos, con un porcentaje de cambio anual de 2,5% (2,8 en hombres y 2,17 en mujeres: 1975-2004)1. Las estrategias de cribado poblacional han demostrado el potencial de disminuir la mortalidad en personas mayores de 50 años2. En el caso del cribado de sangre oculta en heces (SOH) se ha demostrado su efectividad en la disminución de la mortalidad de hasta un 16% con test de guayaco3. Los nuevos tests inmunoquímicos cuantitativos han demostrado ser mejor aceptados por la población, con mayores tasas de participación y de detección de adenomas avanzados (AA) o adenomas de alto riesgo (AAR)4. La Guía Europea de Práctica Clínica de calidad en cribado de CCR recomienda su utilización en cribados poblacionales5. En la comparación entre los 2 métodos de cribado más utilizados en primera ronda (colonoscopia versus SOH inmunoquímica con test OC-Sensor®), encontraron diferencias significativas en cuanto a la detección de CCR6.
La estrategia de puesta en marcha de cribados poblacionales con SOH fue recomendada desde 2003 por la Unión Europea y asumida desde 2006 por el Sistema Nacional de Salud7,8. Esta estrategia ha estado especialmente impulsada desde La Alianza contra el cáncer de colon desde un foro profesional y ciudadano9, en todas las comunidades autónomas.
En la comunidad autónoma vasca, el CCR ocupa el segundo lugar en incidencia de cáncer en mujeres y el segundo en hombres (después de mama y próstata, respectivamente), mostrando incrementos significativos en incidencia y mortalidad desde 1986 a 200810. El control de esta enfermedad fue un objetivo del plan de salud 2002-201011, en cuanto al mantenimiento de las tasas ajustadas (estándar europea) de mortalidad registradas durante 1996-1998 (29,5/100.000 en hombres y 14,5/100.000 en mujeres), observándose en la evaluación realizada en 2011 un descenso en mujeres (15,86%), pero un incremento en hombres (9,15%)12.
Como estrategia para disminuir su incidencia y mortalidad, el Departamento de Sanidad aprobó en mayo del 2008 el cribado poblacional para mujeres y hombres entre 50-69 años, con SOH inmunoquímica cuantitativa bienal y colonoscopia completa con sedación para la confirmación diagnóstica en los casos positivos. Para su puesta en marcha se establecieron como requisitos: la coordinación centralizada del programa y ejecución descentralizada en atención primaria y atención especializada garantizando la continuidad de la atención.
El objetivo de este trabajo es describir los principales resultados del programa respecto a la detección de lesiones y valor predictivo positivo (VPP) del cribado con SOH en primera ronda del programa en 2009-2011.
MétodoLas pruebas de cribado y diagnósticas se organizan en centros públicos (centros de salud, laboratorios de bioquímica y unidades de endoscopia de los hospitales de referencia).
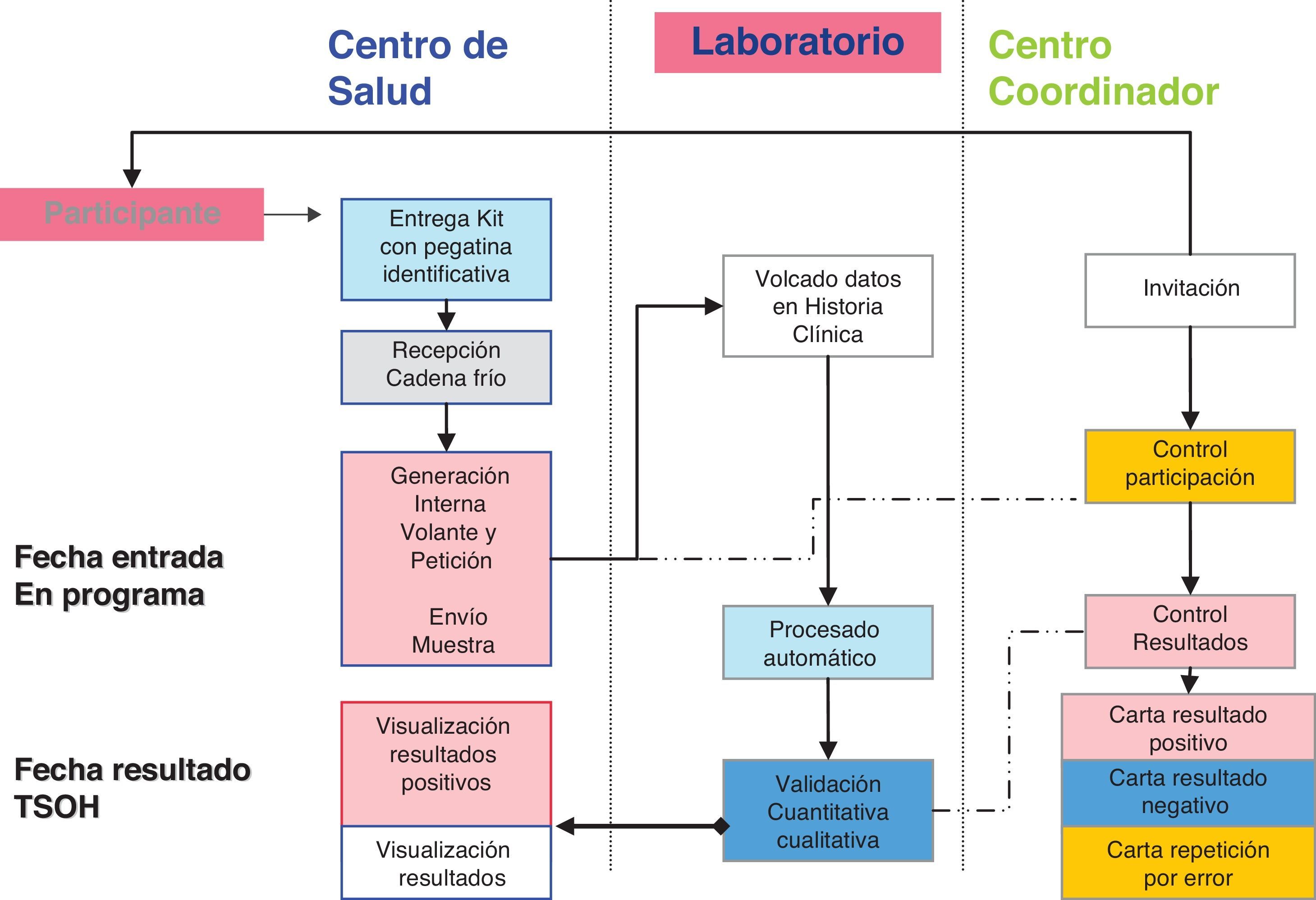
Organización general del programaSe constituyó en 2008 un centro coordinador del programa que realizó la selección de la población y la depuración (exclusión de personas con antecedentes de CCR, enfermedad digestiva en seguimiento y colonoscopia informada realizada en los últimos 5 años, fundamentalmente debido a enfermedades inflamatorias y antecedentes personales de enfermedad adenomatosa. No se excluyeron antecedentes familiares al no contar con base de datos de estos casos. Así mismo, el centro coordinador realizó la invitación a las personas seleccionadas. Las primeras invitaciones se realizaron en 2009. Se envió a las personas que no manifiestan su deseo de no participar el kit a su domicilio, con las instrucciones y una carta personalizada con un código personal autoadhesivo que permitió tanto identificar la muestra como generar una petición al laboratorio vinculada al médico de atención primaria. No se precisaron trámites administrativos para participar, considerándose participación la fecha en que la persona deposita el kit en su centro de salud. Una vez analizado en los laboratorios de referencia, la persona recibió una carta desde el centro coordinador según su resultado: a) negativo, se le indicó que se le volvería a invitar en 2 años (si menor de 70 entonces); b) positivo, se le indicó que acudiera a su médico de atención primaria para ser informado, valorado y referido para realizar una colonoscopia, y c) error, se le envía un nuevo kit para participar (fig. 1).
Prueba de cribadoSe utilizaron los tests disponibles en el mercado: OC-Sensor® y Fob-gold Sentinel®, con punto de corte según fabricante: ≥ 100 ng/ml, resultado positivo. Se utilizó OC-Sensor® desde 01-06-2010 a partir de un estudio de evaluación realizado13.
Confirmación diagnósticaEn el centro de salud se gestionaron las citas para la colonoscopia en su hospital de referencia. Previo a la cita (7-10 días antes), la enfermera de cada cupo de atención primaria realizó una visita en la que ofreció consejos, dieta y la preparación con preparados de polietilenglicol.
Colonoscopia de confirmaciónLas colonoscopias se realizaron en los hospitales de referencia con sedación profunda por endoscopistas expertos. Se monitorizó su calidad: intubación cecal, limpieza colónica (buena: colon limpio; regular: colon con restos semilíquidos aspirables, y mala: heces semisólidas y/o sólidas) y complicaciones (hemorragia digestiva baja con ingreso >24h o transfusión, perforación, depresión respiratoria y otras). No se pudo contabilizar la técnica utilizada en todos los casos y la pérdida de pólipos requirió otra colonoscopia de revisión.
En caso de un resultado negativo (no lesiones adenomatosas/enfermedad relevante/CCR), si la limpieza colónica era adecuada, la persona recibía una carta desde el centro coordinador para volver al cribado en 10 años. Todas las lesiones fueron analizadas en los laboratorios de anatomía patológica. Los endoscopistas emitieron una recomendación de seguimiento para el médico de atención primaria, basado en la Guía de Práctica Clínica de 200914 (según número, tamaño y grado de displasia).
Codificación de las colonoscopiasEl centro coordinador codificó todas las colonoscopias según las guías5,14, los consensos alcanzados en la red de cribados de cáncer15 y la opinión de expertos de nuestro medio: a) normal (hallazgos no relevantes como hemorroides/diverticulosis y pólipos hiperplásicos no serrados); b) adenoma de bajo riesgo (ABR) (1 o 2 adenomas, todos ellos menores de 10mm y sin displasia de alto grado o componente velloso); c) adenoma de alto riesgo o avanzado (AAR), o lesión premaligna (3-10 adenomas o adenoma de ≥10mm, componente velloso o presencia de displasia de alto grado, se incluyen en esta categoría los pTis o anteriormente denominados «carcinoma in situ»; d) CCR o lesión maligna, con invasión de submucosa, y e) enfermedad digestiva relevante (colitis ulcerosa, enfermedad de Crohn, poliposis, etc.). Se consideró resultado concluyente (colonoscopia diagnóstica) la exploración que permitió visualizar toda la mucosa colónica con extirpación completa de los pólipos encontrados o biopsia (en los casos de CCR).
Se contabilizó una colonoscopia por persona y el hallazgo más grave encontrado. Durante 2011 se siguieron los criterios de la GPC Europea 2010, en la que los AAR fueron desglosados en medio y alto riesgo. En este estudio se utilizó la Guía del 200914 para poder comparar resultados del periodo 2009-2011.
Análisis de datosSe seleccionaron las siguientes variables: edad en la invitación; sexo; participación, resultado SOH; resultado colonoscopia, limpieza colónica, complicaciones, intubación cecal, localización, estadio y tipo de primer tratamiento en los casos de CCR.
Para comparar las diferencias entre las variables cualitativas entre hombres y mujeres se ha utilizado la prueba χ2 o su correspondiente corrección de Fisher. A su vez, se ha calculado la odds ratio y su correspondiente intervalo de confianza al 95%. Se ha utilizado un nivel de significación estadística del 5%.
Datos extraídos a 31/05/2012 y analizados con el software estadístico SPSS vs 20.0 y WINPEPI versión 11.24 (Abramson, J.H. WINPEPI updated: computer programs for epidemiologists, and theri teaching potencial. Epidemiologic Perspectivas & Innovations 2011, 8:1.
ResultadosSe invitó a 230.505 personas (2009-2011), analizándose 148.249 muestras. El valor medio de participación fue de 64,3% (IC 95%: 64,1-64,5), superior en mujeres 67,1% (IC 95%: 66,8-67,4; p<0,001) que en hombres (61,4%, IC 95%: 61,1-61,7%). La positividad media fue de 6,7% (IC 95%: 6,6-6,8), superior en hombres (8,9%; IC 95%: 8,7-9,2; p<0,001) que en mujeres (4,7; IC 95%: 4,6-4,9).
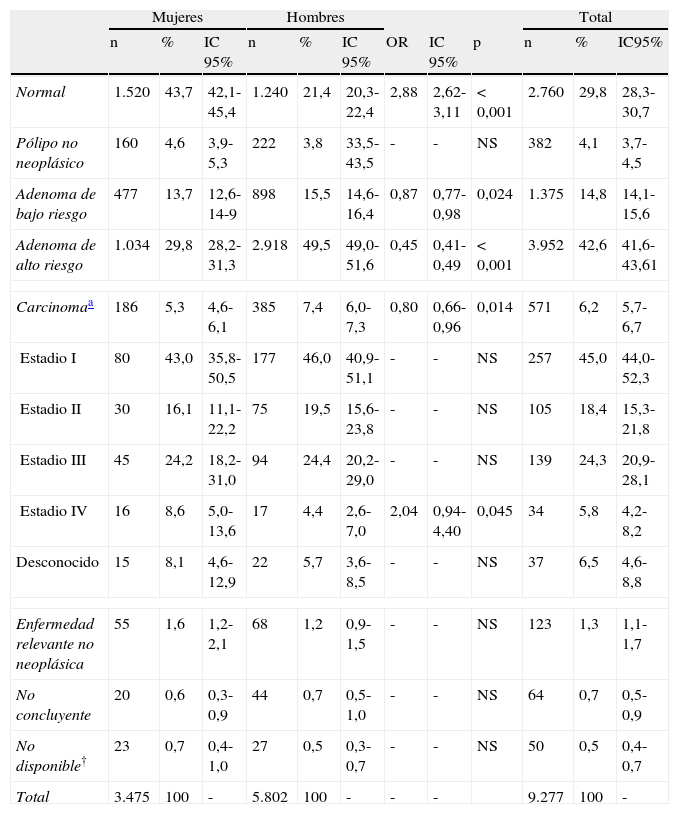
Se realizó colonoscopia al 93,1% (IC 95%: 92,6-93,6) de los participantes con resultado positivo en el SOH. Se obtuvo resultado de la colonoscopia en el 98,8% de los casos. En cuanto a la distribución por sexos, se realizó colonoscopia al 92,6% (IC 95%: 91,8-93,5) de las mujeres y al 93,4% (IC 95%: 93,8-94,0) de los hombres, no existiendo diferencias significativas entre ambos sexos en la tasa de cumplimentación de colonoscopia. En la tabla 1 se puede observar el resultado de las colonoscopias realizadas, tanto en la población global como distribuidos por sexos. Destacar las diferencias observadas en el número de colonoscopias con resultado de adenoma de bajo riesgo (ABR), adenoma de alto riesgo (AAR) y carcinoma (CCR) entre hombres y mujeres, siendo superior el número de casos detectados en los hombres.
Resultados de las colonoscopias con la distribución de los resultados
| Mujeres | Hombres | Total | ||||||||||
| n | % | IC 95% | n | % | IC 95% | OR | IC 95% | p | n | % | IC95% | |
| Normal | 1.520 | 43,7 | 42,1-45,4 | 1.240 | 21,4 | 20,3-22,4 | 2,88 | 2,62-3,11 | < 0,001 | 2.760 | 29,8 | 28,3-30,7 |
| Pólipo no neoplásico | 160 | 4,6 | 3,9-5,3 | 222 | 3,8 | 33,5-43,5 | - | - | NS | 382 | 4,1 | 3,7-4,5 |
| Adenoma de bajo riesgo | 477 | 13,7 | 12,6-14-9 | 898 | 15,5 | 14,6-16,4 | 0,87 | 0,77-0,98 | 0,024 | 1.375 | 14,8 | 14,1-15,6 |
| Adenoma de alto riesgo | 1.034 | 29,8 | 28,2-31,3 | 2.918 | 49,5 | 49,0-51,6 | 0,45 | 0,41-0,49 | < 0,001 | 3.952 | 42,6 | 41,6-43,61 |
| Carcinomaa | 186 | 5,3 | 4,6-6,1 | 385 | 7,4 | 6,0-7,3 | 0,80 | 0,66-0,96 | 0,014 | 571 | 6,2 | 5,7-6,7 |
| Estadio I | 80 | 43,0 | 35,8-50,5 | 177 | 46,0 | 40,9-51,1 | - | - | NS | 257 | 45,0 | 44,0-52,3 |
| Estadio II | 30 | 16,1 | 11,1-22,2 | 75 | 19,5 | 15,6-23,8 | - | - | NS | 105 | 18,4 | 15,3-21,8 |
| Estadio III | 45 | 24,2 | 18,2-31,0 | 94 | 24,4 | 20,2-29,0 | - | - | NS | 139 | 24,3 | 20,9-28,1 |
| Estadio IV | 16 | 8,6 | 5,0-13,6 | 17 | 4,4 | 2,6-7,0 | 2,04 | 0,94-4,40 | 0,045 | 34 | 5,8 | 4,2-8,2 |
| Desconocido | 15 | 8,1 | 4,6-12,9 | 22 | 5,7 | 3,6-8,5 | - | - | NS | 37 | 6,5 | 4,6-8,8 |
| Enfermedad relevante no neoplásica | 55 | 1,6 | 1,2-2,1 | 68 | 1,2 | 0,9-1,5 | - | - | NS | 123 | 1,3 | 1,1-1,7 |
| No concluyente | 20 | 0,6 | 0,3-0,9 | 44 | 0,7 | 0,5-1,0 | - | - | NS | 64 | 0,7 | 0,5-0,9 |
| No disponible† | 23 | 0,7 | 0,4-1,0 | 27 | 0,5 | 0,3-0,7 | - | - | NS | 50 | 0,5 | 0,4-0,7 |
| Total | 3.475 | 100 | - | 5.802 | 100 | - | - | - | 9.277 | 100 | - | |
NS: no significativo.
En los casos de enfermedad relevante no neoplásica (123), en el 90% se detectó enfermedad inflamatoria intestinal (colitis ulcerosa o enfermedad de Crohn), y entre otras: poliposis y metástasis de otros órganos.
El 79,7% de los cánceres se localizaron en colon izquierdo, siendo sigma y la unión rectosigmoidea las localizaciones más frecuentes para ambos sexos.
En el 98,3% de las colonoscopias fueron completas, alcanzando ciego. El 85,7% de las colonoscopias realizadas tenían una preparación buena, un 8,2% regular y un 6,1% mala, estas últimas precisaron una segunda colonoscopia diagnóstica.
En los casos en los que no se realizó o no se obtuvo resultado de la colonoscopia (762), el 52,1% fue por negación, en el 20,3% de los casos no se pudo localizar a la persona, el 16,5% fueron participantes con un resultado de error que no repitieron el TSOH y por lo tanto no se solicitó en ningún caso colonoscopia, el 6,6% se realizaron en el sistema sanitario privado y no se dispuso del informe, el 8,4% fueron colonoscopias no concluyentes a las que se invitó al programa nuevamente o se siguieron con otras pruebas diagnósticas menos sensibles como colonoscopia virtual, y el resto fallecieron sin realizarse la colonoscopia.
Se detectaron un total de 56 complicaciones, de las que 29 fueron hemorragias (0,2%), 15 perforaciones (0,1%) y 12 otras causas (bradicardia, desaturación, dolor posprueba). Se requirió ingreso en 24 casos e intervención quirúrgica en 5 casos. No se registró ningún caso de fallecimiento.
En el 28% de los CCR el primer tratamiento y definitivo fue la resección endoscópica, en estadio i. La cirugía fue el tratamiento de primera elección en el 64,8% en todos los casos.
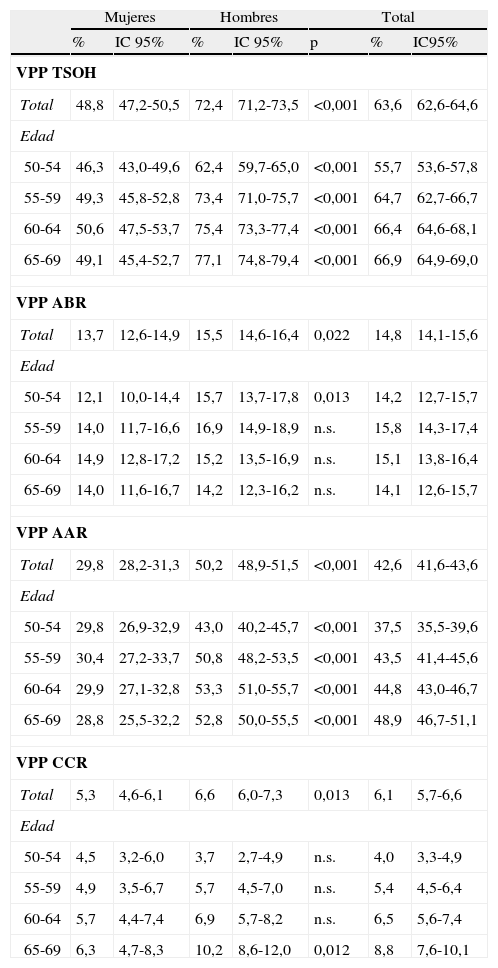
En la tabla 2 se pueden observar los valores predictivos positivo (VPP) de la prueba de SOH para cualquier adenoma (ABR y AAR) y CCR, así como para cada trastorno por separado. No se han encontrado diferencias significativas entre ambos sexos cuando comparamos el VPP de los ABR por rangos de edad, salvo el rango de 50-54 años. Además, en el caso del VPP para carcinoma no existen diferencias al analizar por rangos de edad, salvo en el último rango (65-69 años).
Resultado los valores predictivos positivos de la prueba de sangre oculta en heces, por sexo, rangos de edad y en la población total
| Mujeres | Hombres | Total | |||||
| % | IC 95% | % | IC 95% | p | % | IC95% | |
| VPP TSOH | |||||||
| Total | 48,8 | 47,2-50,5 | 72,4 | 71,2-73,5 | <0,001 | 63,6 | 62,6-64,6 |
| Edad | |||||||
| 50-54 | 46,3 | 43,0-49,6 | 62,4 | 59,7-65,0 | <0,001 | 55,7 | 53,6-57,8 |
| 55-59 | 49,3 | 45,8-52,8 | 73,4 | 71,0-75,7 | <0,001 | 64,7 | 62,7-66,7 |
| 60-64 | 50,6 | 47,5-53,7 | 75,4 | 73,3-77,4 | <0,001 | 66,4 | 64,6-68,1 |
| 65-69 | 49,1 | 45,4-52,7 | 77,1 | 74,8-79,4 | <0,001 | 66,9 | 64,9-69,0 |
| VPP ABR | |||||||
| Total | 13,7 | 12,6-14,9 | 15,5 | 14,6-16,4 | 0,022 | 14,8 | 14,1-15,6 |
| Edad | |||||||
| 50-54 | 12,1 | 10,0-14,4 | 15,7 | 13,7-17,8 | 0,013 | 14,2 | 12,7-15,7 |
| 55-59 | 14,0 | 11,7-16,6 | 16,9 | 14,9-18,9 | n.s. | 15,8 | 14,3-17,4 |
| 60-64 | 14,9 | 12,8-17,2 | 15,2 | 13,5-16,9 | n.s. | 15,1 | 13,8-16,4 |
| 65-69 | 14,0 | 11,6-16,7 | 14,2 | 12,3-16,2 | n.s. | 14,1 | 12,6-15,7 |
| VPP AAR | |||||||
| Total | 29,8 | 28,2-31,3 | 50,2 | 48,9-51,5 | <0,001 | 42,6 | 41,6-43,6 |
| Edad | |||||||
| 50-54 | 29,8 | 26,9-32,9 | 43,0 | 40,2-45,7 | <0,001 | 37,5 | 35,5-39,6 |
| 55-59 | 30,4 | 27,2-33,7 | 50,8 | 48,2-53,5 | <0,001 | 43,5 | 41,4-45,6 |
| 60-64 | 29,9 | 27,1-32,8 | 53,3 | 51,0-55,7 | <0,001 | 44,8 | 43,0-46,7 |
| 65-69 | 28,8 | 25,5-32,2 | 52,8 | 50,0-55,5 | <0,001 | 48,9 | 46,7-51,1 |
| VPP CCR | |||||||
| Total | 5,3 | 4,6-6,1 | 6,6 | 6,0-7,3 | 0,013 | 6,1 | 5,7-6,6 |
| Edad | |||||||
| 50-54 | 4,5 | 3,2-6,0 | 3,7 | 2,7-4,9 | n.s. | 4,0 | 3,3-4,9 |
| 55-59 | 4,9 | 3,5-6,7 | 5,7 | 4,5-7,0 | n.s. | 5,4 | 4,5-6,4 |
| 60-64 | 5,7 | 4,4-7,4 | 6,9 | 5,7-8,2 | n.s. | 6,5 | 5,6-7,4 |
| 65-69 | 6,3 | 4,7-8,3 | 10,2 | 8,6-12,0 | 0,012 | 8,8 | 7,6-10,1 |
El número de casos necesarios a cribar (NNC, prueba de cribado válida/lesiones detectadas) para detectar un cáncer fue de 259, 4 y de 37,5 para detectar un adenoma de alto riesgo. En el caso de número de personas necesarias para realizar una colonoscopia (NNE, número de personas con colonoscopia concluyente/lesiones detectadas) para detectar un cáncer fue de 16 y para detectar un adenoma de alto riesgo de 2,3.
DiscusiónLas tasas de detección de AAR y CCR se situaron en rangos medios respecto a otros estudios. El VPP para cualquier adenoma es superior a los rangos definidos en la GPC Europea (19,6-40,3%), encontrándose el valor predictivo para CCR dentro de estos rangos (4,5-8,6%).
Estos resultados avalan la continuación y extensión del programa, debiendo mejorar la participación de los hombres, tal como señalan los estudios publicados16,17. Ellos, en general, participan menos pero se detecta un mayor número de lesiones. Las diferencias en el VPP en hombres son similares a programas de larga trayectoria18, lo que indica la necesidad de realizar estrategias diferenciadas de incremento de la participación por género, dado que los datos de la comunidad autónoma registran una mayor incidencia y prevalencia de CCR en hombres.
Se encontraron diferencias en la tasa de falsos positivos, más frecuentes en mujeres19, posiblemente con mayor prevalencia de lesiones no adenomatosas que pueden causar sangrado y la menor incidencia de cáncer en mujeres.
Es importante estudiar las tasas de aceptación de la colonoscopia, si bien los resultados comparativos del 2010 con la red de programas españoles presenta cifras superiores a la media (87,6%)15 y los estudios relacionados refieren no encontrar diferencias por estado socioeconómico, sexo o edad20. La calidad de la colonoscopia según los parámetros determinados es necesaria monitorizarla de forma continua con el fin de disminuir las complicaciones y acercarse a las tasas estándares marcadas21. Los especialistas en endoscopia y las técnicas utilizadas en el cribado son clave para disminuir el cáncer de intervalo y el riesgo de desarrollo de lesiones futuras en los seguimientos poscribado22.
De acuerdo con las altas tasas de participación y de detección de lesiones se podría hipotéticamente considerar un programa coste-efectivo, a evaluar a medio-largo plazo, tal como señalan los estudios en este sentido23.
Estudios realizados con tests menos sensibles a la detección de adenomas avanzados y cáncer, ya han demostrado recientemente una reducción importante de la mortalidad en participantes en 3 rondas sucesivas que puede llegar a un 27%24. La utilización de este test, en primera ronda con puntos de corte entre 50-100 ng/ml, ha demostrado tener una alta sensibilidad y especificidad para CCR y adenomas en colon derecho e izquierdo25.
Es reseñable la alta tasa de CCR cuya resección, en estadio i, es posible de forma endoscópica comparable a otros estudios en el que se utiliza el test de SOH inmunoquímico26.
Los casos de cáncer encontrados en mayor frecuencia en estadios iniciales que en la práctica sin cribado en la comunidad autónoma vasca10 necesitarán ser seguidos y contrastados con los cánceres provenientes de personas no cribadas o no invitadas para conocer el verdadero impacto del programa como han demostrado los estudios realizados en Reino Unido27.
Como conclusión, el programa de cribado de CCR ha sido aceptado por la población de la CAV y se observan unas adecuadas tasas de detección de lesiones premalignas y malignas, lo que avala su extensión del programa a toda la población residente entre 50-69 años. Tal como recientemente se ha publicado, si bien son momentos de crisis, la prevención de este CCR no solo es beneficiosa para las personas, sino es coste-efectiva para el sistema sanitario28.
AutoríaLos autores reseñados han contribuido desde su especialidad y servicio a la puesta en marcha y evaluación del programa en la CAV. Se considera necesaria la inclusión de más de 6 autores dada la complejidad y extensión del estudio realizado, que abarca desde las invitaciones, la estandarización de las pruebas de cribado, la medición de calidad de las colonoscopias y el registro de los casos. La Unidad de Epidemiología del Hospital Universitario de Cruces ha desarrollado herramientas de control de calidad de los datos prestando soporte metodológico al programa.
Todos los autores han aportado sugerencias previas al envío de esta publicación.
FinanciaciónPara elaborar este estudio se contó con una beca del Gobierno Vasco en el programa de ayudas a la investigación 2010. Expediente 2009111005.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Se agradece a las autoridades sanitarias de Osakidetza la posibilidad de realizar este estudio y de favorecer la formación e implicación de todas las personas, especialmente de atención primaria sin las que este programa no hubiese alcanzado el éxito de participación. Agradecer especialmente a los servicios de digestivo de todos los hospitales de Osakidetza su implicación en el cribado, realizando las colonoscopias con un alto nivel de calidad. Así mismo, agradecer a epidemiólogos, endoscopistas, bioquímicos, enfermeras, patólogos, cirujanos, oncólogos, personal de citación, directivos, porque han hecho posible el diagnóstico precoz y el tratamiento de todas las personas. Pero sobre todo, agradecer la confianza depositada por la población en los profesionales y en el programa.