El telaprevir (TPV) y el boceprevir (BOC) son los primeros inhibidores de la serin-proteasa NS3/4A del virus de la hepatitis C (VHC) que, en asociación al interferón-pegilado (P) y ribavirina (R), constituyen el tratamiento recomendado de la hepatitis crónica C (HCC) por genotipo 1 desde el año 2012 en nuestro medio.
Los estudios de registro en fase II y III del TPV establecieron las duraciones aconsejables del tratamiento en base al patrón de respuesta al tratamiento previo con PR, la evolución de la cinética viral durante el tratamiento y el grado de fibrosis hepática del paciente1–6. La pauta más corta de tratamiento triple con TPV recomendada hasta la actualidad es de 12 semanas (TPV12PR12) y su eficacia se ha evaluado recientemente en el estudio CONCISE7 (duración no incluida en ficha técnica en el momento de preparar este manuscrito). Su aplicabilidad se limitaría a pacientes naíf o recidivantes al tratamiento con PR, haplotipo CC del gen IL28B y fibrosis F0-F3.
Los estudios de registro en fase III de TPV4–7 mostraron que los pacientes tratados con fibrosis avanzada o cirrosis (F3-F4) tenían peores tasas de respuesta viral sostenida (RVS) que los pacientes con fibrosis moderada o nula (F0-F2). Con la finalidad de reducir las recaídas durante y postratamiento, todos los protocolos indican que los pacientes con cirrosis, tras las 12 semanas iniciales de terapia triple, mantengan el tratamiento con PR hasta completar 48 semanas (TPV12PR48), siempre que no reúnan criterios de parada del tratamiento o este se deba suspender por efectos adversos. Las inferiores tasas de RVS de los pacientes con fibrosis avanzada y su protocolo de tratamiento más largo hacen previsible el fracaso del tratamiento cuando este deba ser suspendido de forma muy precoz.
Este trabajo presenta 4 pacientes con fibrosis avanzada que debieron suspender el tratamiento triple con TPV de forma muy precoz por efectos adversos graves (EAG) y, aun así, 3 de ellos alcanzaron RVS, analizando las circunstancias que pueden contribuir a explicarlo.
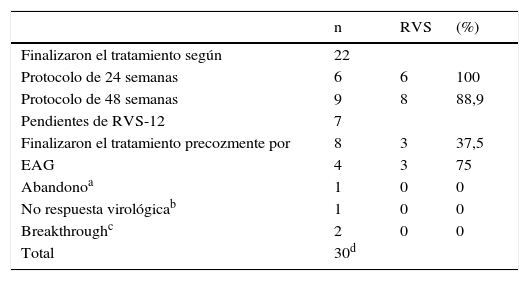
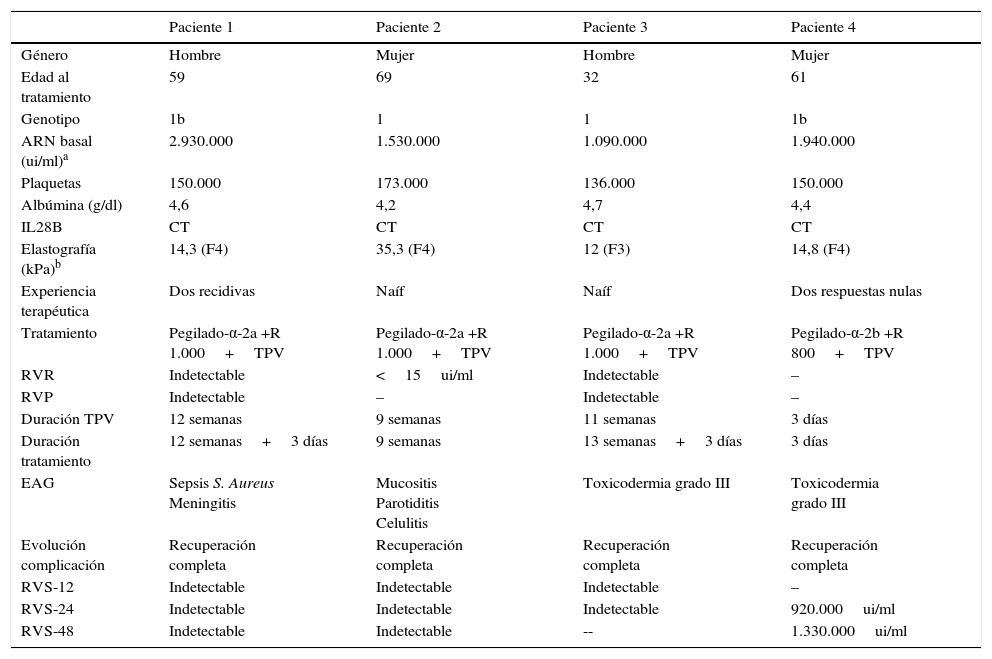
Observaciones clínicasEntre el 1 de enero de 2012 y el 31 de diciembre del 2013, 30 pacientes con HCC genotipo 1 finalizaron el tratamiento antiviral triple con TPV en el Servicio de Aparato Digestivo del Hospital Universitario de Girona «Doctor Josep Trueta» (tabla I). De los 8 pacientes que finalizaron el tratamiento de forma precoz, 4 lo hicieron por EAG y se describen en este trabajo. La tabla II muestra las características demográficas y clínicas basales de los 4 pacientes, la información relativa al curso del tratamiento, las complicaciones responsables de su interrupción y su evolución posterior.
Pacientes con tratados con Telaprevir entre el 1-12-2012 y el 31-12-2013
| n | RVS | (%) | |
|---|---|---|---|
| Finalizaron el tratamiento según | 22 | ||
| Protocolo de 24 semanas | 6 | 6 | 100 |
| Protocolo de 48 semanas | 9 | 8 | 88,9 |
| Pendientes de RVS-12 | 7 | ||
| Finalizaron el tratamiento precozmente por | 8 | 3 | 37,5 |
| EAG | 4 | 3 | 75 |
| Abandonoa | 1 | 0 | 0 |
| No respuesta virológicab | 1 | 0 | 0 |
| Breakthroughc | 2 | 0 | 0 |
| Total | 30d |
RVS: Respuesta viral sostenida; EAG: Efecto adverso grave.
Características de los pacientes con interrupción precoz por EAG
| Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 | |
|---|---|---|---|---|
| Género | Hombre | Mujer | Hombre | Mujer |
| Edad al tratamiento | 59 | 69 | 32 | 61 |
| Genotipo | 1b | 1 | 1 | 1b |
| ARN basal (ui/ml)a | 2.930.000 | 1.530.000 | 1.090.000 | 1.940.000 |
| Plaquetas | 150.000 | 173.000 | 136.000 | 150.000 |
| Albúmina (g/dl) | 4,6 | 4,2 | 4,7 | 4,4 |
| IL28B | CT | CT | CT | CT |
| Elastografía (kPa)b | 14,3 (F4) | 35,3 (F4) | 12 (F3) | 14,8 (F4) |
| Experiencia terapéutica | Dos recidivas | Naíf | Naíf | Dos respuestas nulas |
| Tratamiento | Pegilado-α-2a +R 1.000+TPV | Pegilado-α-2a +R 1.000+TPV | Pegilado-α-2a +R 1.000+TPV | Pegilado-α-2b +R 800+TPV |
| RVR | Indetectable | <15ui/ml | Indetectable | – |
| RVP | Indetectable | – | Indetectable | – |
| Duración TPV | 12 semanas | 9 semanas | 11 semanas | 3 días |
| Duración tratamiento | 12 semanas+3 días | 9 semanas | 13 semanas+3 días | 3 días |
| EAG | Sepsis S. Aureus Meningitis | Mucositis Parotiditis Celulitis | Toxicodermia grado III | Toxicodermia grado III |
| Evolución complicación | Recuperación completa | Recuperación completa | Recuperación completa | Recuperación completa |
| RVS-12 | Indetectable | Indetectable | Indetectable | – |
| RVS-24 | Indetectable | Indetectable | Indetectable | 920.000ui/ml |
| RVS-48 | Indetectable | Indetectable | -- | 1.330.000ui/ml |
Paciente 1. Varón nacido en 1953, transfundido a los 10 años por traumatismo tóraco-abdominal, diagnosticado de HCC el año 1983. Biopsia hepática percutánea en enero de 1984, diagnosticada de hepatitis crónica activa A1-F0. Genotipo 1b. Tratamiento con INF-estándar+R, 48 semanas en julio de 2001 con recidiva postratamiento. Retratado con PR 48 semanas en julio de 2007 con recidiva postratamiento, debiendo ser tratado de neumonía durante el mismo. Valorado para tratamiento triple con TPV en diciembre de 2011, el ARN-VHC basal fue de 2.690.000ui/ml, la elastografía de 14,3kPa (F4) y el polimorfismo del gen IL28B de CT.
A las 24 horas de la última dosis de TPV el paciente presentó fiebre elevada seguida 48 horas después de vómitos, siendo hospitalizado para observación; 24 horas más tarde desarrolló cefalea intensa y bradipsiquia. El examen del líquido cefalorraquídeo mostró características de meningitis bacteriana, iniciándose tratamiento con ampicilina+ceftriaxona. En las horas posteriores se confirmó la existencia de embolismos sépticos cutáneos y oculares (humor vítreo). Los hemocultivos fueron positivos a Staphiloccocus aureus, momento en que se cambió la pauta antibiótica a cloxacilina. Se descartó la coexistencia de endocarditis bacteriana. En el momento del ingreso se suspendió toda la medicación antiviral, habiendo cumplido 12 semanas de tratamiento triple con TPV y 3 días más de PR. La recuperación del paciente fue completa sin secuela neurológica ni oftálmica alguna.
Paciente 2. Mujer nacida en 1943, transfundida a los 28 años por complicaciones obstétricas. HCC genotipo 1 conocida desde el año 2001. Valorada para tratamiento antiviral triple con TPV en octubre de 2012, el ARN-VHC basal fue de 1.530.000ui/ml, la elastografía fue informada de 35,3kPa (F4) y de polimorfismo CT del gen IL28B.
Entre la séptima y octava semanas de tratamiento la paciente desarrolló ulceraciones bucales profundas seguidas, una semana más tarde, de febrícula y tumefacción caliente y dolorosa de la parótida izquierda y signos flogóticos de la piel laterocervical, supraclavicular y hombro izquierdos, junto a grave alteración del estado general, taquicardia y disminución del nivel de conciencia. La paciente fue hospitalizada y diagnosticada de parotiditis y celulitis sépticas, iniciándose hidratación parenteral y tratamiento antibiótico i.v. y suspendiéndose el tratamiento antiviral. Aunque el estado general de la paciente y los signos flogóticos de parótida y piel mejoraron, en los 2 días siguientes apareció importante disnea, derrame pleural subpulmonar bilateral, ascitis y edemas, coincidiendo con Hb 6,7g/dl, hematocrito 21%, albúmina sérica de 2g/dl, urea y creatinina sérica normales y niveles séricos de haptoglobina indetectables. El derrame pleural y la ascitis fueron trasudados.
La paciente fue tratada con furosemida, espironolactona y suplementos nutricionales orales; requirió así mismo 800ml de albúmina humana 20% i.v., 4 unidades de concentrado de hematíes y 40.000u/semana de eritropoyetina durante 6 semanas. La hemoglobina no se normalizó (12,7g/dl) y la haptoglobina no alcanzó valores aceptables (70mg/dl) hasta las 8 y 12 semanas del inicio de la complicación, respectivamente. La recuperación de la paciente fue completa.
Paciente 3. Varón nacido en 1980, diagnosticado de tetralogía de Fallot con transposición de grandes vasos, fue intervenido quirúrgicamente a los 3 meses de vida, siendo transfundido. Diagnosticado de HCC en enero de 2011, mostró tener un genotipo viral 1, elastografía de 12kPa (F3), polimorfismo CT del gen IL28B y ARN-VHC basal de 1.530.000ui/ml, iniciando tratamiento triple con TPV en enero del 2013.
En la semana sexta de tratamiento antiviral el paciente desarrolló prurito intenso y una erupción cutánea leve macular, sin defectos epidérmicos ni vesículas, que afectó al tórax y la región cervical. Fue tratado con antihistamínicos y beclometasona oral (10mg/día) el resto del tratamiento antiviral. A las 11 semanas y 3 días del inicio del tratamiento triple, la erupción cutánea había empeorado a pesar de seguir el tratamiento, afectando alrededor del 80 por ciento de la superficie corporal. Por ello se decidió suspender el TPV y mantener el PR y la beclometasona. A las 13 semanas y 3 días del inicio del tratamiento la erupción se había extendido a la totalidad de la superficie corporal, momento en el que se consideró que el paciente presentaba una toxicodermia grado III progresiva y refractaria a los esteroides, suspendiéndose el tratamiento con PR. Una vez suspendidos estos agentes la recuperación de la toxicodermia fue rápida, completándose en el plazo de 12 días.
Paciente 4. Mujer nacida el año 1950, diagnosticada de HCC en un control analítico el año 1997. Genotipo 1, fue tratada con PR en los años 2004 y 2009, el primero interrumpido por respuesta nula y el segundo por leucopenia grave. Valorada para tratamiento triple a finales del 2011, el ARN- VHC basal fue de 1.940.000ui/ml, el polimorfismo del gen IL28B CT y la elastografía informada de 14,8kPa (F4).
Inició tratamiento triple con TPV en enero de 2012 y, tras haber ingerido 14 comprimidos de TPV (tercer día de tratamiento), desarrolló un intenso prurito y una erupción macular de más del 80 por ciento de la superficie corporal. Valorada por el servicio de dermatología, se diagnosticó de toxicodermia grado III, indicándose la suspensión del tratamiento antiviral. Fue tratada con triamcinolona por vía tópica e hidroxicina v.o. 25mg/8 horas, mejorando de forma lenta hasta la total resolución de la erupción en el plazo de 14 días. Una determinación de carga viral 24 semanas más tarde fue de 920.000ui/ml.
DiscusiónLos pacientes 1-3 confirman la posibilidad de alcanzar la RVS en pacientes con fibrosis avanzada a pesar de la suspensión muy precoz del tratamiento por EAG. Aunque un conjunto de factores podían hacer previsible el fracaso del mismo (interrupción precoz, haplotipos no-CC del gen IL28B, cargas virales basales superiores a 800.000ui/ml y ser portadores de fibrosis hepáticas avanzadas) la revisión de la bibliografía permite hacer otras consideraciones relevantes.
En primer lugar, es evidente que los pacientes 1-3 han estado tratados un tiempo, entre 9-12 semanas, que resultó suficiente para alcanzar la RVS. Ya el estudio ADVANCE4 había incluido pacientes tratados con TPV durante 8 semanas que tuvieron una tasa de RVS del 69 por ciento. La información existente en los estudios de fase II y III acerca de la evolución de los pacientes que abandonaron de forma precoz es muy escasa. El estudio PROVE-22 (fase II, pacientes naíf, no cirróticos) refiere que 3 de los 10 pacientes del brazo TPV12PR12 que interrumpieron el tratamiento prematuramente alcanzaron RVS. El estudio PROVE-33 (fase II, pacientes tratados previamente, 18 por ciento de cirróticos, brazos TPV12PR24/48) informó que 14 de los 56 pacientes (25 por ciento) que habían abandonado prematuramente por causas diferentes a reglas de parada habían alcanzado RVS. El estudio ILLUMINATE6 (fase III, pacientes naíf, 28 por ciento de pacientes F3-F4) comunicó una tasa de RVS del 23 por ciento en un grupo de 100 pacientes que habían suspendido la medicación precozmente, 88 de ellos antes de la semana 12. Finalmente, el estudio CONCISE7 (fase III, pacientes naíf o recidivantes, F0-F3, IL28B-CC) alcanzaron RVS 4 de los 8 pacientes del brazo TPV2PR24 que habían abandonado entre las semanas 12 y 14. Así pues, varios estudios de registro del TPV han informado de tasas de RVS entre el 23-50 por ciento entre los pacientes que interrumpieron el tratamiento de forma precoz. Sin embargo ninguno de ellos ha comunicado el perfil de dichos pacientes y las duraciones de sus tratamientos en relación con el resultado final del mismo.
En segundo lugar, los pacientes 1-3 pertenecen a grupos predictivos de buena respuesta con base al tratamiento previo. Tanto en el estudio REALIZE5, en pacientes tratados previamente, como en subanálisis posteriores del mismo, se ha confirmado que ser recidivante a un tratamiento previo anula la influencia negativa sobre la RVS del tener fibrosis avanzada/cirrosis8 y que el patrón de respuesta a un tratamiento previo limita el valor predictivo del genotipo del IL28B9.
El tercer factor a considerar es la rápida reducción de la carga viral que tuvieron los 3 pacientes. En este sentido, tener una respuesta viral rápida extendida (RVRe), ARN-VHC indetectable en semanas 4 y 12, fue el mejor factor predictivo de RVS en los estudios en fase III de TPV4–6,10. Estos mismos estudios constataron que el valor predictivo de la carga viral basal sobre la RVS desaparece en los brazos tratados con TPV4,5, especialmente en presencia de RVRe6.
En resumen, nuestra experiencia, no comentada específicamente en los estudios de registro, confirma que algunos pacientes con fibrosis avanzada o cirrosis pueden alcanzar la RVS a pesar de suspender el tratamiento triple con TPV de forma precoz por EAG. Tanto nuestra experiencia como la muy escasa información existente en los estudios de registro parecen indicar que la duración del tratamiento triple alrededor de 8 semanas, ser recidivante o naíf a tratamientos previos y conseguir una reducción muy rápida de la carga viral en la semana 4 podrían ser criterios necesarios para conseguirlo. Esta información no debe entenderse, en modo alguno, como una recomendación para reducir las pautas de tratamiento triple con TPV pero puede tenerse presente en la toma de decisiones terapéuticas o pronósticas en algunos pacientes así tratados.