Evaluar la efectividad del tratamiento del carcinoma hepatocelular (CHC) previo al trasplante hepático (TH) y su influencia sobre la supervivencia y recurrencia tumoral en pacientes trasplantados con CHC.
Pacientes y métodosSe incluyeron 67 pacientes trasplantados con diagnóstico preoperatorio de CHC y confirmación en el explante entre enero del año 2000 y octubre del año 2007. Se realizó tratamiento pretrasplante en 46 pacientes (68,7%) (18 radiofrecuencia, 31 quimioembolización transarterial y 2 alcoholización).
ResultadosLa mediana de tiempo entre la inclusión en lista y el TH fue de 4 meses, y fue similar en pacientes tratados y no tratados. El tiempo entre la realización del tratamiento y el TH fue menor de 6 meses en el 65,2%. Los pacientes tratados presentaban mejor función hepática (Child A: el 52,2 vs. el 19%; Child B: el 39,1 vs. el 33,3%; Child C: el 8,7 vs. el 47,6%; p=0,001) y una mayor proporción de tamaño tumoral total >3cm (59,1 vs. 30%; p=0,031). Se confirmó necrosis total del CHC en el 26,1% de los pacientes sin diferencias en el grado de necrosis según el tipo de tratamiento o tamaño tumoral. En 6 pacientes (9%) se produjo recurrencia del CHC. La mediana de tiempo entre el TH y la recurrencia fue de 26,5 meses con una supervivencia tras ésta de 6,6 meses. La supervivencia global fue del 83,5, el 69,9 y el 59,5% y la supervivencia libre de recurrencia tumoral fue del 83,5, el 68,3 y el 58% a 1, 3 y 5 años, respectivamente. El haber recibido tratamiento previo no influyó en la probabilidad de recurrencia o en la supervivencia. Asimismo, el grado de necrosis tampoco se relacionó con la supervivencia o la frecuencia de recurrencia.
ConclusiónLa realización de tratamiento del CHC previo al TH en pacientes con un período en lista de espera menor de 6 meses no parece influir en la supervivencia o en la prevención de la recurrencia tumoral postrasplante.
To evaluate the effectiveness of treatment of hepatocellular carcinoma (HCC) before liver transplantation (LT) and its influence on survival and tumor recurrence in patients transplanted for HCC.
Patients and methodsWe included 67 liver transplant patients with a preoperative diagnosis of HCC and pathological confirmation in the native liver between January 2000 and October 2007. Treatment before LT was performed in 46 (68.7%) patients [radiofrequency ablation in 18, transarterial chemoembolization in 31 and percutaneous ethanol injection in two].
ResultsThe median time between inclusion on the waiting list and LT was 4 months and was similar in treated and untreated patients. The median time between pre-transplantation locoregional therapy and LT was less than 6 months in 65.2% of the patients. Treated patients had better liver function (Child A 52.2 vs 19%; Child B 39.1 vs 33.3%; Child C 8.7 vs. 47.6%; p=0.001) and a higher proportion of total tumor size >3cm (59.1% vs 30%; p=0.031). Total tumor necrosis was observed in 26.1% of the patients, with no differences according to treatment modality or tumor size. Tumor recurrence occurred in six patients (9%). The median time between LT and tumor recurrence was 26.5 months with a subsequent median survival of 6.6 months. Overall survival was 83.5%, 69.9% and 59.5%, and tumor recurrence-free survival was 83.5%, 68.3% and 58% at 1, 3 and 5 years, respectively. Previous HCC treatment showed no influence on survival or tumor recurrence. Likewise, the grade of tumor necrosis was unrelated to overall survival or the probability of recurrence.
ConclusionTreatment of HCC before LT in patients with a waiting list time of less than 6 months does not appear to influence survival or tumor recurrence.
El carcinoma hepatocelular (CHC) es el sexto tumor en frecuencia en todo el mundo y la tercera causa de muerte relacionada con cáncer1,2. En la actualidad el trasplante hepático (TH) se considera como el tratamiento curativo por excelencia, puesto que resuelve simultáneamente la enfermedad tumoral y la cirrosis hepática, su enfermedad premaligna de base. Estudios recientes demuestran que el TH en pacientes seleccionados consigue supervivencias libres de enfermedad tumoral de hasta un 70% a los 5 años3,4, por lo que el CHC constituye hoy en día una de las indicaciones más frecuentes del TH en nuestro país5.
Sin embargo, la creciente demanda de órganos para TH no se ha visto acompañada de un incremento similar en la oferta, lo que ha motivado un incremento del tiempo en lista de espera y como consecuencia un incremento del riesgo de progresión y de exclusión3,6,7. Un problema añadido es el incremento del tamaño tumoral y el mayor riesgo de invasión microvascular y de satelitosis, factores de recurrencia tumoral tras el TH8, lo que puede influir en la probabilidad de recurrencia tumoral y en la supervivencia tras el TH.
Este hecho ha motivado que en muchos centros se considere la realización de tratamientos locorregionales como la radiofrecuencia (RF) o la inyección de etanol (IPE), o bien tratamientos endoluminales como la quimioembolización transarterial (TACE), para controlar el crecimiento del tumor previo a su inclusión o durante el tiempo de espera hasta el TH.
El interrogante es si la aplicación de estos tratamientos puede frenar la progresión tumoral, reducir la tasa de exclusión de lista y la recurrencia tumoral después del TH e incrementar la supervivencia. La información disponible es, sin embargo, escasa y equívoca, y no existe hasta el momento ningún estudio prospectivo aleatorizado que haya evaluado la eficacia del tratamiento locorregional en el aumento de la eficacia del trasplante en esta indicación.
Los objetivos del estudio fueron evaluar el grado de respuesta al tratamiento locorregional pretrasplante, así como su influencia en la recurrencia del hepatocarcinoma y la supervivencia del paciente.
Pacientes y métodosPacientes del estudioEntre enero del año 2000 y octubre del año 2007 en el Hospital General Universitario Gregorio Marañón de Madrid se trasplantaron 346 pacientes. Se realizó un análisis retrospectivo de sus historiales clínicos para detectar aquéllos con diagnóstico preoperatorio de CHC, fuera o no la causa principal que motivó el TH. Para esto se revisó una base de datos asistencial actualizada, con inclusión prospectiva de los pacientes evaluados para TH. Todos los pacientes aceptados como candidatos a la realización de TH cumplían los criterios de Milán4 en el momento de su inclusión en lista.
De los 346 pacientes trasplantados durante este período, 73 (21,1%) se trasplantaron con diagnóstico preoperatorio de CHC. En 6 de éstos (8,2%) no se demostró tumor en el explante (falsos positivos radiológicos), ya que correspondían a nódulos displásicos y de regeneración, por lo que el análisis final se efectuó sobre 67 pacientes. Los pacientes incluidos en la lista se priorizaron con arreglo a su puntuación MELD (Model for End Stage Liver Disease) o por la presencia de CHC multifocal o con nódulo único superior a 3cm.
Se realizó un análisis histológico detallado de la pieza de hepatectomía y se describieron todos los nódulos encontrados. Aquellos pacientes con carcinoma hepatocelular fibrolamelar fueron excluidos.
Características basales, criterios diagnósticos de hepatocarcinoma y estadificación pretrasplanteSe recogieron las características basales de los pacientes incluidos en el estudio: datos demográficos, etiología de la hepatopatía, datos analíticos de función hepática y valor de alfafetoproteína (AFP). La gravedad de la enfermedad hepática se evaluó mediante la clasificación de Child-Pugh y la puntuación MELD. Se confirmó la existencia de cirrosis hepática por criterios histológicos o una combinación de criterios clínicos, analíticos y de pruebas de imagen. Posteriormente, estos datos fueron confirmados con el análisis histológico de la pieza de hepatectomía.
El diagnóstico de CHC se estableció de acuerdo con los criterios de diagnóstico no invasivo de la American Association of Study of Liver Diseases9. Se realizó biopsia o punción con aguja fina de la lesión, cuando el comportamiento de ésta no fuera característico o bien porque por su tamaño no fuera posible el diagnóstico de seguridad con las pruebas de imagen. Se descartó la presencia de metástasis mediante la realización de tomografía axial computarizada (TAC) torácica a todos los pacientes y mediante la realización de gammagrafía ósea cuando existía sospecha de metástasis óseas.
Para la estadificación del CHC previo al TH se utilizó la clasificación Barcelona Clinic Liver Cancer10. Las características del CHC se establecieron de acuerdo con la última prueba de imagen dinámica realizada antes del TH (TAC o resonancia magnética): número de nódulos, tamaño de éstos y del nódulo mayor, localización y afectación vascular o adenopática.
Tratamiento del hepatocarcinoma antes del trasplante hepáticoDe los 67 pacientes incluidos en la cohorte final del estudio, 46 pacientes (68,7%) recibieron tratamiento de CHC previo al TH. El tratamiento se aplicó una vez incluido el paciente en la lista activa o previo a su inclusión, por causas diversas: un 12,5% aproximadamente fue por haberse realizado downstaging del CHC, que cumplía posteriormente los criterios de Milán para poder incluirse en la lista. El 25% recibió inicialmente el tratamiento con intención curativa y posterior pobre respuesta que conllevó la decisión de TH. Finalmente, el resto de los pacientes aceptados para TH recibió el tratamiento inmediatamente antes de la inclusión.
Su objetivo era tratar aquellos pacientes que presentaban una extensión tumoral con mayor riesgo de progresión antes del TH. Para su indicación no existe un protocolo de actuación rígido, sino que la necesidad del tratamiento y la modalidad terapéutica se decidió individualmente tras valoración en un comité multidisciplinario formado por hepatólogos, radiólogos y cirujanos. Los tratamientos que se realizaron fueron RF percutánea, TACE selectiva con inyección de adriamicina y lipiodol e IPE. El resto de los pacientes no recibieron tratamiento, bien por presentar tumores de pequeño tamaño con estimación de baja probabilidad de progresión que permitiera la exclusión de lista activa, bien por dificultad técnica o bien por tener una enfermedad hepática muy evolucionada con riesgo de descompensación de ésta tras el tratamiento.
La eficacia del tratamiento se evaluó tras 6 semanas de su aplicación mediante TAC o resonancia magnética con contraste intravenoso, siempre que el paciente no fuera trasplantado antes de este tiempo. De acuerdo con Sala et al11, se definió como respuesta completa a la ausencia de realce vascular tumoral en el área tratada, como expresión de necrosis tumoral completa. La ausencia de respuesta completa fue considerada como fallo del tratamiento.
Análisis histológicoTras la cirugía, el mismo patólogo (IP) analizó todos los explantes. Tras el estudio de la superficie externa de la pieza de hepatectomía se realizaron secciones de la pieza de 10mm de grosor y se hizo un análisis macroscópico de los nódulos observados: número de nódulos, diámetro máximo de éstos y del nódulo mayor, localización, grado de necrosis, satelitosis e invasión vascular macroscópica.
Se tomaron muestras de todos los nódulos así como del tejido peritumoral y a distancia, y se fijaron en parafina y se tiñeron con hematoxilina-eosina. El grado de diferenciación tumoral (bien diferenciado, moderado grado de diferenciación y pobremente diferenciado) se definió de acuerdo con la clasificación de Edmondson12 y se describió la presencia de invasión microvascular y adenopática. En aquellos nódulos con diferenciación heterogénea se consideró la de peor grado para el análisis estadístico.
Los nódulos satélites se definieron como aquellos sin evidencia de invasión linfovascular, de tamaño inferior a 1cm y localizados a menos de 1cm del nódulo primario. Se consideró la existencia de invasión vascular macroscópica cuando había afectación grosera de las ramas lobulares o segmentarias de la vena porta o de las venas suprahepáticas. La invasión vascular microscópica se definió como la presencia de émbolos tumorales en las vénulas intrahepáticas. Se definió la viabilidad tumoral como la presencia de células neoplásicas con mantenimiento de la arquitectura nuclear y citoplásmica, al contrario que la necrosis tumoral en la que se perdían las características morfológicas. La necrosis completa en los nódulos tratados consistió en la ausencia total de viabilidad tumoral y la necrosis parcial en la existencia de tejido tumoral viable en mayor o menor porcentaje.
Seguimiento postrasplanteTodos los pacientes recibieron de inicio un régimen inmunosupresor doble (anticalcineurínico más esteroides). Se realizó un seguimiento estándar en el postrasplante inmediato con controles clínicos, analíticos y radiológicos, según el tiempo transcurrido desde el TH y la situación clínica. A partir del sexto mes, los pacientes se siguieron en consulta mediante la realización de una ecografía abdominal cada 6 meses y determinación analítica trimestral con AFP para la detección de recurrencia tumoral, durante los 2 primeros años. Posteriormente, se realizaron las pruebas de imagen según la sospecha clínica o analítica.
El seguimiento de los pacientes se realizó desde el momento del TH hasta su muerte o hasta el final del período de seguimiento establecido (mayo de 2008).
Análisis estadísticoLas variables cuantitativas se expresaron como media (DE) o como mediana (rango) en función de la distribución de la variable; las variables cualitativas se expresaron como porcentajes. La comparación entre grupos se realizó mediante el test de la t de Student o de la U de Mann-Whitney en el caso de las variables cuantitativas, y el test de la χ2 o el test de Fisher en las variables cualitativas. Los tiempos de seguimiento y supervivencia se expresaron como mediana (rango). La influencia del tratamiento sobre la recurrencia tumoral y la supervivencia se analizó mediante curvas de Kaplan-Meier y su comparación con el test de log-rank. Por otro lado, se obtuvieron por análisis de Cox univariado las variables asociadas con recurrencia tumoral. Se consideró significación estadística cuando p<0,05. Para el análisis de los datos se utilizó el paquete informático SPSS versión 14.0 (SPSS® 14.0; SPSS Inc., Chicago, Illinois, EE. UU.).
ResultadosCaracterísticas basales y tratamiento realizadoLa edad media de la cohorte en estudio fue de 58±7,1 años; el 82% de los pacientes eran hombres. La etiología más frecuente de la hepatopatía fue la infección crónica por el virus de la hepatitis C en el 41,8% de los pacientes. El 41,8% de los pacientes fueron Child-Pugh A y el 58,2% fueron Child-Pugh B-C. La mediana de la puntuación MELD fue de 13 puntos (7–27).
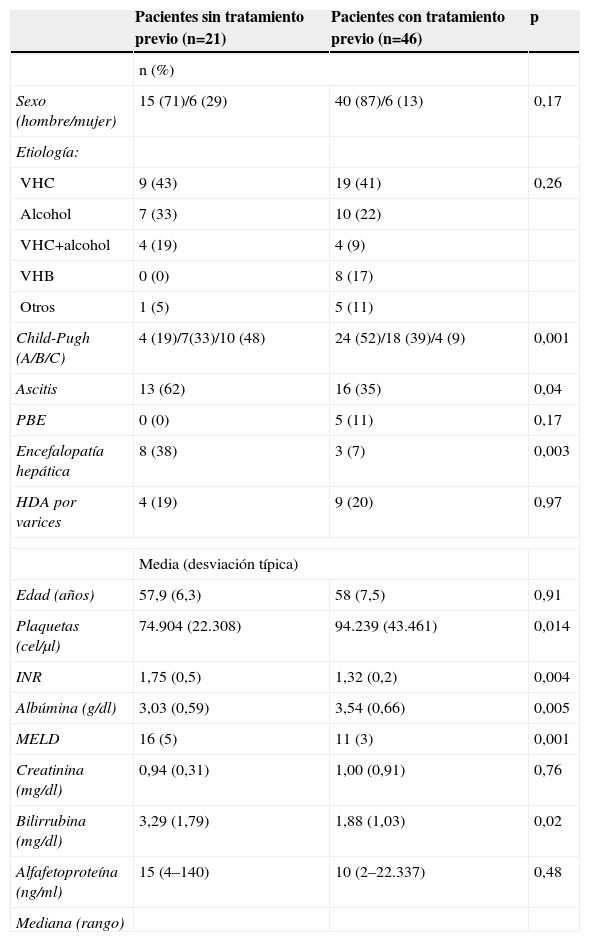
Las características basales de los pacientes según hubieran recibido o no tratamiento pretrasplante se muestran en la tabla 1.
Comparación de variables epidemiológicas y clínicas entre pacientes tratados y no tratados
| Pacientes sin tratamiento previo (n=21) | Pacientes con tratamiento previo (n=46) | p | |
| n (%) | |||
| Sexo (hombre/mujer) | 15 (71)/6 (29) | 40 (87)/6 (13) | 0,17 |
| Etiología: | |||
| VHC | 9 (43) | 19 (41) | 0,26 |
| Alcohol | 7 (33) | 10 (22) | |
| VHC+alcohol | 4 (19) | 4 (9) | |
| VHB | 0 (0) | 8 (17) | |
| Otros | 1 (5) | 5 (11) | |
| Child-Pugh (A/B/C) | 4 (19)/7(33)/10 (48) | 24 (52)/18 (39)/4 (9) | 0,001 |
| Ascitis | 13 (62) | 16 (35) | 0,04 |
| PBE | 0 (0) | 5 (11) | 0,17 |
| Encefalopatía hepática | 8 (38) | 3 (7) | 0,003 |
| HDA por varices | 4 (19) | 9 (20) | 0,97 |
| Media (desviación típica) | |||
| Edad (años) | 57,9 (6,3) | 58 (7,5) | 0,91 |
| Plaquetas (cel/μl) | 74.904 (22.308) | 94.239 (43.461) | 0,014 |
| INR | 1,75 (0,5) | 1,32 (0,2) | 0,004 |
| Albúmina (g/dl) | 3,03 (0,59) | 3,54 (0,66) | 0,005 |
| MELD | 16 (5) | 11 (3) | 0,001 |
| Creatinina (mg/dl) | 0,94 (0,31) | 1,00 (0,91) | 0,76 |
| Bilirrubina (mg/dl) | 3,29 (1,79) | 1,88 (1,03) | 0,02 |
| Alfafetoproteína (ng/ml) | 15 (4–140) | 10 (2–22.337) | 0,48 |
| Mediana (rango) | |||
HDA: hemorragia digestiva alta; INR: Internacional Normalized Ratio; MELD: Model for End Stage Liver Disease; PBE: peritonitis bacteriana espontánea; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C.
De los 67 pacientes incluidos en el estudio, 46 (68,7%) recibieron tratamiento previo al trasplante. Trece pacientes (28,3%) recibieron ablación por RF, 27 pacientes (58,7%) recibieron TACE y un paciente (2,2%) recibió IPE. Cinco pacientes recibieron tratamiento combinado: 4 (8,7%) con RF+TACE y uno (2,2%) con RF+IPE. Cinco pacientes de los tratados con RF y 6 pacientes de los tratados con TACE recibieron más de una sesión.
El 51,2% de los pacientes recibieron el tratamiento tras incluirse en la lista, mientras que el 48,8% restante fue tratado antes de su inclusión. La mediana de tiempo entre la realización de la última sesión de tratamiento y el TH fue de 5 meses, y menor de 6 meses en el 65,2% de los pacientes; no se encontraron diferencias entre los tratados con TACE o con RF.
La mediana de tiempo entre la inclusión en la lista y el TH fue de 4 meses (0,5–15) y fue similar en pacientes tratados (5 meses [0,5–15]) y en pacientes no tratados (3 meses [0,5–12]) (p=0,36). El 67,7% de los pacientes no permaneció en la lista de espera más de 6 meses, si bien la mediana de tiempo entre el diagnóstico de CHC y TH fue significativamente mayor en los pacientes que recibieron tratamiento (11,5 [1–43] vs. 7 [1–22] meses; p=0,0001).
Características del hepatocarcinoma en el análisis del explanteEn 3 pacientes no se pudo recuperar la pieza de hepatectomía para su análisis histológico para el presente estudio, por lo que se procesaron los explantes de 64 pacientes. Se demostraron 82 nódulos tumorales en los 64 pacientes. Nueve pacientes (14,1%) presentaban satelitosis adyacente al tumor primario (6 tratados [13,6%] vs. 3 no tratados [15%]; p=0,88). Cuarenta y tres pacientes tenían una lesión única y 21 pacientes tenían tumores multinodulares.
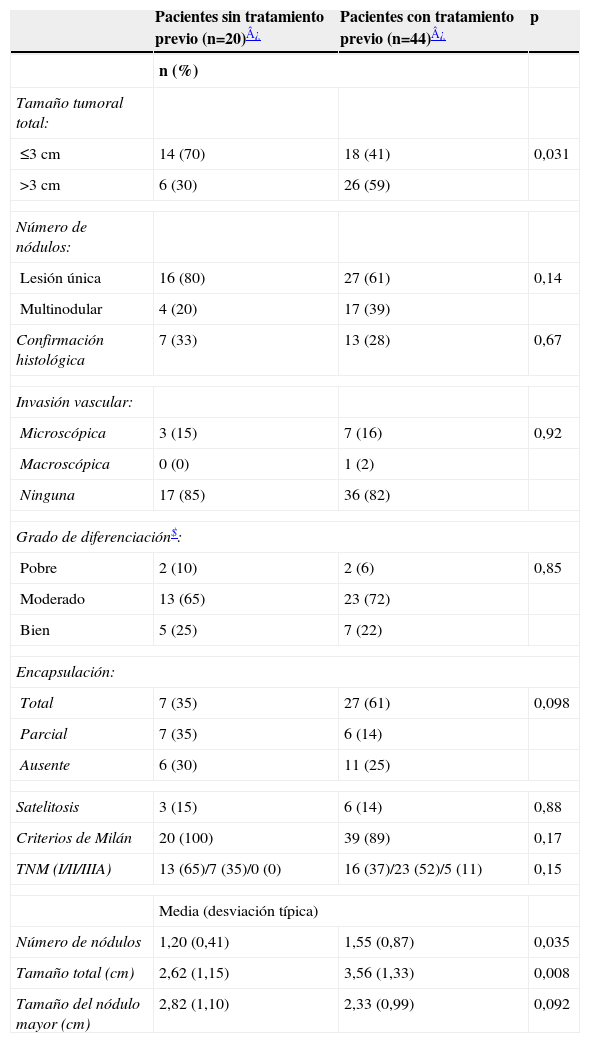
Los pacientes tratados presentaban un mayor tamaño tumoral total medio, una mayor proporción de tamaño tumoral total superior a 3 cm y una media de nódulos en el explante mayor que los pacientes no tratados (tabla 2). En un paciente se descubrió una afectación vascular macroscópica, y había recibido previamente tratamiento con TACE. Cinco pacientes no cumplieron los criterios de Milán en el explante aunque 4 de éstos sí cumplieron los criterios expandidos de la Universidad de California-San Francisco13.
Comparación de variables histológicas y tumorales en el explante entre pacientes tratados y no tratados
| Pacientes sin tratamiento previo (n=20)¿ | Pacientes con tratamiento previo (n=44)¿ | p | |
| n (%) | |||
| Tamaño tumoral total: | |||
| ≤3cm | 14 (70) | 18 (41) | 0,031 |
| >3cm | 6 (30) | 26 (59) | |
| Número de nódulos: | |||
| Lesión única | 16 (80) | 27 (61) | 0,14 |
| Multinodular | 4 (20) | 17 (39) | |
| Confirmación histológica | 7 (33) | 13 (28) | 0,67 |
| Invasión vascular: | |||
| Microscópica | 3 (15) | 7 (16) | 0,92 |
| Macroscópica | 0 (0) | 1 (2) | |
| Ninguna | 17 (85) | 36 (82) | |
| Grado de diferenciación$: | |||
| Pobre | 2 (10) | 2 (6) | 0,85 |
| Moderado | 13 (65) | 23 (72) | |
| Bien | 5 (25) | 7 (22) | |
| Encapsulación: | |||
| Total | 7 (35) | 27 (61) | 0,098 |
| Parcial | 7 (35) | 6 (14) | |
| Ausente | 6 (30) | 11 (25) | |
| Satelitosis | 3 (15) | 6 (14) | 0,88 |
| Criterios de Milán | 20 (100) | 39 (89) | 0,17 |
| TNM (I/II/IIIA) | 13 (65)/7 (35)/0 (0) | 16 (37)/23 (52)/5 (11) | 0,15 |
| Media (desviación típica) | |||
| Número de nódulos | 1,20 (0,41) | 1,55 (0,87) | 0,035 |
| Tamaño total (cm) | 2,62 (1,15) | 3,56 (1,33) | 0,008 |
| Tamaño del nódulo mayor (cm) | 2,82 (1,10) | 2,33 (0,99) | 0,092 |
Treinta de los 46 pacientes tratados presentaron en el análisis del explante algún grado de necrosis de los nódulos tratados, que fue completa en 12 pacientes (26,1%) y parcial en 18 pacientes (39,1%). En el resto no se demostraron áreas de necrosis tumoral. En relación con el tipo de tratamiento empleado, se obtuvo necrosis completa en el 23,1% de los pacientes tratados con RF y en el 22,2% de los tratados con TACE. Respecto a los pacientes que recibieron tratamiento combinado, todos los que recibieron TACE+RF obtuvieron algún grado de necrosis (el 50% era completa y el 50% era incompleta) y el paciente tratado con RF+IPE obtuvo necrosis completa.
No se observó diferencia de las características histológicas de malignidad (número y tamaño tumoral, presencia de cápsula, satelitosis, invasión vascular o grado de diferenciación) entre los pacientes con necrosis completa y aquéllos con necrosis parcial o sin necrosis. Tampoco hubo asociación con las características basales o grado de función hepática de los pacientes tratados ni con la realización del tratamiento en lista de espera o con el tiempo transcurrido entre la terapéutica y el trasplante.
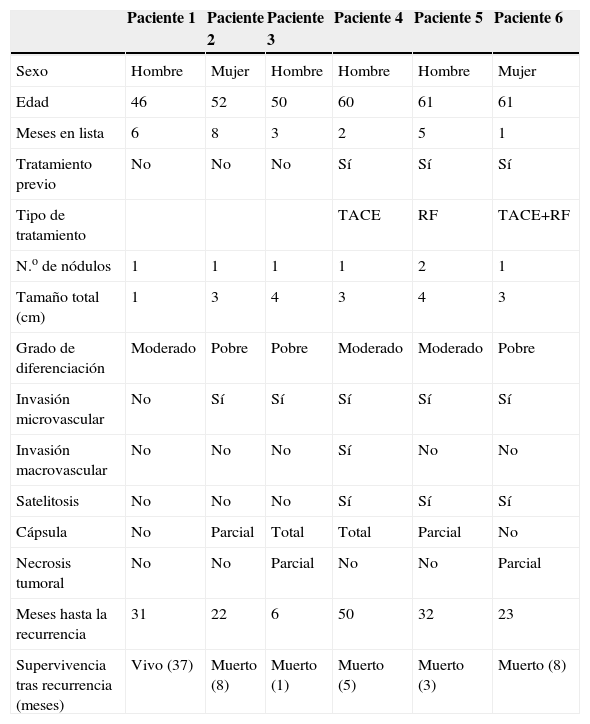
Recurrencia tumoral e influencia del tratamiento previo al THDe los 67 pacientes trasplantados por CHC, en 6 (9%) se produjo recurrencia tumoral. En la tabla 3 se muestran las características de estos pacientes. La recurrencia fue exclusivamente intrahepática en un paciente y metastásica en 5 pacientes. Tres pacientes habían recibido tratamiento previo al TH: un paciente con TACE, otro con RF y otro una combinación de TACE+RF. La mediana de tiempo entre el TH y la aparición de recurrencia fue de 26,5 meses (5–49), con una mediana de supervivencia tras ésta de 6,6 meses (1–37). Se hizo tratamiento con intención curativa tras la recurrencia en el único paciente con recurrencia intrahepática mediante resección quirúrgica y es el único paciente que permanece vivo en el seguimiento.
Características de los pacientes con recurrencia tumoral
| Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 | Paciente 5 | Paciente 6 | |
| Sexo | Hombre | Mujer | Hombre | Hombre | Hombre | Mujer |
| Edad | 46 | 52 | 50 | 60 | 61 | 61 |
| Meses en lista | 6 | 8 | 3 | 2 | 5 | 1 |
| Tratamiento previo | No | No | No | Sí | Sí | Sí |
| Tipo de tratamiento | TACE | RF | TACE+RF | |||
| N.o de nódulos | 1 | 1 | 1 | 1 | 2 | 1 |
| Tamaño total (cm) | 1 | 3 | 4 | 3 | 4 | 3 |
| Grado de diferenciación | Moderado | Pobre | Pobre | Moderado | Moderado | Pobre |
| Invasión microvascular | No | Sí | Sí | Sí | Sí | Sí |
| Invasión macrovascular | No | No | No | Sí | No | No |
| Satelitosis | No | No | No | Sí | Sí | Sí |
| Cápsula | No | Parcial | Total | Total | Parcial | No |
| Necrosis tumoral | No | No | Parcial | No | No | Parcial |
| Meses hasta la recurrencia | 31 | 22 | 6 | 50 | 32 | 23 |
| Supervivencia tras recurrencia (meses) | Vivo (37) | Muerto (8) | Muerto (1) | Muerto (5) | Muerto (3) | Muerto (8) |
RF: radiofrecuencia; TACE: quimioembolización transarterial.
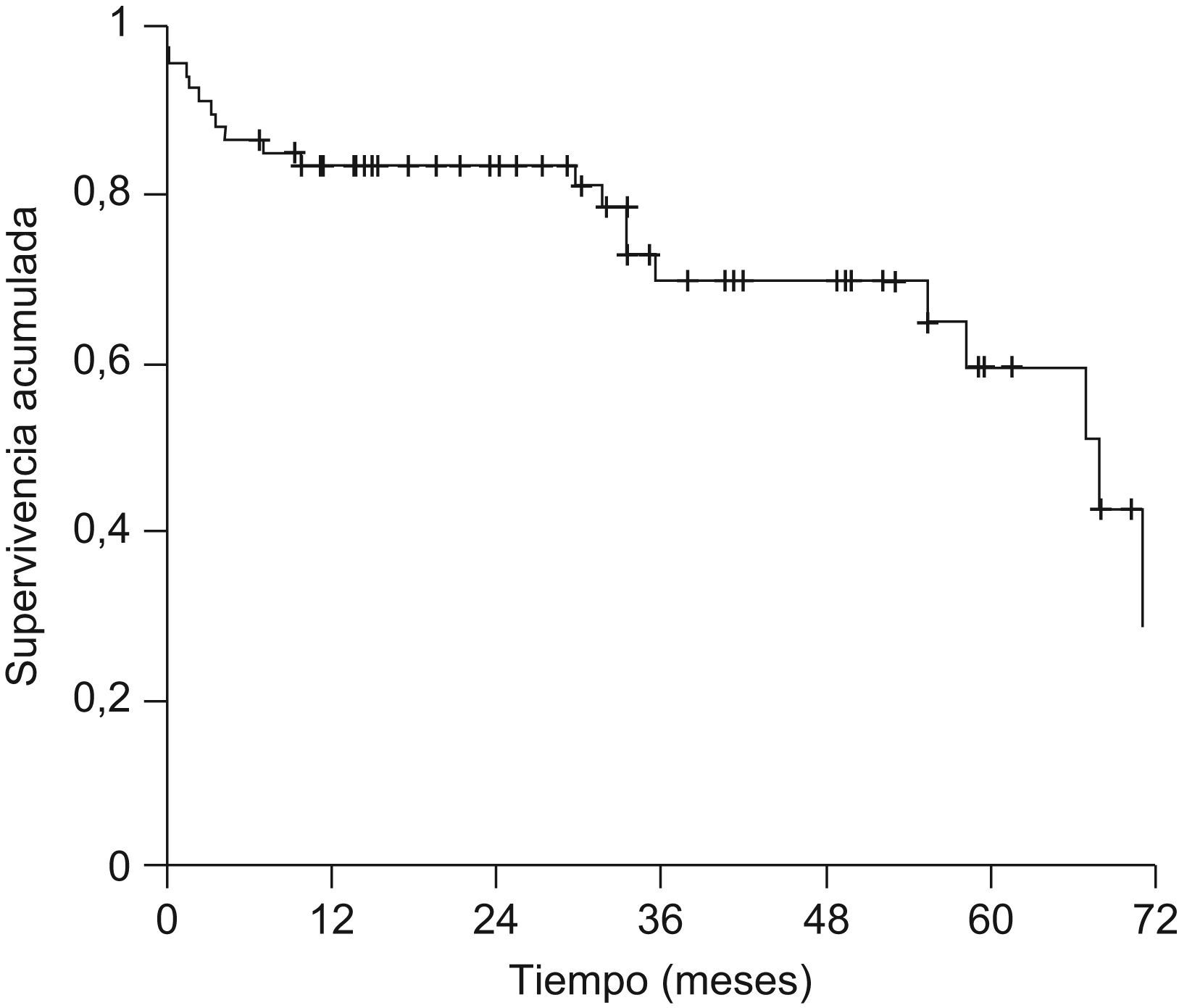
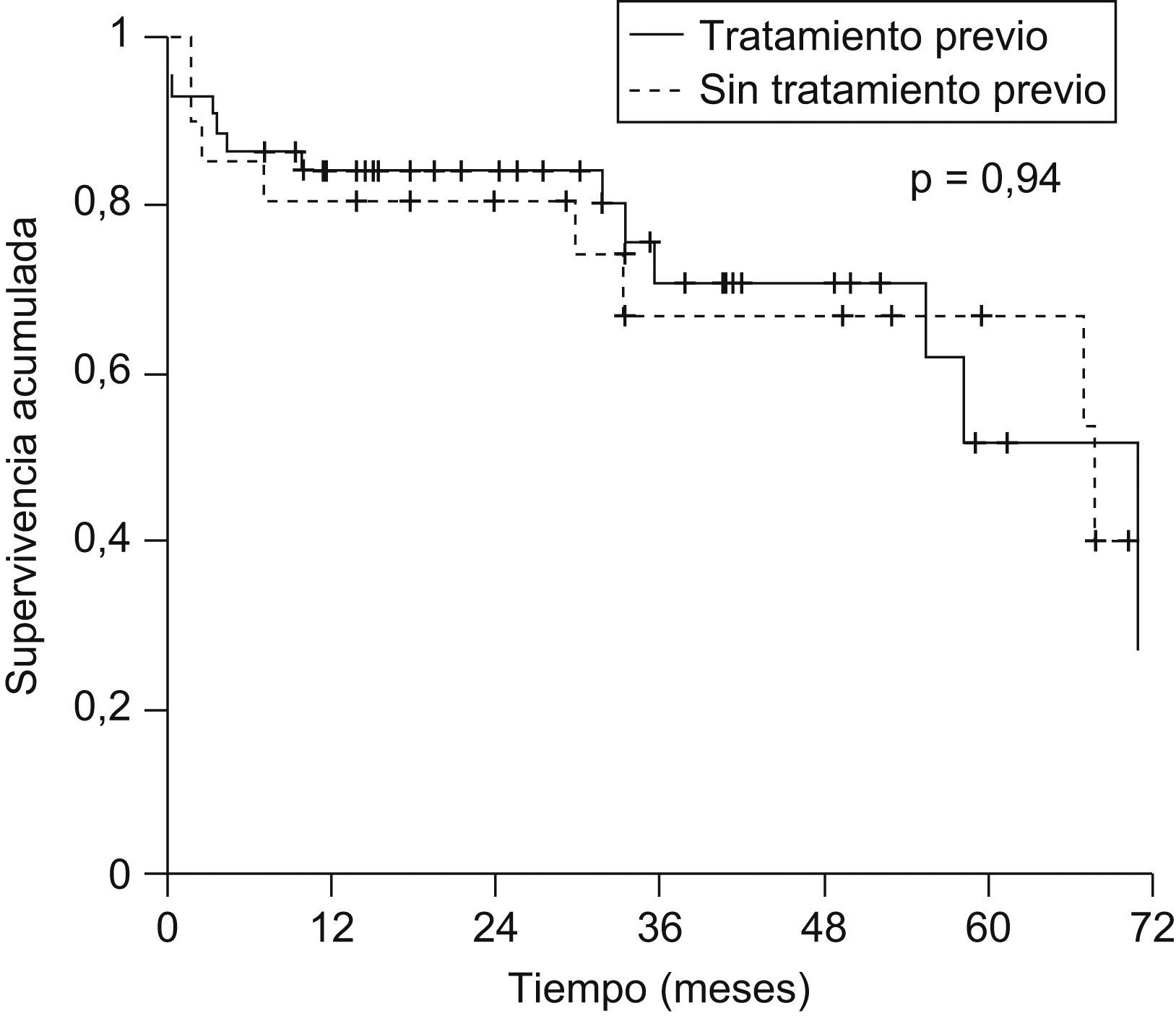
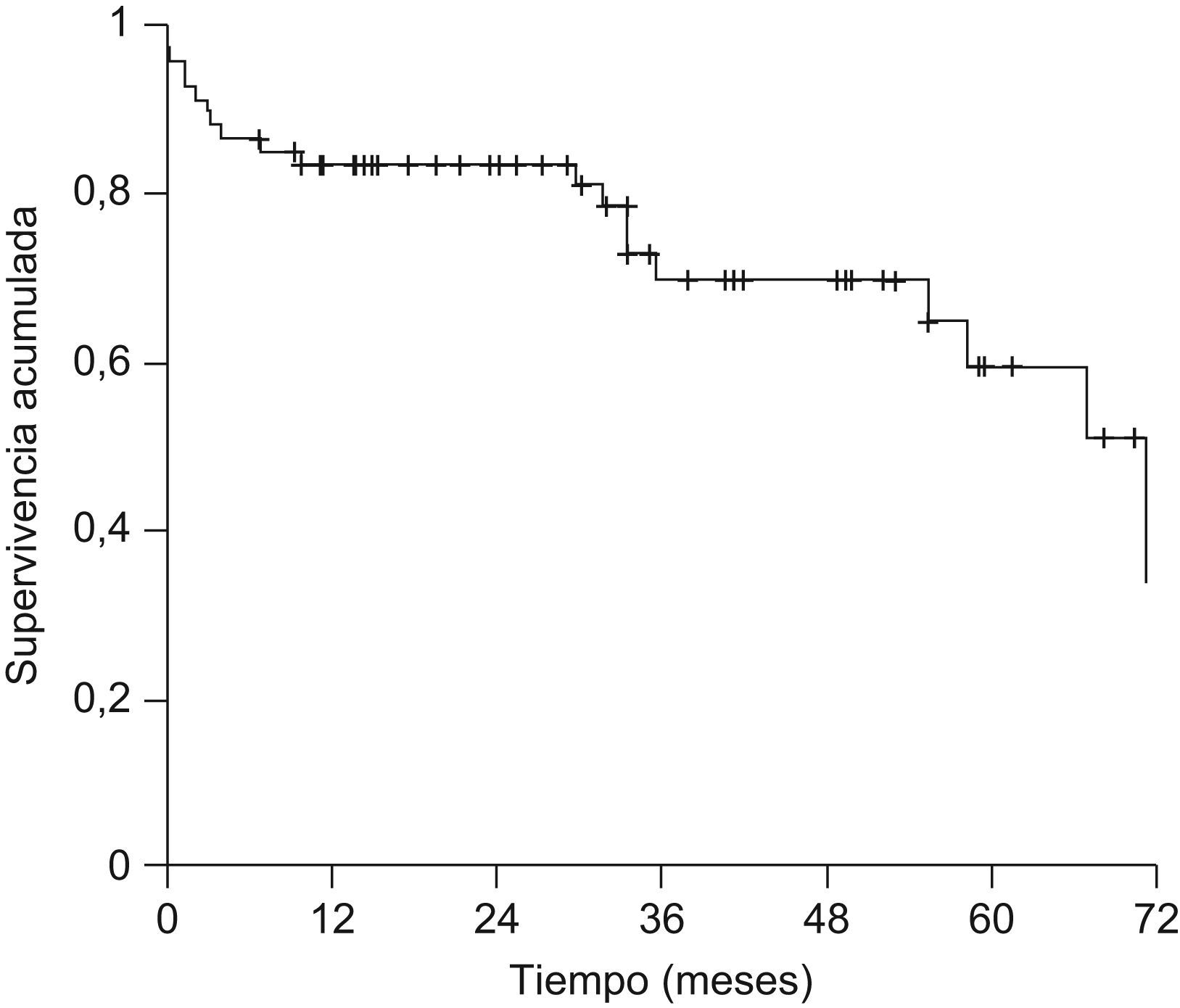
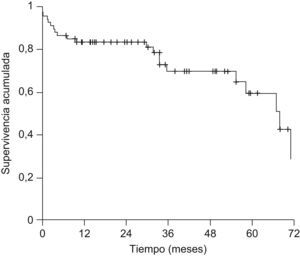
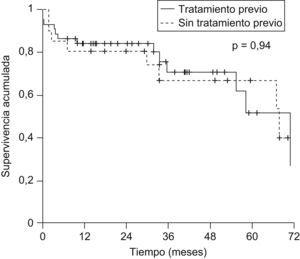
La probabilidad actuarial de recurrencia del CHC fue del 1,5, el 5,4, el 10,3 y el 14,4% a 1, 2, 3 y 5 años, respectivamente; la supervivencia libre de recurrencia tumoral fue del 83,5, el 68,3 y el 58% a 1, 3 y 5 años, respectivamente (fig. 1). La realización de tratamiento previo al TH no influyó en la recurrencia tumoral (hazard ratio [HR]: 0,59; IC 95%: 0,11–2,93; p=0,52) y no se observaron diferencias en la supervivencia libre de recurrencia a los 5 años entre ambos grupos (fig. 2). El grado de necrosis obtenido tras el tratamiento tampoco influyó en la recurrencia, así como tampoco la realización del tratamiento en lista o el tiempo transcurrido entre el tratamiento y el TH.
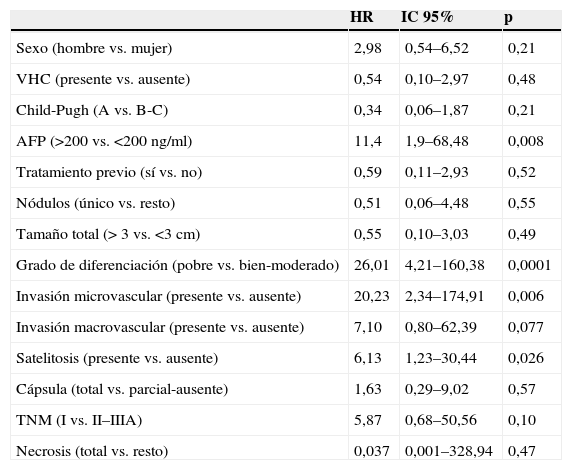
Se realizó un análisis univariado mediante regresión de Cox que demostró asociación con la recurrencia tumoral de un valor de AFP mayor de 200ng/ml, el pobre grado de diferenciación tumoral, la invasión microvascular y la presencia de satelitosis (tabla 4).
Análisis univariado de factores predictivos de recurrencia tumoral
| HR | IC 95% | p | |
| Sexo (hombre vs. mujer) | 2,98 | 0,54–6,52 | 0,21 |
| VHC (presente vs. ausente) | 0,54 | 0,10–2,97 | 0,48 |
| Child-Pugh (A vs. B-C) | 0,34 | 0,06–1,87 | 0,21 |
| AFP (>200 vs. <200 ng/ml) | 11,4 | 1,9–68,48 | 0,008 |
| Tratamiento previo (sí vs. no) | 0,59 | 0,11–2,93 | 0,52 |
| Nódulos (único vs. resto) | 0,51 | 0,06–4,48 | 0,55 |
| Tamaño total (> 3 vs. <3cm) | 0,55 | 0,10–3,03 | 0,49 |
| Grado de diferenciación (pobre vs. bien-moderado) | 26,01 | 4,21–160,38 | 0,0001 |
| Invasión microvascular (presente vs. ausente) | 20,23 | 2,34–174,91 | 0,006 |
| Invasión macrovascular (presente vs. ausente) | 7,10 | 0,80–62,39 | 0,077 |
| Satelitosis (presente vs. ausente) | 6,13 | 1,23–30,44 | 0,026 |
| Cápsula (total vs. parcial-ausente) | 1,63 | 0,29–9,02 | 0,57 |
| TNM (I vs. II–IIIA) | 5,87 | 0,68–50,56 | 0,10 |
| Necrosis (total vs. resto) | 0,037 | 0,001–328,94 | 0,47 |
AFP: alfafetoproteína; HR: hazard ratio; IC: intervalo de confianza; VHC: virus de la hepatitis C.
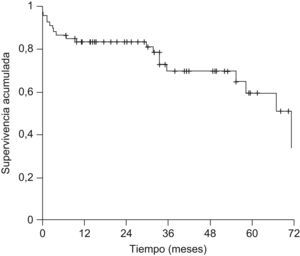
La mediana de seguimiento de la serie global fue de 29,6 meses (1–89). Veinte pacientes (29,9%) fallecieron durante el seguimiento. Las causas más frecuentes de muerte fueron la recurrencia del CHC y la sepsis con 5 pacientes (25%) cada una, recurrencia del virus de la hepatitis C con fallo hepático en 4 pacientes (20%) y complicaciones posquirúrgicas en 3 pacientes (15%). La supervivencia global de la serie fue del 83,5, el 69,9 y el 59,5% a 1, 3 y 5 años, respectivamente (fig. 3).
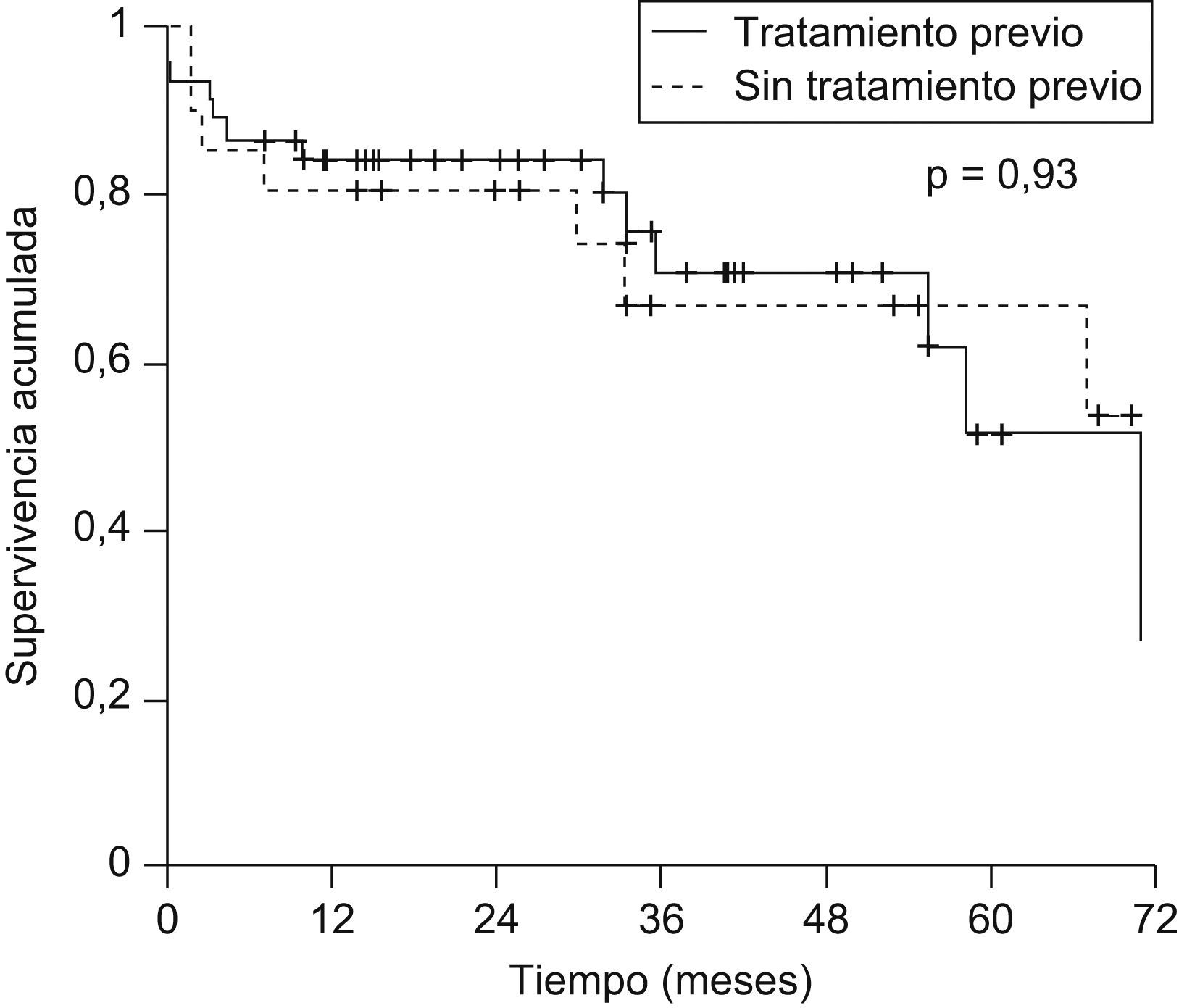
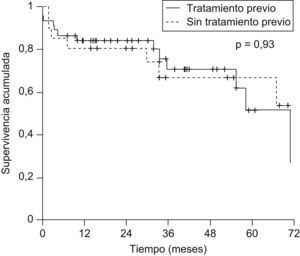
No se observó influencia de la realización de tratamiento pretrasplante del CHC en la supervivencia posterior (supervivencia a los 5 años: el 51,9 vs. el 67,3%; p=0,93) (fig. 4).
DiscusiónAunque la realización de tratamiento del CHC en la lista de espera es una medida habitual en las unidades de TH, es difícil valorar la eficacia de esta estrategia ya que los diferentes grupos de trabajo utilizan diferentes políticas de priorización, aplican diferentes pautas de tratamiento o vigilancia y tienen períodos de lista de espera variables. Diversos estudios han evaluado la influencia del tratamiento antes del TH, y sugieren un beneficio en cuanto al aumento de la supervivencia y reducción de la recurrencia, aunque la mayoría de éstos son estudios abiertos no controlados, el tratamiento más frecuentemente empleado fue la TACE. Así, el estudio retrospectivo de Veltri et al14 con controles históricos mostraba una mejor supervivencia en los pacientes tratados con TACE, pero sólo cuando se combinaba con IPE. Otros 5 estudios no controlados indicaban un cierto beneficio de la TACE realizada antes del TH15–19. En cambio, Ravaioli et al20 observaron cómo la obtención de necrosis parcial tras la TACE era una variable predictora de recurrencia tumoral tras el TH.
En el caso del tratamiento con RF los estudios son más escasos e igualmente no controlados ni aleatorizados, no presentan grupo control sin tratamiento, para comparar la efectividad de la técnica en cuanto a aumento de la supervivencia o en cuanto a disminuir la recurrencia tumoral21–23. Tan sólo hay 3 estudios en los que se compara un grupo tratado con uno control, la RF es uno de los tratamientos evaluados entre otros, aunque no se hicieron análisis por subgrupos de tratamiento para evaluar la respuesta a la RF individualmente. Uno de éstos no encontró diferencias entre ambos grupos de pacientes24 y otro observó un incremento de la supervivencia en el grupo de pacientes tratados, pero sólo en el caso de tumores avanzados (p=T2–T4)25.
En este sentido, en nuestro estudio no hemos observado diferencias en la supervivencia global o en la supervivencia libre de recurrencia tumoral, entre los pacientes tratados y no tratados. Estos datos coinciden con los obtenidos por otros autores24,26–28. Así, la supervivencia obtenida en nuestro estudio a los 5 años en los pacientes tratados y no tratados fue del 51,9 y el 67,3%, respectivamente, cifra similar a la obtenida en un estudio reciente por Decaens et al27 (59,4 vs. 59,3%), que evaluaba a pacientes tratados con TACE. En el caso de la supervivencia libre de recurrencia observamos a los 5 años un 53,4 vs. un 61,6% de pacientes sin recurrencia en los tratados y los no tratados respectivamente, comparable a lo publicado por Decaens et al27 (69,3 vs. 64,1%) o Majno et al29 (57 vs. 59%) aunque la frecuencia de recurrencia fue mayor (el 18% en el caso del primero y el 20,7% en el segundo). Otros autores, como Bharat et al25, han observado supervivencias mayores (83,7 vs. 75,9%).
Si bien estos estudios presentan un número de pacientes limitado, un reciente estudio publicado en forma de resumen evaluó a más de 2.000 pacientes en lista de espera de TH por CHC con objetivo de deteminar si la realización de TACE o RF pretrasplante incrementaba la supervivencia. Al igual que en el presente estudio, los pacientes tratados presentaban mejor situación funcional hepática (puntuaciones MELD y estadio de Child más bajos), mayor volumen tumoral y más tiempo en lista de espera hasta el TH. Llamativamente, el haber recibido tratamiento previo locorregional se asociaba de forma independiente con la supervivencia global30.
Respecto a la evaluación de la recurrencia tumoral, en nuestro trabajo obtuvimos una frecuencia de recurrencia del 9%. En los diferentes estudios evaluados, esta cifra varía considerablemente, desde el 422 hasta el 20,7%29. Por otro lado, el haber recibido tratamiento previo no influyó en la frecuencia de recurrencia tumoral, al igual que en lo observado en otros trabajos24,25,27,31.
Es importante tener en cuenta que los tratamientos locorregionales tienen una aplicabilidad limitada de acuerdo con la reserva funcional hepática del paciente. Así, en nuestro estudio los pacientes que recibieron tratamiento tenían un grado de Child-Pugh y una puntuación MELD significativamente menor que los pacientes que no se trataron, al igual que lo publicado por otros autores27,29,31. Este dato indicaría que los pacientes no tratados tendrían mayor riesgo de mortalidad precoz que los pacientes tratados. A pesar de todo, no hubo diferencias en la supervivencia global o precoz entre ambos grupos. Por otro lado, los pacientes tratados presentaban un mayor tamaño tumoral, aunque esta característica tampoco influyó en la probabilidad de recurrencia o de muerte. Es importante destacar que dada la naturaleza del estudio no se pueden extraer conclusiones firmes acerca del impacto del tratamiento locorregional pretrasplante sobre la recurrencia tumoral y la supervivencia.
Por otro lado, en diferentes trabajos se ha demostrado cómo la realización de tratamiento locorregional del CHC antes del TH previene las exclusiones de la lista, tanto con TACE como con RF15,32. Este beneficio no se ha evaluado en nuestro estudio, puesto que la población de estudio estaba formada por pacientes que recibieron finalmente el TH y no los que se incluyeron inicialmente en la lista, por lo que no se ha podido realizar un análisis por intención de tratamiento.
Las razones por las que el tratamiento previo al TH no induce incremento de la supervivencia o descenso de la recurrencia no quedan claras. Un motivo podría ser la efectividad del tratamiento en cuanto al grado de necrosis obtenido. Así, en nuestro trabajo hemos obtenido una baja frecuencia de necrosis tumoral completa (26,1%) y no encontramos diferencias en el grado de necrosis entre la realización de RF o TACE. Este escaso grado de necrosis también se ha observado en otros estudios que han evaluado la respuesta al tratamiento mediante el análisis histológico del hígado resecado o explantado. En el caso de la TACE, Zavaglia et al33 comprueban un 18,9% de necrosis completa, Decaens et al27, un 16%, Majno et al29, un 27% y Maddala et al34, un 15%, aunque Stockland et al31 demuestran un grado de necrosis completa mucho mayor (77%). En el caso de la RF, y a pesar de que se considera un tratamiento con potencial curativo, algunos autores comprueban una escasa frecuencia de respuesta completa, como Johnson et al (9%)35; en la mayoría de los trabajos evaluados es mucho mayor, como en el caso de Pompili et al (41,3%)36, Brillet et al37 (69%) o Mazzaferro et al (55%)22. Estos últimos datos coinciden con lo descrito en la literatura médica para pacientes tratados con RF como tratamiento único, no como puente hasta el TH, con una frecuencia de necrosis completa de más del 90% en tumores menores de 3cm38 o de hasta del 50% en los de mayor tamaño39, aunque los objetivos que se buscan en el caso del tratamiento como puente al TH son diferentes de los que se quieren conseguir cuando se aplican con intención curativa. Esta discordancia de la frecuencia de necrosis completa entre los diversos estudios y nuestro trabajo posiblemente es debido al elevado porcentaje de lesiones de gran tamaño (el 59,1% de los pacientes tratados presentaba un tamaño tumoral total mayor de 3cm).
Otra posible explicación de la baja frecuencia de necrosis completa puede ser el número de procedimientos realizados antes del TH. Así, la mayoría de los pacientes recibieron tan sólo una sesión de tratamiento previo al TH. El 22,2 y el 38,4% de los pacientes que se trataron con TACE y RF, respectivamente, recibieron más de una sesión y se observó cómo estos pacientes presentaron necrosis completa en el explante en mayor proporción, pero sin alcanzar significación estadística (37,5 vs. 20%). Este comportamiento se explica probablemente por la rapidez en la realización del TH desde que los pacientes se incluyeron en la lista, en nuestro caso de 4 meses, lo que hizo que la posibilidad de aumentar eficacia con un nuevo tratamiento fuera menor y se propusieran terapéuticas menos intensivas, al contrario de lo que ocurre cuando el tiempo en la lista es mayor o cuando no se realiza el tratamiento como puente al TH7,15,35.
Aunque los resultados obtenidos en el presente estudio son relevantes, hay que reseñar ciertas limitaciones. A pesar de que la base asistencial de TH de nuestro centro se mantiene actualizada de forma prospectiva, este trabajo representa una revisión retrospectiva de 7 años, en los que el tratamiento del paciente y el uso de las técnicas de imagen y tratamientos locorregionales han mejorado de forma significativa. Ésto puede haber influido en los resultados, al no ser del todo homogéneos en el tiempo, a pesar de que no se han observado grandes diferencias en este sentido. Por otro lado, dado que no se trata de un estudio aleatorizado ni prospectivo, existe un cierto sesgo de selección asociado a la variabilidad de la práctica asistencial. Así se comprueba cómo los pacientes tratados corresponden a aquéllos con tumores más grandes y, por lo tanto, con mayor riesgo de crecimiento tumoral en lista con riesgo de exclusión, y además con mejor reserva funcional hepática que permita realizar dichos procedimientos con total garantía. Estas limitaciones tan sólo se podrían solventar con la realización de un ensayo clínico prospectivo, controlado y aleatorizado.
En conclusión, nuestro estudio muestra cómo en los pacientes con CHC a los que se les realizó TH con un tiempo de espera en la lista relativamente corto (4 meses), la realización de tratamiento previo no demuestra un impacto significativo sobre la recurrencia tumoral postrasplante, ni en la supervivencia global o libre de recurrencia tumoral tras el TH. A pesar de estos resultados, y dado que el tiempo en lista de espera no es predecible ni homogéneo y, por otra parte, ha aumentado claramente en los últimos años, la estrategia terapéutica de nuestro centro sigue siendo la de realizar tratamiento antes del TH en aquellos pacientes con perfil tumoral más desfavorable.
Sin embargo, la influencia del tratamiento locorregional puede ser diferente en pacientes con CHC con un tiempo de espera más prolongado. En este sentido, y a pesar de la pobre evidencia disponible, las recomendaciones de la American Association of Study of Liver Diseases del año 2005 indican que podría realizarse tratamiento pretrasplante en el caso de existir un tiempo de espera previsto antes del trasplante de más de 6 meses9, actitud que es coste efectiva6.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.