Se desconoce la incidencia de anemia ferropénica (AF) tras un episodio de hemorragia digestiva no asociada a hipertensión portal (HDA).
ObjetivosEl objetivo principal fue estudiar la incidencia de AF tras una HDA, y los secundarios describir los factores predictivos de AF y elaborar modelos que permitan detectar aquellos pacientes que se beneficiarían de ferroterapia.
Material y métodoDesde abril de 2007 hasta mayo de 2009 se valoraron de forma prospectiva 391 pacientes con HDA. Se excluyeron todas las hemorragias secundarias a hipertensión portal y pacientes con condiciones clínicas y/o biológicas que pudieran artefactuar el patrón ferrocinético. Se practicó una analítica con parámetros férricos al ingreso, al 5.° y al 30.° día de la HDA. Se utilizó un modelo de regresión logística múltiple y un modelo de árboles de decisión.
ResultadosDe los 124 pacientes incluidos 76 (61,3%) presentaron AF a los 30 días de la HDA. Las variables predictoras de AF: edad>75 años (p=0,037; OR 3,9; IC 95%: 1,3-11,6), urea inicial >80mg/dl (p=0,027; OR 2,9; IC 95%: 1,1-7,6), ferritina inicial ≤65ng/dl (p=0,002; OR 7,6; IC 95%: 2,9-18,5), Hb inicial ≤100g/l (p=0,003; OR 3,2; IC 95%: 1,3-8,0), Hb al 5.° día ≤100g/l (p<0,001; OR 14,9; IC 95%: 3,6-61,1) e índice de saturación de transferrina al 5.° día <10% (p<0,001; OR 7,2; IC 95%: 2,6-20,3).
ConclusionesLa mayoría de pacientes con HDA presentan AF a los 30 días del episodio hemorrágico. La identificación de los factores predictivos de la misma permite establecer una indicación de ferroterapia tras la HDA.
There are few studies on iron deficiency anemia (IDA) after non-variceal acute upper gastrointestinal bleeding (UGIB) in patients without portal hypertension.
ObjectivesTo define the incidence of IDA after UGIB, to characterize the predictive factors for IDA and to design algorithms that could help physicians identify those patients who could benefit from iron therapy.
Material and methodWe registered 391 patients with UGIB between April 2007 and May 2009. Patients with portal hypertension and those with clinical or/and biological conditions that could affect the ferrokinetic pattern were excluded. Blood analyses were performed, including ferric parameters upon admission, on the 5th day, and on the 30th day after the hemorrhage episode. We used a multiple logistic regression model and a classification and regression tree model.
ResultsA total of 124 patients were included, of which 76 (61.3%) developed IDA 30 days after UGIB. The predictive variables were age >75 years (P=.037; OR 3.9; 95% CI: 1.3-11.6), initial urea level >80mg/dL (P=.027; OR 2.9; 95% CI: 1.1-7.6), initial ferritin level ≤65ng/dL (P=.002; OR 7.6; 95% CI: 2.9-18.5), initial hemoglobin level ≤100g/L (P=.003; OR 3.2; 95% CI: 1.3-8.0), hemoglobin level on the 5th day ≤100g/L (P<.001; OR 14.9; 95% CI: 3.6-61.1) and the value of the transferrin saturation index on the 5th day <10% (p<0.001; OR 7.2; 95% CI: 2.6-20.3).
ConclusionsMost patients with UGIB developed IDA 30 days after the episode. Identification of the predictive factors for IDA may help to establish guidelines for the administration of iron therapy.
La hemorragia digestiva alta continúa siendo una urgencia médica frecuente, y aunque en algunos estudios1 se observa una disminución de su incidencia en la última década, en otros se mantiene entre 48 y 160 casos por 100.000 adultos y año2. Recientemente se ha observado una disminución de la mortalidad derivada de la hemorragia digesiva3. La mayoría de pacientes fallecen por comorbilidad asociada o descompensación de enfermedades previas, a pesar del control de la hemorragia4. Es bien conocida la morbimortalidad de la hemorragia digestiva a corto plazo durante el periodo de hospitalización, sin embargo hay pocos datos en la literatura sobre la evolución a medio plazo, y en particular, no existen estudios sobre la incidencia de anemia por deficiencia de hierro (AF) en los meses siguientes a la hemorragia, ni tampoco sobre la influencia de la pérdida hemática en los parámetros analíticos clásicos de anemia5. Además, no existen guías sobre la recomendación de ferroterapia una vez superada la fase aguda, y la mayoría de médicos que atienden a estos pacientes indican tratamiento con hierro de una forma arbitraria.
El objetivo principal del estudio fue estudiar la incidencia de AF después de la fase aguda de hemorragia digestiva alta no asociada a hipertensión portal (HDA) y los objetivos secundarios fueron describir los factores clínicos y biológicos predictivos de la misma y elaborar algoritmos de decisión que, de una forma fácil y rápida, permitan detectar aquellos casos que se beneficiarían de un tratamiento con hierro.
Material y métodosEstudio prospectivo observacional que incluye la cohorte de pacientes con HDA atendidos en el Hospital Universitari Arnau de Vilanova de Lleida. Dicho hospital cuenta con una población de referencia de 300.000 habitantes. El protocolo de estudio fue aprobado por el comité ético de investigación clínica del hospital. Se obtuvo el consentimiento informado de todos los pacientes incluidos.
Desde abril de 2007 hasta mayo de 2009 se valoraron para su inclusión en el estudio todos los pacientes adultos (≥18 años) que ingresaron en el servicio de urgencias de nuestro centro por una hemorragia digestiva aguda.
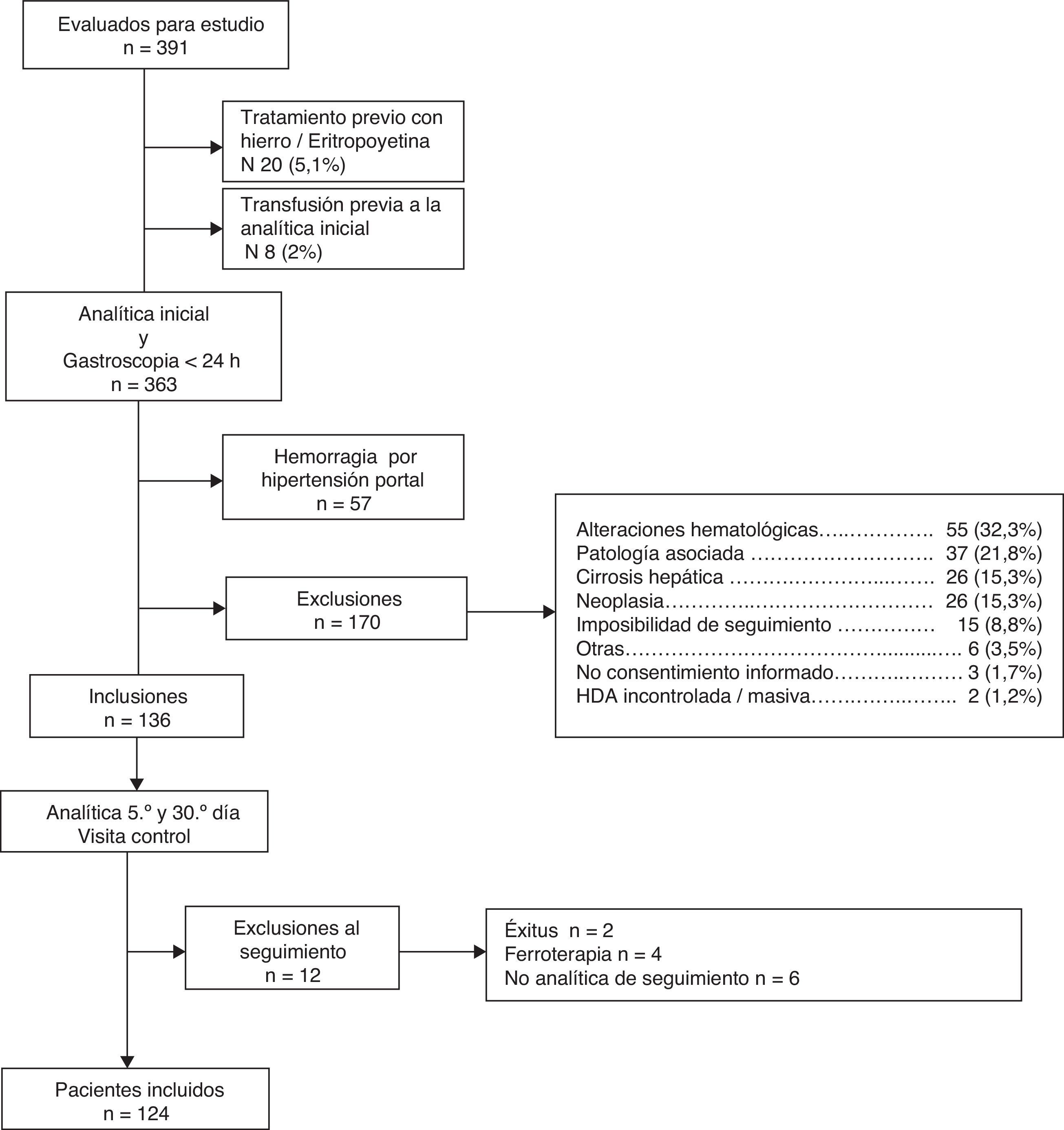
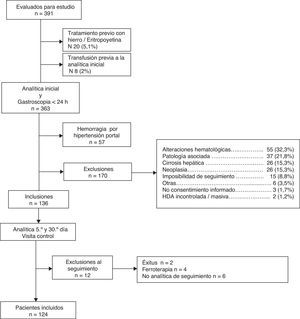
Las causas de exclusión se reflejan en la figura 1.
Hay que destacar que se excluyeron todos aquellos pacientes con hemorragia secundaria a hipertensión portal, a los que ya presentaban anemia o ferropenia en analíticas previas al episodio hemorrágico o que habían recibido tratamiento con hierro o factores estimulantes eritrocitarios en los últimos 6 meses, a aquellos con alteraciones hematológicas (macrocitosis, talasemia, leucemia, etc.) y a aquellos con determinadas enfermedades asociadas que pudieran artefactuar el patrón ferrocinético (insuficiencia cardíaca, insuficiencia renal crónica, cirrosis hepática, enfermedad pulmonar obstructiva crónica, neoplasia activa). También se excluyeron aquellos pacientes a los que se les transfundió concentrados de hematíes previa realización de analítica basal (8 pacientes de 391 [2%]).
Por lo tanto, se aseguró que los pacientes analizados finalmente en nuestro estudio presentaran como único factor etiológico de AF el episodio de HDA.
En todos los casos se efectuó una analítica inicial al ingreso en urgencias.
Se practicó una endoscopia en el transcurso de las primeras 24h de la admisión en urgencias. Se trataron endoscópicamente con tratamiento combinado (adrenalina+polidocanol y/o colocación de clips hemostáticos) las lesiones con estigmas de alto riesgo (sangrado activo en jet o en sábana o vaso visible no sangrante) o estigmas de moderado riesgo (coágulo rojo adherido)6–8.
Se consideró que existía persistencia del sangrado en los casos con sangrado activo (espontáneo o inducido por el tratamiento) que no cedía con el tratamiento endoscópico y se consideró que se había conseguido hemostasia cuando cesaba el sangrado después del mismo.
Se consideró recidiva hemorrágica cuando, tras el episodio hemorrágico inicial y tras haber conseguido hemostasia, reaparecía exteriorización del sangrado junto con inestabilidad hemodinámica (TAS<100mmHg y/o FC>100 pulsaciones por minuto) y/o descenso de 20g/l de Hb en menos de 12h9. En los casos de recidiva hemorrágica se practicó nueva endoscopia y retratamiento endoscópico de la lesión. Consideramos que los pacientes eran candidatos a tratamiento quirúrgico cuando presentaron persistencia de la hemorragia tras el primer tratamiento endoscópico, o en caso de recidiva hemorrágica después del segundo tratamiento endoscópico6. Los pacientes que precisaron tratamiento endoscópico ingresaron en el servicio de gastroenterología, y los que no lo precisaron, si la situación clínica y presencia de enfermedades asociadas no lo contraindicaba, fueron dados de alta con tratamiento antisecretor oral, en las primeras 24h tras la endoscopia6. Se interrumpió el tratamiento con antiinflamatorios no esteroideos, la antigregación10 o anticoagulación en aquellos pacientes que tomaban dichos fármacos, se administró vitamina K o hemoderivados si era preciso previa valoración por el servicio de hematología11,12. Se transfundieron concentrados de hematíes, en función del estado hemodinámico del paciente, de los valores de hemoglobina, enfermedades asociadas y riesgo de recidiva hemorrágica13,14.
A todos los pacientes se les administró un bolus incial de 80mg de pantoprazol seguido de la perfusión endovenosa 8mg/h6. A los pacientes con úlcera péptica que precisaron tratamiento endoscópico se les mantuvo esta perfusión durante 72h6,15.
En los casos con diagnóstico de úlcera péptica se investigó la infección por Helicobacter pylori, y en los casos en que resultó positivo se erradicó6,9,16. En las úlceras gástricas con Helicobacter pylori negativo se completó tratamiento antisecretor durante 8 semanas, comprobándose posteriormente la cicatrización de la lesión con nueva endoscopia de forma ambulatoria9.
Se estudiaron las características demográficas, clínicas, analíticas y endoscópicas de todos los pacientes incluidos en el estudio. Se utilizó el índice de Charlson para valorar la comorbilidad17 y el índice de Rockall18 para la estratificación del riesgo de mortalidad.
En todos los casos se efectuó una analítica inicial en urgencias que incluía hemograma, ionograma, función renal, índice de normalización de la ratio tiempo de protrombina, tiempo parcial de tromboplastina activada, reticulocitos y hemoglobinización de reticulocitos (Ret-He), hierro, transferrina (Tf), ferritina, receptor soluble de la transferrina (sTfR) y proteína C reactiva. Las determinaciones anteriores permitieron también calcular el índice de saturación de la transferrina (IST) (Fe/Tf) y el índice de ferritina (IF) (sTfR/logF).
A los pacientes incluidos en el estudio también se les practicó un hemograma dentro de las primeras 24h y una analítica, que incluía los mismos parámetros que la analítica inicial, al 5.° y 30.° día de la HDA. Se consideró Hb más baja dentro de las primeras 24h, el valor de hemoglobina más bajo constatado dentro de las primeras 24h, siempre previo a transfusión.
Se registró la incidencia de AF, la recidiva hemorrágica, la mortalidad y las causas de la misma a los 30 días del episodio hemorrágico.
Se definió anemia siguiendo los criterios de la OMS, si la cifra de hemoglobina era inferior a 130g/l en los varones e inferior a 120g/l en las mujeres y AF cuando además se añadía microcitosis y/o hipocromía con valores de ferritina inferiores a 30ng/dl y/o índice de saturación de la transferrina inferior al 15%19.
Las variables se presentan como media±desviación estándar o como porcentaje. Para la comparación de variables categóricas se utilizó el test de Chi-cuadrado, y para las variables continuas se usó el test de Mann-Whitney.
Se realizó un análisis univariado con todas las variables incluidas en el estudio en las primeras 24h y al 5.° día tras la HDA.
Para calcular el riesgo de AF tras la HDA se construyeron 2 modelos multivariantes utilizando todas las variables disponibles (maximum models), uno con las variables disponibles en las primeras 24horas y otro con las variables disponibles en el quinto día post-HDA. Se utilizaron 2 metodologías: la primera, una regresión logística (RL) múltiple con la selección de las variables más relevantes mediante una estrategia de paso a paso hacia atrás no automática para seleccionar las que predicen AF a los 30 días, y la segunda un modelo de árboles de decisión tipo CART con sistema de validación cruzada20–23. Para comparar los diferentes modelos se utilizó el área bajo la curva ROC (AUC)24.
El análisis estadístico se realizó con el programa SPSS (versión 11.5) y con el módulo Answer-Tree para el desarrollo de los modelos CART (versión 15.0).
ResultadosDesde abril de 2007 hasta mayo de 2009 se evaluaron 391 pacientes con hemorragia digestiva, de los cuales se incluyeron en el estudio 136: 12 de ellos se excluyeron durante el seguimiento, por lo que los pacientes finalmente estudiados fueron 124 (fig. 1).
De los 124 pacientes 101 (81,5%) eran varones y 23 mujeres (18,5%). La edad media fue de 60±20 años. La mayoría (61,3%) de los pacientes presentaba enfermedad asociada. En el 66,1% de los casos, existía el antecedente de tratamiento con antiinflamatorios no esteroideos, antiagregantes o anticoagulantes (tabla 1).
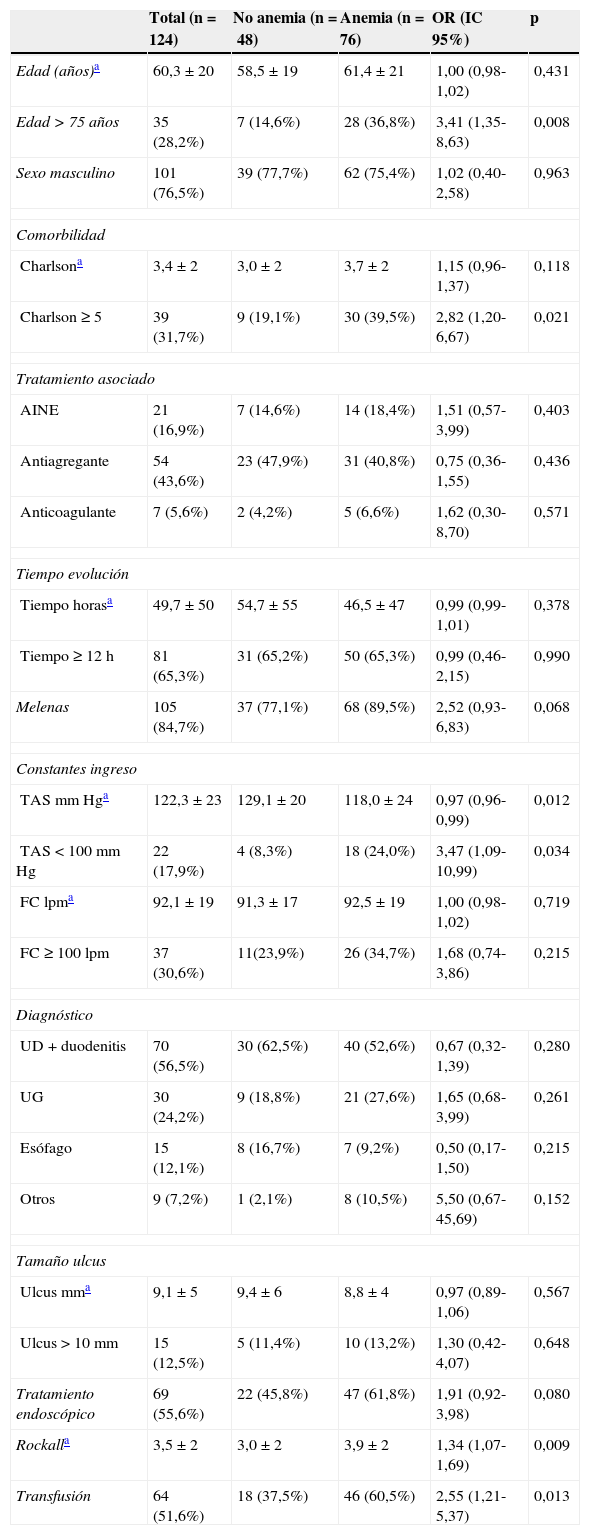
Factores asociados a AF a los 30 días del episodio de HDA. Variables clínicas y endoscópicas en las primeras 24h
| Total (n=124) | No anemia (n=48) | Anemia (n=76) | OR (IC 95%) | p | |
|---|---|---|---|---|---|
| Edad (años)a | 60,3±20 | 58,5±19 | 61,4±21 | 1,00 (0,98-1,02) | 0,431 |
| Edad>75 años | 35 (28,2%) | 7 (14,6%) | 28 (36,8%) | 3,41 (1,35-8,63) | 0,008 |
| Sexo masculino | 101 (76,5%) | 39 (77,7%) | 62 (75,4%) | 1,02 (0,40-2,58) | 0,963 |
| Comorbilidad | |||||
| Charlsona | 3,4±2 | 3,0±2 | 3,7±2 | 1,15 (0,96-1,37) | 0,118 |
| Charlson≥5 | 39 (31,7%) | 9 (19,1%) | 30 (39,5%) | 2,82 (1,20-6,67) | 0,021 |
| Tratamiento asociado | |||||
| AINE | 21 (16,9%) | 7 (14,6%) | 14 (18,4%) | 1,51 (0,57-3,99) | 0,403 |
| Antiagregante | 54 (43,6%) | 23 (47,9%) | 31 (40,8%) | 0,75 (0,36-1,55) | 0,436 |
| Anticoagulante | 7 (5,6%) | 2 (4,2%) | 5 (6,6%) | 1,62 (0,30-8,70) | 0,571 |
| Tiempo evolución | |||||
| Tiempo horasa | 49,7±50 | 54,7±55 | 46,5±47 | 0,99 (0,99-1,01) | 0,378 |
| Tiempo≥12h | 81 (65,3%) | 31 (65,2%) | 50 (65,3%) | 0,99 (0,46-2,15) | 0,990 |
| Melenas | 105 (84,7%) | 37 (77,1%) | 68 (89,5%) | 2,52 (0,93-6,83) | 0,068 |
| Constantes ingreso | |||||
| TAS mmHga | 122,3±23 | 129,1±20 | 118,0±24 | 0,97 (0,96-0,99) | 0,012 |
| TAS<100mmHg | 22 (17,9%) | 4 (8,3%) | 18 (24,0%) | 3,47 (1,09-10,99) | 0,034 |
| FClpma | 92,1±19 | 91,3±17 | 92,5±19 | 1,00 (0,98-1,02) | 0,719 |
| FC≥100lpm | 37 (30,6%) | 11(23,9%) | 26 (34,7%) | 1,68 (0,74-3,86) | 0,215 |
| Diagnóstico | |||||
| UD+duodenitis | 70 (56,5%) | 30 (62,5%) | 40 (52,6%) | 0,67 (0,32-1,39) | 0,280 |
| UG | 30 (24,2%) | 9 (18,8%) | 21 (27,6%) | 1,65 (0,68-3,99) | 0,261 |
| Esófago | 15 (12,1%) | 8 (16,7%) | 7 (9,2%) | 0,50 (0,17-1,50) | 0,215 |
| Otros | 9 (7,2%) | 1 (2,1%) | 8 (10,5%) | 5,50 (0,67-45,69) | 0,152 |
| Tamaño ulcus | |||||
| Ulcus mma | 9,1±5 | 9,4±6 | 8,8±4 | 0,97 (0,89-1,06) | 0,567 |
| Ulcus>10mm | 15 (12,5%) | 5 (11,4%) | 10 (13,2%) | 1,30 (0,42-4,07) | 0,648 |
| Tratamiento endoscópico | 69 (55,6%) | 22 (45,8%) | 47 (61,8%) | 1,91 (0,92-3,98) | 0,080 |
| Rockalla | 3,5±2 | 3,0±2 | 3,9±2 | 1,34 (1,07-1,69) | 0,009 |
| Transfusión | 64 (51,6%) | 18 (37,5%) | 46 (60,5%) | 2,55 (1,21-5,37) | 0,013 |
Valores como n (%).
FC: frecuencia cardíaca; IC: intervalo de confianza; OR: odds ratio; TAS: tensión arterial sistólica; UD: ulcus duodenal; UG: ulcus gástrico.
La presentación clínica más frecuente de la HDA fue en forma de melenas, y en casi un 20% de los casos se constató repercusión hemodinámica con hipotensión al ingreso en urgencias. La principal causa de sangrado fue la úlcera duodenal (53,2%), seguida de la úlcera gástrica (24,2%) y de la enfermedad esofágica (esofagitis péptica, síndrome de Mallory Weiss, 12%). Las otras causas de sangrado fueron: duodenitis erosiva (3,3%), lesiones agudas de mucosa gástrica (2,4%), úlceras de Cameron (1,6%), angiodisplasias (1,6%), pólipo gástrico (0,8%) y Dieulafoy (0,8%).
En el 54% de las lesiones se identificaron signos endoscópicos de alto y moderado riesgo. Se efectuó tratamiento endoscópico en el 55,6% de los casos, incluyendo 2 casos de angiodisplasias que aunque no presentaban estigmas directos de sangrado, en ausencia de otras lesiones potencialmente sangrantes se les atribuyó la causa de la HDA y se trataron con argón plasma.
La recidiva global tras una HDA no secundaria a hipertensión portal registrada en nuestro centro es del 10,8%. En el subgrupo de pacientes incluidos en este estudio (pacientes sin enfermedad asociada grave), la recidiva hemorrágica tras el tratamiento endoscópico inicial (n=69) fue del 5,8% (n=4). La mortalidad global por HDA no secundaria a hipertensión portal registrada en nuestro centro es del 5,6%, y la mortalidad en los pacientes incluidos en este estudio fue de un 1,4%. Las causas de la muerte fueron la presencia de comorbilidad asociada en uno de los casos y la HDA en el otro.
A los 30 días de la HDA 76 pacientes (61,3%) presentaron AF, mientras que 48 (38,7%) no.
Se compararon las características clínicas, endoscópicas y analíticas de los pacientes que presentaron AF a los 30 días de la HDA con aquellos que no la presentaron (tablas 1–3).
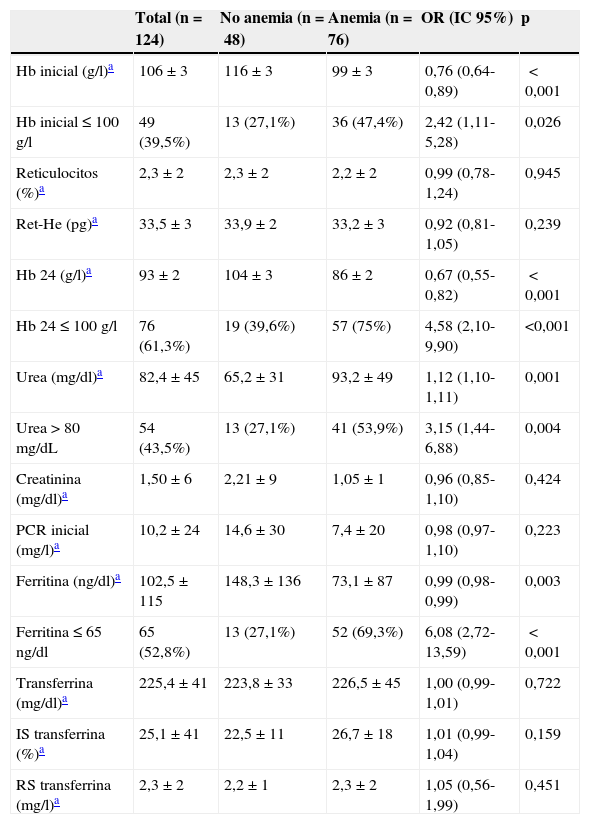
Factores asociados a AF a los 30 días del episodio de HDA. Variables analíticas en las primeras 24h
| Total (n=124) | No anemia (n=48) | Anemia (n=76) | OR (IC 95%) | p | |
|---|---|---|---|---|---|
| Hb inicial (g/l)a | 106±3 | 116±3 | 99±3 | 0,76 (0,64-0,89) | <0,001 |
| Hb inicial≤100g/l | 49 (39,5%) | 13 (27,1%) | 36 (47,4%) | 2,42 (1,11-5,28) | 0,026 |
| Reticulocitos (%)a | 2,3±2 | 2,3±2 | 2,2±2 | 0,99 (0,78-1,24) | 0,945 |
| Ret-He (pg)a | 33,5±3 | 33,9±2 | 33,2±3 | 0,92 (0,81-1,05) | 0,239 |
| Hb 24 (g/l)a | 93±2 | 104±3 | 86±2 | 0,67 (0,55-0,82) | <0,001 |
| Hb 24≤100g/l | 76 (61,3%) | 19 (39,6%) | 57 (75%) | 4,58 (2,10-9,90) | <0,001 |
| Urea (mg/dl)a | 82,4±45 | 65,2±31 | 93,2±49 | 1,12 (1,10-1,11) | 0,001 |
| Urea>80mg/dL | 54 (43,5%) | 13 (27,1%) | 41 (53,9%) | 3,15 (1,44-6,88) | 0,004 |
| Creatinina (mg/dl)a | 1,50±6 | 2,21±9 | 1,05±1 | 0,96 (0,85-1,10) | 0,424 |
| PCR inicial (mg/l)a | 10,2±24 | 14,6±30 | 7,4±20 | 0,98 (0,97-1,10) | 0,223 |
| Ferritina (ng/dl)a | 102,5±115 | 148,3±136 | 73,1±87 | 0,99 (0,98-0,99) | 0,003 |
| Ferritina≤65ng/dl | 65 (52,8%) | 13 (27,1%) | 52 (69,3%) | 6,08 (2,72-13,59) | <0,001 |
| Transferrina (mg/dl)a | 225,4±41 | 223,8±33 | 226,5±45 | 1,00 (0,99-1,01) | 0,722 |
| IS transferrina (%)a | 25,1±41 | 22,5±11 | 26,7±18 | 1,01 (0,99-1,04) | 0,159 |
| RS transferrina (mg/l)a | 2,3±2 | 2,2±1 | 2,3±2 | 1,05 (0,56-1,99) | 0,451 |
Valores como n (%).
Hb: hemoglobina; IC: intervalo de confianza; IS: índice de saturación; OR: odds ratio; PCR: proteína C reactiva; Ret-He: hemoglobinización de reticulocitos; RS: receptor soluble.
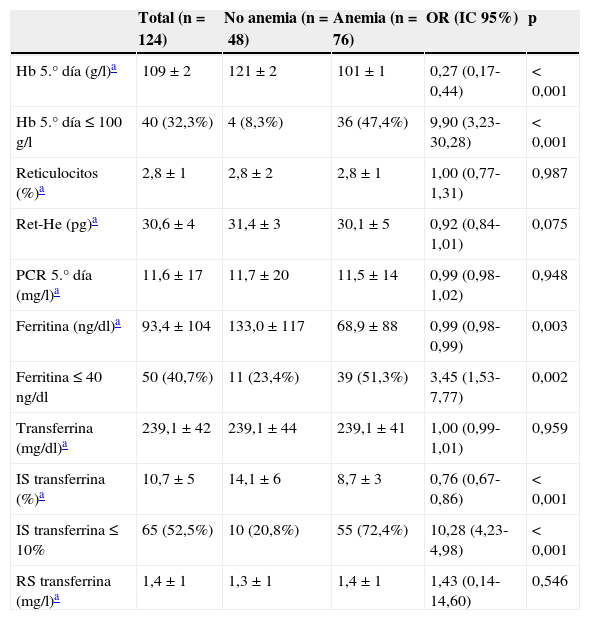
Factores asociados a AF a los 30 días del episodio de la HDA. Variables analíticas al quinto día de evolución
| Total (n=124) | No anemia (n=48) | Anemia (n=76) | OR (IC 95%) | p | |
|---|---|---|---|---|---|
| Hb 5.° día (g/l)a | 109±2 | 121±2 | 101±1 | 0,27 (0,17-0,44) | <0,001 |
| Hb 5.° día≤100g/l | 40 (32,3%) | 4 (8,3%) | 36 (47,4%) | 9,90 (3,23-30,28) | <0,001 |
| Reticulocitos (%)a | 2,8±1 | 2,8±2 | 2,8±1 | 1,00 (0,77-1,31) | 0,987 |
| Ret-He (pg)a | 30,6±4 | 31,4±3 | 30,1±5 | 0,92 (0,84-1,01) | 0,075 |
| PCR 5.° día (mg/l)a | 11,6±17 | 11,7±20 | 11,5±14 | 0,99 (0,98-1,02) | 0,948 |
| Ferritina (ng/dl)a | 93,4±104 | 133,0±117 | 68,9±88 | 0,99 (0,98-0,99) | 0,003 |
| Ferritina≤40ng/dl | 50 (40,7%) | 11 (23,4%) | 39 (51,3%) | 3,45 (1,53-7,77) | 0,002 |
| Transferrina (mg/dl)a | 239,1±42 | 239,1±44 | 239,1±41 | 1,00 (0,99-1,01) | 0,959 |
| IS transferrina (%)a | 10,7±5 | 14,1±6 | 8,7±3 | 0,76 (0,67-0,86) | <0,001 |
| IS transferrina≤10% | 65 (52,5%) | 10 (20,8%) | 55 (72,4%) | 10,28 (4,23-4,98) | <0,001 |
| RS transferrina (mg/l)a | 1,4±1 | 1,3±1 | 1,4±1 | 1,43 (0,14-14,60) | 0,546 |
Valores como n (%).
Hb: hemoglobina; IC: intervalo de confianza; IS: índice de saturación; OR: odds ratio; PCR: proteína C reactiva; Ret-He: hemoglobinización de reticulocitos; RS: receptor soluble.
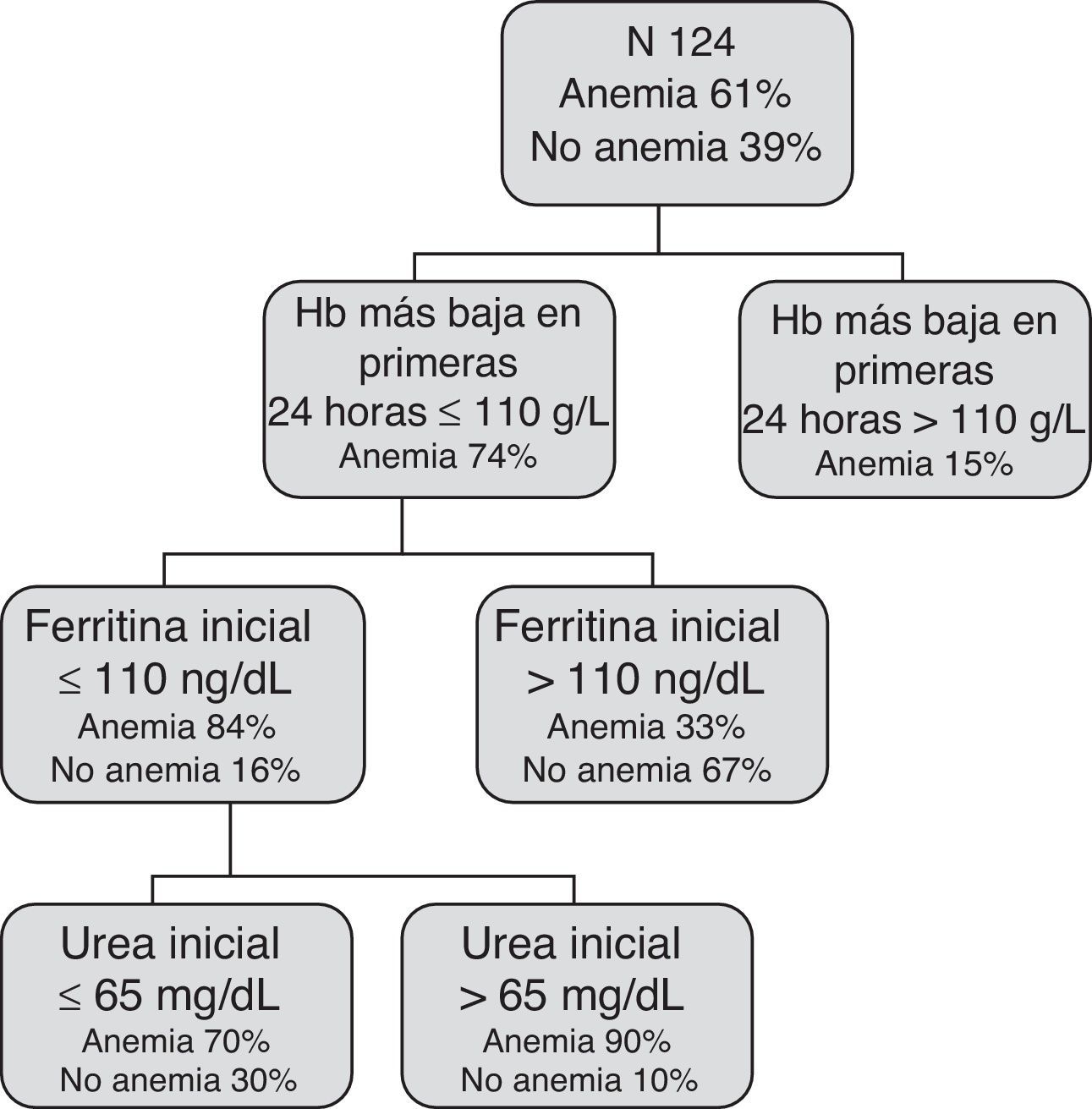
En el análisis multivariado basado en RL las variables disponibles en las primeras 24h del ingreso con capacidad predictiva independiente para la presencia de AF a los 30 días del episodio de HDA son: edad>75 años, urea>80mg/dl, ferritina ≤65ng/dl y Hb más baja en las primeras 24h≤100g/l (tabla 4).
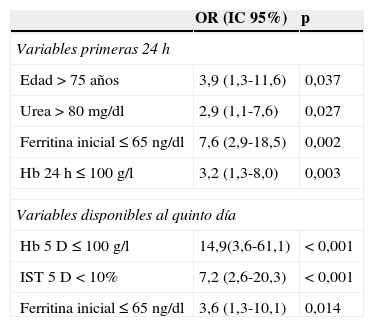
Factores de riesgo asociados a AF a los 30 días del episodio de HDA. Modelos con las variables disponibles en las primeras 24h y a los 5 días del episodio
| OR (IC 95%) | p | |
|---|---|---|
| Variables primeras 24h | ||
| Edad>75 años | 3,9 (1,3-11,6) | 0,037 |
| Urea>80mg/dl | 2,9 (1,1-7,6) | 0,027 |
| Ferritina inicial≤65ng/dl | 7,6 (2,9-18,5) | 0,002 |
| Hb 24h≤100g/l | 3,2 (1,3-8,0) | 0,003 |
| Variables disponibles al quinto día | ||
| Hb 5D≤100g/l | 14,9(3,6-61,1) | <0,001 |
| IST 5D<10% | 7,2 (2,6-20,3) | <0,001 |
| Ferritina inicial≤65ng/dl | 3,6 (1,3-10,1) | 0,014 |
5D: valores al quinto día; Hb 24h: hemoglobina más baja las primeras 24h; IC: intervalo de confianza; IS: índice de saturación de la transferrina; OR: odds ratio.
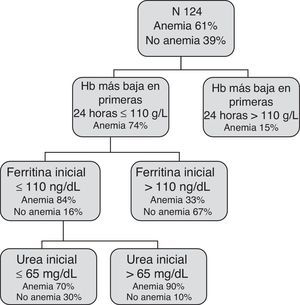
El modelo basado en CART no incluye la variable edad, e incluye 3 reglas de decisión combinando las variables: Hb más baja en las primeras 24h, ferritina y urea inicial y selecciona distintos puntos de corte para las mismas (fig. 2).
El modelo LR obtuvo una AUC de 0,83 (IC 95%: 0,76-0,90) y el CART de 0,85 (IC 95%: 0,78-0,92).
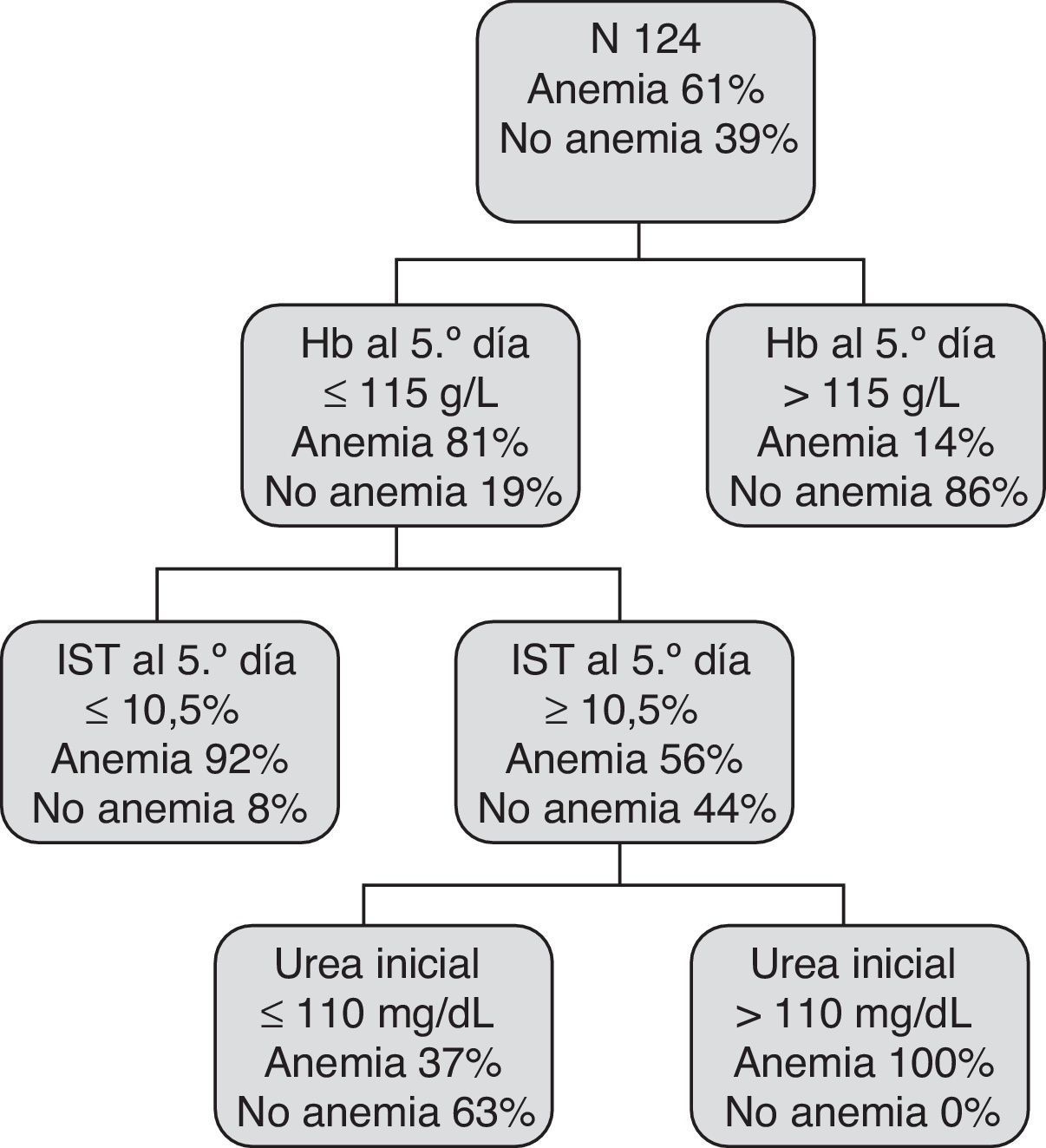
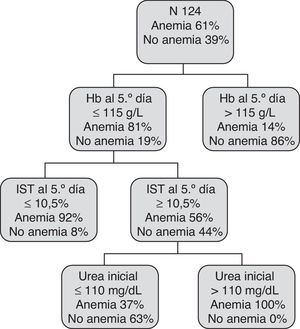
Realizamos un segundo modelo predictivo con las variables disponibles al 5.° día del episodio de HDA. En el análisis multivariado basado en RL las variables con capacidad predictiva independiente para la presencia de AF a los 30 días del episodio de HDA son: Hb≤100g/l al 5.° día, IST≤10% al 5.° día y ferritina≤65ng/dl al ingreso (tabla 4).
El modelo CART incluye 3 reglas de decisión combinando las variables: Hb al 5.° día, IST al 5.° día y urea inicial y selecciona distintos puntos de corte para las mismas (fig. 3).
El modelo LR obtuvo una AUC 0,87 (IC 95%: 0,8-0,93) y el CART de 0,89 (IC 95%: 0,84-0,96).
De los 4 pacientes con recidiva hemorrágica 3 presentaron AF a los 30 días y uno no (6,4% vs 4,5%, p=0,77).
DiscusiónNo existen estudios previos que demuestren la existencia y valoren la incidencia de AF tras un episodio de HDA a pesar de que, en la práctica clínica, es frecuente indicar tratamiento con hierro tras el episodio agudo. Nuestro estudio demuestra que el 61% de los pacientes presentan AF a los 30 días del episodio hemorrágico. Posiblemente la incidencia real de dicha anemia sea superior, puesto que para demostrar que la única causa de dicha anemia era el episodio hemorrágico se excluyeron todos los pacientes con enfermedad asociada, condiciones biológicas y analíticas que pudieran influir en la valoración de los parámetros hematológicos.
La valoración de los factores predictivos de AF post-HDA es importante para establecer la indicación de tratamiento con hierro después del episodio hemorrágico.
En múltiples estudios previos se han identificado factores clínicos (edad avanzada, presencia de enfermedad asociada, inestabilidad hemodinámica) y endoscópicos (estigma de sangrado, tamaño de la úlcera, localización de la lesión) predictores de una evolución adversa de la HDA25,26.
Incluimos todas las variables clínicas y endoscópicas identificadas como factores predictores de evolución adversa en estudios previos, y también se incluyeron todos los parámetros biológicos que pueden verse afectados en un episodio hemorrágico y que definen el estado de AF y/o estado ferrodeficitario.
De todas las variables clínicas y endoscópicas incluidas, la única variable predictiva de AF en el modelo de RL fue la edad superior a 75 años, y este hecho se podría explicar por una menor capacidad de respuesta y regeneración medular en los pacientes ancianos27.
Variables como el índice de Charlson, la hipotensión al ingreso, el índice de Rockall y la necesidad de transfusión, que resultaron significativas en el análisis univariado, no alcanzaron la significación estadística en el análisis multivariado. No se encontraron diferencias al analizar el tiempo de evolución desde el inicio de los síntomas, sexo, tratamiento previo con antiinflamatorios no esteroideos, antiagregantes o anticoagulantes, tamaño de la lesión, signo de hemorragia y necesidad de tratamiento endoscópico.
La causa más frecuente de HDA fue la úlcera péptica, un dato similar al comunicado en otras series1. No se constataron diferencias en la incidencia de AF entre las distintas causas de HDA.
Por otra parte, se incluyeron en el análisis todos los párametros biológicos clásicos para la definición de AF y se realizó también la determinación de Ret-He. La determinación de Ret-He valora la hemoglobinización de los reticulocitos que habitualmente aparecen entre los 3 y 5 días posteriores al inicio de la eritropoyesis, por ello se efectuó una analítica al 5.° día que nos permitiera evaluar con mayor precisión la población reticulocitaria. En estudios realizados en pacientes con insuficiencia renal crónica tratados con eritropoyetina, la determinación de Ret-He conjuntamente con el IF en la gráfica de Thomas son predictores de ferrodeficiencia, sin verse alterados por los reactantes de fase aguda (por ejemplo ferritina)28. En nuestro estudio el valor de Ret-He no resultó predictor de AF a los 30 días de la UGIB, ni en la determinación inicial ni a los 5 días del episodio, si bien en este último caso estuvo cerca de la significación estadística.
Las variables biológicas con capacidad predictiva de AF seleccionadas por ambos modelos (LR y CART) fueron la Hb menor a 100g/l en las primeras 24h, la urea y la ferritina inicial, la Hb y el ISTF al 5.° día.
La hemoglobina más baja en las primeras 24h y la hemoglobina al 5.° día de la HDA son factores predictores de anemia a los 30 días. La hemoglobina inicial no es un buen reflejo de la hemoglobina real debido al estado de hemoconcentración secundario a la hipovolemia. Además, a la hemodilución fisiológica posthemorragia debida al paso de líquidos desde el espacio extravascular al intravascular, se le añade la hemodilución secundaria a la reposición de volumen como tratamiento de la HDA29. Es por ello que un dato importante que se desprende de este estudio es la necesidad de tener en cuenta el valor de hemoglobina más bajo en las primeras 24h.
Otro parámetro predictor de AF post-HDA es la cifra de urea en la analítica inicial. La elevación de la urea se debe, por una parte, a la absorción de las proteínas de la sangre a nivel intestinal y, por otra parte, a la disminución de la presión de filtración y del filtrado glomerular en relación con la hipovolemia. Así pues, un mayor sangrado implica mayor volumen de sangre en la luz intestinal y mayor absorción de urea.
La ferritina inicial también es un factor predictivo de anemia. A pesar de que la cifra obtenida (65ng/dl) esté dentro de la normalidad, es posible que los depósitos de hierro no sean suficientemente óptimos para garantizar la eritropoyesis necesaria ante una pérdida hemática aguda.
El índice de saturación de la transferrina al 5.° día de la UGIB es también predictor de anemia a los 30 días, y este hecho se explica por el estímulo que representa la pérdida de hierro para la producción de transferrina. Se estimula la eritopoyesis por aumento de la secreción de eritropoyetina, detectable ya al cabo de 2-3 días de la hemorragia30.
Los 2 modelos nos permiten identificar los pacientes que se beneficiarían de tratamiento con hierro para evitar el desarrollo de una AF tras el episodio de HDA, pero la ventaja del modelo CART es la simplicidad en la interpretación de los resultados. El CART es un modelo muy práctico, ya que siguiendo un sencillo algoritmo de decisión, en las primeras 24h del ingreso, conociendo la Hb más baja, la ferritina y la urea, podemos predecir qué pacientes tendrán más posibilidad de presentar anemia a los 30 días. Este modelo inicial será de gran importancia para aquellos pacientes tributarios de alta precoz sin necesidad de ingreso hospitalario. De hecho, en este algoritmo la hemoglobina más baja en las primeras 24h del ingreso ya nos permite identificar a la mayoría (74%) de los pacientes que presentarán AF a los 30 días de la HDA, y esto es de gran utilidad en la práctica clínica habitual, dado que esta enfermedad conlleva una corta estancia hospitalaria. El algoritmo al 5.° día nos ha sido útil para estudiar mejor el comportamiento de la eritropoyesis en fase subaguda del evento hemorrágico.
Las limitaciones del estudio son: el tamaño de la muestra, ya que del total de episodios de HDA atendidos en nuestro centro solo se incluyeron 124 pacientes, y la razón principal fueron los estrictos criterios de inclusión, como ya se ha mencionado anteriormente, y otra limitación es que el estudio se ha realizado en un solo centro y sería importante realizar una validación externa de nuestros modelos.
El estudio demuestra que la incidencia de AF tras un episodio de HDA es del 61%, y que la aplicación de unos sencillos algoritmos CART permite identificar, dentro de las primeras 24h, a los pacientes que se beneficiarán de tratamiento con hierro, y por consiguiente, adoptar una medida terapéutica antes del alta del paciente, ya sea con hierro por vía oral o intravenosa.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.