La hipertensión intraabdominal se define como una elevación de la presión intraabdominal que da lugar a una disfunción progresiva de los órganos intraabdominales.
ObjetivoEstudiar las consecuencias de la hipertensión intraabdominal a nivel esplácnico en un modelo porcino determinando la medida indirecta de elección.
Material y métodosSe utilizaron 10 cerdos divididos en un grupo control y en un grupo de presión de 20mmHg con un modelo de ascitis. Se registraron las presiones intraabdominal transvesical y transperitoneal, calculándose el grado de correlación entre ambas. Se obtuvo el ácido láctico, la alanina aminotransferasa, la glucosa y el pH intramucoso gástrico. Se determinó la presión arterial media y la presión de perfusión abdominal, observando la correlación de esta con el pH intramucoso gástrico y el ácido láctico. Los parámetros se registraron durante 3 h.
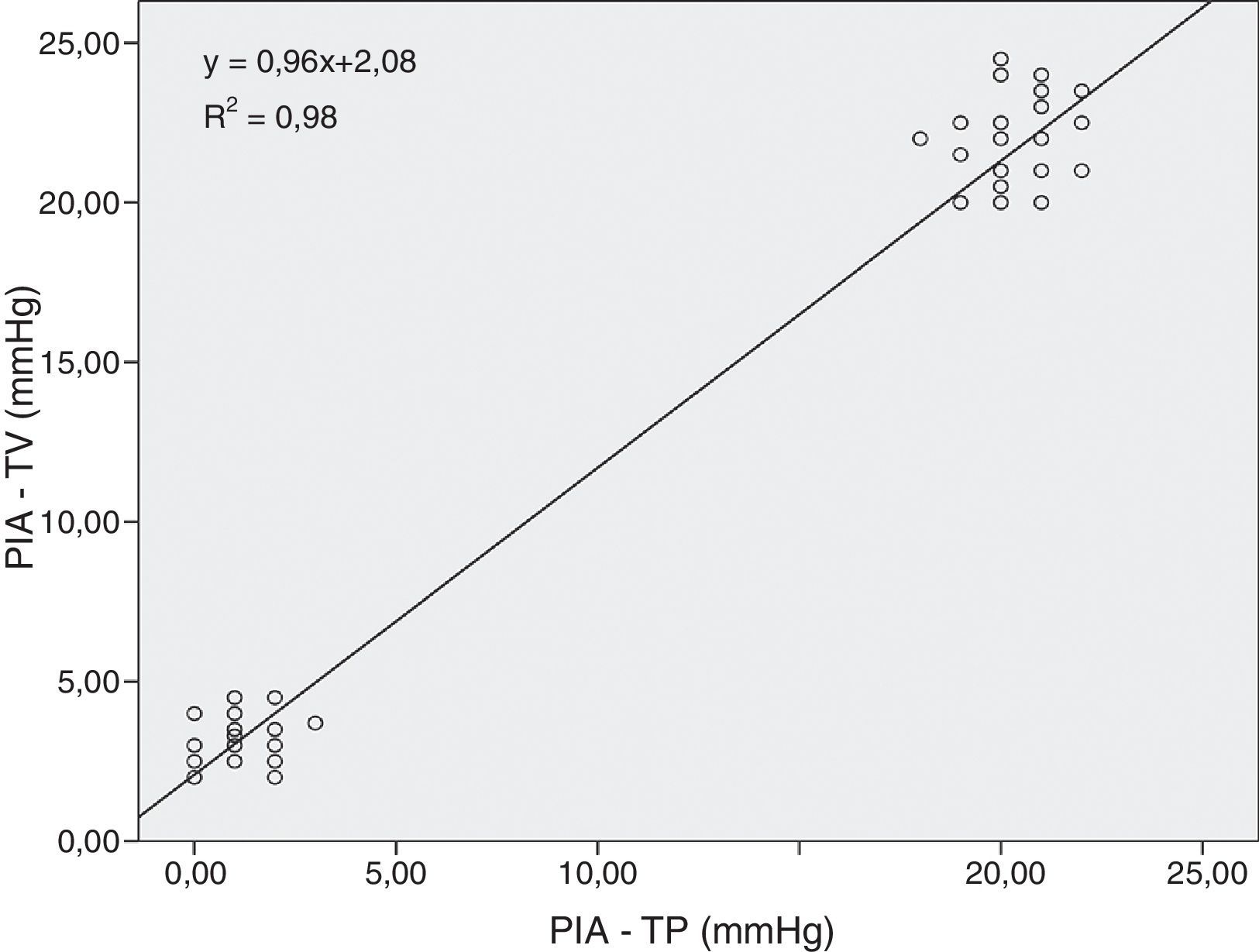
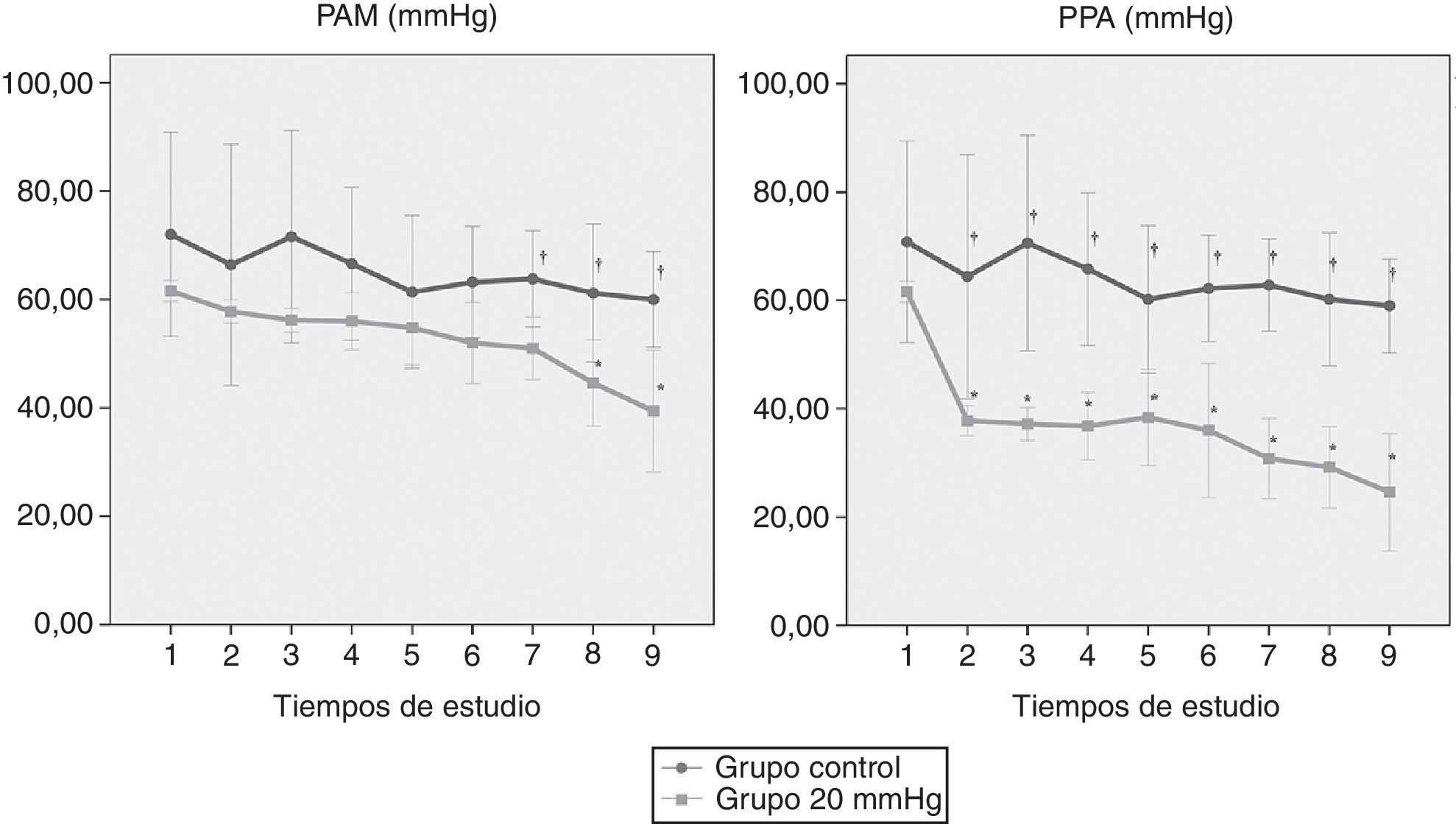
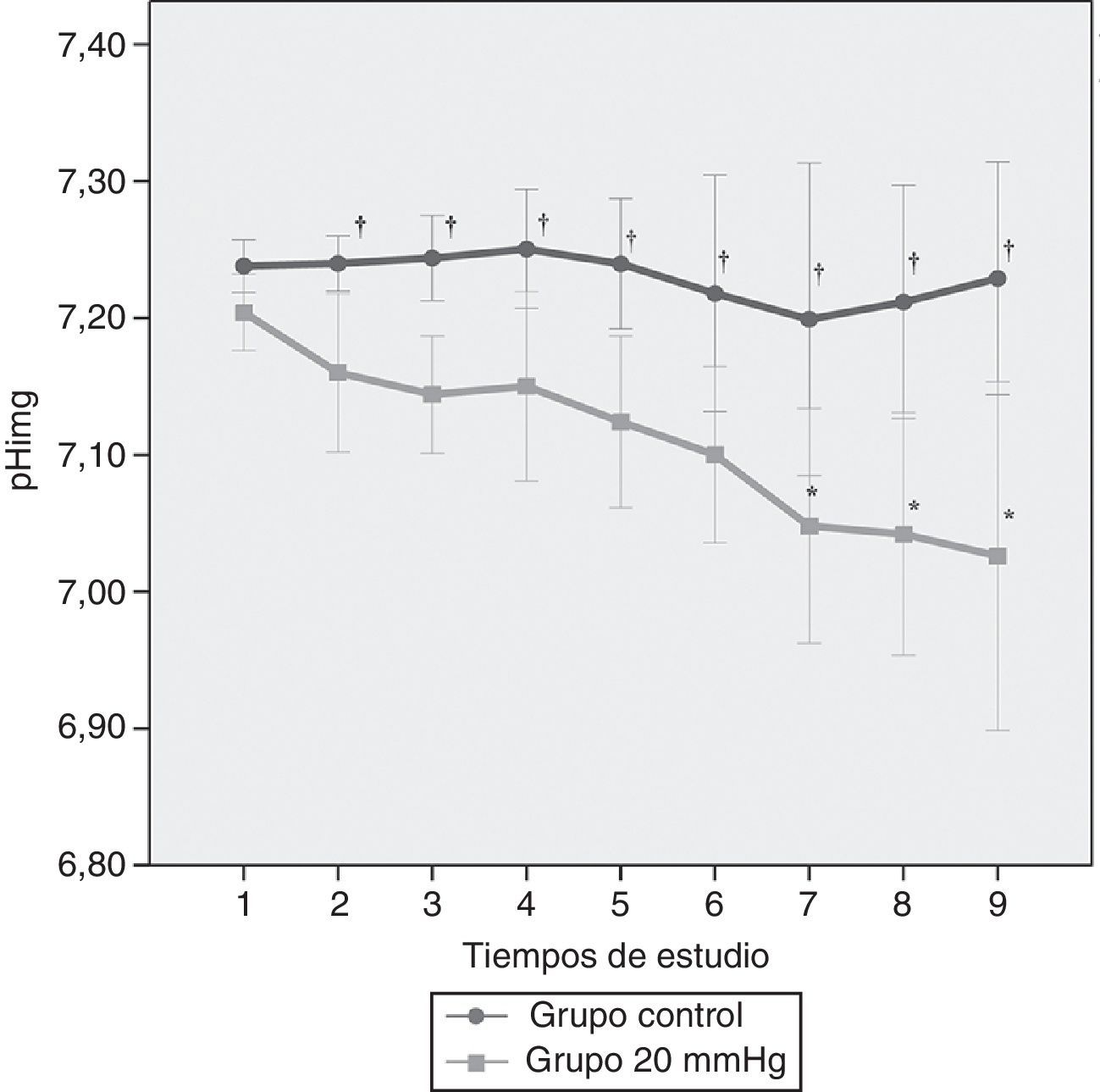
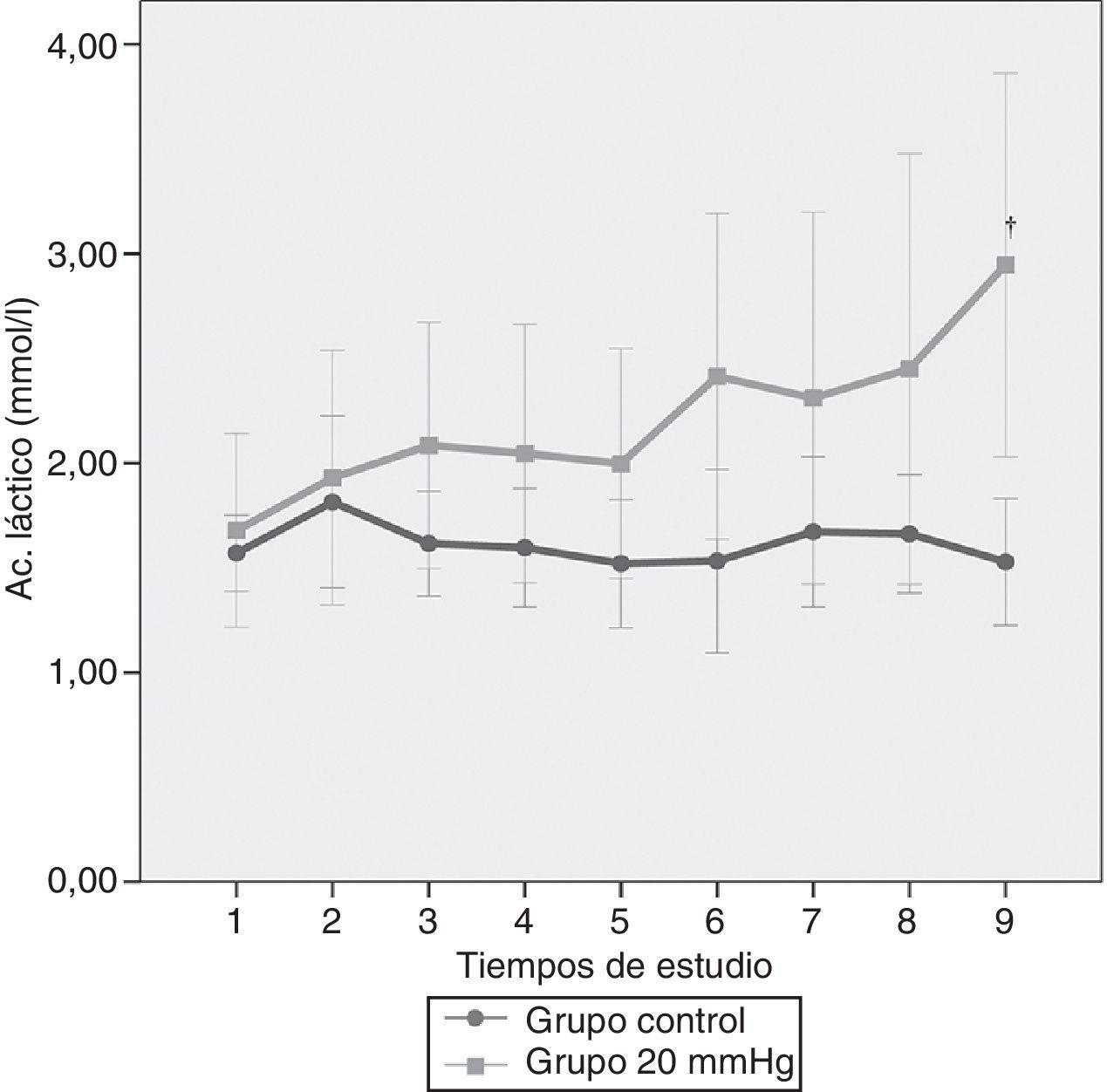
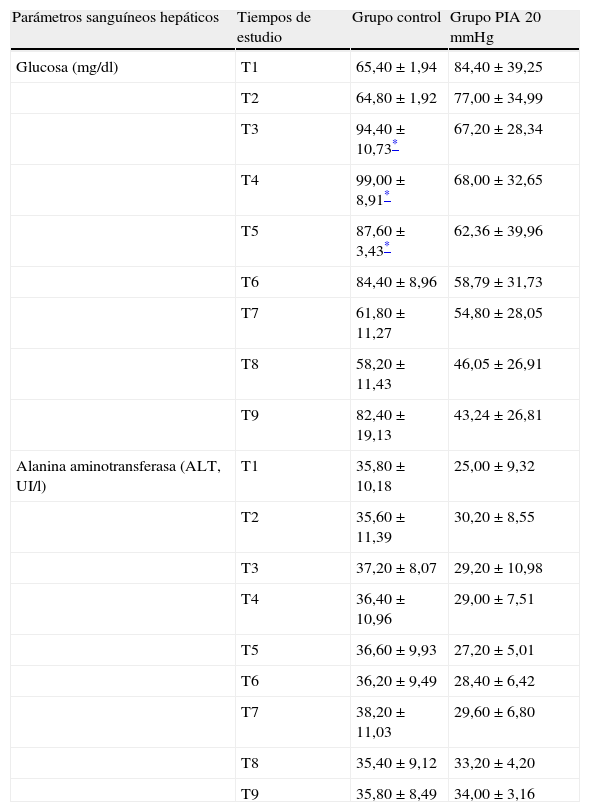
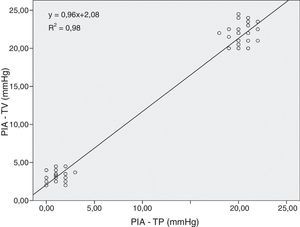
ResultadosHubo una alta correlación entre ambas presiones (R2=0,98). A 20mmHg el ácido láctico aumentó significativamente entre grupos a los 180 min (p<0,011). El pH intramucoso gástrico mostró diferencias significativas entre grupos desde el inicio (p=0,004) descendiendo significativamente a partir de los 120 min. La presión arterial media y la perfusión abdominal disminuyeron progresivamente apreciándose cambios significativos más precoces en la presión de perfusión abdominal (p=0,001) mostrando una buena correlación con los parámetros estudiados. No hubo afectación significativa de los parámetros hepáticos.
ConclusionesConsideramos la presión intraabdominal transvesical como la técnica de elección, siendo la presión de perfusión abdominal un marcador sensitivo de la hipertensión intraabdominal y el pH intramucoso gástrico el parámetro más precozmente afectado.
Intra-abdominal hypertension is defined as a rise in intra-abdominal pressure leading to progressive dysfunction of the abdominal organs.
ObjectiveTo evaluate the effects of intra-abdominal hypertension on the splanchnic circulation in a porcine animal model with a view to determining the diagnostic method of choice.
Material and methodsA total of 10 swine were divided into 2 groups: a control group and a group with an ascites pressure of 20mmHg. Transvesical and transperitoneal intra-abdominal pressures were registered, and the correlation between the measurements obtained was determined. Concentrations of lactic acid, alanine aminotransferase, glucose and gastric mucosal pH were also obtained. We registered the mean arterial and abdominal perfusion pressures, and the correlation of the latter with gastric mucosal pH and lactic acid concentrations. The parameters were registered for a total of 3hours.
ResultsWe observed a high correlation between transvesical and transperitoneal measurements of intra-abdominal pressure (R2=0.98). In the 20mmHg pressure group, lactic acid concentrations increased significantly at 180min (p<0.011). Gastric mucosal pH differed significantly between the 2 groups from the beginning of the study (p=0.004) and significantly decreased from 120min onward. Mean arterial and abdominal perfusion pressures gradually decreased during the trial, with early significant changes in the abdominal perfusion pressure (p=0.001), and a good correlation with the remaining study parameters. There were no significant changes in hepatic indicators.
ConclusionsWe believe the transvesical approach to be the technique of choice to determine intra-abdominal pressure. Abdominal perfusion pressure is a sensitive marker of intra-abdominal hypertension, and gastric mucosal pH is the first parameter to be affected.
La hipertensión intraabdominal (HIA) se caracteriza por una elevada presión intraabdominal (PIA) que desencadena un conjunto de cambios fisiopatológicos progresivos con potencial para provocar, si no se diagnostica y corrige a tiempo, un síndrome compartimental abdominal (SCA) que conducirá a una disfunción multiorgánica y a la muerte del paciente1.
Estudios previos concluyen que las principales causas que pueden provocar el aumento de la PIA en enfermos de UCI son la pancreatitis aguda2, el trasplante hepático3,4, la rotura de aneurisma de aorta5 y la obstrucción intestinal6, así como también puede ocurrir en aquellos pacientes a los que se les ha practicado una cirugía abdominal mayor7.
A nivel orgánico, el tracto gastrointestinal es uno de los primeros en afectarse en presencia de un metabolismo inadecuado de oxígeno o disfunción cardiovascular8. Las alteraciones en dicho sistema pueden evaluarse mediante la tonometría, la cual refleja de forma rápida y sensible los cambios en el pH intramucoso gástrico (pHimg)8. Además, el hígado también parece ser particularmente susceptible a sufrir alteraciones cuando se producen aumentos de la PIA, observándose una elevación de la PIA tanto en pacientes con enfermedades hepáticas como cirrosis e incluso en aquellos que han recibido un trasplante hepático3,4.
Complementario a la tonometría, la presión de perfusión abdominal (PPA), indicador del adecuado flujo por los vasos esplácnicos, se considera el mejor índice de supervivencia durante el tratamiento de pacientes con HIA y SCA10.
Por todo ello, el objetivo planteado en este trabajo es el de estudiar, experimentalmente, las consecuencias y repercusiones fisiopatológicas que la HIA ocasiona en la circulación esplácnica en un modelo de ascitis de 20mmHg de presión y así poder relacionar con mayor exactitud el aumento de la PIA y las alteraciones que esta desencadena, comparando 2 tipos de medidas de la PIA, con la finalidad de permitir actuar con más rapidez en el diagnóstico y en la instauración de un tratamiento adecuado.
Material y métodosSe realizó un estudio experimental empleando para ello 10 hembras sanas de la especie porcina raza Large-White con pesos comprendidos entre los 20 y 30kg. El estudio fue aprobado por el comité de ética de experimentación animal de nuestra institución cumpliendo la normativa europea sobre protección de los animales empleados para experimentación y otros fines científicos.
El estudio se inició tras el periodo de adaptación y cuarentena de los animales. Durante todo el procedimiento todos los animales recibieron anestesia general inhalatoria con idéntico protocolo anestésico y de analgesia intraoperatoria.
Los sujetos se dividieron aleatoriamente en 2 grupos de 5 sujetos cada uno, un grupo control (n=5) y un grupo con PIA 20mmHg (n=5). En el grupo control no se elevó la PIA. En el grupo de 20mmHg, para la elevación de la PIA, se creó un modelo de ascitis colocando un trocar umbilical a través del cual se instiló suero salino fisiológico (SFF) en la cavidad abdominal hasta llegar a la presión deseada.
En ambos grupos se registraron los siguientes parámetros en 9 tiempos hasta las 3 h de estudio como se detalla a continuación: T1, basal, tras completa monitorización; T2, tras obtener la presión adecuada (10min en el grupo control); T3, tras 20min de obtener la presión adecuada (periodo de estabilización); T4, tras 30min de T3; T5, tras 60min de T3; T6, tras 90min de T3; T7, tras 120min de T3; T8, tras 150min de T3, y T9, tras 180min de T3.
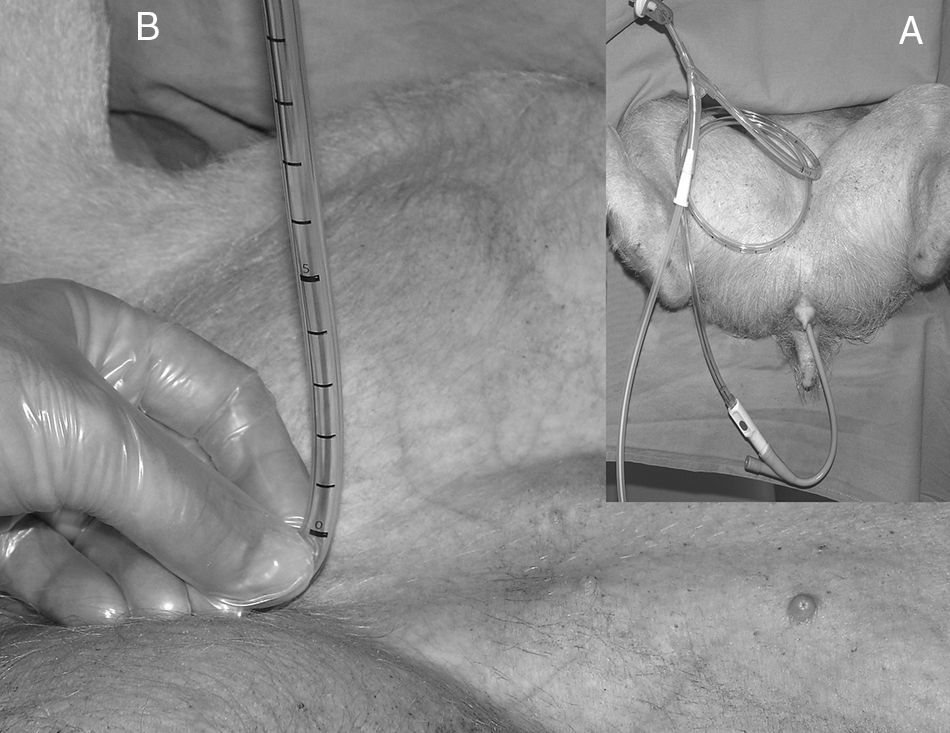
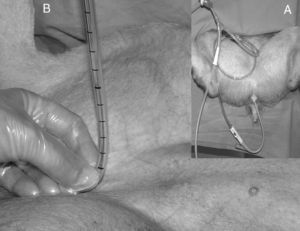
Presión intraabdominal transvesicalSe registró de manera indirecta y de forma intermitente con el animal previamente sondado con un sistema de Foley manómetro (Holtech Medical, Copenhagen, Denmark®) calibrado con marcas en mmHg de 0 a 40mmHg. Para la realización de la medida, se dispuso el sistema entre la sonda de Foley y la bolsa de diuresis y, tras ser purgado con 20ml de suero salino fisiológico, se colocó el 0 del sistema medidor en posición de 90° respecto a la horizontal del animal a nivel de la sínfisis púbica de la cadera. Una vez abierta la pinza para realizar la medida se observa descender en primer lugar el suero fisiológico que ha sido utilizado para la purga del sistema y, posteriormente, la orina contenida en el sistema hasta estabilizarse y proporcionar la medida de la PIA11 (fig. 1).
Presión intraabdominal transperitonealSe calculó de manera continua y de forma directa. Para ello se introdujo un catéter de Jackson-Prat conectado a un traductor de presión en la cavidad abdominal. Dicho catéter a su vez se conectó a un monitor compacto de anestesia S/5TM de General Electric Datex-Ohmeda.
Medida de la presión arterial media y la presión de perfusión abdominalPara la determinación de la presión arterial media (PAM) se empleó el sistema PICCO®.
La PPA se calculó de manera indirecta a partir de la PIA y de la PAM según la fórmula: PPA=PAM-PIA.
Medida de la tonometría gástrica para el cálculo del pH intramucoso gástricoSe empleó la tonometría gástrica continua con tonómetro aéreo. Para ello se introdujo en el estómago un catéter gastrointestinal (TonometricsTM Catheter 14F), conectado a un módulo de tonometría E-Tono, insertado en un monitor compacto de anestesia S/5TM de General Electric Datex-Ohmeda®.
Finalmente, en cada uno de los tiempos descritos se realizó estudio bioquímico determinándose la concentración sérica de la glucosa, el ácido láctico y la alanina aminotransferasa (ALT).
Tras la fase experimental los animales fueron eutanasiados mediante la administración de cloruro potásico (KCl) (1-2mmol/kg) siguiendo las directrices de la American Veterinary Medical Association Panel on Eutanasia12.
Análisis estadísticoSe utilizó el programa informático Statistical Package for the Social Sciences versión 15.0 (SPSS, Chicago, IL). De acuerdo con la naturaleza de los datos, se utilizaron pruebas paramétricas para el análisis estadístico de los mismos. En cada uno de los tiempos, para la comparación entre grupos 2 a 2, se realizó la prueba t de Student. La evolución de los parámetros fue analizada mediante un análisis multivarianza, ANOVA de medidas repetidas. El grado de correlación de las variables se determinó mediante el coeficiente de correlación de Pearson entre cada 2 variables. Un valor de p<0,05 fue considerado significativo.
ResultadosEn todos los animales se consiguió obtener la presión deseada, no observándose complicaciones en el modelo descrito.
En la figura 2 se puede observar que existió un alto grado de correlación positiva entre la PIA transvesical y la presión transperitoneal.
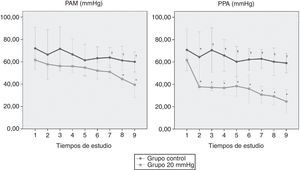
La PPA y la PAM (fig. 3) se mantuvieron dentro de los límites de normalidad en el grupo control. Por el contrario, en el grupo de 20mmHg se observó una reducción progresiva de ambos parámetros a lo largo del tiempo apreciando cambios significativos más precoces en la PPA. Las diferencias respecto al grupo control tuvieron lugar desde la creación del modelo en el caso de la PPA (p=0,019) y a partir de las 2 h de estudio en el caso de la PAM (p=0,031).
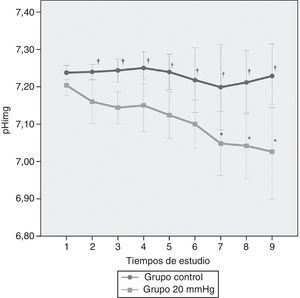
Tal y como queda reflejado en la figura 4, el pHimg mostró un descenso significativo a lo largo del tiempo a presiones de 20mmHg a partir de los 120min tras la creación del modelo (p<0,05). Sin embargo, las diferencias estadísticamente significativas entre presiones tuvieron lugar desde el inicio de la experiencia (p<0,02).
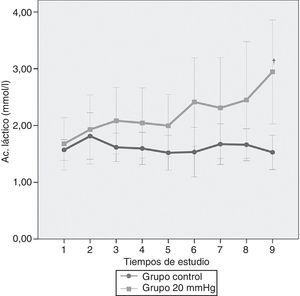
En la figura 5 se puede apreciar la variación del ácido láctico en los 2 grupos de estudio a lo largo del tiempo. A pesar de observarse un aumento a presiones de 20mmHg, este no llegó a ser significativo a lo largo del tiempo, sin embargo las diferencias estadísticamente significativas entre presiones se observan al final del estudio (p<0,011).
En relación con las correlaciones, el estudio estadístico mostró una buena correlación de la PPA tanto con el pHimg (r=0,666) como con el ácido láctico (r=−0,633).
En la tabla 1 se muestran los parámetros sanguíneos hepáticos medidos en los 2 grupos; en ella puede apreciarse a 20mmHg una disminución de la glucosa a lo largo del tiempo sin llegar a ser significativa. No se observan alteraciones significativas en la ALT.
Valores de los parámetros sanguíneos hepáticos recogidos a lo largo del estudio en los grupos de presión intraabdominal 20 y 30mmHg durante 3h
| Parámetros sanguíneos hepáticos | Tiempos de estudio | Grupo control | Grupo PIA 20mmHg |
| Glucosa (mg/dl) | T1 | 65,40±1,94 | 84,40±39,25 |
| T2 | 64,80±1,92 | 77,00±34,99 | |
| T3 | 94,40±10,73* | 67,20±28,34 | |
| T4 | 99,00±8,91* | 68,00±32,65 | |
| T5 | 87,60±3,43* | 62,36±39,96 | |
| T6 | 84,40±8,96 | 58,79±31,73 | |
| T7 | 61,80±11,27 | 54,80±28,05 | |
| T8 | 58,20±11,43 | 46,05±26,91 | |
| T9 | 82,40±19,13 | 43,24±26,81 | |
| Alanina aminotransferasa (ALT, UI/l) | T1 | 35,80±10,18 | 25,00±9,32 |
| T2 | 35,60±11,39 | 30,20±8,55 | |
| T3 | 37,20±8,07 | 29,20±10,98 | |
| T4 | 36,40±10,96 | 29,00±7,51 | |
| T5 | 36,60±9,93 | 27,20±5,01 | |
| T6 | 36,20±9,49 | 28,40±6,42 | |
| T7 | 38,20±11,03 | 29,60±6,80 | |
| T8 | 35,40±9,12 | 33,20±4,20 | |
| T9 | 35,80±8,49 | 34,00±3,16 |
El modelo desarrollado nos ha permitido determinar precozmente las consecuencias fisiopatológicas sobre la circulación esplácnica que ocurren ante una elevación de la PIA, reproduciendo de manera eficaz las alteraciones producidas en la clínica humana. A pesar de ser conocidos desde el siglo pasado los efectos adversos de la elevación de la PIA, su estudio y aplicación clínica es una problemática que ha resurgido en la última década al aumentar la conciencia de la gran relevancia que comparten. De este modo, los datos obtenidos a partir de trabajos experimentales y estudios clínicos ponen de manifiesto que los efectos adversos que provoca una PIA elevada pueden aparecer incluso antes de que el SCA sea clínicamente evidente13,14. Por todo ello, en este estudio se ha desarrollado un modelo de ascitis a 20mmHg con la finalidad de llegar a conocer precozmente las consecuencias y repercusiones fisiopatológicas que la HIA-SCA ocasionan en la circulación esplácnica correlacionando 2 técnicas de medida de la PIA para determinar si la PIA-TV puede ser considerada una buena técnica indirecta de medida de la PIA.
En relación con la realización de la medida de la PIA, la Sociedad Mundial del Síndrome Compartimental Abdominal definió por consenso la medida de la presión transvesical como la técnica indirecta de elección para determinar la PIA1. La técnica de manometría empleada en este estudio ya ha sido empleada en un trabajo previo de nuestro equipo investigador11, así como por otros autores15, demostrando que es un método fácil de realizar y seguro. En este estudio se corroboran estos resultados mostrando una alta correlación con la medida transperitoneal, por lo que consideramos esta técnica como la de elección en pacientes con HIA.
Estudios previos han comprobado que el aumento de la PIA ocasiona alteraciones en la circulación esplácnica, provocando una disminución en la perfusión y el pH de la mucosa gastrointestinal, lo que predispone a un fallo multiorgánico16. En pacientes con HIA la medida de la PIA no puede utilizarse como único objetivo terapéutico debido a la variabilidad entre individuos. De esta forma, Cheatham et al.10 propusieron, por primera vez, el concepto de PPA como predictor de la supervivencia. Esto está en concordancia con nuestros resultados, donde se observó una disminución significativa de la PPA coincidiendo con estudios previos17,18; sin embargo, a diferencia de ellos, donde realizan una sola medida tras establecer la PIA, consideramos que la PPA debe tenerse en cuenta siempre en relación con el estado del paciente observando su evolución a lo largo del tiempo para, de este modo, poder detectar alteraciones precoces de este parámetro. En relación con esto, nuestros resultados también muestran una correlación buena de la PPA con el pHimg y el ácido láctico. Dichos parámetros han sido considerados como marcadores de hipoperfusión por varios autores19. De este modo, corroboramos los resultados de otros autores10 y consideramos que la PPA evalúa tanto la gravedad del aumento de la PIA del paciente como la adaptación de la perfusión abdominal.
Respecto a la hipoperfusión esplácnica, trabajos previos muestran en pacientes críticos disminuciones del pHimg con una estabilidad hemodinámica, incluso antes de que las manifestaciones del SCA sean evidentes20; este hecho está en concordancia con nuestros resultados, donde se observa una disminución significativa más precoz en el pHimg que en la PAM. Nuestros resultados también muestran una disminución del ácido láctico a lo largo del tiempo, sin embargo, y debido a que se ha comprobado que dicho parámetro también aumenta por otras causas y de forma similar a otros estudios clínicos21, observamos que estas alteraciones son más precoces en el pHimg que en el ácido láctico. Por todo ello, coincidimos con Portas et al.22 y con estudios previos de nuestro equipo investigador9 en que el conocimiento precoz del pHimg puede alertarnos de una hipoperfusión intestinal que puede preceder a otras complicaciones sistémicas.
En cuanto a la funcionalidad hepática, series previas han demostrado deterioro de la función celular y de la perfusión hepática ante elevaciones leves de la PIA3,14 observándose disminuciones del flujo hepático a presiones de 10 mmHg23. Estos resultados son acordes con los observados en trabajos previos de nuestro equipo investigador en los que se aprecia una reducción en el diámetro de la aorta y de las venas cava y porta24. De esta forma, del mismo modo que ocurre en el intestino, la reducción del flujo sanguíneo va a afectar negativamente a la función metabólica hepática que se traduce en una disminución en la depuración de lactato, el metabolismo de la glucosa y de la función mitocondrial23. Esto coincide con nuestros resultados, puesto que un hallazgo importante en este trabajo es la hipoglucemia observada a lo largo del tiempo a 20mmHg de PIA. Esto lo atribuimos posiblemente a una alteración en la funcionalidad hepática que impide la realización de la glucogénesis y, por tanto, que el ácido láctico se convierta en glucosa, acumulándose en sangre como hemos comentado anteriormente. Así pues, tras lo anteriormente expuesto y a pesar de que durante todos los tiempos registrados la ALT se encontró dentro de los límites de normalidad, podemos decir que nuestros resultados preliminares muestran afectación hepática. Sin embargo, para corroborar estos resultados consideramos importante realizar tanto estudios histopatológicos posteriores que determinen el daño celular hepático, como la ampliación de las horas de estudio para determinar si se produce la afectación de dichos parámetros, debido a que en humanos se ha observado elevación de dichas enzimas a partir de las 12h25.
En función de nuestros resultados preliminares podemos concluir que el modelo experimental desarrollado permite evaluar de manera segura, eficaz y reproducible los cambios ocasionados por el aumento de la PIA, siendo la PPA un marcador sensitivo y específico de la HIA. Por otro lado, el uso de una técnica mínimamente invasiva permite observar precozmente la sensibilidad de la mucosa gástrica ante el aumento de la PIA, siendo el pHimg un factor pronóstico de esta complicación.
En general, consideramos que los resultados de este trabajo podrían tener una gran implicación clínica, debido a que la HIA es una situación clínica que está siendo subvalorada y la mayoría de los pacientes con enfermedad abdominal progresan hacia un SCA. De este modo, este estudio tendría un gran interés en los beneficios que aportaría a los pacientes ingresados en las plantas de cirugía, medicina del aparato digestivo y en las UCI, traduciéndose en un diagnóstico precoz, basándose en los parámetros estudiados en este trabajo, los cuales son indicativos de hipoperfusión esplácnica. En la práctica clínica diaria la determinación del ácido láctico es más factible que la del pHimg, por lo que, y siempre en correlación del estado del paciente, la realización de pruebas sanguíneas que nos indiquen aumento de este parámetro junto con una disminución de la PPA y una aumento de la PIA serían indicativos de que se podría estar desarrollando un SCA. Todo ello permitiría así una mayor celeridad a la hora de establecer el tratamiento y evitaría un mayor número de complicaciones y morbimortalidad. Además, los beneficios de este trabajo podrían suponer una mejora en la calidad asistencial para los pacientes atendidos en el sistema de salud. Por todo ello, en trabajos futuros plantearemos aumentar el número de sujetos, así como prolongar las horas de estudio de nuestro modelo experimental que corroboren, completen y confirmen nuestros resultados preliminares. De este modo, también se realizarán estudios histopatológicos a nivel hepático y gastrointestinal para confirmar si se produce afectación microscópica en estos órganos.
FinanciaciónEste trabajo ha sido subvencionado por la Fundación para la Formación y la Investigación de los Profesionales de la Salud de Extremadura (Fundesalud).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al personal del Área Quirúrgica del Centro de Cirugía de Mínima Invasión Jesús Usón.