Los fármacos antivirales frente al virus de la hepatitis C (VHC) presentan un número importante de interacciones. El objetivo de este estudio es describir la interacción de telaprevir, boceprevir y sofosbuvir con los fármacos inmunosupresores en pacientes trasplantados.
MétodosEstudio observacional retrospectivo de pacientes trasplantados hepáticos con infección por VHC que iniciaron tratamiento con telaprevir, boceprevir o sofosbuvir. Se recogieron las dosis, pautas posológicas y niveles plasmáticos de tacrolimus, ciclosporina y sirolimus previas y posteriores al inicio del tratamiento antiviral. Se calculó la variación media de dosis e intervalo de dosificación, así como la modificación de los niveles de inmunosupresor tras iniciar el tratamiento.
ResultadosSe incluyeron 35 pacientes. En pacientes tratados con telaprevir (n=18), la dosis de ciclosporina se redujo una media de 59,1% (SD=14,6%), obteniéndose una reducción media de 14,6% (18,8%) en los niveles plasmáticos. En cuanto a tacrolimus, la dosis se redujo en un 34,3% (31,7%) aumentando el intervalo de dosificación una media de 73,4 (38,2) horas. Con ello, los niveles se incrementaron un 59,7% (89,6%).
En los pacientes tratados con boceprevir (n=4), tacrolimus se inició con una reducción del 18,1% (9,8%) de la dosis inicial y un aumento medio en el intervalo de dosificación de 12,0 (16,9) horas, observándose una reducción media del 37,7% (21,8%) en los niveles plasmáticos. El tratamiento con sofosbuvir (n=13) no mostró variaciones importantes en los niveles de inmunosupresores.
ConclusionesLa interacción de telaprevir y boceprevir con los fármacos inmunosupresores requiere un ajuste de la dosis previa de los mismos al inicio del tratamiento, así como una monitorización rigurosa de sus niveles plasmáticos.
Antiviral drugs for the treatment of hepatitis C virus (HCV) infections have a large number of interactions. The aim of this study was to describe the interactions of telaprevir, boceprevir and sofosbuvir with immunosuppressive drugs in liver transplant recipients.
MethodsA retrospective observational study was performed in liver transplant patients with HCV infection who started treatment with telaprevir, boceprevir or sofosbuvir. Dose, regimens and plasma levels of tacrolimus, cyclosporine and sirolimus before and after antiviral treatment initiation were collected. Average variations in dose, dosing interval and immunosuppressive plasma levels after the start of treatment were calculated.
ResultsThirty-five patients were included. In patients treated with telaprevir (n=18), the cyclosporine dose was reduced by an average of 59.1% (SD=14.6%), yielding an average reduction of 14.6% (18.8%) in plasma levels. The dose of tacrolimus was reduced by 34.3% (31.7%), increasing the dosing interval by a mean of 73.4 (38.2) hours. After this variation, tacrolimus levels were increased by an average of 59.7% (89.6%).
In patients treated with boceprevir (n=4), tacrolimus started with a reduction of 18.1% (9.8%) of the initial dose and an average increase in the dosing interval of 12.0 (16.9) hours, showing a mean reduction in plasma levels of 37.7% (21.8%). Sofosbuvir therapy (n=13) showed no significant variations in immunosuppressive drug levels.
ConclusionsThe interaction of telaprevir and boceprevir with immunosuppressive drugs requires a substantial dose reduction at the beginning of treatment and close monitoring of plasma levels.
La infección por el virus de la hepatitis C (VHC) constituye una de las principales causas de hepatitis, cirrosis y hepatocarcinoma1,2. Hasta el año 2011, su tratamiento estaba basado en la administración de ribavirina e interferón, alcanzándose una respuesta viral sostenida en el 40-50% de los pacientes3. En el año 2011, con la aparición de nuevas moléculas antivirales directas frente al VHC, se ha comenzado a utilizar una nueva estrategia basada en la incorporación de un tercer fármaco al tratamiento con interferón y ribavirina. Telaprevir y boceprevir, dos inhibidores selectivos de proteasas de serina 3-4, han sido los primeros antivirales directos en comercializarse. Estos fármacos han permitido aumentar el porcentaje de pacientes que alcanzan respuesta viral sostenida a cerca de un 70%4. Sofosbuvir, un inhibidor directo de la nucleótido polimerasa viral5, es el último fármaco antiviral autorizado por la FDA para el tratamiento del VHC.
Entre el 75 y 90% de los pacientes trasplantados por hepatitis secundaria al VHC sufren reinfección tras el trasplante hepático6. Por ello, los nuevos fármacos frente al VHC han comenzado a utilizarse en este grupo de pacientes. Los pocos datos publicados hasta el momento otorgan a estos fármacos una tasa de respuesta del 40-70% en pacientes trasplantados7,8.
Se han identificado tres grandes problemas asociados al uso de estos fármacos: la adherencia debido a la complejidad posológica, su toxicidad, fundamentalmente cutánea y hematológica y por último el elevado número de interacciones farmacológicas asociadas a boceprevir y telaprevir9,10.
El uso de boceprevir y telaprevir junto a ciclosporina y tacrolimus presenta una elevada complejidad debido a la fuerte interacción existente entre estos medicamentos10,11. Por otro lado, los limitados datos disponibles con sofosbuvir en voluntarios sanos muestran que este fármaco no presenta interacción relevante con los fármacos inmunosupresores12.
El objetivo de este estudio es evaluar la interacción farmacológica entre los nuevos fármacos antivirales empleados en el tratamiento de la hepatitis C y la terapia inmunosupresora en pacientes con trasplante hepático.
MétodosSe diseñó un estudio observacional retrospectivo. Se incluyeron todos los pacientes con trasplante hepático que tuvieron reinfección por VHC tras el trasplante y que recibieron tratamiento antiviral con telaprevir, boceprevir o sofosbuvir durante el periodo de enero de 2012 a septiembre de 2013.
Los datos demográficos, las fechas de inicio de la terapia antiviral así como las dosis de inmunosupresores recibidos por los pacientes se obtuvieron a partir de la historia clínica informatizada y la base de datos de dispensaciones de la Unidad de Atención Farmacéutica a Pacientes Externos del hospital.
Para analizar la interacción entre estos se comparó la media de los tres niveles valle (Co) de ciclosporina, tacrolimus y sirolimus y sus respectivas pautas posológicas de las tres determinaciones previas, así como de las determinaciones realizadas durante los dos meses posteriores al inicio del tratamiento con telaprevir, boceprevir o sofosbuvir. La reducción de dosis así como de niveles plasmáticos se expresaron como porcentaje respecto a los niveles y dosis previas al inicio del tratamiento.
Los niveles plasmáticos de inmunosupresores de los pacientes se recogieron de las determinaciones realizadas en práctica clínica habitual a través del equipo Dimension® (Siemens Healthcare).
Así mismo, se recogió la presencia de fármacos inductores e inhibidores potentes del CYP3A4 y glucoproteína-P en los pacientes tratados, con el fin de establecer su posible influencia en los niveles plasmáticos de los fármacos inmunosupresores.
Por otro lado, se evaluó la presencia de posibles efectos adversos asociados a la elevación de concentraciones plasmáticas de inmunosupresores, incluyendo empeoramiento de función renal, definida como aumento del grado de insuficiencia renal de acuerdo a los criterios establecidos en Common Terminology Criteria for Adverse Events (CTCAE) v4.0, presencia de temblores o convulsiones, así como el desarrollo de infecciones durante los dos primeros meses de tratamiento.
ResultadosSe incluyeron un total de 40 pacientes en el estudio (77,5% hombres). La triple terapia antiviral se inició con una mediana de dos años y ocho meses (rango: 2 meses-25 años) tras el trasplante hepático.
De los 40 pacientes, en cinco no fue posible determinar el grado de interacción: dos pacientes cambiaron el tratamiento inmunosupresor de ciclosporina a tacrolimus mientras que en tres pacientes se suspendió el tratamiento con ciclosporina o tacrolimus al inicio del tratamiento anti-VHC debido a la presencia de insuficiencia renal, manteniéndose la inmunosupresión con ácido micofenólico y prednisona.
De los 35 pacientes restantes, 18 pacientes fueron tratados con telaprevir, cuatro con boceprevir y 13 con sofosbuvir.
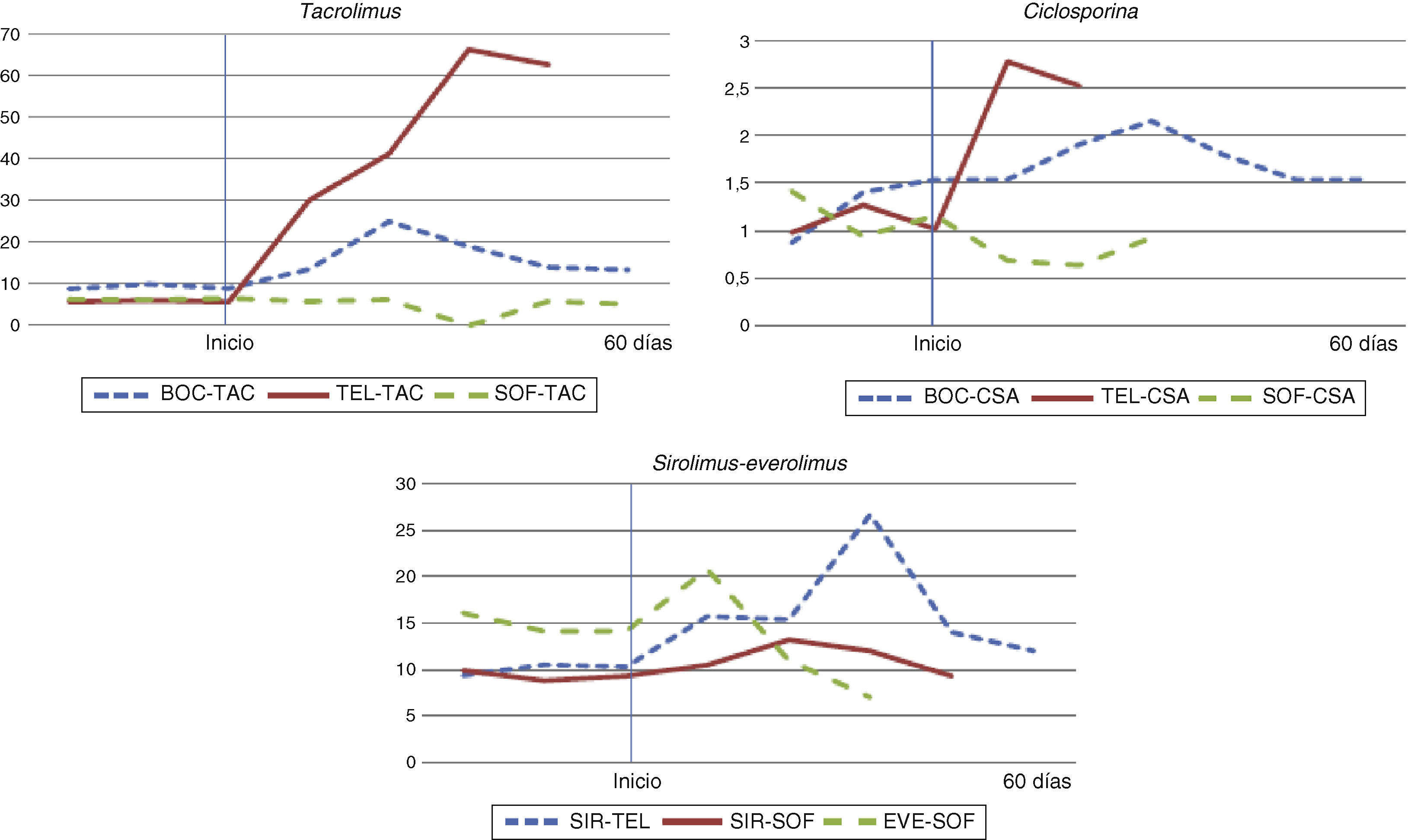
De los 18 pacientes que recibieron telaprevir, ocho mantuvieron el tratamiento con ciclosporina, ocho con tacrolimus y dos con sirolimus. El uso de ciclosporina con telaprevir generó una reducción media de la dosis diaria de ciclosporina de un 59,1% (SD=14,6%) con respecto a la dosis inicial, observándose con esta medida una reducción media del 14,6% (18,8%) de los niveles plasmáticos previos al tratamiento. En cuanto al tratamiento con tacrolimus, el inicio de tratamiento con telaprevir condujo a un ajuste de dosis e intervalo posológico en todos los pacientes, con un descenso medio de la dosis diaria de un 34,3% (31,7%) y un aumento medio de 73,4 (38,2) horas en el intervalo de dosificación. A pesar de ello, los niveles de tacrolimus se incrementaron en un 59,7% (89,6%) con respecto a los niveles basales, observándose un aumento progresivo de los niveles durante el tratamiento. Únicamente dos pacientes recibieron tratamiento simultáneo con telaprevir y sirolimus. En uno de los pacientes no se modificó la dosis ni la pauta de administración al iniciar el tratamiento. En este paciente, los niveles de sirolimus se incrementaron un 30,5%. En el otro paciente, se mantuvo la misma dosis y se aumentó el intervalo de dosificación progresivamente hasta llegar a las 144 horas, observándose a pesar de ello un aumento del 22,9% en los niveles de sirolimus.
En solo cuatro pacientes se pudo observar la interacción entre boceprevir y los inmunosupresores; tres pacientes recibieron tacrolimus y uno ciclosporina. Con respecto al tratamiento con tacrolimus, el tratamiento se inició con una reducción del 18,1% (9,8%) de la dosis inicial y un aumento en el intervalo de dosificación de 12,0 (16,9) horas, observándose una reducción media en los niveles del 37,7% (21,8%). Un único paciente recibió ciclosporina junto a boceprevir, obteniéndose con una reducción de su dosis diaria del 79,8% y un descenso del 64,6% de los niveles plasmáticos iniciales.
Con respecto al tratamiento con sofosbuvir, en dos pacientes en los que se administró junto a ciclosporina, la mediana de reducción de dosis durante el tratamiento fue del 54,2% (17,6%), observándose con esta reducción una disminución de los niveles de ciclosporina del 36,1% (13,3%). En los nueve pacientes en los que se administró junto a tacrolimus, la reducción media de dosis fue del 12,6% (35,3%). Los niveles de este se redujeron un 3,3% (44,0%). Un único paciente recibió sirolimus junto a sofosbuvir, obteniéndose un incremento de los niveles medios de sirolimus de un 43,0% sin haberse modificado la dosis de inmunosupresor. Otro paciente recibió tratamiento con everolimus, reduciéndose su dosis al iniciar el tratamiento un 40,0%, generándose una reducción en sus niveles plasmáticos de un 47,9%.
La evolución de los niveles plasmáticos de inmunosupresores ponderados por la dosis diaria recibida se encuentra reflejada en la figura 1.
Evolución del parámetro Cmin/dosis de inmunosupresores antes y después de iniciar el tratamiento con telaprevir, boceprevir o sofosbuvir.
Resultados expresados en Cmin (concentración valle de inmunosupresor (ng/mL)/dosis de inmunosupresor recibida (mg).
BOC: boceprevir; CSA: ciclosporina; EVE: everolimus; SIR: sirolimus; SOF: sofosbuvir; TAC: tacrolimus; TEL: telaprevir.
No se encontraron pacientes con fármacos inductores o inhibidores potentes del CYP3A4 o glucoproteína-P en los dos primeros meses de inicio de tratamiento antiviral.
En lo que respecta a la aparición de efectos adversos, el 47,1% de los pacientes con telaprevir presentaron empeoramiento de su función renal durante los dos primeros meses de tratamiento. Un solo paciente del grupo de boceprevir y otro paciente del grupo de sofosbuvir presentaron deterioro de función renal en comparación con su estado previo al tratamiento. No obstante, solo el 50% de los pacientes con deterioro de función renal mostraron niveles plasmáticos valle de inmunosupresores más elevados en comparación con los niveles previos al inicio de tratamiento. Una paciente en tratamiento con ciclosporina desarrolló temblores tras iniciar el tratamiento con boceprevir. Esta paciente no presentó niveles valle de ciclosporina elevados tras iniciar el tratamiento con boceprevir. Con respecto a la presencia de infecciones, un total de cuatro pacientes desarrollaron infecciones respiratorias tras iniciar el tratamiento antiviral, dos con telaprevir, dos con boceprevir y uno con sofosbuvir. Uno de estos pacientes presentaba niveles plasmáticos de tacrolimus por encima de 15ng/mL en el momento del diagnóstico de la infección.
DiscusiónEl uso de telaprevir y boceprevir se ha asociando a un número muy importante de interacciones10. Los resultados de nuestro estudio muestran la importancia de la interacción con los fármacos inmunosupresores. Como limitaciones del mismo encontramos el reducido número de pacientes, especialmente con boceprevir, así como la variabilidad de ajustes posológicos al inicio del tratamiento antiviral, lo que dificulta la comparación de niveles plasmáticos previos y posteriores al inicio del tratamiento.
La interacción de los nuevos fármacos frente al VHC con los fármacos inmunosupresores es conocida desde los inicios de su desarrollo clínico. Los resultados de un ensayo clínico en fase I13 mostraron que con la administración de una dosis única de ciclosporina de 100mg junto a una dosis única de telaprevir se obtenían unos valores de AUC 4,6 veces superiores y una semivida de 12 a 42 horas más prolongada de ciclosporina. Por su parte, los niveles de tacrolimus se incrementaron hasta 70 veces y la semivida de eliminación de 40 a 196 horas. Los mecanismos que explican esta interacción se basan por un lado en el efecto sustrato inhibidor de telaprevir sobre el citocromo P450 isoenzima 3AE y por otro en la inhibición de proteínas trasportadoras en hígado y riñón, entre ellas la glucoproteína P14. Los fármacos inmunosupresores se ven claramente afectados por los fármacos inhibidores de los CYP3A y de la glucoproteína P15.
Por otro lado, boceprevir actúa también como potente inhibidor del CYP 3A4 y 3A5 además de ser sustrato no inhibidor de la glucoproteína P. Se ha estimado que la administración concomitante de boceprevir con ciclosporina y tacrolimus aumenta los valores de AUC en 2,7 y 17 veces respectivamente16.
En julio de 2012, la AEMPS estableció unas recomendaciones para la dosificación de ciclosporina y tacrolimus en pacientes trasplantados hepáticos que inician tratamiento con boceprevir o telaprevir. En estas recomendaciones se establecía que en el caso de tratamiento con boceprevir se debería reducir la dosis de ciclosporina a la mitad el día del inicio del tratamiento antiviral y espaciar su administración a cada 24 horas. En cuanto al uso concomitante con tacrolimus, se recomendaba reducir la dosis 1/10 el día del inicio del tratamiento y espaciar la administración a cada 24 horas. En nuestros pacientes, se optó por una reducción menor de la dosis de tacrolimus (solo un 18,1%) y un aumento del intervalo de dosificación de 24 a 48 horas, resultando estas medidas suficientes para evitar el aumento de los niveles de tacrolimus. En un estudio reciente en pacientes trasplantados, la reducción de la dosis diaria de ciclosporina y tacrolimus con boceprevir fue del 36 y 78% respectivamente8.
En el caso de tratamiento con telaprevir, se recomendaba reducir la dosis de ciclosporina a la mitad el día del inicio del tratamiento y espaciar la administración a 48 horas. En ocho pacientes de nuestro estudio, con la reducción de dosis diaria del 59% se consiguió reducir los niveles de ciclosporina un 16,6%. En cuanto a tacrolimus, las recomendaciones establecían que se debería reducir la dosis 1/10 el día del inicio del tratamiento con telaprevir y espaciar su administración a pautas de cada 48-72 horas. En nuestros pacientes la reducción de dosis fue inferior a la recomendada (un 34,3%), aumentándose el intervalo de dosificación una media de 73 horas. Con estos ajustes se produjeron aumentos importantes de los niveles de tacrolimus. Parece por tanto necesaria una reducción de dosis de al menos un 50% acompañada del aumento del intervalo de dosificación de más de 48 horas para evitar aumentos importantes en los niveles plasmáticos de tacrolimus.
Dos pacientes cambiaron su tratamiento inmunosupresor de tacrolimus a ciclosporina al iniciar tratamiento antiviral. De acuerdo a las recomendaciones de la AEMPS este cambio está recomendado en aquellos pacientes con recidiva grave e inmunosupresión no estable, ya que el manejo de ciclosporina junto con telaprevir y boceprevir es menos complejo.
Con respecto a sirolimus, aún no se han publicado estudios de interacción de la administración conjunta con estos fármacos. No obstante, los niveles plasmáticos de sirolimus se ven aumentados por inhibidores potentes del CYP450 y glucoproteína P17. En nuestro estudio, en el paciente al que se administró telaprevir junto a sirolimus sin modificación de dosis del inmunosupresor sí se observó un incremento importante de las concentraciones plasmáticas del mismo.
El uso de sofosbuvir no resultó en incrementos relevantes de los niveles plasmáticos de ciclosporina o tacrolimus. Sofosbuvir y su metabolito intermedio GS-566500 actúan como sustratos de la glucoproteína P. El metabolito GS-331007, en el que se transforma más del 90% de este fármaco, no actúa como sustrato de esta glucoproteína, de tal forma que no parece haber interacciones relevantes con los fármacos inmunosupresores12. No obstante, un único paciente de nuestro estudio tratado con sirolimus sí presentó elevación importante de los niveles plasmáticos al iniciar el tratamiento con sofosbuvir. Por otro lado, en el paciente en tratamiento con everolimus la reducción de dosis al iniciar sofosbuvir se asoció a una reducción de sus niveles plasmáticos, no observándose ningún tipo de interacción.
No se han encontrado pacientes con fármacos inductores o inhibidores potentes del CYP3A4 o glucoproteína-P durante el inicio de tratamiento antiviral. No obstante, la presencia de estos fármacos debe de ser evaluada a la hora de iniciar el tratamiento, ya que afectan de forma significativa a las concentraciones plasmáticas tanto de inmunosupresores como de los propios fármacos antivirales10,18.
Con respecto al perfil de toxicidad, un número importante de pacientes presentaron algún efecto adverso relacionado con los fármacos inmunosupresores. A pesar de que la mayoría de ellos no presentaban incrementos importantes en los niveles plasmáticos valle (Cmin) en el momento en que se produjeron los mismos, se ha de tener en cuenta que en casi todos los pacientes, la exposición a niveles elevados de ciclosporina, tacrolimus y sirolimus se mantuvo durante más tiempo, ya que los niveles valles se midieron en la mayoría de los casos en tiempos superiores a 24 horas. Por otro lado, se ha de considerar que los nuevos fármacos antivirales también contribuyen pos sí mismos a la aparición de estos efectos adversos, independientemente del tratamiento inmunosupresor.
En resumen, los pacientes con trasplante hepático que inician triple terapia antiviral con telaprevir o boceprevir requieren ajustar la dosis de inmunosupresión en el momento de inicio del tratamiento y mantener un estrecho seguimiento farmacocinético para evitar la aparición de efectos adversos derivados de las altas concentraciones plasmáticas de inmunosupresores secundarias a la interacción con estos medicamentos. Sofosbuvir no parece provocar modificaciones relevantes de los niveles de inmunosupresores. Son necesarios estudios con mayor número de pacientes para establecer recomendaciones de ajuste de dosis a la hora de iniciar tratamiento con los nuevos fármacos frente al VHC en pacientes trasplantados.
Conflicto de interésLos autores declaran no tener ningún conflicto de intereses.