La gastrectomía tubular es uno de los principales tratamientos en cirugía bariátrica y otras enfermedades1. Pese a su abordaje laparoscópico, presenta complicaciones, siendo una de las más frecuentes la dehiscencia de sutura (entre el 0,6 y el 7%)2,3.
Aunque su tratamiento tradicionalmente ha sido quirúrgico, cada vez más se opta por técnicas mínimamente invasivas como drenaje externo de colecciones, colocación de clips, pegamentos biológicos, clips Ovesco®, sistema de sutura Overstitch® y colocación endoscópica de prótesis metálicas autoexpandibles con posibilidad de extracción1,4–6.
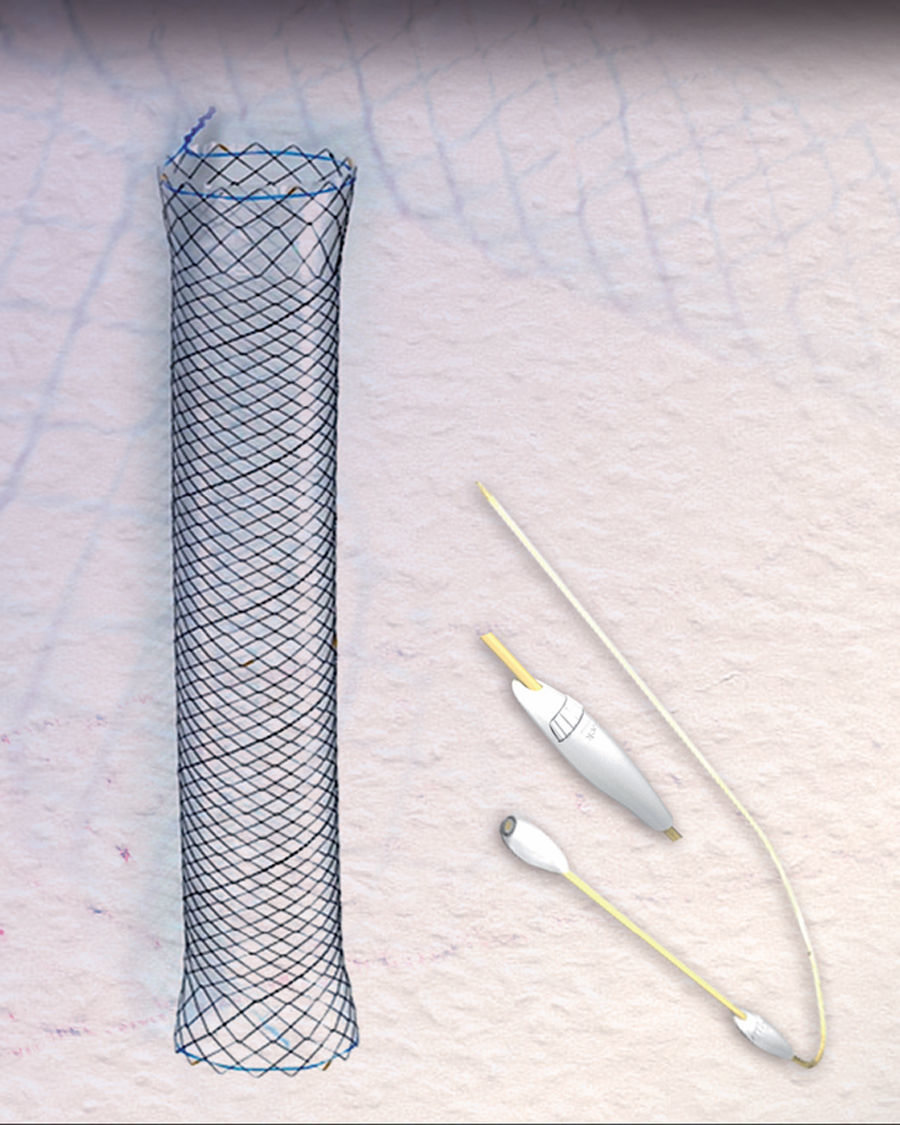
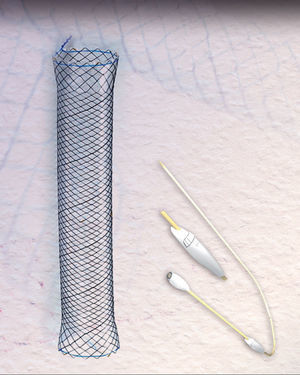
El éxito con estas prótesis es de aproximadamente el 80%, variando del 50 al 100%, según las series4–10. Sin embargo, la migración y la mala tolerancia siguen presentando una limitación importante4,5,7,10. En los últimos años disponemos de una nueva prótesis metálica totalmente recubierta HANAROSTENT® Bariatric (fig. 1) diseñada para pacientes con dehiscencia de sutura tras gastrectomía tubular, con una forma adaptada a esta cirugía para evitar su migración, incrementando teóricamente el cierre de la fuga.
Para observar si se producen estas supuestas ventajas respecto a las anteriores prótesis, la utilizamos en 3 pacientes. La cirugía fue laparoscópica y se procedió al alta hospitalaria precoz (72-96h poscirugía), previo inicio de tolerancia oral y realización de un tránsito esofagogastroduodenal (TEGD) para descartar fuga anastomótica. Utilizamos la prótesis de mayor longitud (240mm) ya que era la idónea para cubrir las áreas anastomóticas de esófago, sleeve y estómago con anclaje en área prepilórica con intención de evitar la migración, que era el principal problema que teníamos con las prótesis anteriores. Se colocaron con gastroscopio estándar bajo sedación profunda y las maniobras de extracción y recolocación se realizaron traccionando los extremos mediante pinza de biopsias. Se comprobó su correcta colocación por control radiológico. Se inició tolerancia oral el mismo día de su colocación, con dieta líquida las primeras 24h y, posteriormente, dieta blanda, siendo dados de alta a las 24-48h, salvo que precisaran mayor tiempo de ingreso por complicaciones derivadas de la dehiscencia.
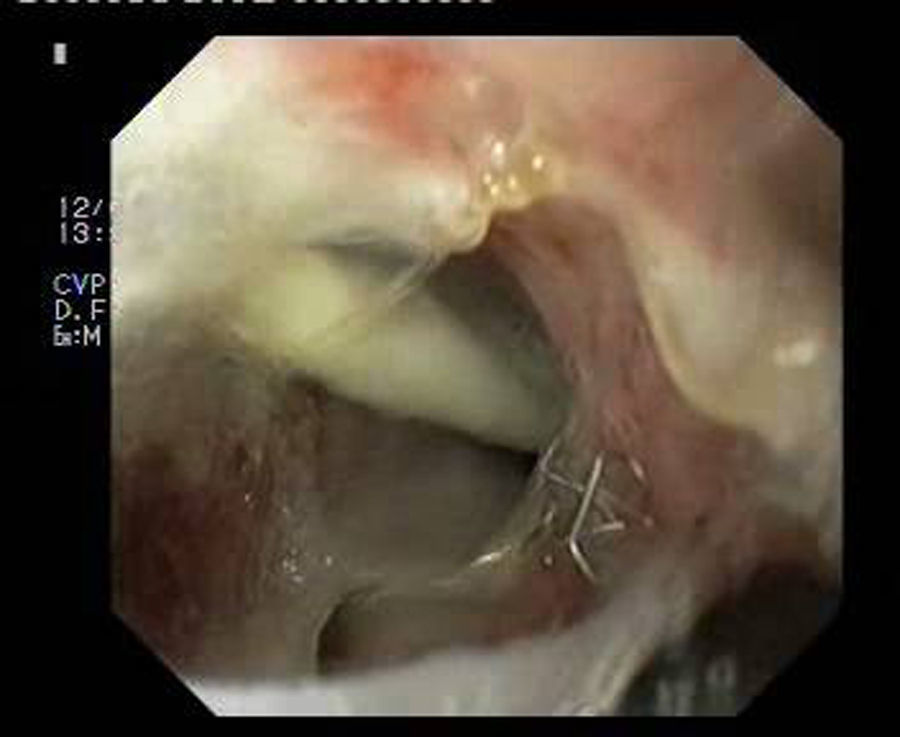
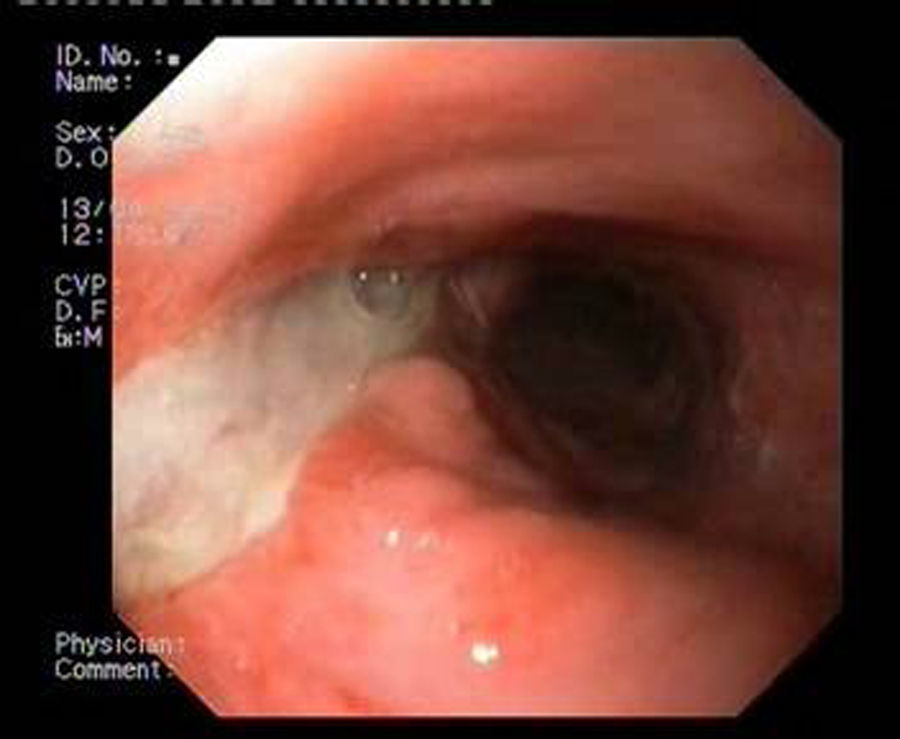
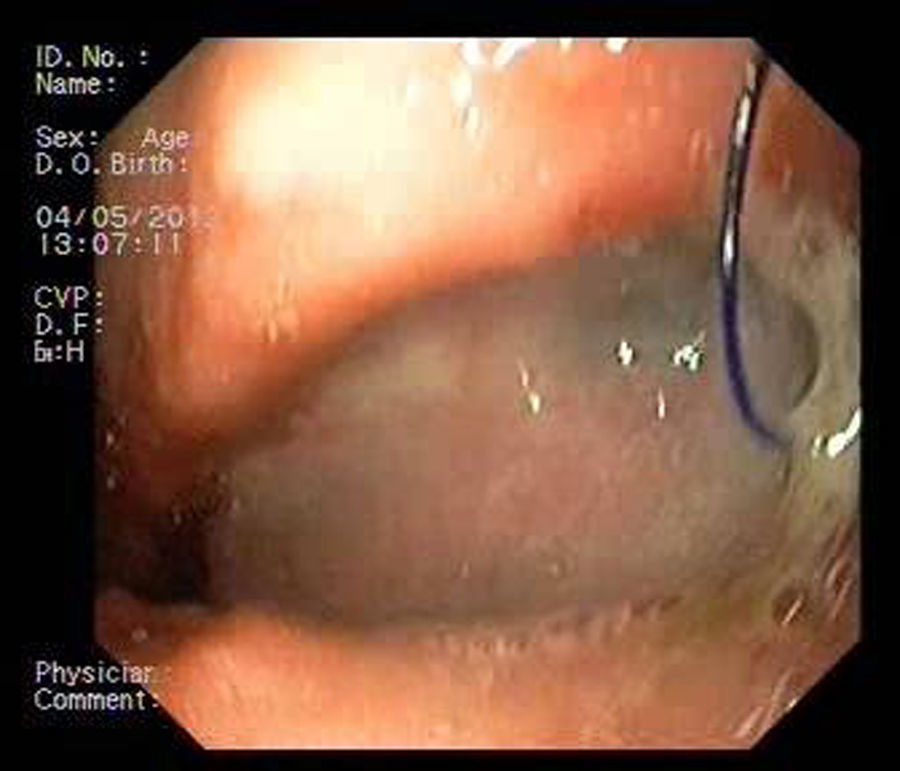
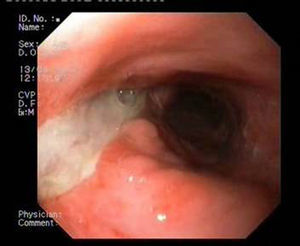
Paciente 1Mujer de 46 años intervenida de obesidad mórbida. A los 10 días presenta dolor abdominal, observando una colección intraabdominal por dehiscencia de sutura, realizando cirugía urgente con sutura y refuerzo con ligamento y dejando drenajes externos. Dos semanas después, dado el alto débito por el tubo de drenaje, se realiza gastroscopia que evidencia dehiscencia amplia de sutura de 40mm de diámetro (fig. 2). Se decide finalmente colocar la prótesis 8 semanas tras la cirugía, e iniciar tolerancia oral. La radiografía de control observa invaginación de la malla metálica hacia la luz, resolviéndose con movilización endoscópica de la misma. Cinco semanas después de su colocación, se retira la prótesis, evidenciando el cierre total de la fístula (fig. 3). El paciente presentó dolor retrotorácico que se controló con mórficos.
Paciente 2Mujer de 58 años intervenida de obesidad mórbida. Pasados 3 meses se observa una pequeña fuga mediante un TEGD, evidenciando en la gastroscopia dos orificios fistulosos menores de 5mm en la anastomosis. Dado el pequeño diámetro de los orificios se opta por tratamiento endoscópico con pegamento biológico. Aunque la evolución clínica es muy favorable no se consigue el sellado de las fístulas, por lo que decidimos colocar la prótesis pasados 2 años y medio de la cirugía. La paciente presenta mala tolerancia y a las 3 semanas el TEGD evidencia persistencia de fuga de contraste por el orificio fistuloso aunque parece estar correctamente colocada. Se opta por retirarla, apreciando en la gastroscopia que estaba invaginada.
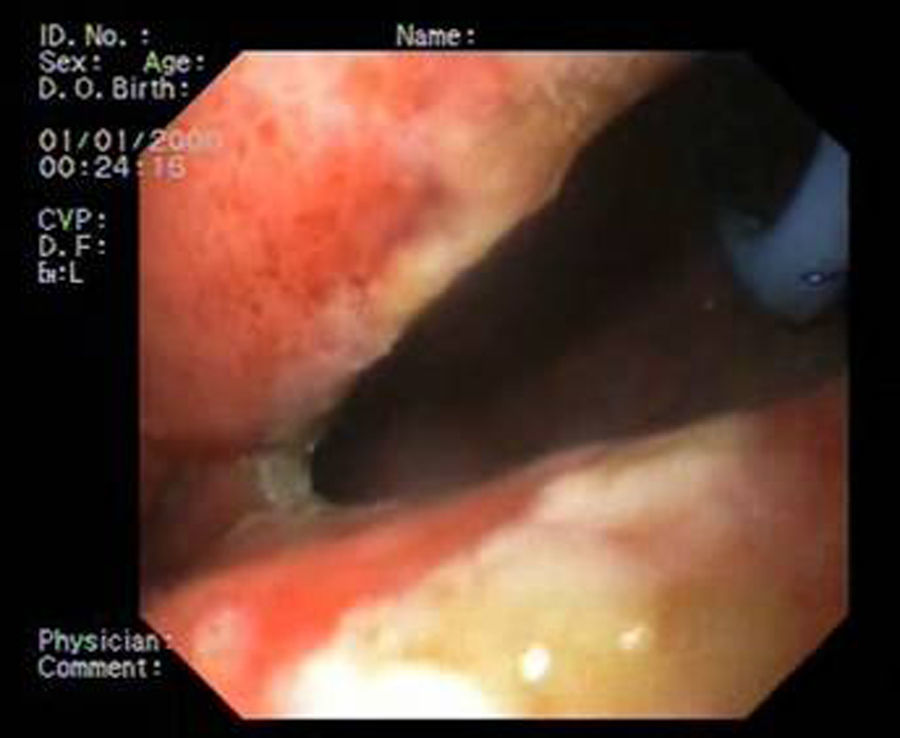
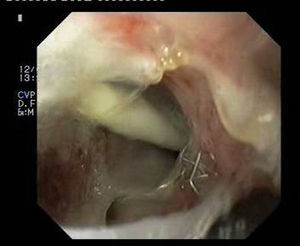
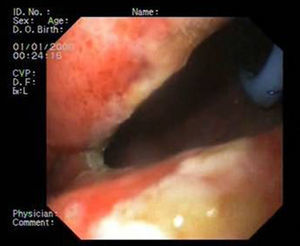
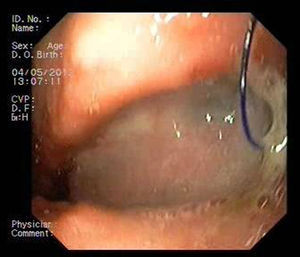
Paciente 3Varón de 64 años intervenido de adenocarcinoma de tercio inferior esofágico mediante gastrectomía tubular más esofaguectomía distal con anastomosis esofagogástrica. A las 2 semanas el paciente ingresa con una neumonía por colección paraesofágica secundaria a fuga en la región anastomótica por dehiscencia de sutura de 30mm de diámetro (fig. 4). Se procede a drenaje externo y a la colocación de la prótesis pasadas 6 semanas de la cirugía. A pesar de su correcta expansión, existía angulación persistente en su tercio medio, que desaparece tras su recolocación endoscópica. No obstante, el TEGD observa una pequeña extravasación de contraste, evidenciando mediante gastroscopia una rotura en la membrana de silicona de la prótesis, que se sella con cianocrilato en spray. Se retira la prótesis a las 6 semanas, apreciando 2 pequeños orificios fistulosos remanentes de 2-3mm que se resuelven con 3 sesiones de pegamento biológico (fig. 5).
Se obtuvo el éxito técnico (capacidad para la correcta colocación, movilización y extracción vía endoscópica de la prótesis) en los 3 pacientes y el éxito clínico (resolución de la fuga) en 2. Los resultados descritos en la literatura respecto al éxito clínico con las anteriores prótesis son similares a los nuestros4–9.
No se observaron complicaciones inmediatas, pero sí tardías, con acodamiento y/o invaginación de la prótesis en los 3 casos. En el paciente 3 se produjo una rotura de la membrana de silicona de la prótesis y 2 pacientes presentaron dolor retroesternal. Sin embargo, no observamos migración de la prótesis (tabla 1).
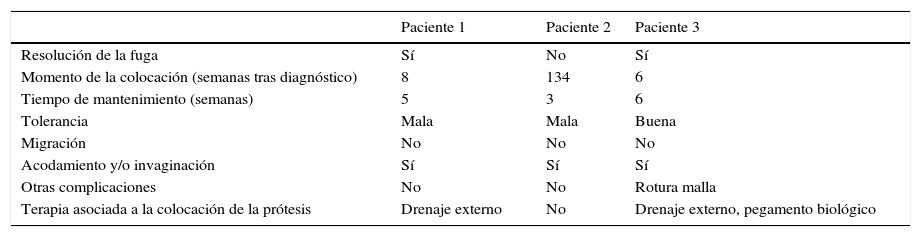
Resultados con la prótesis HANAROSTENT® Bariatric en nuestros 3 pacientes
| Paciente 1 | Paciente 2 | Paciente 3 | |
|---|---|---|---|
| Resolución de la fuga | Sí | No | Sí |
| Momento de la colocación (semanas tras diagnóstico) | 8 | 134 | 6 |
| Tiempo de mantenimiento (semanas) | 5 | 3 | 6 |
| Tolerancia | Mala | Mala | Buena |
| Migración | No | No | No |
| Acodamiento y/o invaginación | Sí | Sí | Sí |
| Otras complicaciones | No | No | Rotura malla |
| Terapia asociada a la colocación de la prótesis | Drenaje externo | No | Drenaje externo, pegamento biológico |
El fracaso terapéutico del paciente 2 creemos que está en relación con la cronicidad de esta prótesis, ya que varios estudios han demostrado que el éxito del cierre de la fuga está íntimamente relacionado con la inserción precoz de la prótesis tras la dehiscencia5,7,10. Además existía invaginación de la prótesis, que solo observamos durante su retirada, que también podría estar implicada en este fracaso.
El uso combinado con el drenaje externo de las colecciones en fase aguda o el uso de pegamentos biológicos tras la retirada de la misma pueden aumentar la eficacia de la prótesis, como se demuestra en nuestro paciente 3. También hemos observado que ante pequeñas roturas en la prótesis es viable el sellado del defecto con cianocrilato en spray.
Intentamos mantener la prótesis 6 semanas, ya que lo recomienda la bibliografía7,10. Sin embargo, solo se mantuvo ese tiempo en un paciente. Destacamos que el dolor retrotorácico condicionó que retiraramos la prótesis en la semana 5 en el paciente 1 porque creíamos, tal y como confirmamos, que se había cerrado la fístula, y en la semana 3 en el paciente 2, porque dado que persistía la fuga, consideramos que ya no se iba a resolver alargando el tratamiento. Por tanto, si bien fue un problema importante, se podía controlar con analgesia y no fue el único motivo de la interrupción precoz del tratamiento en estos 2 pacientes.
Pese a que no observamos migración, sí que se produjeron acodamiento e invaginación, solucionándose con la recolocación endoscópica de la prótesis. Tanto esto como la mala tolerancia creemos que son debidos a la gran longitud de la prótesis que elegimos, especialmente en su porción esofágica. La siguiente evolución de esta prótesis consta de una reducción de esta porción, lo que teóricamente minimizará estos efectos adversos. Nos queda la duda sobre la aparición de estas complicaciones si hubiéramos elegido prótesis de menor longitud, aunque en este caso creemos que podríamos haber tenido migración.
Recomendamos realizar endoscopia precoz a las 24-48h para comprobar la correcta colocación y expansión de la prótesis y, posteriormente, siempre que se sospechen complicaciones, ya que los estudios radiológicos no siempre las detectan. En caso de querer prolongar la prótesis a 6 semanas, recomendamos gastroscopia a las 4 semanas, porque hemos observado tendencia a la hiperplasia mucosa por el decúbito, siendo útil su movilización para evitar la fijación de la prótesis y facilitar la posterior retirada.
Nuestras limitaciones son el bajo número de pacientes y que estos son manejados inicialmente por servicios diferentes al nuestro, dificultando así su selección.
Concluimos que estas prótesis deben ser consideradas como una herramienta más en el tratamiento precoz de la dehiscencia de sutura, ya que aunque no hemos observado que sean mejores que las anteriores (salvo por la ausencia de migración), los resultados obtenidos son esperanzadores. Es importante elegir el tamaño de la prótesis que mejor se adapte al paciente, para evitar problemas de mala tolerancia y acodamiento que dificulten el cierre de las fístulas. Creemos que las siguientes evoluciones de estas prótesis aumentarán el éxito clínico al disminuir las complicaciones, aunque serán necesarios estudios al respecto.
Conflicto de interesesLos autores aseguran no tener ningún conflicto de intereses.