Se presenta el caso de una paciente con diagnóstico previo de cirrosis biliar primaria (CBP) y hepatitis B crónica en fase de portador inactivo que, en tratamiento con ácido ursodesoxicólico, presentó elevación de las transaminasas, sin datos de reactivación de su hepatitis B crónica. Se realizó biopsia hepática en la que se observaron cambios compatibles con hepatitis autoinmune (HAI) sobreañadida. Las alteraciones analíticas respondieron al tratamiento con budesonida. Se realiza una revisión sobre la entidad clínica del síndrome de solapamiento CBP-HAI y las características especiales de esta paciente para alcanzar el diagnóstico y su tratamiento.
We describe the case of a female patient with a previous diagnosis of primary biliary cirrhosis (PBC) and chronic hepatitis B in inactive phase who developed increased transaminase levels with no evidence of hepatitis B virus reactivation while receiving ursodeoxycholic acid treatment. A liver biopsy showed changes compatible with overlapping autoimmune hepatitis (AIH). Budesonide treatment achieved normalization of transaminase levels. We provide a review of PBC and AIH overlap syndrome and discuss the particular features of this case that led us to this diagnosis, as well as the treatment provided.
La cirrosis biliar primaria (CBP) y la hepatitis autoinmunitaria (HAI) son las 2 principales enfermedades de base inmunológica hepáticas. Habitualmente son diferenciables sin dificultad. La CBP es una enfermedad hepática crónica de tipo colestásico caracterizada por la presencia de anticuerpos antimitocondriales (AMA) e histológicamente por la destrucción de patogenia autoinmunitaria de los ductos biliares intrahepáticos de pequeño y mediano calibre1,2. En cambio, la HAI es una enfermedad hepática necroinflamatoria crónica caracterizada por la presencia de autoanticuerpos circulantes, hipergammaglobulinemia con valores elevados de inmunoglobulina G (IgG) y una lesión histológica necroinflamatoria con hepatitis de interfase e infiltrado inflamatorio linfoplasmocitario3. Si bien el antígeno diana, y por tanto la célula afectada, y su expresión clínica son diferentes, sus mecanismos etiopatogénicos son similares2,4. El desarrollo de la enfermedad hepática autoinmune se basa en una etiología desconocida en cuya patogenia interviene una compleja interacción entre factores desencadenantes medioambientales sobre una susceptibilidad genética y una alteración en los mecanismos de regulación del sistema inmunológico con pérdida de la autotolerancia4.
Dada esta patogenia común, es conocida y frecuente la asociación de las enfermedades inmunológicas hepáticas con otras que afectan a otros órganos y sistemas de la economía, y viceversa. Así, también, existe expresión de alguna de las características típicas de una de las enfermedades inmunológicas hepáticas en otra, llegando incluso al diagnóstico de los llamados síndromes de solapamiento hepático, con la dificultad clínica de su diagnóstico y tratamiento en la práctica clínica1,5. El síndrome de solapamiento CBP-HAI es infrecuente, con una prevalencia de la expresión de las características típicas de ambas enfermedades, en el mismo paciente con sospecha de CBP, en torno al 10%6. Pero todavía es más inusual la transición de una enfermedad inmunológica hepática a la otra o la presentación del síndrome overlap de forma secuencial y no en el diagnóstico inicial de la enfermedad hepática7.
A continuación presentamos el caso de una paciente que con diagnóstico clínico e histológico de CBP desarrolló en su evolución una HAI que constituyó un síndrome de solapamiento CBP-HAI, consiguiéndose un control adecuado con la introducción de tratamiento inmunosupresor asociado al tratamiento previo con ácido ursodesoxicólico (AUDC). Todo ello complicado con la presencia en la misma paciente de una hepatitis B crónica (HBC).
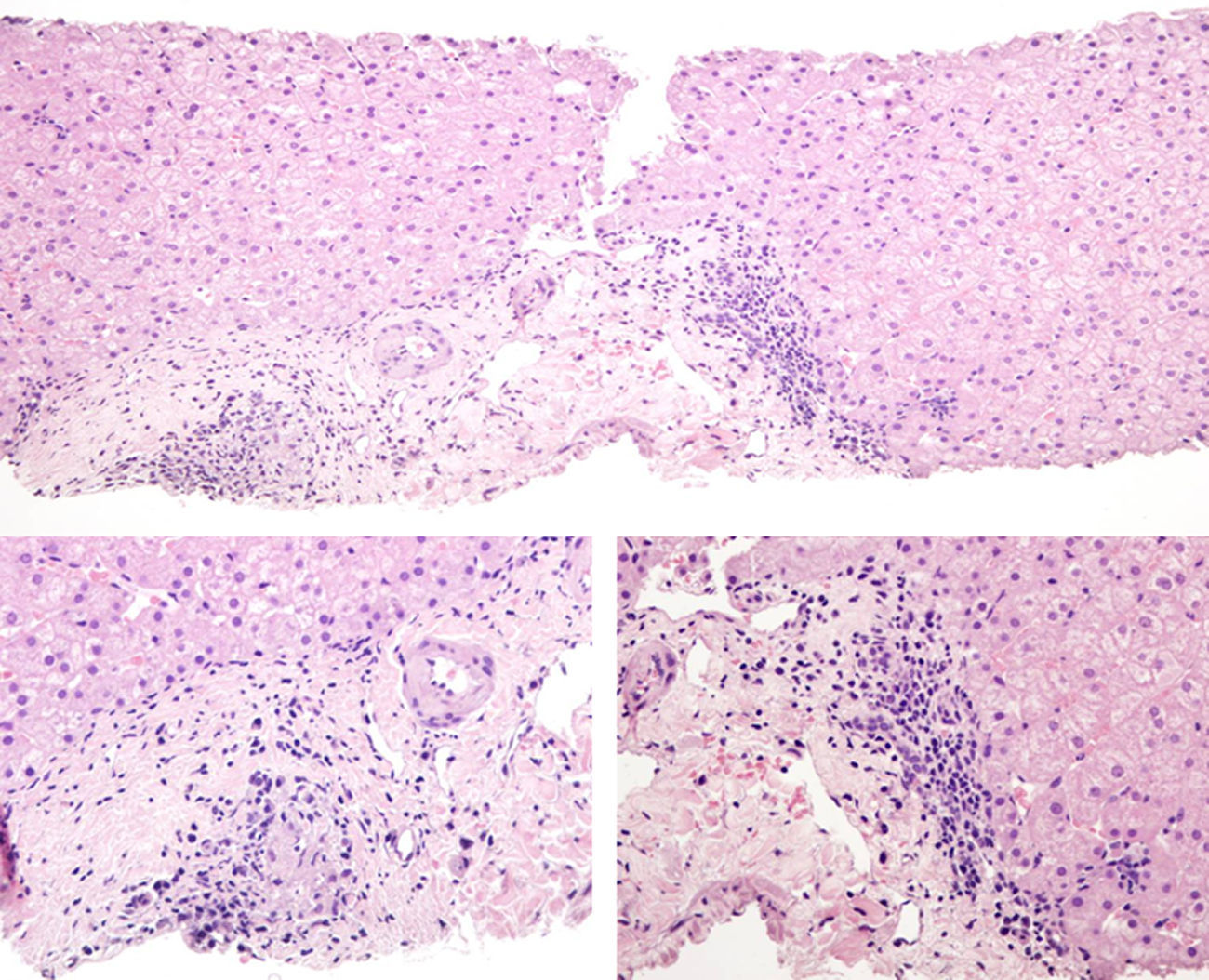
Observación clínicaPaciente mujer de 53 años derivada desde atención primaria para su seguimiento en la consulta de digestivo, tras evaluación inicial en su hospital previo de referencia con informe clínico con los diagnósticos de HBC y CBP. El diagnóstico de CBP se realizó ante la presencia de AMA anti-M2 en valores 1/2.560, colestasis disociada significativa, niveles elevados de IgM y biopsia hepática percutánea, realizada 4 meses antes de su derivación, con el resultado de cilindro hepático con arquitectura conservada y con cambios histológicos compatibles con CBP. No se demostró la presencia de hepatocitos esmerilados ni detección por inmunohistoquímica de antígeno del core o superficie de la hepatitis B (fig. 1). La paciente estaba en tratamiento con AUDC en una dosis de unos 10mg/kg y se encontraba asintomática en su primera valoración.
Biopsia hepática. Se muestra espacio porta de forma global y en 2 áreas con mayor detalle donde se observa infiltrado inflamatorio de moderada intensidad constituido por linfocitos y células plasmáticas con tendencia a la focalidad, disponiéndose en torno a los conductillos biliares y la interfase. El epitelio de los conductillos biliares no se visualiza en ocasiones en relación con el denso infiltrado inflamatorio y muestra signos regenerativos (HE, ×10 y ×20).
Se solicitó estudio inicial obteniéndose unos resultados de Hb 13,8g/dl, plaquetas 238.000/μ3, leucocitos 4.230/μ3, glucosa 90mg/dl, creatinina 0,94mg/dl, bilirrubina total 0,3mg/dl, GOT 39 U/l, GPT 32 U/l, GGT 238 U/l, FA 148 U/l, albúmina 4g/dl, INR 1, colesterol total 251mg/dl (HDL 79mg/dl, LDL 149mg/dl), IgG 2.100mg/dl, IgM 274mg/dl, anticuerpos antinucleares (ANA) positivos a 1/320, AMA (anti-M2) positivos a 1/320, con antimúsculo liso (AML) negativos y HBsAg positivo, HBeAg negativo, anti-HBe positivo y ADN del virus de la hepatitis B (VHB) de 2.833 UI/ml. Se observa por tanto leve colestasis disociada, con elevación de IgG e IgM, positividad de AMA y ANA, estos últimos informados con patrón Dots y AMA, y HBC con ADN-VHB en límite alto para su valoración como portador inactivo. Se aumentó la dosis de AUDC a unos 15mg/kg.
En las siguientes 2 revisiones, con periodicidad semestral, se observaron niveles de GOT y GPT en torno a 30-40 U/l y descenso progresivo de GGT y FA, en el segundo control con valores de 45 y 107 U/l, respectivamente, y con niveles ADN VHB < 2.000 U/ml. Todo ello era compatible con una buena evolución analítica con el tratamiento pautado y se continuó con controles analíticos y revisiones semestrales.
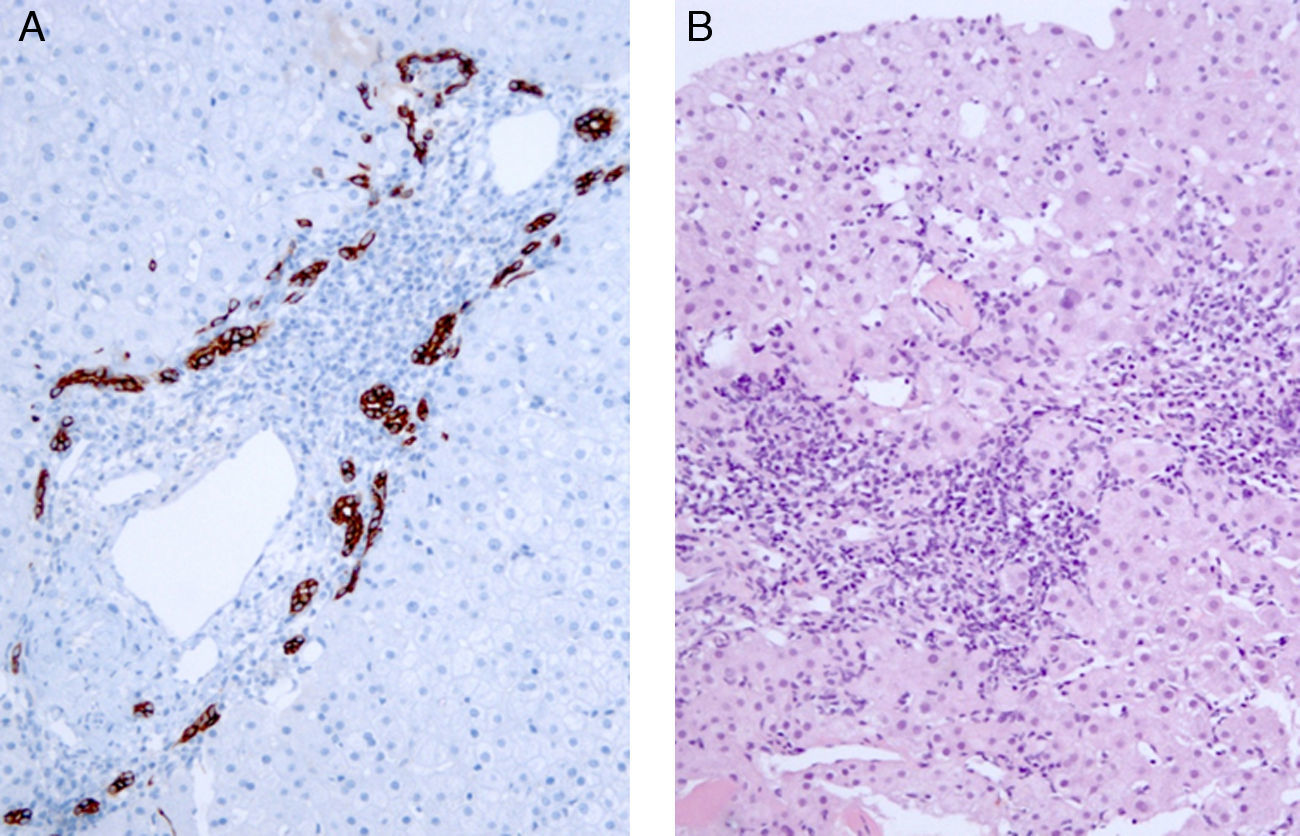
En el control clínico, aproximadamente un año después, se observó un significativo cambio en los parámetros analíticos con bilirrubina total 0,4mg/dl, GOT 80 U/l, GPT 90 U/l, FA 105 U/l y GGT 58 U/l. Persistía elevada la IgG en similares cifras con normalización de IgM, 228mg/dl. No se observó reactivación de su HBC al presentar ADN VHB de 588 U/ml. La paciente refiere tomar la medicación de forma correcta, y como único cambio haber iniciado tratamiento adelgazante con dieta e infusiones de un té dietético elaborado con Malva silvestris, Cassia angustifolia, Salvia divinorum y algas marinas, producto anunciado y dispensado en farmacia. Se le recomienda la suspensión del tratamiento adelgazante y se repite la analítica a los 3 meses. En este control se confirma perfil hepático con citolisis en aumento a pesar de haber suspendido la toma del producto adelgazante (bilirrubina total 0,4mg/dl, GPT 130 U/l, GOT 108 U/l, FA 90 U/l y GGT 51 U/l). Se solicita estudio más completo ante la evolución analítica, donde se observan niveles de IgG en torno a 1,5× (2.308mg/dl) con factor reumatoide elevado (78,2 U/ml), GPT 204 U/l, GOT 164 U/l y ADN VHB 320 UI/ml. Se realiza biopsia hepática percutánea, unas 2 semanas más tarde, informada como hepatitis crónica periportal con infiltrado plasmocelular con necrosis erosiva moderada, infiltrados inflamatorios lobulillares con necrosis de hepatocitos focales múltiples y ampliación fibrosa de los espacios porta sin conformar septos. No se observan granulomas ni destrucción de los ductos biliares en el espacio porta pero sí proliferación de ductos biliares en la placa limitante. Se informa por tanto de CBP en estadio ii con significativos cambios necroinflamatorios y necrosis de hepatocitos indicativos de solapamiento con una HAI (fig. 2).
Biopsia hepática. A) Se muestra espacio porta con proliferación de ductos biliares en la placa limitante mediante inmunohistoquímica con citoqueratina 7 (×20). B) Lesión a nivel portal y periportal con hepatitis de la interfase con infiltrado linfoplasmocitario y necrosis erosiva moderada (HE, ×20).
Ante los datos clínicos y el resultado histológico, se diagnostica de un probable síndrome de solapamiento CBP-HAI secuencial y se modifica el tratamiento manteniendo la misma dosis de UDCA y añadiendo budesonida 9mg diarios, entecavir 0,5mg 1 comprimido diario, como tratamiento preventivo de reactivación viral por esteroides, pantoprazol 40mg diarios y suplementos de calcio y vitamina D. En el primer control a los 3 meses de iniciar el tratamiento se observa mejoría analítica franca con GOT y GPT 47 U/l, FA 90 U/l, GGT 25 U/l e IgG 1.935mg/dl. El ADN VHB era indetectable (< 6 U/ml). Al año de inicio del tratamiento existe normalización de todo el patrón hepático, práctica normalización de los valores de IgG, persiste ADN VHB indetectable y se introduce tratamiento con azatioprina en dosis aproximada de 1,5mg/kg (100mg) con descenso de la dosis de budesonida a 6mg diarios. En el último control clínico realizado, a los 6 meses del previo referido, persiste respuesta completa con GOT 20 U/l, GPT 12 U/l, FA 55 U/l, GGT 17 U/l y bilirrubina total 0,5mg/dl, niveles de IgG 1.625mg/dl e IgM 126mg/dl, factor reumatoide normalizado, ANA no detectables y AMA en valores de 1/320, y ADN VHB indetectable.
DiscusiónLa terminología y entidad de los síndromes de solapamiento como enfermedades hepáticas inmunológicas diferenciadas son temas sin un acuerdo completo. El síndrome de solapamiento entre CBP y HAI debiera ser definido cuando existieran en un mismo paciente expresión de las características fundamentales clínicas, bioquímicas e histológicas de ambas enfermedades8,9. Su correcto diagnóstico tiene implicaciones clínicas relevantes en cuanto a las consecuencias pronósticas del tratamiento, diferente cuando ambas se dan por separado, en la historia natural tanto de la CBP como de la HAI1,3,10.
El primer punto importante es alcanzar un correcto diagnóstico de las enfermedades hepáticas inmunológicas. En la HAI se han establecido sistemas de puntuación para su identificación y necesidad de tratamiento esteroideo, siendo la respuesta a este también un criterio diagnóstico11,12. Los criterios diagnósticos revisados del International Autoimmune Hepatitis Group (IAIHG) publicados en 1999 establecen una puntuación para un diagnóstico probable y definitivo, previo y posterior al tratamiento, siendo complejos para su uso en la práctica clínica y con un objetivo inicial de homogeneizar los criterios de diagnóstico de HAI entre centros a la hora de investigación y publicación de estudios, y posibilitar su comparación11. Derivado de estos motivos, más recientemente, este mismo grupo estableció unos criterios simplificados basados en variables típicas de la HAI y que posibilitaría un diagnóstico probable o definitivo más fácil y rápido para la práctica clínica habitual12. Cuando se comparan ambos criterios diagnósticos en la misma cohorte de pacientes se observa una alta concordancia en obtener el diagnóstico de HAI, pero no son intercambiables y según qué situaciones clínicas puede ser más valioso uno que otro. Así, en pacientes con pocas o atípicas manifestaciones, los criterios simplificados pueden infraestimar el diagnóstico de HAI, en cambio presentan mayor especificidad y valor predictivo positivo que los criterios IAIHG revisados, más complejos y dependientes de más variables13,14. En todo caso, hay que recordar que la HAI no tiene características patognomónicas para su diagnóstico y estos criterios nunca deben suplir al juicio clínico del médico. Además, no tienen una validación en series prospectivas de pacientes que evalúen la implicación del diagnóstico, como de su categorización en probable o definitivo, así como en la indicación de la aplicación del tratamiento esteroideo, en el pronóstico del paciente, que es el objetivo clínico fundamental asistencial14.
El diagnóstico de la CBP se basa en la presencia de las características típicas de la enfermedad y en la exclusión de otras causas de daño hepático, en el contexto clínico de un paciente con colestasis crónica1. Así la elevación más marcada de las enzimas de colestasis, como la FA, que las enzimas de citolisis junto con un aumento en el nivel de inmunoglobulinas, principalmente IgM, hacen sospechar el diagnóstico. La presencia de AMA se detecta en al menos el 95% de los pacientes; si bien son característicos de esta entidad y tienen una gran especificidad, no son patognomónicos, pues también se pueden detectar, por ejemplo, en pacientes con HAI, al igual que ANA o AML en la CBP. En todo caso, la conjunción de ambos criterios son suficientes para el diagnóstico de CBP y, en casos dudosos, se deberá recurrir al tercer criterio diagnóstico, la biopsia hepática, que mostrará una colangitis no supurativa con afectación de los ductos biliares interlobulares y septales, y de este modo alcanzar 2 de los 3 criterios que se recomiendan como suficientes para el diagnóstico1.
En este contexto clínico se establece la dificultad para el diagnóstico y tratamiento del síndrome de solapamiento de CBP-HAI1,9. Los criterios diagnósticos más utilizados son los denominados criterios de París que requieren para el diagnóstico la presencia de 2 de los 3 criterios definidos para cada una de las 2 enfermedades6. Así, se establecen para la CBP: 1) aumento al menos 2× de FA o 5x de GGT; 2) positividad AMA, y 3) histología compatible con daño biliar; y con respecto a la HAI: 1) aumento de GPT al menos 5x; 2) aumento al menos 2× IgG o presencia de AML, y 3) presencia de necrosis piecemeal linfocítica periportal o periseptal. Estos criterios han sido reconocidos por la European Association for the Study of the Liver (EASL) pero incidiendo en que para el diagnóstico es fundamental la presencia de hepatitis de interfase15. También para su diagnostico se han aplicado los criterios revisados o simplificados de la IAIHG, previamente comentados, sobre pacientes con CBP, y se observa cómo de la aplicación de unos u otros criterios se modifica la prevalencia del síndrome de solapamiento CBP-HAI, lo que influye en la dificultad del diagnóstico9. Así, en un estudio que comparó los 3 criterios diagnósticos en una cohorte de pacientes con enfermedades inmunológicas hepáticas de un único centro (PBC, HAI y síndrome de solapamiento) concluyó que los criterios de París tenían mejor capacidad diagnóstica que los criterios simplificados y revisados de la IAIHG16. En el caso de nuestra paciente la aplicación de los criterios de París referidos confirma el diagnóstico. La aplicación de los criterios para HAI es más difícil en nuestro caso, primero por la presencia de una HBC en la paciente, como comentaremos y desarrollaremos posteriormente, lo que hace que la puntuación con los criterios simplificados de la IAIHG obtenga una puntuación de 6 puntos, y con los criterios revisados de la IAIHG se obtengan 10 puntos, además tampoco se dispone de estudio HLA pero, a pesar de ello, se alcanza la puntuación mínima para un diagnóstico probable en ambos.
En cuanto a la aplicación del tratamiento dirigido al síndrome de solapamiento CBP-HAI existe también controversia. Como comentamos, el alcanzar el diagnóstico debiera hacernos evaluar un cambio terapéutico para el control de la enfermedad y, por tanto, con implicación pronóstica, si bien estos puntos no están claros y bien definidos. El estudio original que aplicó los criterios de París6 evaluó la respuesta terapéutica en los 12 pacientes en los que se diagnosticó el solapamiento CBP-HAI, concluyendo que el tratamiento combinado AUDC y esteroides es el que obtiene mejores resultados bioquímicos y clínicos. En un estudio posterior del mismo grupo, se evaluó en 17 pacientes seguidos durante una mediana de seguimiento de 7,5 años la respuesta al tratamiento con AUDC (11 pacientes) frente a AUDC más inmunosupresores, siendo la mejor opción y con menor progresión de la lesión histológica la terapia combinada17. A su vez existen estudios publicados que no encuentran diferencia en la respuesta al AUDC entre pacientes con CBP o solapamiento CBP-HAI18. Pero, en todo caso, lo que no existen son estudios prospectivos con un diseño adecuado que hayan evaluado el tratamiento en este grupo de pacientes para obtener una recomendación con evidencia científica firme. Por tanto, el posicionamiento del IAIHG y de las guías clínicas de la EASL para enfermedades colestásicas es el reconocimiento como mejor opción del tratamiento combinado, si bien resaltando la falta de evidencia que respalde y que en pacientes con diagnóstico ya de inicio de solapamiento CBP-HAI se podría tratar inicialmente con AUDC y, si no alcanzara una respuesta, añadir esteroides9,15.
En los pacientes con CBP es conocida la gran prevalencia de osteoporosis, hasta en un tercio de los pacientes1. Por tanto, el uso de esteroides debiera ser realizado con extremo cuidado. En este contexto, el de evitar los efectos secundarios del tratamiento esteroideo sin perder su eficacia, se ha evaluado en pacientes con HAI en un estudio fase iib el tratamiento con budesonida, corticoide de gran potencia, con un importante metabolismo de primer paso hepático y baja disponibilidad sistémica19. En este estudio se demostró que el tratamiento con budesonida frente a prednisona, más azatioprina en ambos grupos, alcanzaba a los 6 meses de tratamiento, de forma superior y estadísticamente significativa, el objetivo primario de normalización de las transaminasas sin provocar efectos secundarios esteroideos (47 frente a 18,4%). En relación con estos resultados, conocidos con anterioridad a su publicación, se pautó en nuestra paciente tratamiento con budesonida, y posteriormente se añadió azatioprina, obteniendo la respuesta completa bioquímica expuesta y, por tanto, pudiendo ser una posibilidad en este tipo de pacientes a los corticoides clásicos, opción que debiera ser validada en estudios diseñados con este objetivo.
Además, el caso de nuestra paciente es más complejo que el ya de por sí diagnóstico de síndrome de solapamiento CBP-HAI, pues además en ella se asociaba una HBC negativa. Dado que una posible reactivación de su HBC era una posible explicación, se controló el nivel de ADN VHB y se evaluó en la biopsia hepática. Así, por los datos basales donde no existía lesión necroinflamatoria ni fibrosis significativas ni indicativas de daño vírico e incluso ni expresión de los antígenos víricos por inmunohistoquímica, se diagnosticó de HBC en fase de portador inactivo, situación que se mantenía dados los niveles de ADN VHB en suero y la persistencia de falta de expresión en la biopsia hepática con el diagnóstico de síndrome de solapamiento CBP-HAI. Su presencia, a pesar de descartar la actividad replicativa vírica, implica una mayor dificultad diagnóstica ya que, como se ha comentado, la presencia de HBsAg positivo es criterio que penaliza en los sistemas de puntuación de los criterios diagnósticos de HAI11,12.
Otro punto a destacar es si su infección crónica por el VHB pudiera tener relación con un posible factor desencadenante del proceso inmunológico, hecho referenciado en la literatura médica4. La base etiopatogénica barajada es la del mimetismo molecular por la que un antígeno externo genera una respuesta inmunológica cruzada frente a un antígeno propio, al compartir secuencias de aminoácidos en su cadena peptídica. Este dato se ha referenciado específicamente en pacientes con HBC al detectarse secuencias de aminoácidos compartidas entre la polimerasa del VHB y las dianas antigénicas de los ANA y los AML20. Esta posible implicación del VHB en la génesis de una HAI ha sido descrita en la práctica clínica en casos aislados, o por una mayor prevalencia de una hepatitis B oculta en pacientes con una enfermedad hepática autoinmune21–23. A su vez, relacionado con la posibilidad de ser desencadenante de la reacción inmunológica autoinmunitaria, está el hecho de la toma de productos adelgazantes y su hepatotoxicidad. En nuestro caso eran infusiones, no la toma del extracto de las plantas implicadas, su suspensión no conllevó una mejoría y no existe evidencia publicada firme de su implicación en reacciones de hepatotoxicidad, por lo que se descartó como causa24.
Por último, es importante tener en cuenta en pacientes con HBC la necesidad de tratamiento antiviral profiláctico cuando se va a precisar un tratamiento inmunosupresor. Para su prescripción se tuvo en cuenta que el tratamiento iba a ser a largo plazo, combinado con 2 fármacos en gran parte del mismo y que la paciente había llegado a presentar una determinación de ADN VHB superior a 2.000 U/ml en una ocasión, por lo que se decidió tratamiento con un antiviral de elevada potencia y baja posibilidad de resistencias como entecavir. Fundamentos que son apoyados en las guías de práctica clínica más recientes25.
En conclusión, presentamos un caso de especial y de compleja evaluación, que pone de manifiesto la dificultad para el diagnóstico de los síndromes de solapamiento, con el añadido además de su presentación secuencial, la aplicación de nuevos tratamientos y la dificultad diagnóstica e implicaciones clínicas en pacientes con otras causas coincidentes de enfermedad hepática, como la HBC que presentaba la paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.