La administración de infliximab puede provocar la aparición de reacciones infusionales (RI) agudas o retardadas que pueden ser causa de la suspensión del tratamiento. Nuestro objetivo fue conocer la frecuencia de aparición de RI en pacientes con una enfermedad inflamatoria intestinal que han recibido tratamiento con infliximab, utilizando un protocolo de premedicación con un esteroide y un antihistamínico.
MétodosEstudio prospectivo en 100 pacientes consecutivos (74 con enfermedad de Crohn y 26 con colitis ulcerosa) tratados con infliximab en pauta de inducción (3 dosis: semanas 0, 2 y 6), seguida o no de terapia de mantenimiento cada 8 semanas. Se administraron por vía intravenosa, de forma sistemática 30 min antes de cada infusión, 100 mg de hidrocortisona y 5 mg de dexclorfeniramina.
ResultadosLa media de edad de los pacientes era de 40,9±13 años; un 51% eran mujeres y un 38%, fumadores. El 92% de los pacientes recibía tratamiento inmunomodulador de base con azatioprina/mercaptopurina (85%) o metotrexato (7%). El número total de infusiones fue de 560 (media de 5,6 por paciente; rango, 1-21). El 56% de los pacientes siguió un tratamiento de mantenimiento. La media de seguimiento fue de 17±16 meses. Se produjeron RI en el 6% de los pacientes y en el 1,4% de todas las infusiones (8/560). Todas las RI fueron leves o moderadas. Cinco pacientes presentaron RI inmediatas tras la segunda dosis. Una paciente presentó una RI retardada en forma de exantema a los 5 días de la segunda infusión. El tratamiento con infliximab se suspendió únicamente en 3 casos: el paciente que presentó la RI retardada y 2 de los pacientes con RI inmediatas que reaparecieron durante la tercera infusión.
ConclusiónEn los pacientes con una enfermedad inflamatoria intestinal, bajo profilaxis con inmunomoduladores, la premedicación con un esteroide y un antihistamínico se asocia a una baja tasa de RI por infliximab. El tratamiento con infliximab sólo se suspendió en el 3% de los casos tras un estrecho seguimiento.
Infliximab can provoke acute or delayed infusion reactions (IR) leading to treatment withdrawal. Our aim was to determine the frequency of IR in patients with inflammatory bowel disease receiving intravenous infliximab and premedicated with steroids and antihistaminics.
MethodsWe prospectively studied 100 consecutive patients (74 with Crohn's disease, 26 with ulcerative colitis) treated with infliximab induction therapy (3 doses: weeks 0-2-6), followed or not by maintenance every 8 weeks. All patients were premedicated with 100 mg i.v. hydrocortisone and 5 mg i.v. dexchlorpheniramine 30 min before each infusion.
ResultsThe mean age was 40.9±13 years (51% females, and 38% smokers). Ninety-two percent of the patients were under immunomodulator therapy (azathioprine/ mercaptopurine 85% or methotrexate 7%). A total of 560 infusions were administered, with a mean of 5.6 per patient (range, 1-21). Fifty-six percent of the patients received maintenance therapy. The mean length of follow-up was 17±16 months. IR occurred in 6 patients (6%) and in 1.4% of all infusions (8/560). All reactions were mild or moderate. Five IR were immediate, occurring in the second infusion. One IR was delayed (exanthema 5 days after the second infusion). Infliximab therapy was discontinued in only 3 patients (in the patient with the delayed IR and in 2 patients with immediate IR that reappeared during the third infusion).
ConclusionIn patients with inflammatory bowel disease treated with infliximab and under immunomodulator therapy, premedication with steroids and antihistaminics was associated with a low prevalence of IR. Moreover, after close follow-up, infliximab had to be discontinued in only 3% of the patients.
Infliximab (IFX) es un anticuerpo monoclonal quimérico IgG1 frente al factor de necrosis tumoral alfa (TNFα) con una parte humana y otra murina, que constituye una terapia eficaz para el tratamiento de la enfermedad de Crohn y de la colitis ulcerosa. Se ha descrito que la infusión de IFX puede provocar la aparición de reacciones infusionales (RI) tanto agudas, en las primeras 24 h, como retardadas, pasadas 24 h hasta 14 días tras la infusión del fármaco. Las RI pueden aparecer en el 5-20% de los pacientes, y pueden ser causa de la suspensión del tratamiento con IFX. La administración de IFX puede originar la formación de anticuerpos frente al fármaco (ATI) que pueden desempeñar un importante papel en la aparición de las mencionadas RI. Se ha descrito que el sistema inmunitario puede producir anticuerpos frente a las regiones Fv, Fc o epítopos murinos de IFX1.
El objetivo de nuestro estudio era conocer la frecuencia con que se produce tanto la aparición de las RI como la retirada del tratamiento debido a éstas, en pacientes con una enfermedad inflamatoria intestinal (EII) que han recibido tratamiento con IFX, utilizando de forma sistemática un protocolo de premedicación con un esteroide y un antihistamínico.
MATERIAL Y MÉTODOSPara alcanzar los objetivos, se estudiaron de forma prospectiva 100 pacientes consecutivos diagnosticados adecuadamente de EII2 (74 con enfermedad de Crohn y 26 con colitis ulcerosa) tratados con IFX (Remicade ®, Schering & Plough) en pauta de inducción (3 dosis: semanas 0, 2 y 6), seguida o no de terapia de mantenimiento cada 8 semanas. Siguiendo el protocolo de administración de IFX aprobado en nuestro centro, se pautaron por vía intravenosa, de forma sistemática 30 min antes de cada infusión, 100 mg de hidrocortisona, excepto cuando los pacientes estaban en tratamiento con esteroides, en cuyo caso se administraba una dosis equivalente de metilprednisolona, y 5 mg de dexclorfeniramina. Se recogieron los datos demográficos, los relativos a su enfermedad de base, los fármacos que tomaba para su EII, la fecha de inicio de los tratamientos, y los antecedentes de alergia a fármacos y de otras alergias. Se realizó un estudio estadístico descriptivo mediante el programa SPSS 12.0, calculando los porcentajes y su intervalo de confianza (IC) del 95%, la media y el rango.
RESULTADOSLa media de edad fue de 40,9 ± 13 años, y un 51% eran mujeres. Las características basales de los pacientes se describen en la tabla I. El 4% tenía antecedente de alergia a fármacos betalactámicos (n = 2) o antiinflamatorios no esteroideos (n = 2). El 4% tenía antecedente de eccema atópico. En el 42% de los pacientes con enfermedad de Crohn la indicación para el uso de IFX fue la enfermedad fistulosa. Todos los pacientes excepto 8 recibían tratamiento inmunomodulador (IMM) de base (92%), ya fuera con azatioprina/mercaptopurina (85%) o metotrexato (7%), y esta terapia se había comenzado al menos 3 meses antes de la administración de IFX en el 96% de ellos. El tiempo medio de tratamiento previo con IMM fue de 18,6 ± 13 meses. El numero total de infusiones fue de 560 (media de 5,6 por paciente; rango, 1-21). El 56% de los pacientes siguió tratamiento de mantenimiento, el 35% recibió únicamente pauta de inducción con 2-3 dosis, el 8% tratamiento episódico y en un caso una dosis única. La media de seguimiento fue de 17 ± 16 meses.
Características basales de los pacientes
| Edad | 40,9 ± 13 años |
| Sexo | 51% mujeres |
| Tabaco | 38% fumadores |
| Tipo de EII | 74% EC/26% CU |
| Extensión de la EII (clasificación de Montreal) | CU: 40% CU extensa 60% |
| CU izquierda | |
| EC: L3 65%, L2 19%, | |
| L1 12%, L3+L4 3% L1+L4 1% | |
| Patrón clínico de la EC | B1 24% B1+p 28% |
| B2 8% B2+p 7% | |
| B3 11% B3+p 22% | |
| Medicación inmunomoduladora de base | Azatioprina/6-mercaptopurina: 85%Metotrexato: 7% |
CU: colitis ulcerosa; EC: enfermedad de Crohn; EII: enfermedad inflamatoria intestinal.
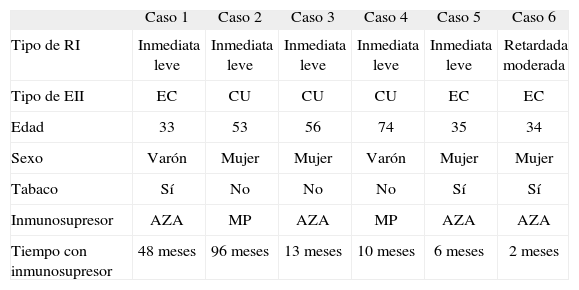
Se produjeron RI en el 6% (IC del 95%, 2-12) de pacientes y en el 1,4% de todas las infusiones (8/560). En la tabla II se describen las características clínicas de los pacientes que presentaron RI. No detectamos características clínicas que se asociaran a mayor tasa de RI. Cinco pacientes sufrieron reacciones inmediatas, todas ellas en la segunda dosis: rubor y diaforesis (n = 2), cefalea (n = 1), hipotensión (n = 1) y taquicardia (n = 1). En 2 casos la reacción volvió a aparecer en la tercera dosis, lo que motivó la suspensión del tratamiento. En el resto de los casos se continuó con la administración de IFX, disminuyendo el ritmo de infusión; en estos 3 pacientes no se han producido nuevas RI durante la terapia de mantenimiento, con un ritmo de infusión en dosis inicialmente bajas y progresivamente crecientes al comprobar la tolerancia.
Características clínicas de los pacientes que presentaron una reacción infusional por infliximab
| Caso 1 | Caso 2 | Caso 3 | Caso 4 | Caso 5 | Caso 6 | |
| Tipo de RI | Inmediata leve | Inmediata leve | Inmediata leve | Inmediata leve | Inmediata leve | Retardada moderada |
| Tipo de EII | EC | CU | CU | CU | EC | EC |
| Edad | 33 | 53 | 56 | 74 | 35 | 34 |
| Sexo | Varón | Mujer | Mujer | Varón | Mujer | Mujer |
| Tabaco | Sí | No | No | No | Sí | Sí |
| Inmunosupresor | AZA | MP | AZA | MP | AZA | AZA |
| Tiempo con inmunosupresor | 48 meses | 96 meses | 13 meses | 10 meses | 6 meses | 2 meses |
AZA: azatioprina; CU: colitis ulcerosa; EC: enfermedad de Crohn; EII: enfermedad inflamatoria intestinal; MP: mercaptopurina; RI: reacción infusional.
Una paciente presentó una reacción retardada en forma de exantema a los 5 días de la segunda infusión, precisó esteroides y motivó la suspensión del tratamiento. No se produjeron RI graves en ningún caso. El tratamiento con IFX sólo se suspendió globalmente en el 3% (IC del 95%, 0,6-8) de los pacientes.
DISCUSIÓNLas RI en pacientes que reciben tratamiento con IFX aparecen en un porcentaje significativo de las infusiones que, según la ficha técnica del producto, puede alcanzar el hasta el 19%. Diversas estrategias pueden influir en la prevención de la inmunogenicidad de IFX y, por tanto, en la disminución de las RI al fármaco: a) el tratamiento concomitante con IMM; b) la terapia de mantenimiento cada 8 semanas; c) la premedicación antes de cada infusión, y d) la administración de una terapia de inducción con 3 dosis1.
Diversos autores han evaluado la frecuencia de las RI a IFX con resultados dispares3–12. Así, en el estudio de Baert et al3, de 125 pacientes con enfermedad de Crohn refractaria que recibían tratamiento con IFX en pauta a demanda, un 27% presentó RI agudas. En la serie retrospectiva de la clínica Mayo realizada en 500 pacientes tratados con IFX, el 3,8% presentó RI agudas, la mayor parte de ellas tras la segunda dosis9. En la mayoría de los casos los pacientes se encontraban bajo tratamiento IMM, como ocurría en nuestra serie. En otro estudio retrospectivo realizado en 156 pacientes, Cheifetz et al6 comunican RI en el 9,7% de los pacientes y el 6,1% de las infusiones (un 5,4% de RI agudas y un 0,6% tardías). La mitad de las RI se produjeron durante la terapia de inducción, sobre todo tras la segunda dosis. En estos 3 estudios los pacientes no se premedicaban por sistema, sólo si había sucedido una RI previamente. En nuestra serie, todas las RI se produjeron durante la terapia de inducción (segunda o tercera dosis), lo que concuerda con lo descrito en los 2 últimos trabajos, y sugiere que una vez superada la fase inicial de terapia de inducción, si el paciente ha tolerado bien el fármaco, es probable que no vaya a presentar reacciones en el futuro, sobre todo si se utiliza un esquema de tratamiento de mantenimiento y no episódico.
Por otro lado, los ATI pueden desempeñar un papel importante en la aparición de RI a IFX. La prevalencia de ATI descrita en diferentes estudios oscila entre el 6 y el 61%3–5,8,13–15. Estos anticuerpos parecen ejercer un papel en las RI y algunos autores han demostrado que la administración de un IMM concomitante disminuye significativamente la formación de ATI (el 24-43 frente al 63- 75%)3,5 y de forma específica, que el tratamiento con IMM desde al menos 3 meses antes del inicio de IFX constituiría un factor protector5. Estos datos influyeron en la práctica clínica generalizada de utilizar el cotratamiento con IMM con el fin de reducir la inmnogenicidad, incluso planeando el inicio del IMM en los pacientes que no estaban recibiéndolo, un tiempo antes del IFX si la situación clínica lo permitía. La mayoría de nuestros pacientes tenía un IMM de base, lo que sin duda puede haber influido en nuestra baja tasa de RI, y en la mayoría de los casos el IMM se había iniciado al menos 3 meses antes. Sin embargo, la influencia del uso concomitante de IMM no es tan notoria cuando la administración de IFX se realiza en pauta de mantenimiento: los porcentajes de ATI con tratamiento de mantenimiento son similares en los pacientes con y sin IMM concomitante4,10. Por otra parte, Vermeire et al12 han descrito, en pacientes bajo terapia episódica, que el cotratamiento con IMM reduce tanto la formación de ATI (el 46% con IMM frente al 73% sin IMM; p < 0,001), como la frecuencia de RI (el 16 frente al 40%; p = 0,04); sin embargo, la incidencia de ATI en pacientes que comenzaron IFX de forma concomitante con el IMM fue similar a la de los que ya recibían IMM durante un tiempo superior a 3 meses: la protección sería independiente del tiempo de exposición previo al IMM. Además, la azatioprina y el metotrexato parecen poseer similar eficacia en la prevención de la inmunogenicidad. En cualquier caso, los resultados de estos estudios sugieren utilizar IMM en los pacientes que vayan a recibir un esquema de tratamiento episódico con IFX, mientras que en los que se plantee una terapia de mantenimiento, tal vez no sería preciso utilizar IMM con la finalidad de disminuir la inmunogenicidad.
En nuestra serie las RI se produjeron durante la terapia de inducción con IFX y el porcentaje de pacientes con tratamiento episódico fue bajo, por lo cual no podemos valorar adecuadamente la influencia del tipo de esquema de administración de IFX. No obstante, es relevante la ausencia de RI que observamos durante el tratamiento de mantenimiento, dado que esta pauta de administración era seguida por más de la mitad de los pacientes y con un seguimiento medio de aproximadamente año y medio.
Con respecto a la opción de premedicar antes de cada infusión, Farrell et al5, en un estudio realizado en 80 pacientes con enfermedad de Crohn, compararon la administración de hidrocortisona 200 mg intravenosa frente a placebo con un seguimiento de 16 semanas. Dicha premedicación lograba disminuir los valores de ATI pero no el porcentaje de RI (el 15% con hidrocortisona frente al 24% con placebo; p = 0,3). Por tanto, no encuentran diferencias entre premedicar o no relacionadas con la probabilidad de desarrollar una RI. Los autores recomiendan considerar la administración de hidrocortisona en los pacientes con comienzo reciente de terapia inmunomoduladora o en los que no toleran los inmunomoduladores. Los resultados del grupo de pacientes premedicados con hidrocortisona en esta serie difieren de los obtenidos en nuestros pacientes; el corto período de seguimiento y los porcentajes no elevados de uso de IMM (al contrario que en nuestra serie) pueden tener influencia en sus resultados. En nuestra experiencia la premedicación se asocia a una baja tasa de RI (el 1,2% de todas las infusiones y el 6,3% de los pacientes). Además, no observamos RI gra- ves en ninguno caso, mientras que Farrell et al5 describen un 2,5% de RI graves con hidrocortisona y un 5% con placebo.
Por otra parte, se ha sugerido que la premedicación con hidrocortisona 250 mg resulta igual de efectiva que el tratamiento concomitante con azatioprina, en la prevención de la pérdida de respuesta a IFX y en la disminución de la inmunogenicidad16. Aunque el diseño del estudio no era el adecuado para demostrarlo (no era aleatorizado ni ciego), la similar eficacia de ambas estrategias a largo plazo haría pensar que la azatioprina podría ser innecesaria para estos fines. Nuestra serie no dispone de grupo control y, sin duda, se precisan estudios con un mejor diseño para poder dar una respuesta definitiva a estas cuestiones. Un estudio comparativo de monoterapia con IFX con y sin premedicación con hidrocortisona podría ser útil en este aspecto. La administración de una inducción con 2 o 3 dosis podría disminuir la inmunogenicidad4,5, aunque otros autores no encuentran diferencias con la administración de dosis única de inducción a este respecto3. Todos nuestros pacientes recibieron un esquema de inducción con 3 dosis, lo que puede suponer un factor más con potencial influencia en la baja tasa de RI observada.
Con respecto a las RI tardías, que se caracterizan por la aparición de artralgias, mialgias y exantema, con o sin fiebre, la existencia de un intervalo prolongado entre infusiones constituye un factor de riesgo para su aparición. No parecen tener relación con la presencia de ATI3,4. Para disminuir la probabilidad de que aparezcan, se ha recomendado la utilización de una profilaxis con hidrocortisona intravenosa antes de la infusión cuando el intervalo entre ellas sea superior a 14 semanas17. La frecuencia de aparición de este tipo de RI oscila entre el 2,8 y el 0,6%4,6,9, intervalo en el que también se encuentran nuestros pacientes (1%).
Podemos concluir que en los pacientes con EII y bajo profilaxis con inmunomoduladores, la premedicación con un esteroide y un antihistamínico se asocia a unas bajas tasas tanto de RI por IFX como de abandonos de este tratamiento por dichas RI. Desconocemos cuál de las estrategias comentadas es la más eficaz en la prevención de la inmunogenicidad de IFX, pero esta premedicación puede constituir una alternativa atractiva en ciertos esquemas terapéuticos del fármaco, aunque todas estas cuestiones deberán aclararse mediante la realización de nuevos estudios bien diseñados.
CONFLICTOS DE INTERÉSFernando Bermejo y Antonio López-Sanromán han actuado como asesores y conferenciantes para Schering & Plough. Alicia Algaba y Manuel van Domselaar son receptores de una beca de Schering & Plough.