La duodenosis linfocítica (DL) es una lesión característica en las fases iniciales de la enfermedad celíaca (EC), pero puede asociarse a otras muchas entidades. El objetivo de este trabajo fue evaluar la prevalencia de las diferentes causas de DL y valorar posibles diferencias en la presentación clínica según la etiología responsable.
MétodosEstudio retrospectivo que incluye 194 pacientes diagnosticados de una DL (más de 25 linfocitos intraepiteliales por 100 células epiteliales). Se siguió una estrategia de evaluación etiológica definida que incluyó serología celíaca (anticuerpos antitransglutaminasa), genotipos HLA-DQ2/DQ8, diagnóstico Helicobacter pylori (H. pylori) y sobrecrecimiento bacteriano intestinal (SBID). El diagnóstico de EC se estableció en función de la respuesta clínica e histológica a una DSG en pacientes con serología positiva o un estudio HLA-DQ2 (al menos uno de los alelos) o −DQ8 (ambos alelos) compatibles.
ResultadosLa EC (39%) resultó la causa más frecuente de DL, seguida por SBID (22%), H. pylori (14%), EC y SBID (12%) y otras causas (13%). La mayoría (83%) de los pacientes presentaron un genotipo HLA-DQ2 o −DQ8 compatible. En estos pacientes el diagnóstico más frecuente fue la EC (46%), mientras que en ausencia de HLA-DQ2/DQ8 los diagnósticos más frecuentes fueron el SBID (44%) y H. pylori (22%). En los pacientes enviados por dispepsia, diarrea y anemia, la EC fue el diagnóstico más frecuente, mientras que H. pylori lo fue en los pacientes con dolor abdominal.
ConclusionesLa EC, seguida del SBID y la infección por H. pylori, constituyen las causas más frecuentes de DL en nuestro medio.
Lymphocytic duodenosis (LD) is a characteristic lesion in the initial phases of celiac disease (CD) but can be associated with many other entities. The aim of this study was to evaluate the prevalence of distinct causes of LD and possible differences in clinical presentation according to etiology.
MethodsA retrospective study was performed that included 194 patients diagnosed with LD (more than 25 intraepithelial lymphocytes per 100 epithelial cells). A preestablished strategy to evaluate the cause of the disease was followed that included celiac serology (antitransglutaminase antibodies), HLA-DQ2/DQ8 genotypes, diagnosis of Helicobacter pylori and small intestinal bacterial overgrowth (SIBO). Diagnosis of CD was established on the basis of clinical and histological response to a gluten-free diet in patients with positive serology or compatible findings on HLA–DQ2 (at least one of the alleles) or -DQ8 (both alleles) study.
ResultsThe most frequent cause of LD was CD (39%), followed by SBBO (22%), H.pylori (14%), CD and SIBO (12%), and other causes (13%). Most of the patients (83%) had a compatible HLA-DQ2 or -DQ8 genotype. In these patients, the most frequent diagnosis was CD (46%), while in the absence of HLA-DQ2/DQ8, the most frequent diagnoses were SIBO (44%) and H. pylori (22%). CD was the most frequent diagnosis in patients referred for dyspepsia, diarrhea and anemia, while H. pylori was the most frequent diagnosis in patients with abdominal pain.
ConclusionsThe most common causes of LD in our environment are CD, followed by SIBO and H. pylori infection.
La duodenosis linfocítica (DL), también denominada enteropatía linfocítica o enteritis microscópica, se caracteriza por un aumento de linfocitos intraepiteliales (LIE) en las vellosidades intestinales, siendo una lesión característica en las fases iniciales de la enfermedad celíaca (EC)1. Estudios recientes han demostrado que estos pacientes, al igual que aquellos con atrofia vellositaria, pueden presentar síntomas dependientes del gluten, tanto digestivos como extradigestivos, y en este caso beneficiarse de una dieta sin gluten (DSG)2–4. El diagnóstico de EC en estos pacientes no es sencillo, dado que con frecuencia la serología celíaca es negativa, y es necesario demostrar inequívocamente que los síntomas y la enteropatía son dependientes del gluten1,5.
Por otra parte, la EC no es la única entidad que puede ocasionar un aumento de LIE en la mucosa intestinal. Otras posibles causas de DL son la infección por Helicobacter pylori (H. pylori), el sobrecimiento bacteriano de intestino delgado (SBID), la intolerancia a otras proteínas alimentarias (leche de vaca, huevo, etc.), parasitosis como la giardiasis, la ingesta de fármacos (AINE), la enfermedad inflamatoria intestinal, la gastroenteritis eosinófila, enfermedades autoinmunes o la inmunodeficiencia común variable, entre otras6–8. Es probable que el aumento de LIE en el intestino delgado represente una respuesta inmunitaria innata o no específica del epitelio intestinal a todos aquellos antígenos o microorganismos que acceden a través de la luz intestinal6.
En los últimos años, la toma rutinaria de biopsias de duodeno para el cribado de la EC en grupos de riesgo, como es el caso de familiares de primer grado o pacientes con diarrea, dispepsia o anemia, se ha seguido de un aumento en el diagnóstico de casos de DL2,10–12. Sin embargo, todavía no está suficientemente claro cuál es el significado clínico de esta entidad, cuáles son los pacientes que realmente pertenecen al espectro de la EC que podrían beneficiarse de una DSG y cuál es la estrategia de diagnóstico y tratamiento que se debería seguir cuando se establece el diagnóstico de DL en un paciente8.
Con estos antecedentes, el objetivo de este estudio fue evaluar en primer lugar la prevalencia de las diferentes causas de DL en una serie amplia de pacientes, y secundariamente investigar la existencia de diferencias en la forma de presentación clínica en relación con las diferentes entidades etiológicas, así como proporcionar información práctica para realizar una estrategia diagnóstica secuencial en estos pacientes.
Pacientes y métodoEstudio retrospectivo, observacional y descriptivo, en el que se incluyen pacientes de edad comprendida entre 14 y 80 años, diagnosticados de DL en la Unidad de Gastroenterología del Hospital San Jorge de Huesca, en el período comprendido entre enero de 2007 y diciembre de 2009.
Se han excluido del estudio pacientes con diagnóstico previo de EC, enfermedad sistémica severa (insuficiencia cardiaca, respiratoria, hepática y/o renal) y/o enfermedad neoplásica diseminada, así como aquellos pacientes que no completaron el seguimiento en la consulta externa de aparato digestivo.
Los pacientes con diagnóstico de DL fueron identificados a través del registro de casos de la base de datos ENDOBASE de la unidad de endoscopia digestiva y la base de datos del servicio de anatomía patológica. La información relativa a datos demográficos, antecedentes medicoquirúrgicos, toma de fármacos, motivo de indicación de la endoscopia digestiva alta (EDA), síntomas digestivos y extradigestivos, pruebas diagnósticas, tratamiento realizado y evolución clínica se obtuvo mediante una revisión de las historias clínicas y consulta telefónica a los pacientes.
Diagnóstico de duodenosis linfocíticaEn el año 2007, la Unidad de Endoscopia del Hospital San Jorge incluyó la toma de biopsias de duodeno para facilitar el cribado de la EC en pacientes enviados para realización de una EDA con motivo de dispepsia, dolor abdominal, diarrea crónica y/o anemia. En estos pacientes, en ausencia de una lesión estructural de la mucosa que justificara los síntomas, se tomaron entre 4 y 6 biopsias de la segunda y tercera porción del duodeno, así como biopsias en cuerpo y antro gástrico para estudio diagnóstico de la infección por H. pylori mediante test de ureasa (CLO-test®, Kimberly-Clark, Roswell, Estados Unidos).
El estudio histopatológico de las biopsias de duodeno se realizó mediante tinción de hematoxilina-eosina e inmunohistoquímica con anticuerpos monoclonales antilinfocitos CD3 (DakoCytomation, Glostrup, Denmark). El diagnóstico de DL se estableció cuando se observaron al menos 25 linfocitos CD3 (+) por cada 100 células epiteliales en las vellosidades intestinales del duodeno9.
Evaluación diagnóstica de la causa de duodenosis linfocíticaEl estudio diagnóstico inicial de los pacientes con diagnóstico histopatológico de DL incluyó la realización de serología de enfermedad celíaca, mediante anticuerpos IgA antitransglutaminasa tisular (ATGT), determinación de inmunoglobulinas en suero y estudio genético de los haplotipos HLA-DQ2 y DQ8. La determinación de ATGT se realizó utilizando un método automatizado y cuantitativo de inmunoanálisis (EliA™ Celikey™ IgA, Phadia AB, Uppsala, Suecia), considerando positivo un valor superior a 3 U/ml. El estudio genético HLA-DQ2 (alelos DQA1*05 y DQB1*02) y DQ8 (alelos DQA1*03 y DQB1*0302) se realizó mediante amplificación por PCR. Se consideró que un paciente tenía riesgo genético para presentar EC cuando al menos uno de los alelos del gen HLA-DQ2 era positivo, o cuando ambos alelos del gen HLA-DQ8 estaban presentes.
A los sujetos que presentaron un resultado positivo de la serología celíaca o bien un estudio genético compatible se les ofreció la posibilidad de iniciar una DSG de prueba. La respuesta sintomática a la DSG se evaluó a los 3 meses de seguimiento. En el caso de mejoría clínica se recomendó continuar la DSG y se realizó una nueva EDA con biopsias de duodeno para valorar la respuesta histológica al menos 18 meses después de haber iniciado la DSG.
En aquellos individuos con serología celíaca negativa y ausencia de genotipo HLA-DQ2 o DQ8, así como en aquellos que no mejoraron clínicamente con la DSG, se completó el estudio con la realización de las siguientes pruebas diagnósticas: a) prueba del aliento con urea-C13 para el diagnóstico de H. pylori, en los casos con resultado negativo de la prueba de ureasa; b) prueba de hidrógeno espirado con lactulosa y posterior tratamiento con antibióticos (rifaximina o metronidazol) en los casos positivos, para evaluación de SBID; c) estudio de parásitos en heces, si el síntoma guía era la diarrea, y d) estudio de alergias alimentarias y dietas individualizadas o específicas de exclusión. Cada uno de estos pacientes recibió un tratamiento específico de acuerdo con el resultado de las pruebas diagnósticas.
Criterios diagnósticos para el diagnóstico etiológico de duodenosis linfocíticaEl diagnóstico de DL secundaria a EC se realizó en aquellos pacientes con un resultado positivo de la serología o bien un estudio genético HLA compatible, que además presentaron una respuesta clínica e histológica a la DSG. La respuesta clínica se definió como la desaparición del síntoma que motivo la indicación de la EDA, mientras que la respuesta histológica se definió como la normalización en el número de LIE o su reducción en un 50% con respecto al estudio histopatológico inicial12.
El diagnóstico etiológico del resto de entidades se estableció de la siguiente manera: a) infección por H. pylori: positividad de una prueba diagnóstica (de ureasa, histología o del aliento con urea-C13) y respuesta sintomática e histológica tras la erradicación de la infección; b) AINE: antecedente de toma de AINE en los 7 días previos a la EDA, y ausencia de criterios diagnósticos para EC o infección por H. pylori; c) SBID: prueba de hidrógeno espirado con lactulosa positivo con mejoría clínica e histológica tras tratamiento antibiótico empírico, así como ausencia de criterios diagnósticos para EC; d) parasitosis: detección del parásito en las muestras de biopsia duodenal o en heces; e) el diagnóstico de enfermedad inflamatoria intestinal, inmunodeficiencia común variable y enfermedad autoinmune requirió la presencia de dicha enfermedad y la ausencia de criterios diagnósticos para las causas de DL previamente descritas; f) la intolerancia a otras proteínas alimentarias se estableció por exclusión de otras causas de DL y la respuesta sintomática e histológica a la retirada de la proteína alimentaria de la dieta.
EstadísticaLa información de los pacientes se recogió en un formulario y una base de datos diseñados con Microsoft Office Access 2003. El análisis estadístico se realizó con el paquete informático SPSS 14.0, e incluyó un análisis descriptivo de las diferentes variables demográficas y clínicas, y un análisis univariable para evaluar diferencias en la presentación clínica dependiendo de la causa de la DL. Los resultados de las variables cualitativas se presentan como proporciones, y las variables cuantitativas como media con su desviación estándar. La existencia de diferencias estadísticamente significativas (p<0,05) entre las variables cualitativas se estableció tras la realización del test de chi-cuadrado o el test de Fisher, cuando alguna de las frecuencias esperadas fue inferior a 5. En el caso de las variables cuantitativas, se empleó la t de Student para la comparación de medias.
ÉticaLos pacientes firmaron consentimiento informado previo a la realización de la endoscopia digestiva alta y la toma de biopsias, y dieron su consentimiento para la recogida de datos y posterior análisis de los mismos.
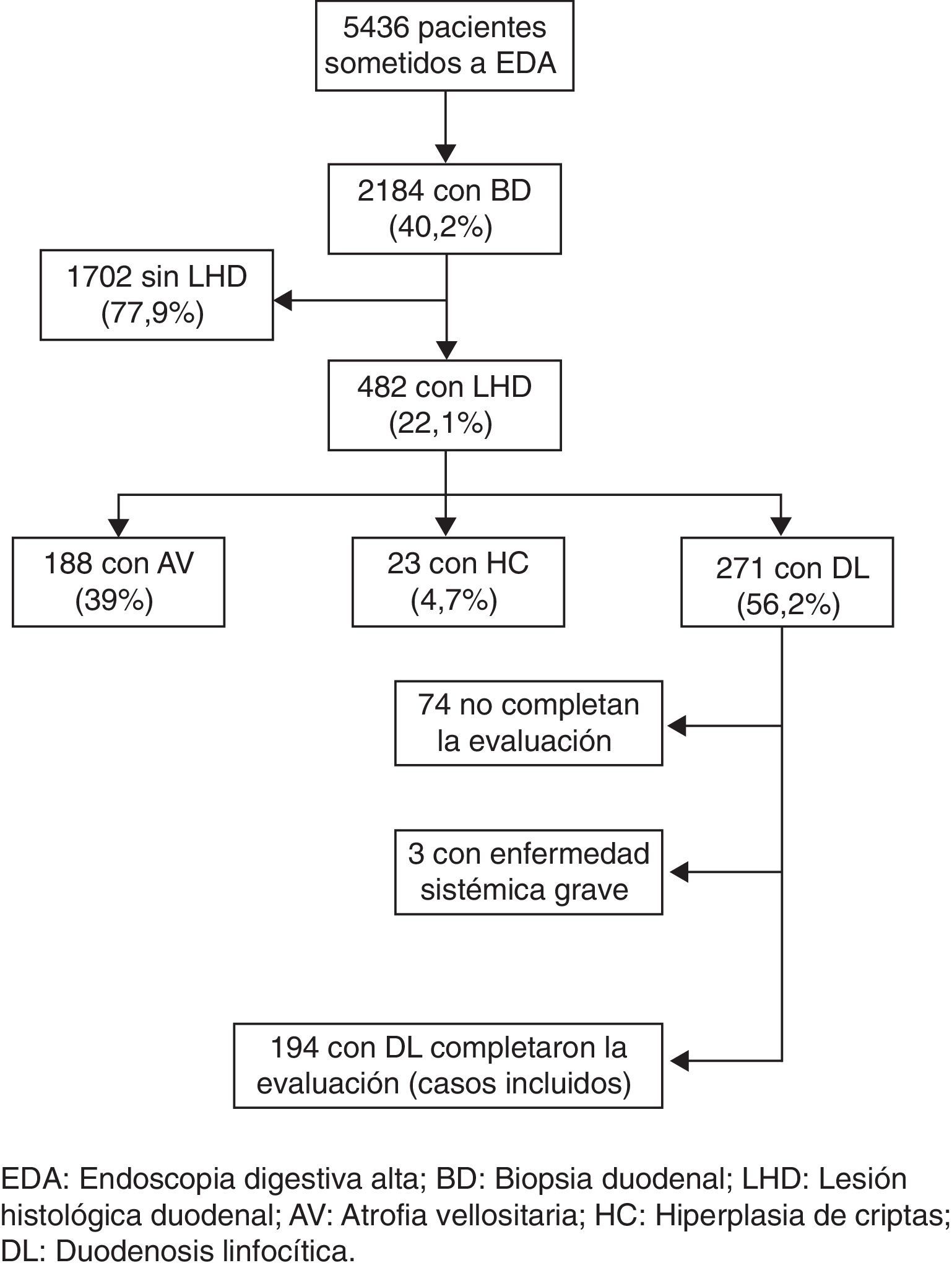
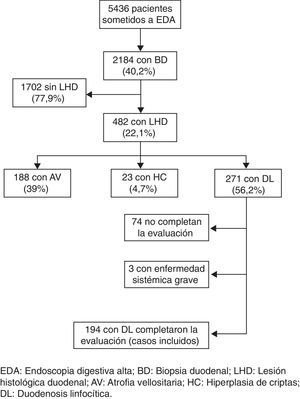
ResultadosDescripción de la muestraEntre enero de 2007 y diciembre de 2009 se realizaron un total de 5436 EDA. En 2.184 pacientes (40,2%), sin una lesión estructural de la mucosa que justificara los síntomas, se tomaron biopsias de duodeno. En 482 (22,1%) de los casos biopsiados se observó algún tipo de lesión histopatológica en el duodeno: 188 (39%) presentaron atrofia vellositaria (severa en 11, moderada en 43 y leve en 134), 23 (4,7%) hiperplasia de criptas y 271 (56,2%) una DL. De los 271 pacientes con DL, 74 no completaron el estudio diagnóstico en la consulta de aparato digestivo y 3 presentaban una enfermedad sistémica severa, por lo que fueron excluidos del estudio. Se incluyen finalmente 194 pacientes, 154 (79,4%) mujeres y 40 (21,6%) varones, con una edad media de 43,4 ± 14,9 años (rango 15-76) (fig. 1).
La indicación que motivó la realización de la EDA y la toma de biopsias de duodeno fue: 115 (59%) dispepsia; 35 (18%) diarrea crónica; 16 (8,2%) anemia; 9 (4,6%) dolor abdominal; 9 (4,6%) pirosis/regurgitación; 3 (1,5%) hipertransaminasemia, y 7 (3,6%) otras indicaciones (antecedentes familiares de EC, vómitos, estreñimiento).
Evaluación diagnóstica y evolución clínicaEl porcentaje medio de LIE fue 33,5±8 (rango 25-68). Solamente 2 (1%) pacientes con DL presentaron un resultado positivo de la serología celíaca, mientras que 154/186 (82,7%) pacientes eran portadores de alguno de los alelos del genotipo HLA-DQ2 y/o los 2 alelos del genotipo HLA-DQ8. En 174 casos se realizó una prueba diagnóstica para detectar infección por H. pylori (prueba de ureasa o del aliento con urea-C13) con resultado positivo en 87 de ellos (50%). En 64 pacientes se realizó una prueba de lactulosa para el diagnóstico de SBID, resultando positiva en 52 (81,2%) de ellos.
Un total de 155 pacientes iniciaron una DSG de prueba, 132 con estudio genético HLA-DQ2 o DQ8 compatible, y 23 con estudio genético negativo. En estos últimos, se había descartado previamente infección por H. pylori y otras causas de DL. De los pacientes con estudio genético compatible, 111 presentaron una respuesta clínica a la DSG (84%) frente a únicamente 11 (47,8%) de los pacientes con estudio genético negativo (p<0,0001). En 113 de los pacientes que iniciaron una DSG se realizaron nuevas biopsias de duodeno a los 18 meses de seguimiento, observando una respuesta histopatológica en 72 (63,7%). Un total de 98 pacientes con respuesta clínica a la DSG fueron finalmente diagnosticados de EC, si bien en 23 de ellos se realizó también un diagnóstico de SBID. Solamente 3 (3,1%) de los pacientes con diagnóstico de EC no eran portadores de un genotipo HLA-DQ2 o DQ8.
Diagnóstico etiológico de la duodenosis linfocíticaLa EC y el SBID fueron el diagnóstico final más frecuente (71,5%). Setenta y cinco (38,6%) pacientes fueron diagnosticados de EC, 41 (21,1%) de SBID y en 23 (11,8%) coexistieron ambos diagnósticos. El resto de los pacientes fueron diagnosticados de enteropatía por H. pylori (14,9%), enfermedad inflamatoria intestinal (2,6%), enteritis por fármacos (2,1%), enfermedad autoinmune (1,5%), gastroenteritis eosinófila (1,5%), intolerancia y alergia a otras proteínas alimentarias (1,5%) y parásitos (0,5%). En 7 pacientes (3,6%) no se identificó ningún factor etiológico y se consideró idiopática. En los pacientes con estudio genético HLA-DQ2 o DQ8 compatible, el diagnóstico más frecuente fue la EC (46,7%), seguido de SBID (17,5%) y la infección por H. pylori (9,1%), mientras que en los pacientes con estudio genético negativo el diagnóstico más frecuente fue el SBID (43,8%), seguido de la infección por H. pylori (21,9%), fármacos (9,4%) y la EC (9,4%) (tabla 1).
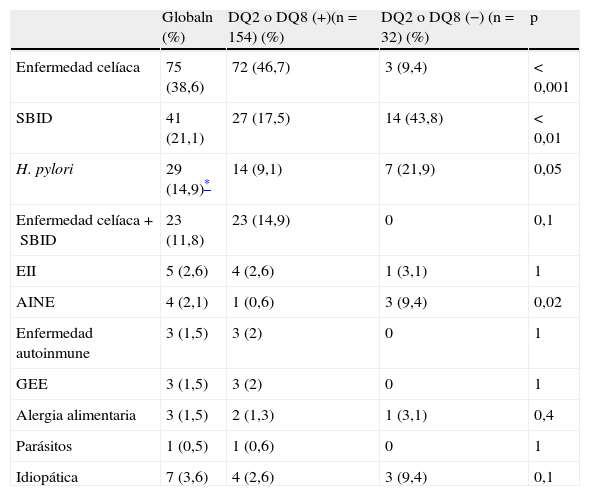
Etiología de la duodenosis linfocítica en relación con el resultado del estudio genético HLA-DQ2 y DQ8
| Globaln (%) | DQ2 o DQ8 (+)(n=154) (%) | DQ2 o DQ8 (−) (n=32) (%) | p | |
| Enfermedad celíaca | 75 (38,6) | 72 (46,7) | 3 (9,4) | < 0,001 |
| SBID | 41 (21,1) | 27 (17,5) | 14 (43,8) | < 0,01 |
| H. pylori | 29 (14,9)* | 14 (9,1) | 7 (21,9) | 0,05 |
| Enfermedad celíaca+SBID | 23 (11,8) | 23 (14,9) | 0 | 0,1 |
| EII | 5 (2,6) | 4 (2,6) | 1 (3,1) | 1 |
| AINE | 4 (2,1) | 1 (0,6) | 3 (9,4) | 0,02 |
| Enfermedad autoinmune | 3 (1,5) | 3 (2) | 0 | 1 |
| GEE | 3 (1,5) | 3 (2) | 0 | 1 |
| Alergia alimentaria | 3 (1,5) | 2 (1,3) | 1 (3,1) | 0,4 |
| Parásitos | 1 (0,5) | 1 (0,6) | 0 | 1 |
| Idiopática | 7 (3,6) | 4 (2,6) | 3 (9,4) | 0,1 |
AINE: antiinflamatorios no esteroideos; EII: enfermedad inflamatoria intestinal; GEE: gastroenteritis eosinófila; SBID: sobrecrecimiento bacteriano en intestino delgado.
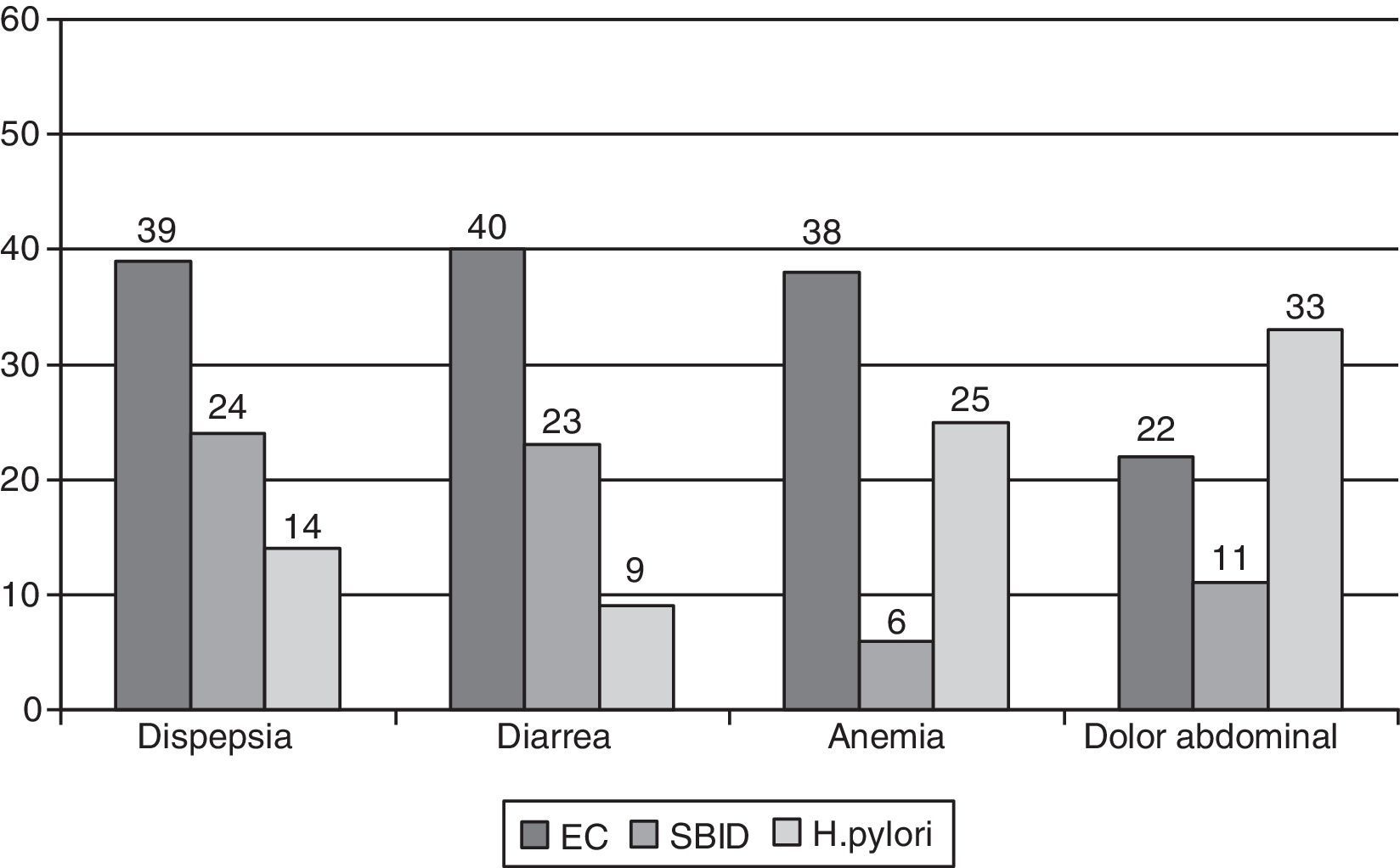
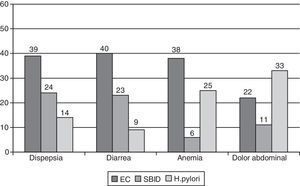
Cuando analizamos las causas de DL según el síntoma guía que motivó la indicación de la EDA, observamos cómo la EC fue la causa más frecuente en los pacientes que fueron enviados por dispepsia, diarrea y anemia. La infección por H. pylori fue la causa más frecuente en los pacientes con dolor abdominal, y la segunda causa más frecuente en pacientes con anemia. El SBID fue la segunda causa más frecuente, después de la EC, en los pacientes con dispepsia y diarrea. Sin embargo, estas diferencias observadas no presentaron significación estadística (fig. 2).
Diferencias en la presentación clínicaNo hemos observado diferencias significativas en la edad y sexo de los pacientes, ni tampoco en el número de LIE antes y después del tratamiento realizado, en relación con el diagnóstico etiológico de la DL (tabla 2).
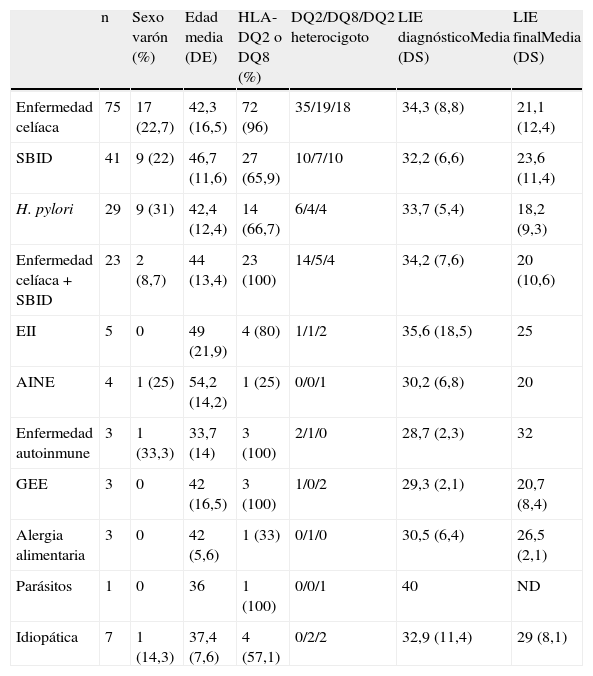
Datos demográficos, estudio genético y evolución del número de linfocitos intraepiteliales (LIE) en relación con el diagnóstico etiológico
| n | Sexo varón (%) | Edad media (DE) | HLA-DQ2 o DQ8 (%) | DQ2/DQ8/DQ2 heterocigoto | LIE diagnósticoMedia (DS) | LIE finalMedia (DS) | |
| Enfermedad celíaca | 75 | 17 (22,7) | 42,3 (16,5) | 72 (96) | 35/19/18 | 34,3 (8,8) | 21,1 (12,4) |
| SBID | 41 | 9 (22) | 46,7 (11,6) | 27 (65,9) | 10/7/10 | 32,2 (6,6) | 23,6 (11,4) |
| H. pylori | 29 | 9 (31) | 42,4 (12,4) | 14 (66,7) | 6/4/4 | 33,7 (5,4) | 18,2 (9,3) |
| Enfermedad celíaca+SBID | 23 | 2 (8,7) | 44 (13,4) | 23 (100) | 14/5/4 | 34,2 (7,6) | 20 (10,6) |
| EII | 5 | 0 | 49 (21,9) | 4 (80) | 1/1/2 | 35,6 (18,5) | 25 |
| AINE | 4 | 1 (25) | 54,2 (14,2) | 1 (25) | 0/0/1 | 30,2 (6,8) | 20 |
| Enfermedad autoinmune | 3 | 1 (33,3) | 33,7 (14) | 3 (100) | 2/1/0 | 28,7 (2,3) | 32 |
| GEE | 3 | 0 | 42 (16,5) | 3 (100) | 1/0/2 | 29,3 (2,1) | 20,7 (8,4) |
| Alergia alimentaria | 3 | 0 | 42 (5,6) | 1 (33) | 0/1/0 | 30,5 (6,4) | 26,5 (2,1) |
| Parásitos | 1 | 0 | 36 | 1 (100) | 0/0/1 | 40 | ND |
| Idiopática | 7 | 1 (14,3) | 37,4 (7,6) | 4 (57,1) | 0/2/2 | 32,9 (11,4) | 29 (8,1) |
AINE: antiinflamatorios no esteroideos; EII: enfermedad inflamatoria intestinal; GEE: gastroenteritis eosinófila; ND: no determinado; SBID: sobrecrecimiento bacteriano en intestino delgado.
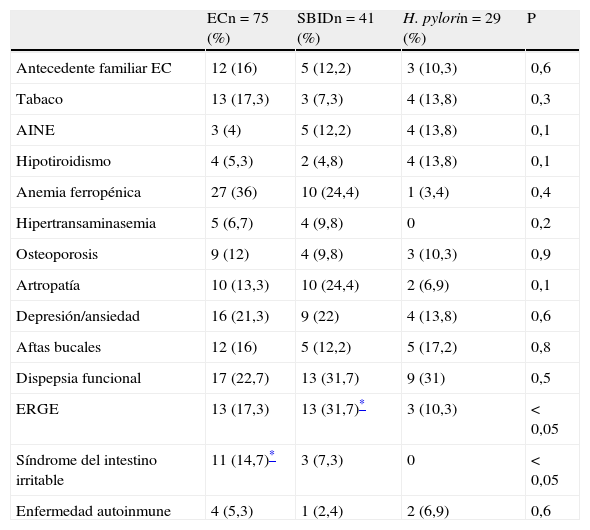
Cuando analizamos los antecedentes médicos y enfermedades asociadas en relación con las 3 causas más frecuentes de la DL, observamos cómo los pacientes diagnosticados de EC tenían con mayor frecuencia un antecedente previo de síndrome de intestino irritable (14,7%), en comparación con los pacientes con SBID (7,3%) e infección por H. pylori (0%) (p<0,05). Una historia previa de ERGE fue más frecuente en los pacientes con SBID (31,7%) en comparación con los pacientes con infección por H. pylori (10,3%) (p<0,05). No se observaron diferencias estadísticamente significativas en relación con otros antecedentes médicos como hipotiroidismo, anemia, hipertransaminasemia, osteoporosis, depresión/ansiedad, dispepsia funcional o enfermedades autoinmunes (tabla 3).
Antecedentes médicos y enfermedades asociadas en relación con el diagnóstico etiológico de la duodenosis linfocítica
| ECn=75 (%) | SBIDn=41 (%) | H. pylorin=29 (%) | P | |
| Antecedente familiar EC | 12 (16) | 5 (12,2) | 3 (10,3) | 0,6 |
| Tabaco | 13 (17,3) | 3 (7,3) | 4 (13,8) | 0,3 |
| AINE | 3 (4) | 5 (12,2) | 4 (13,8) | 0,1 |
| Hipotiroidismo | 4 (5,3) | 2 (4,8) | 4 (13,8) | 0,1 |
| Anemia ferropénica | 27 (36) | 10 (24,4) | 1 (3,4) | 0,4 |
| Hipertransaminasemia | 5 (6,7) | 4 (9,8) | 0 | 0,2 |
| Osteoporosis | 9 (12) | 4 (9,8) | 3 (10,3) | 0,9 |
| Artropatía | 10 (13,3) | 10 (24,4) | 2 (6,9) | 0,1 |
| Depresión/ansiedad | 16 (21,3) | 9 (22) | 4 (13,8) | 0,6 |
| Aftas bucales | 12 (16) | 5 (12,2) | 5 (17,2) | 0,8 |
| Dispepsia funcional | 17 (22,7) | 13 (31,7) | 9 (31) | 0,5 |
| ERGE | 13 (17,3) | 13 (31,7)* | 3 (10,3) | < 0,05 |
| Síndrome del intestino irritable | 11 (14,7)* | 3 (7,3) | 0 | < 0,05 |
| Enfermedad autoinmune | 4 (5,3) | 1 (2,4) | 2 (6,9) | 0,6 |
EC: enfermedad celiac; SBID: sobrecrecimiento bacteriano de intestino delgado.
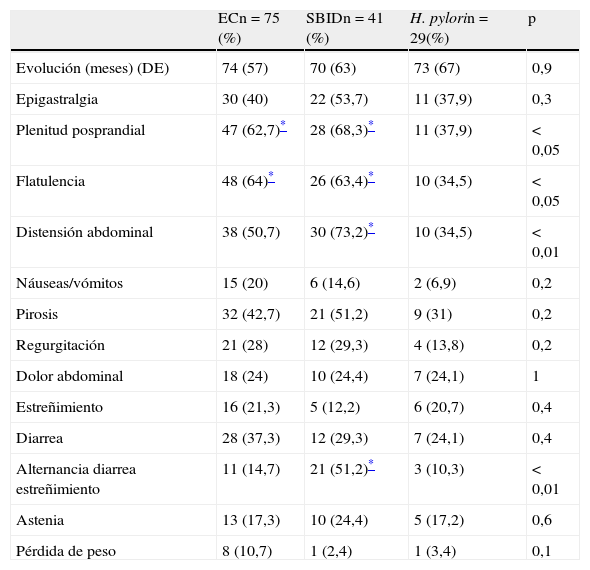
En la tabla 4 se muestra la presentación clínica de los pacientes en el momento de realización de la EDA en relación con las 3 causas más frecuentes de DL. Síntomas como plenitud posprandial y flatulencia fueron más frecuentes en los pacientes diagnosticados de EC (62,7 y 64%) y SBID (68,3 y 63,4%) en comparación con los pacientes con enteropatía secundaria a H. pylori (37,9 y 34,5%) (p<0,05). Los pacientes con SBID presentaron con mayor frecuencia distensión abdominal (73,2%) y una alternancia de diarrea y estreñimiento (51,2%) en comparación con los pacientes con enteropatía por H.pylori (34,5% y 10,3% respectivamente) (p<0,01). No se observaron diferencias estadísticamente significativas en relación con síntomas como epigastralgia, náuseas/vómitos, pirosis y regurgitación, estreñimiento, diarrea, dolor abdominal, astenia y pérdida de peso.
Presentación clínica en relación con el diagnóstico etiológico de la duodenosis linfocítica
| ECn=75 (%) | SBIDn=41 (%) | H. pylorin=29(%) | p | |
| Evolución (meses) (DE) | 74 (57) | 70 (63) | 73 (67) | 0,9 |
| Epigastralgia | 30 (40) | 22 (53,7) | 11 (37,9) | 0,3 |
| Plenitud posprandial | 47 (62,7)* | 28 (68,3)* | 11 (37,9) | < 0,05 |
| Flatulencia | 48 (64)* | 26 (63,4)* | 10 (34,5) | < 0,05 |
| Distensión abdominal | 38 (50,7) | 30 (73,2)* | 10 (34,5) | < 0,01 |
| Náuseas/vómitos | 15 (20) | 6 (14,6) | 2 (6,9) | 0,2 |
| Pirosis | 32 (42,7) | 21 (51,2) | 9 (31) | 0,2 |
| Regurgitación | 21 (28) | 12 (29,3) | 4 (13,8) | 0,2 |
| Dolor abdominal | 18 (24) | 10 (24,4) | 7 (24,1) | 1 |
| Estreñimiento | 16 (21,3) | 5 (12,2) | 6 (20,7) | 0,4 |
| Diarrea | 28 (37,3) | 12 (29,3) | 7 (24,1) | 0,4 |
| Alternancia diarrea estreñimiento | 11 (14,7) | 21 (51,2)* | 3 (10,3) | < 0,01 |
| Astenia | 13 (17,3) | 10 (24,4) | 5 (17,2) | 0,6 |
| Pérdida de peso | 8 (10,7) | 1 (2,4) | 1 (3,4) | 0,1 |
EC: enfermedad celíaca; SBID: sobrecrecimiento bacteriano de intestino delgado.
Este estudio retrospectivo, realizado en una serie amplia de pacientes con síntomas del espectro clínico de la EC, pone de manifiesto la elevada prevalencia de lesiones histológicas duodenales cuando se toman biopsias de duodeno de forma sistemática. Hasta un 22% de los pacientes a los que se realizaron biopsias de duodeno por presentar síntomas como dispepsia, diarrea, anemia o dolor abdominal presentaron algún grado de enteropatía, siendo la DL (56,2%) la lesión más común. Esta lesión histopatológica puede formar parte del espectro de la enteropatía sensible al gluten, pero también puede ser secundaria a otras muchas causas. En el presente trabajo, realizado siguiendo una estrategia de evaluación etiológica definida, las causas más frecuentes de DL fueron la EC (38%), el SBID (21,1%) y la infección por H. pylori (14,9%).
El diagnóstico de EC en pacientes con DL es actualmente motivo de controversia, especialmente cuando el resultado de la serología es negativo, y depende en gran medida de los criterios diagnósticos y la estrategia diagnóstica empleada. Aziz et al.7, en un estudio etiológico de las causas de DL en 100 pacientes, establecieron un diagnóstico de EC en un 16% de los casos, pero únicamente consideraron aquellos con un resultado positivo de la serología celíaca. Los casos de DL con serología celíaca negativa constituyen un auténtico reto diagnóstico, y algunos autores consideran que forman parte de una nueva entidad clínica denominada sensibilidad al gluten no celíaca13. Sin embargo, en muchos de estos pacientes se puede detectar por técnicas de inmunohistoquímica la presencia de depósitos de IgA dirigida frente a la transglutaminasa tisular (TG2) a nivel subepitelial y endotelial, hecho que apoyaría la existencia de una respuesta inmunitaria adaptativa que es característica de la EC14. Esta técnica diagnóstica que ha demostrado ser muy sensible y específica para el diagnóstico de la EC es, por otra parte, compleja y difícil de implementar en la práctica clínica habitual puesto que su realización precisa muestras frescas o congeladas a −70°C15. Un aumento de la proporción de la subpoblación de LIE γδ+ en duodeno es también un hallazgo característico de los pacientes con EC, pero esta determinación inmunofenotípica se realiza por citometría de flujo y solamente está disponible en laboratorios especializados1. Por este motivo, el diagnóstico de EC en los pacientes con DL y síntomas del espectro clínico de la EC, pero con serología celíaca negativa, se sustenta frecuentemente en la presencia de un genotipo HLA-DQ2 o DQ8 compatible, y en la demostración inequívoca de que los síntomas y las lesiones son dependientes del gluten, para lo cual en ocasiones puede ser incluso necesaria realizar una sobrecarga de gluten1. La existencia de antecedentes familiares, enfermedades autoinmunes u otras enfermedades del espectro de la EC pueden ayudar en el diagnóstico final. Con esta estrategia, Rosinach et al.8 establecieron un diagnóstico de enteropatía sensible al gluten en 39 (43%) pacientes de un total de 90 pacientes consecutivos con DL y síntomas del espectro clínico de la EC.
El estudio genético HLA-DQ2 y/o DQ8ha demostrado ser una «herramienta» útil en el diagnóstico de la EC en personas con sospecha clínica bien fundada, serología celíaca negativa y presencia de una lesión histológica no concluyente, ya que su presencia apoya el diagnóstico, mientras que su ausencia lo permite excluir con una elevada probabilidad16. En nuestro estudio, el 96% de los pacientes diagnosticados de EC eran portadores de alguno de los alelos del gen HLA-DQ2 y/o de los 2 alelos del gen HLA-DQ8. En estos pacientes, la EC constituyó el diagnóstico de la DL en más del 60% de los casos, mientras que en ausencia de los genotipos HLA-DQ2 o DQ8, los diagnósticos más frecuentes fueron el SBID (43,8%) y la infección por H. pylori (21,9%). La positividad del estudio genético resultó ser además un buen predictor de respuesta clínica a la DSG (84 vs 47,8% en nuestra serie) en pacientes con DL.
El SBID constituye en este estudio la segunda causa más frecuente de DL estando presente en un 21,1% de los casos como diagnóstico principal y en un 11,8% coexistiendo con el diagnóstico de EC. En este último grupo el SBID fue responsable de la reaparición de los síntomas digestivos, una vez que el paciente había presentado una mejoría clínica con la DSG. En los trabajos previos que estudian la etiología de la DL esta posibilidad diagnóstica no se había investigado7,8 o bien se había evaluado mediante cultivo de aspirado duodenal representando menos del 10% de los diagnósticos6,17. En nuestra serie, la presencia de SBID se investigó mediante la realización de una prueba de hidrógeno espirado con lactulosa. Aunque esta prueba tiene una sensibilidad y especificidad limitada (52 y 86%, respectivamente), el diagnóstico final se estableció después de demostrar una respuesta clínica al tratamiento con rifaximina o metronidazol18. Se desconoce el mecanismo exacto por el cual los microorganismos potencialmente perjudiciales pueden ocasionar una enteropatía con un aumento de la expresión de LIE, pero podrían contribuir por alguna de las siguientes vías: aumento de la permeabilidad del epitelio, activación de una respuesta inmunológica por similitud molecular con autoantígenos del huésped o interacción directa con células epiteliales o presentadoras de antígenos con activación de una respuesta tipo Th1 y liberación de citocinas proinflamatorias (TNF-α, IFN-γ)19. En los pacientes con EC, el SBID se ha implicado como una causa frecuente de reaparición de los síntomas digestivos tras la respuesta clínica a la DSG20,21.
La infección por H. pylori es un diagnóstico etiológico frecuente en los pacientes con DL. Nahon et al.22, en una serie de 17 pacientes con DL, encontraron la presencia de H. pylori en 12 (71%) pacientes, y demostraron cómo la erradicación de la infección se seguía de un descenso en el número de LIE. Rosinach et al.8, en un estudio en el que se utilizó una estrategia secuencial de diagnóstico y tratamiento para evaluar la etiología de la DL en 90 pacientes, observaron cómo 45 (50%) pacientes presentaron infección por H. pylori y cómo en 22 (24,4%) la erradicación de la infección se siguió de una mejoría clínica e histológica. En nuestro trabajo, que ha incluido la evaluación de 174 pacientes, de los que 87 (50%) presentaban infección por H. pylori, esta ha sido la causa de la DL en una proporción menor de pacientes (14,9%). Estas diferencias podrían ser explicadas debido a que la estrategia de diagnóstico y tratamiento utilizada ha sido diferente. En nuestro estudio, el tratamiento erradicador no constituyó en la mayoría de los casos la primera opción terapéutica, y se recomendó solamente en aquellos pacientes con estudio genético HLA-DQ2 o DQ8 negativo o bien cuando este estudio era positivo y los pacientes no habían presentado una respuesta clínica a la DSG.
Existe poca información acerca de valor de los síntomas a la hora de diferenciar entre las diferentes enfermedades implicadas en la DL8. Los resultados aportados por este estudio no permiten establecer asociaciones exclusivas entre un síntoma determinado o un grupo de síntomas y una etiología concreta, de manera que la valoración clínica sigue siendo insuficiente para alcanzar este objetivo. Sin embargo, sí hemos encontrado algunas diferencias que en determinadas circunstancias podrían ser de utilidad para orientar al clínico entre las causas más prevalentes. Los síntomas relacionados con la dispepsia, incluidos algunos comúnmente asociados a este síndrome como la flatulencia y la distensión abdominal, y otros con los que existe frecuente solapamiento como los relacionados con el síndrome de intestino irritable y la enfermedad por reflujo, parecen ser más frecuentes en presencia de EC y/o SBID que en los casos atribuidos a H. pylori. Por otro lado, las formas de presentación del tipo anemia y dolor abdominal sí podrían relacionarse en mayor medida con la infección por el microorganismo y ser infrecuentes en la DL por SBID. No obstante, el carácter retrospectivo de la obtención de la información obliga a ser cautos con respecto a estos datos.
El amplio abanico de causas que puede ocasionar una DL, así como la ausencia de diferencias claras en la presentación clínica entre las mismas, dificulta en gran medida el diagnóstico etiológico, especialmente cuando el resultado de la serología celíaca es negativo. En estos pacientes, la realización de una estrategia secuencial de diagnóstico y tratamiento puede ayudar a establecer la relación causal entre una determinada entidad y la respuesta clínica e histológica a un tratamiento específico. Teniendo en cuenta los resultados del presente trabajo y la complejidad de los diferentes tratamientos etiológicos, proponemos la siguiente estrategia diagnóstico-terapéutica. En todo paciente con diagnóstico histopatológico de DL se debería disponer de serología celíaca (ATGT), estudio genético HLA-DQ2 y DQ8 y una prueba diagnóstica para H. pylori, así como descartar consumo reciente de AINE o antagonistas del receptor de la angiotensina ii23. Si el resultado de la serología es positivo se debería recomendar al paciente iniciar una DSG y valorar la respuesta clínica y serológica. En los casos restantes en los cuales el resultado de la serología celíaca es negativo, la estrategia terapéutica vendrá determinada en gran medida por el síntoma principal del paciente y el resultado del estudio genético HLA.
Si el síntoma principal que ha conducido a realizar la EDA es la diarrea se debería realizar un estudio de parásitos en heces y descartar mediante sangre oculta y leucocitos en heces que se trate de una diarrea de origen inflamatorio; siendo todo ello negativo y ante un estudio genético HLA compatible se debería proponer al paciente iniciar una DSG de prueba para valorar la respuesta clínica. Si el estudio genético HLA fuera negativo, o bien no existiera una respuesta clínica a la DSG, se debería descartar el diagnóstico de SBID, bien realizando una prueba de hidrógeno con lactulosa o bien iniciando un tratamiento antibiótico empírico. En pacientes con dispepsia, anemia o dolor abdominal, el tratamiento inicial debería ser la erradicación de H. pylori siempre que esté presente. Si no existe una respuesta clínica a la erradicación, o bien la infección está ausente, la estrategia terapéutica dependerá del resultado genético HLA. En pacientes con HLA compatible se debería proponer al paciente iniciar una DSG y valorar la respuesta clínica. En caso de ausencia de mejoría clínica, o bien los casos con estudio HLA negativo, se debería descartar el diagnóstico de SBID bien realizando una prueba de hidrógeno con lactulosa o bien iniciando un tratamiento antibiótico empírico. En todos los casos, una vez conseguida la mejoría clínica, se debería demostrar además que existe una respuesta histológica antes de establecer el diagnóstico etiológico final de la DL.
Sin embargo, el presente estudio es retrospectivo y esta estrategia de diagnóstico y tratamiento debería confirmarse en estudios prospectivos de coste-efectividad. Además, el diseño empleado no permite descartar la posibilidad de una resolución espontánea (sin necesidad de ningún tratamiento) de la DL, por lo que es igualmente necesario confirmar estos resultados en estudios aleatorizados controlados con placebo. La detección de depósitos subepiteliales de IgA anti-TG2 en la mucosa duodenal mediante técnicas de inmunofluorescencia podría facilitar la estrategia de diagnóstico de los pacientes con DL y serología celíaca negativa, y establecer qué pacientes de los que responden a una DSG pertenecen realmente al espectro de la EC y cuáles forman parte de la sensibilidad al gluten no celíaca. Sin embargo, se trata de una técnica de laboratorio compleja que no es posible realizar en la mayoría de los laboratorios13,15.
En conclusión, la toma de biopsias de duodeno de forma sistemática en pacientes con síntomas del espectro clínico de la EC pone de manifiesto la elevada prevalencia de lesiones histológicas duodenales, siendo la DL la lesión más frecuente. En nuestro medio, la EC, seguida del SBID y la infección por H. pylori, constituyen las causas más frecuentes de DL. Una estrategia de diagnóstico y tratamiento, basada en la presentación clínica y los resultados de la serología celíaca, el estudio genético HLA y el estatus H. pylori, puede facilitar el diagnóstico final de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.