Durante muchos años los procedimientos endoscópicos, casi siempre desagradables y a veces dolorosos, se practicaron sin ningún tipo de sedación o analgesia. El desarrollo de las técnicas de sedación tiene el objetivo de mejorar la tolerancia de la endoscopia y reducir el temor a estas exploraciones. La sedación y la analgesia, en la endoscopia gastrointestinal, reducen o eliminan la ansiedad, el dolor y el recuerdo desagradable del procedimiento, un objetivo especialmente importante teniendo en cuenta la frecuencia con la que es necesario repetirlo. En la actualidad la sedación es considerada como un «componente integral» de la exploración endoscópica1. Su demanda ha aumentado en la última década2–4 no solo por reducir la ansiedad y el malestar del paciente, sino también porque proporciona un entorno apropiado para realizar una exploración completa. Este hecho es especialmente importante si se considera la progresiva evolución hacia la realización de un mayor número y complejidad de las técnicas endoscópicas5.
La sedación ideal para la endoscopia sería aquella que tuviera un inicio rápido de la acción sedante y analgésica, una facilidad en el control del nivel deseado de sedación, y una desaparición del efecto sedante con recuperación rápida del paciente, todo ello manteniendo un buen perfil de seguridad.
La endoscopia diagnóstica estándar puede realizarse con sedación moderada o consciente. Ésta consigue un perfil de tolerancia muy aceptable mientras el paciente mantiene la respuesta a estímulos táctiles o auditivos superficiales y una correcta función cardiorrespiratoria. Proporciona por tanto una adecuada ansiólisis, control del dolor y amnesia, y es más segura que la sedación profunda6. Existen exploraciones de mayor complejidad (colangiopancreatografía retrógrada endoscópica [CPRE], ecografía endoscópica) que precisan de una sedación profunda. En este nivel, se alcanza un grado más avanzado de sedación: el paciente solo responde ante estímulos táctiles o auditivos intensos, y ocasionalmente puede necesitar soporte respiratorio y/o hemodinámico. A pesar de lo cual se consigue una tolerancia y facilidad para la realización de la exploración mayor que con la sedación moderada o consciente manteniendo un perfil de seguridad muy aceptable6,7.
Aunque la sedación consciente se utiliza de manera habitual, la disponibilidad de fármacos, como el propofol, que mejoran el perfil de seguridad de la sedación profunda, hace que esta se indique cada vez más, incluso en exploraciones estándar (gastroscopia y colonoscopia diagnósticas6,7) demostrando seguridad y superioridad en tolerancia, aceptación del paciente y tiempo de recuperación.
Debe tenerse en cuenta no obstante que todo el proceso de sedación/anestesia es un continuum entre el estado normal de conciencia y la anestesia general. Los límites entre los diferentes niveles de sedación no son fácilmente reconocibles y es posible pasar con facilidad de un nivel de sedación al superior, pudiendose alcanzar grados de anestesia general de forma imperceptible e involuntaria. En el nivel de la anestesia general el paciente no responde a ningún estímulo y frecuentemente se debe mantener su función respiratoria de manera artificial6–8. Por ello, las personas responsables de la sedación deben tener formación y conocimiento de los diferentes niveles de sedación y capacidad para detectar y revertir estados de sedación no deseados o innecesarios para el tipo de exploración que se realiza. Esta capacitación no es exclusiva de ninguna especialidad y es factible y coste/eficaz que los propios médicos responsables de la realización de los procedimientos endoscópicos y las enfermeras entrenadas puedan realizar la sedación, si tienen estos conocimientos, sin la necesidad absoluta de un anestesiólogo en la sala de endoscopia9.
En este documento se define la posición de la Sociedad Catalana de Digestologia respecto a la sedación durante los procedimientos de la endoscopia digestiva. Se pretende aportar los datos que nos permitan establecer, con base objetiva y suficiente, los criterios para la administración de sedación en la endoscopia con la mejor calidad de atención y los menores riesgos posibles.
Base racional para el uso de sedación en endoscopia digestivaEl número de procedimientos endoscópicos en todo el mundo ha aumentado de forma considerable en la última década y, por tanto, también la importancia de la calidad de éstos. El uso de la sedación durante una exploración minimiza el dolor y el malestar del paciente mejorando la tolerancia y la aceptación a la prueba10,11. En una reciente revisión y metanálisis de 36 estudios que incluyeron un total de 3.918 pacientes a quienes se les habían realizado gastroscopias o colonoscopias, se observó que la administración de una sedación moderada proporcionaba un alto nivel de satisfacción para el paciente y para el médico con un bajo riesgo de efectos adversos12. A pesar de ello existe una gran variabilidad sobre el uso y tipo de sedación entre los diferentes países, siendo por ejemplo estas diferencias muy importantes en Europa respecto al uso de la sedación en una gastroscopia diagnóstica de rutina (17% en España vs. 77% en Suiza)10. De igual forma se pone de manifiesto una gran variabilidad en los fármacos utilizados (diazepam, midazolam, meperidina, fentanilo remifentanilo, propofol, ketamina o gases anestésicos) para la sedación y en quien los administra (anestesiólogo, endoscopista, otro médico no endoscopista ni anestesiólogo, enfermera de anestesia o enfermera de endoscopia). De forma global, la mayoría de endoscopias que se realizan de rutina en América del Norte y Australia se practican bajo sedación consciente, mientras que el nivel de la sedación varía ampliamente en Europa, Asia y África y entre los diferentes hospitales de un mismo país.
Una correcta sedación en endoscopia comporta una buena tolerancia del paciente a la exploración y, por tanto, una mayor disponibilidad por parte del mismo para repetirla en caso de ser necesario13,14. Para obtener una correcta sedación, el objetivo es encontrar un equilibrio entre los beneficios y los riesgos potencialmente evitables (tabla 1 y tabla 2)11.
Objetivos de una sedación endoscópica. (Adaptada de Thomson et al.)11
| • Disminución del nivel de consciencia y de la ansiedad |
| • Amnesia |
| • Analgesia |
| • Cooperación del paciente |
| • Mantenimiento de la vía aérea y de los reflejos de la misma |
| • Estabilidad hemodinámica |
| • Recuperación rápida y segura posprocedimiento |
Lo que hay que evitar en una sedación endoscópica (adaptada de Thomson et al.)11
| • Agitación del paciente |
| • Estado profundo de sedación innecesario |
| • Ausencia de respuesta útil a la estimulación |
| • Pérdida de los reflejos protectores de la vía aérea |
| • Imposibilidad de mantener al paciente ventilado |
| • Hipoxemia/hipercapnia |
| • Inestabilidad cardiovascular (arritmia o hipotensión) |
Para la aplicación correcta de la sedación en endoscopia es necesario disponer de guías y consensos basados en datos objetivos de evidencia científica. Actualmente disponemos de diferentes guías desarrolladas por varias sociedades nacionales (británica15, española16,17, austriaca18, alemana19, europea20 y americana21 y un documento internacional de posicionamiento («The Athens international position statements» realizado por la World Organization of Digestive Endoscopy, la Hellenic Society of Gastroenterology, la European Society of Gastrointestinal Endoscopy y la United European Gastroenterology Federation y aprobado por la American Society for Gastrointestinal Endoscopy)22. A pesar de las diferencias socioculturales, económicas y medicolegales entre los diferentes países, se ha llegado a un acuerdo respecto algunos puntos claves principales y prácticas de sedación en endoscopia: 1) la sedación mejora la tolerancia y el cumplimiento para la realización de una endoscopia, aumentando la calidad de dicha exploración; 2) la necesidad de un consentimiento informado; 3) la posibilidad de ofrecer al paciente una endoscopia sin sedación; 4) monitorización de los signos vitales, así como de los niveles de conciencia y dolor/malestar en todos los pacientes que requieren una endoscopia; 5) disponibilidad de endoscopistas y enfermeras/os entrenados correctamente para administrar propofol de forma efectiva y segura en pacientes de riesgo medio; 6) necesidad de más estudios comparativos prospectivos sobre la efectividad del uso de benzodiacepinas y opiáceos frente a propofol con respecto a la eficacia y seguridad de su uso en una gastroscopia y/o colonoscopia.
El gran debate creado en torno a la sedación en endoscopia es si el propofol puede ser administrado por endoscopistas frente a la obligatoriedad de que lo hagan anestesiólogos. Existen múltiples revisiones y consensos que apoyan la seguridad y eficacia del uso del propofol por endoscopistas y/o enfermeras/os que disponen de una correcta preparación para su utilización20,22,23. En un reciente artículo se realiza una revisión de la bibliografía publicada sobre la seguridad de la sedación con propofol dirigida por el endoscopista, en un total 646.080 casos endoscópicos24. Se comunican 11 intubaciones endotraqueales, ningún daño neurológico permanente y 4 muertes en pacientes con importante comorbilidad asociada. Los autores concluyen que si se compara con la información disponible anteriormente, acerca del uso de sedación tradicional (benzodiacepinas y opiáceos) se obtiene un índice menor de mortalidad y un índice similar que con la anestesia general realizada por anestesistas, y se indica que se hubiera producido un incremento considerable del coste si se hubiese realizado por un anestesista sin añadirse ningún potencial beneficio relativo.
Por todo ello se puede concluir que: 1) existe una base racional para la administración de sedación durante la endoscopia cuando el paciente lo desee y consienta; 2) hay datos bibliográficos sobre la idoneidad, eficacia y seguridad de utilizar benzodiacepinas y opiáceos y, en los últimos años, propofol para la sedación profunda, y 3) el propofol puede ser utilizado por médicos y/o enfermeras entrenadas en su administración en pacientes de riesgo medio sin la necesidad de que un anestesiólogo esté presente en la sala en el momento de la realización del procedimiento.
Características técnicas, metodología de utilización, curva de aprendizajeCaracterísticas técnicasRequerimientos de la Unidad8,17,25PersonalLos médicos y enfermeras deberán conocer los fármacos usados en sedación, su mecanismo de acción, las dosis y sus efectos adversos.
La American Society of Anaesthesiology (ASA) recomienda que haya al menos una persona entrenada en soporte vital básico dentro de la sala mientras se realiza sedación moderada o profunda. Además se recomienda que una persona cualificada en soporte vital avanzado esté disponible de forma inmediata (1- 5 min). Durante una sedación profunda, debe haber personal sanitario dedicado a la sedación y monitorización de forma exclusiva, mientras que en la sedación moderada, la persona responsable puede ayudar a la realización de la prueba6.
Instalaciones/materialLa sala de endoscopia debe disponer de salida de oxígeno, y aspirador independiente del utilizado para el procedimiento endoscópico y de todo el material necesario tanto para llevar a cabo el procedimiento como para realizar una reanimación cardiopulmonar.
- •
Carro de reanimación cardiopulmonar con desfibrilador.
- •
Equipo básico y avanzado para el manejo respiratorio: tomas de oxígeno y vacío, sondas para aspiración de secreciones, mascarilla, ambú, laringoscopio y tubos endotraqueales de diferentes medidas.
- •
Material para establecer un acceso venoso adecuado
- •
Fármacos para realizar la sedación, sus antagonistas farmacológicos (naloxona y flumacenil) y para realizar una reanimación cardiopulmonar avanzada.
- •
Bombas de infusión (opcional).
Se debe disponer de monitorización de:
- •
Presión arterial (PA): basal y a intervalos de 3-5 min.
- •
Frecuencia cardíaca (FC): continua durante toda la sedación y recuperación postsedación.
- •
Oxímetro de pulso: durante toda la sedación y recuperación.
- •
Electrocardiograma: recomendado en los pacientes con arritmia o enfermedad cardiológica grave, pero no es necesario en pacientes de bajo riesgo21.
- •
Capnógrafo: recomendado en procedimientos prolongados o cuando no puedan observarse los movimientos respiratorios durante la sedación. No se recomienda su uso sistemático en endoscopia20,21.
La sala de recuperación estará:
- •
Dotada de monitores, toma de oxígeno y de vacío y personal sanitario para observación del paciente hasta el alta.
- •
Midazolam. El fármaco de elección es el midazolam que tiene una potencia de acción 5 veces superior al diazepam, inicio de acción más rápido (2-3 min), menor vida media (1-3 h) y mayor efecto amnésico26. Se recomienda administrar un bolo inicial por vía intravenosa, de 1-2mg, y posteriores cada 2- 3 min. Se recomienda un 50% de esta dosis en pacientes ancianos o con enfermedades cardiorrespiratorias. La combinación con otros fármacos aumenta el riesgo de efectos adversos, por adición o sinergia. Las pautas de sedación balanceada junto a opiáceos y propofol se han preconizado, sobre todo en Estados Unidos, para mantener grados de sedación moderada27,28. En dosis bajas y en bolo se ha utilizado para reducir la ansiedad antes de la exploración en pacientes jóvenes, o en pacientes con enfermedad cardíaca grave y baja fracción de eyección, ya que tiene menor efecto cardiodepresor que el propofol29.
- •
Meperidina. Es 10 veces menos potente que la morfina y con una vida media de 3 h, un rango terapéutico más seguro. Sin embargo, posee mayor capacidad para provocar depresión cardiovascular. Debe administrarse con precaución en pacientes con insuficiencia hepática o renal, y presenta una gran vida media de eliminación, lo que retrasa el alta hospitalaria. La dosis recomendada es de 50-100mg por vía intravenosa lenta, de 15 a 30 min antes de la exploración.
- •
Fentanilo. Con menos efectos secundarios, mayor potencia analgésica (50 veces superior a la morfina) y menor duración que la meperidina. Su efecto empieza a los 30 s, tiene un pico máximo a los 4 min y una duración de unos 40 min en bolo único y a dosis bajas, por lo que es un fármaco más adecuado para su uso en endoscopia30. Los efectos secundarios más frecuentes son depresión respiratoria, náuseas o vómitos, prurito e hipotensión. Se administra en bolo inicial de 50μg con incrementos de 25-50μg hasta conseguir el efecto deseado. Es recomendable disminuir la dosis en pacientes ancianos o con enfermedades cardiorrespiratorias. Su asociación a benzodiacepinas tiene un efecto sinérgico, obteniéndose un mayor efecto sedante, con menor dosis total de ambos fármacos, pero también con un mayor riesgo de efectos adversos.
- •
Propofol. Es un agente hipnótico con propiedades sedantes y amnésicas. Su ficha técnica especifica que debe ser administrado por personal entrenado en administración de anestesia general o manejo de una unidad de cuidados intensivos. Sin embargo, desde su introducción en 1980, su uso se ha extendido a otras áreas. La experiencia en sedación endoscópica usando propofol sin anestesiólogo supera los 646.080 pacientes24. El propofol contiene aceite de soja, glicerol y lecitina de huevo, por lo que está contraindicado en pacientes alérgicos a estos alimentos. Sus principales ventajas son su inicio de acción rápido (30-60 s) y su corta duración (3-10 min). Si se administra en perfusión continua su velocidad de eliminación es más lenta por acumulación en tejido adiposo. El principal inconveniente es que no dispone de antídoto específico. En procedimientos de corta duración se recomienda administrar el propofol en forma de bolo intermitentes en lugar de perfusión intravenosa continua. Inicialmente se administra una dosis de 0,5-1mg/kg y posteriormente bolos sucesivos de 0,25-0,5mg/kg cada 2-4 min. En exploraciones largas, es más útil administrarlo en bomba de perfusión con un bolo inicial de 0,5mg/kg seguido de perfusión de 6-12mg/kg/h. En pacientes mayores de 60 años, o con comorbilidad importante, se recomienda reducir a la mitad tanto las dosis iniciales como los bolos posteriores o la perfusión31. Por el contrario, en alcohólicos y fumadores se requerirán dosis mayores. En pacientes con insuficiencia hepática o renal, prácticamente no se modifican sus propiedades farmacocinéticas, por lo que no es necesario realizar ajustes de dosis, incluyendo pacientes con hepatopatía crónica y riesgo de encefalopatía32. También debe ajustarse la dosis cuando se administra junto con benzodiacepinas y opiáceos, que aumentan los efectos sedantes e hipnóticos. La asociación con dosis bajas de midazolam o fentanilo puede mejorar la calidad de la sedación sin incrementos en el tiempo de recuperación33,34. Su efecto secundario más importante es la disminución de la PA sanguínea, debida a vasodilatación y depresión miocárdica. Los pacientes con tratamiento crónico con inhibidores de la enzima conversora de la angiotensina (IECA) pueden sufrir hipotensión arterial grave. También es frecuente la aparición de bradicardia y depresión respiratoria, especialmente cuando se asocia con opiáceos.
Los antagonistas de las benzodiacepinas y de los opiáceos se utilizan para reducir la depresión respiratoria o sus efectos secundarios graves cuando no hay respuesta a la administración de oxígeno suplementario o a la estimulación. También se han indicado para disminuir el tiempo de recuperación tras la sedación, en cuyo caso debe considerarse que la duración del efecto del antídoto en ocasiones es inferior a la del sedante y pueden producirse episodios de resedación.
- •
Flumacenilo. Antagonista de las benzodiacepinas. Tarda unos 5 min en hacer efecto, y tiene una duración de 1-2 h. La dosis inicial es de 0,2mg. En ocasiones es necesario administrar dosis adicionales de 0,1- 0,2mg, sin sobrepasar una dosis máxima de 2-3mg.
- •
Naloxona. Es un antagonista competitivo de los opiáceos. En caso de depresión respiratoria se administra diluido en suero fisiológico a dosis de 40μg por vía intravenosa cada 2-3 min. Debido a su corta vida media, se ha de administrar una perfusión de 5μg/kg/min hasta que se metabolice el opiáceo administrado.
En exploraciones más largas o en pruebas que pueden resultar más dolorosas, pueden usarse combinaciones de fármacos. Las más frecuentes son la asociación de un opiáceo junto a una benzodiacepina o un hipnótico (midazolam+fentanilo; propofol+fentanilo), para disminuir el dolor, o bien la asociación de una benzodiacepina y un hipnótico (midazolam+propofol), que podría mejorar la calidad de la sedación sin aumentar el tiempo de recuperación. Cuando se utilizan combinaciones de fármacos el riesgo de sobredosificación y aparición de efectos adversos es mayor. Inicialmente es conveniente reducir las dosis hasta observar el efecto producido y administrar antes el mórfico. La sedación con propofol balanceada (balanced propofol sedation, BSP) pretende administrar midazolam y opiáceos en dosis única junto a pequeños bolos de propofol con el objetivo de mantener al paciente en niveles de sedación moderada28,35.
Metodología de utilizaciónPreparación del paciente- -
Ayunas. Se recomienda seguir los estándares de las guías de la ASA: no ingerir líquidos desde 2 h antes de la prueba ni sólidos o leche de vaca desde 6 h antes de la prueba6.
- -
También se le ha de indicar al paciente que venga acompañado.
La ley exige el previo consentimiento del usuario para cualquier procedimiento que se vaya a realizar en el ámbito de la salud. Todos los pacientes tienen derecho a escoger si desean o no que el procedimiento se realice con sedación. Así pues, se les debe informar sobre la posibilidad de realizar la prueba con sedación, explicando de forma clara en qué consiste el procedimiento, los riesgos del mismo, las posibles complicaciones específicas relacionadas, y quién va a realizarla, para que el paciente pueda decidir libremente entre las opciones disponibles. Aunque el consentimiento para la sedación puede incluirse en la misma hoja de consentimiento general para la exploración, se recomienda hacer una hoja de consentimiento específico aparte de la del procedimiento.
Historia clínica y exploración física específica para sedación en endoscopia- •
Historia clínica. Debe recoger los siguientes aspectos:
- •
Enfermedad cardiopulmonar o neurológica importante.
- •
Historia de apnea del sueño.
- •
Efectos adversos previos con la sedación/anestesia o historia de intubación difícil.
- •
Abuso de alcohol u otras drogas.
- •
Alergias a medicamentos o alimentos y específicamente al huevo y la soja.
- •
Antecedentes o historia de dificultad de vaciamiento gástrico, obstrucción gastrointestinal o posibles riesgos de broncoaspiración.
- •
- •
Exploración física:
- •
Constantes vitales y nivel de conciencia previo a la exploración.
- •
Grado de obesidad.
- •
Alteraciones de cuello y orofaringe (cuello corto, limitación de la extensión cervical, masas, apertura reducida de la boca, malformaciones orofaciales, etc.).
- •
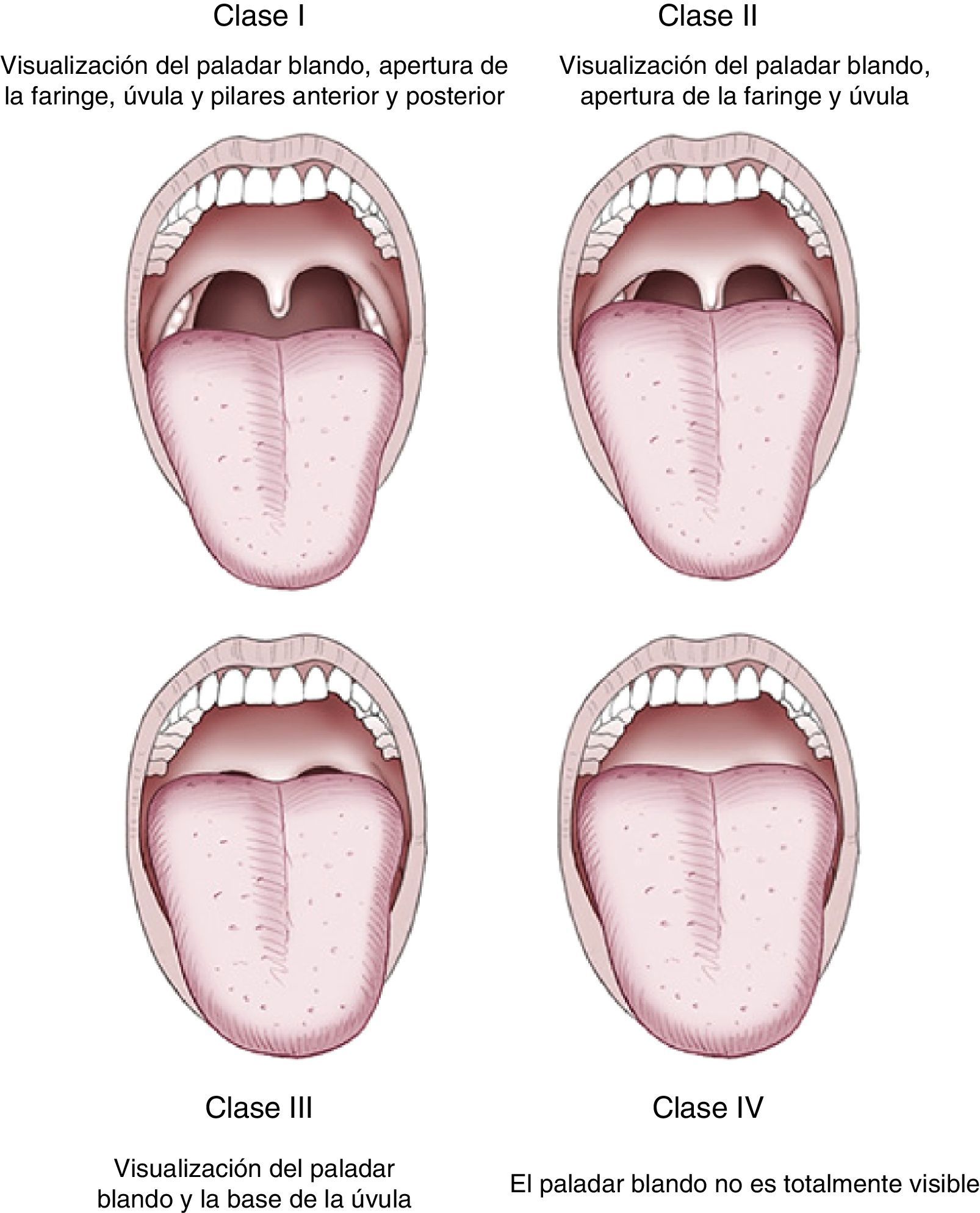
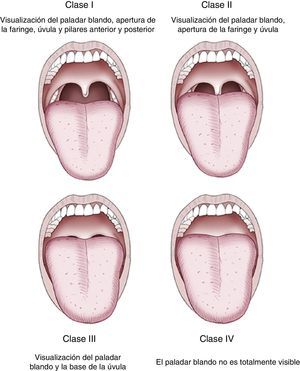
Una vez realizada la historia clínica, podemos clasificar a los pacientes según su riesgo de acuerdo con el la clasificación de la ASA (tabla 3) 6 y la dificultad para una posible intubación según la clasificación de Mallampati et al.37, que valora la visualización de estructuras anatómicas faríngeas (fig. 1). Debe considerarse la presencia de un anestesista siempre que el paciente presente un ASA>III, dificultad a la intubación, historia de reacciones adversas graves con la sedación, alcoholismo importante, drogadicción, grados avanzados de apnea del sueño e insuficiencia cardíaca o respiratoria grave.
Clasificación de la situación física según la American Society of Anesthesiologists (ASA)
| ASA I | El paciente no presenta ninguna alteración fisiológica, bioquímica o psiquiátrica. El proceso patológico que motiva la intervención quirúrgica está localizado y no tiene repercusiones sistémicas |
| ASA II | Alteración sistémica leve o moderada secundaria a la enfermedad que motiva la intervención quirúrgica o a cualquier otro proceso fisiopatológico. Los niños pequeños y los ancianos pueden incluirse también en este grupo, aunque no tengan ninguna enfermedad sistémica. Se clasifica, asimismo, en este grupo a los pacientes excesivamente obesos y con bronquitis crónica |
| ASA III | Enfermedades sistémicas graves de cualquier tipo, incluidas aquellas en las que no resulta posible definir claramente el grado de incapacidad |
| ASA IV | Trastornos sistémicos graves y potencialmente mortales, no siempre corregibles quirúrgicamente |
| ASA V | Paciente moribundo con pocas posibilidades de supervivencia, que requiere una intervención quirúrgica desesperada. En la mayoría de los casos la intervención quirúrgica se puede considerar una medida de reanimación y se realiza con anestesia mínima o nula |
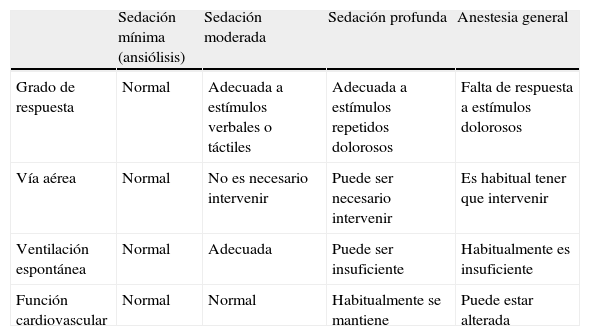
En función del riesgo del paciente y de la prueba que se vaya a realizar (duración, complejidad, tipo de procedimiento endoscópico, posibles molestias, etc.), decidiremos el nivel de sedación que queremos conseguir. La escala de la ASA es la más utilizada en endoscopia y describe 4 niveles de sedación: ansiólisis, sedación moderada, profunda y anestesia en función del nivel de reacción a estímulos y la función respiratoria6 (tabla 4). El nivel de sedación debe conseguirse de manera progresiva, aunque como no siempre es posible predecir la respuesta de un paciente a los fármacos, es necesario que el personal responsable esté preparado para revertir al paciente de un nivel de sedación superior al inicialmente previsto o deseado.
Nivel de sedación
| Sedación mínima (ansiólisis) | Sedación moderada | Sedación profunda | Anestesia general | |
| Grado de respuesta | Normal | Adecuada a estímulos verbales o táctiles | Adecuada a estímulos repetidos dolorosos | Falta de respuesta a estímulos dolorosos |
| Vía aérea | Normal | No es necesario intervenir | Puede ser necesario intervenir | Es habitual tener que intervenir |
| Ventilación espontánea | Normal | Adecuada | Puede ser insuficiente | Habitualmente es insuficiente |
| Función cardiovascular | Normal | Normal | Habitualmente se mantiene | Puede estar alterada |
Modificada de American Society of Anesthesiologists (ASA)6.
Se recomienda administrar oxígeno desde 5 min antes del procedimiento. Si el paciente presenta hipoxemia durante la prueba se debe incrementar el aporte de oxígeno6. Debe tenerse en cuenta que la administración de oxígeno suplementario puede retrasar la aparición de una disminución de la saturación de oxígeno. En este sentido, la curva de actividad respiratoria proporcionada por la capnografía nos muestra con precisión las fases y duración de la apnea previas a la desaturación de oxígeno.
Administración de fármacosUna vez decidido el nivel de sedación deseado, se deben administrar los fármacos según las dosis recomendadas previamente.
Monitorización durante el procedimiento38La seguridad y prevención de las complicaciones asociadas a la sedación obliga a que todos los pacientes a los que se les administre fármacos sedantes sean controlados a 3 niveles:
- •
Monitorización hemodinámica. De la FC de manera continua y de la PA basal y cada 3-5 min. En pacientes con cardiopatías graves debe mantenerse un registro electrocardiográfico continuo.
- •
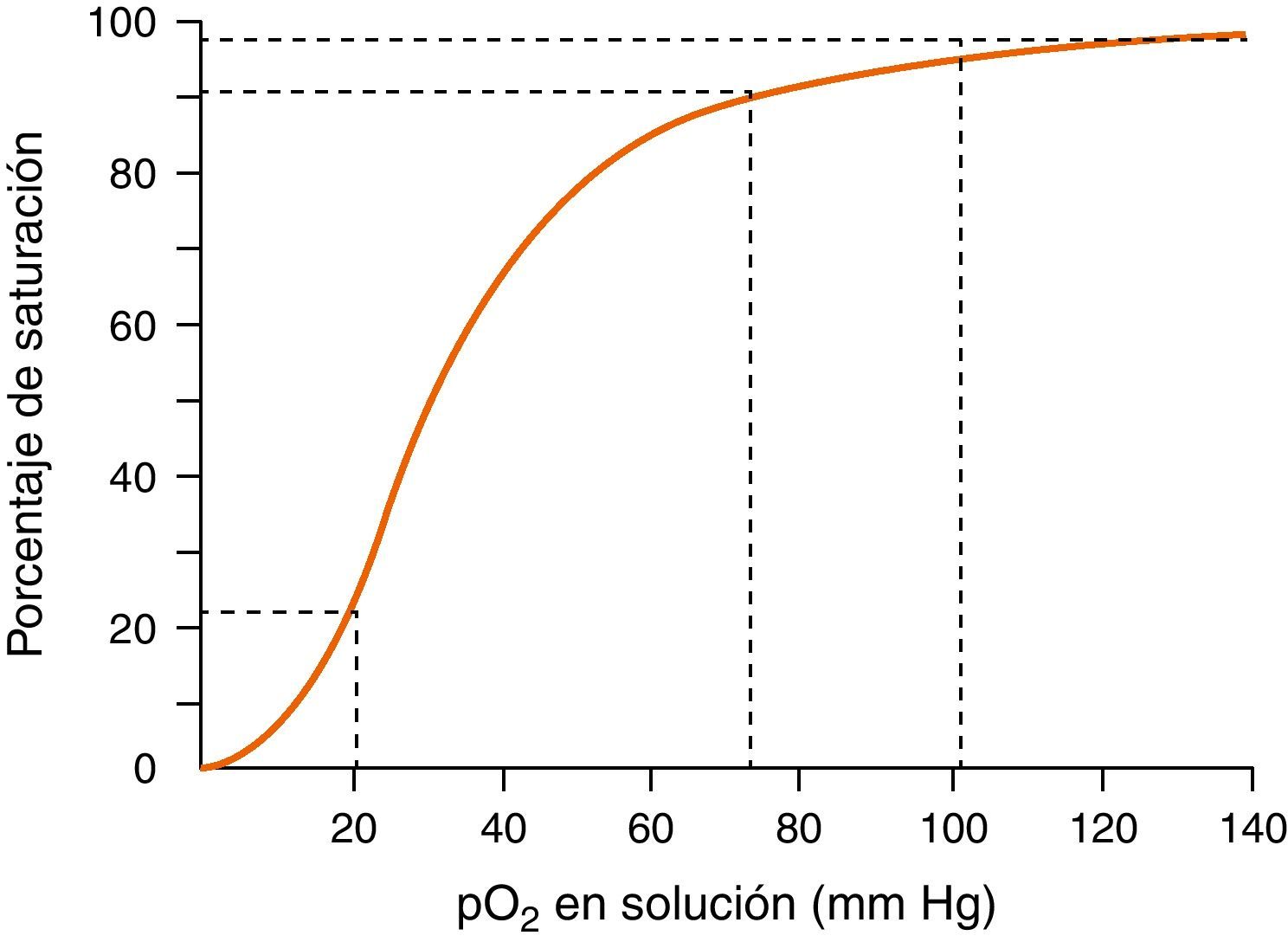
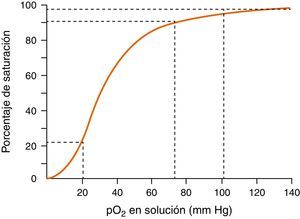
Monitorización de la función respiratoria. Incluye: 1) la oximetría de pulso, para monitorización continua de la saturación de oxígeno en la hemoglobina de la sangre arterial, teniendo en cuenta que el porcentaje de saturación de la hemoglobina no es un reflejo exacto de la pO2 (véase curva de disociación de la oxihemoglobina en figura 2), y 2) la actividad respiratoria que permita la detección precoz de la hipoventilación o la aparición de apneas prolongadas mediante la observación de los movimientos respiratorios o la capnografía.
- •
Monitorización del nivel de conciencia. La respuesta a estímulos verbales o táctiles es un reflejo del nivel de conciencia. Los estímulos necesarios para obtener una respuesta deberán ser más intensos cuanto mayor sea la profundidad del nivel de sedación. Hay varias escalas que nos ayudarán a establecer el nivel de conciencia y, en función de ello y el grado de sedación deseado: evaluación de alerta-sedación modificada (MOAA/S)39 (tabla 5), escala de Ramsay40 (tabla 6). Se recomienda mantener al paciente en un nivel de la escala de Ramsay II-III o MOAA/S 4-5 cuando se desea una sedación superficial, y en un nivel IV-V de la escala de Ramsay o 2- 3 de la escala MOAA/S cuando se desea una sedación profunda. Esta valoración debe realizarse cada 3-5 min por la persona responsable de la sedación
Tabla 5.Escala Modified Observer's Assessment of Alertness/Sedation (MOAA/S)
Respuesta Puntuación Agitado 6 Responde rápidamente cuando se le llama por su nombre 5 Letárgico, responde en tono normal al llamarlo por su nombre 4 Respuesta solo tras llamarlo por su nombre con voz fuerte y/o repetidamente 3 Respuesta solo tras estímulo doloroso o agitarlo de forma suave 2 No responde después de un estímulo doloroso o de agitarlo 1 No responde a ningún estímulo profundo 0 Tabla 6.Escalas de niveles de sedación: clasificación de Ramsay
I Ansioso, agitado, inquieto II Cooperador, orientado, tranquilo III Sedado pero responde a órdenes verbales IV Dormido pero respuesta rápida a estímulos táctiles ligero V Dormido pero responde con lentitud a estímulos VI Dormido, sin respuesta a estímulos
- •
En caso de disminución de la saturación de O2 por debajo del 90%, el responsable de la sedación deberá: 1) aumentar el aporte de oxígeno; 2) asegurar la permeabilidad de la vía aérea (levantar la barbilla cánula de Guedel, aspiración de secreciones), y 3) ajustar la dosis de fármacos o administrar antagonistas si se dispone de ellos. La intensidad de estas acciones dependerá del nivel de disminución de la saturación de O2. El mantenimiento prolongado de la disminución de la saturación o la evidencia de parada respiratoria puede obligar a la detención del procedimiento con retirada del endoscopio y a mantener la ventilación del paciente con máscara de oxígeno (ambú), mascarilla laríngea o incluso la intubación orotraqueal.
- •
Estimular al paciente y bajar las dosis o detener la administración de sedante en caso de que el paciente pase a un nivel de sedación más profundo del pretendido.
Todos los pacientes que hayan recibido sedación deben mantenerse en observación hasta su recuperación y alta. En casos de sedación superficial, con fármacos de vida media corta y pacientes jóvenes, el periodo de recuperación es menor y la observación podría realizarse en la misma sala de endoscopia.
En casos en los que se prevea un periodo de recuperación más largo, el paciente deberá pasar a una sala de reanimación que debe estar equipada adecuadamente y dotada de personal, capacitado para monitorizar la función cardiorrespiratoria y manejar las complicaciones que puedan aparecer.
Se recomienda usar sistemas de puntuación para poder dar el alta a los pacientes, como la escala de Aldrete (tabla 7)41,42. Basándose en esta escala a los pacientes se les puede dar el alta con una puntuación superior a 9. Esta escala evalúa parámetros físicos y no la actividad psicomotora (reflejos, velocidad de cálculo y raciocinio, etc,), por lo que a los pacientes se le debe dar el alta acompañados por un adulto responsable.
Escala de Aldrete modificada
| Puntuación | |
| Actividad | |
| Mueve 4 extremidades voluntariamente o ante órdenes | 2 |
| Mueve 2 extremidades voluntariamente o ante órdenes | 1 |
| Incapaz de mover extremidades | 0 |
| Respiración | |
| Capaz de respirar profundamente y toser libremente | 2 |
| Disnea o limitación a la respiración | 1 |
| Apnea | 0 |
| Circulación | |
| Presión arterial ≤ 20% del valor preanestésico | 2 |
| Presión arterial 20-49% del valor preanestésico | 1 |
| Presión arterial ≥ 50% del valor preanestésico | 0 |
| Conciencia | |
| Completamente despierto | 2 |
| Responde a la llamada | 1 |
| No responde | 0 |
| Saturación arterial de oxígeno (SaO2) | |
| Mantiene SaO2>92% con aire ambiente | 2 |
| Necesita oxígeno para mantener SaO2>90% | 1 |
| SaO2<90% con oxígeno suplementario | 0 |
Para dar el alta es necesaria una puntuación igual o superior a 9.
Cuando se han administrado fármacos antagonistas, es necesario además dejar pasar el tiempo suficiente para evitar los posibles episodios de resedación, en función de la vida media de los fármacos (sedantes y antagonistas) administrados.
El alta se dará en presencia de un adulto que pueda acompañarlos y vigilar las posibles reacciones adversas. Se debe evitar sedar a pacientes que no vengan acompañados.
Recomendaciones al pacientePuesto que las escalas de recuperación no evalúan la actividad psicomotora, se recomienda que los pacientes recuperados tras la sedación eviten conducir, tomar decisiones importantes, o realizar actividades peligrosas o de precisión, durante al menos 6 a 24 h dependiendo de los fármacos administrados. Estas instrucciones se darán por escrito por el potencial efecto amnésico de los fármacos administrado
Curva de aprendizajeLos médicos y enfermeras responsables de la sedación deben tener una formación adecuada, sin que haya consenso sobre cómo debe ser la misma, ni sobre cuántos procedimientos son requeridos para adquirir la competencia en sedación. Hay recomendaciones de las sociedades científicas que indican que una educación reglada que incluya aspectos didácticos y prácticos es más efectiva que un aprendizaje no estructurado o basado en la experiencia personal38,43.
La ASA, cuando se usa sedación con propofol, recomienda un aprendizaje basado en 4 pilares fundamentales35.
Sesión de conocimientos teóricosEn esta sesión se deben impartir conocimientos teóricos sobre los fármacos usados en sedación que incluyan su farmacología, dosificación, efectos secundarios y manejo de los mismos.
Taller sobre el manejo de la vía respiratoriaEl adecuado manejo de la vía respiratoria es una de las aptitudes necesarias y el principal requisito para poder realizar la sedación durante los procedimientos endoscópicos con seguridad.
Los conocimientos necesarios para un correcto manejo de la vía aérea incluyen:
- •
Habilidad para evaluar correctamente la permeabilidad de la vía aérea.
- •
Capacidad para asegurar la permeabilidad de la vía aérea mediante el uso de técnicas manuales, cánulas o intubación.
- •
Ventilación manual.
También es importante saber evaluar de manera correcta la vía aérea antes del procedimiento para poder identificar a aquellos pacientes en los que se prevea que pueda ser difícil la intubación o la ventilación manual (escala de Mallampati, fig. 1)37.
Entrenamiento con simuladoresEn los últimos años, los simuladores han pasado a desempeñar un papel importante para la formación de personal en el ámbito de anestesia. Los simuladores permiten recrear situaciones graves o cruciales que nos podrían suceder en la práctica clínica habitual, permitiendo la toma de decisiones en estas situaciones, así como la adquisición de habilidades clínicas necesarias para la intubación y reanimación cardiopulmonar.
Supervisión por un tutorLa sedación en endoscopia debería realizarse siguiendo alguno de los protocolos publicados que se han demostrado seguros y efectivos para la sedación administrada por personal no formado en anestesia. Cuando se inicia el programa de sedación en una unidad, se recomienda realizar las exploraciones bajo la supervisión de personal médico cualificado en técnicas de sedación. De igual forma es necesario que el personal de enfermería esté cualificado y formado para la realización de sedación. Un estudio reciente44 evalúa el riesgo de la implementación de un programa de sedación profunda con propofol en una unidad de endoscopias siguiendo un programa de entrenamiento estructurado: las enfermeras seguían un curso teórico y práctico durante 6 semanas que incluía entrenamiento en el manejo de la vía aérea. El programa para los endoscopistas consistió en un curso teórico de 2,5 h y un entrenamiento práctico de corta duración en manejo de la vía aérea. En este estudio se indica que este tipo de formación fue efectivo y suficiente para la administración de propofol sin la necesidad de que los especialistas de anestesia estén presentes de forma continuada en la unidad de endoscopia, recomendando su presencia, solo durante los primeros 3 meses de la implementación del programa.
Indicaciones para la administración de sedación profunda con propofol dirigida por el endoscopistaIndicaciones relacionadas con el riesgo del paciente a la sedaciónAquellos pacientes a los que se tenga que realizar una gastroscopia o una colonoscopia y que presenten un grado de riesgo a la sedación ASA I o ASA II (clasificación de riesgo físico a la sedación o a la anestesia de la ASA) pueden ser sedados con propofol por un médico no anestesiólogo o por una enfermera bajo la supervisión de éste35, siempre y cuando dispongan de la adecuada formación y conocimientos en la sedación con propofol.
La presencia de un anestesiólogo, no es coste-efectiva en los pacientes que han recibido técnicas endoscópicas digestivas básicas, como la gastroscopia o la colonoscopia, y que no presentan factores de riesgo (ASA I y ASA II)45.
En los pacientes con los grados más elevados de la clasificación de la ASA; es decir, pacientes con un grado ASA III, ASA IV o ASA V, se recomienda una revisión detallada de la historia clínica y de la exploración física. Puede ser recomendable que estos pacientes, con mayores probabilidades de sufrir complicaciones durante la sedación, sean tratados directamente por los anestesiólogos20. Sin embargo, existen algunos estudios que indican que médicos no anestesiólogos obtienen resultados muy seguros, incluso en pacientes con niveles de ASA>III. En estos pacientes, se recomienda que la persona encargada de la sedación, bien sea un anestesiólogo, un médico o una enfermera, se dediquen de forma única y exclusiva a la administración y control de la sedación46–49.
En los pacientes con un grado de riesgo ASA I o ASA II a los que vaya a realizarse un procedimiento endoscópico básico (gastroscopia o colonoscopia) y sin otros factores de riesgo asociados a las características de los pacientes, es probable que puedan ser sedados sin la necesidad de que una persona se encargue únicamente de la sedación50,51. Es decir, que una de las personas que colabora con el procedimiento endoscópico, además se encarga de la administración y control de la sedación. Ello puede conseguir una reducción del coste económico total.
Indicaciones relacionadas con la técnica endoscópicaLos procedimientos endoscópicos básicos como la gastroscopia y la colonoscopia pueden realizarse con sedación con propofol, proporcionando un nivel elevado de satisfacción y tolerancia a la técnica por parte del paciente28,52–55. A su vez, permiten mejorar la precisión y calidad del procedimiento endoscópico. Las técnicas endoscópicas más complejas y prolongadas, como la colangiopancreatografía retrógrada endoscópica (CPRE) o la ecoendoscopia, se acostumbran a realizar con sedación más profunda y prolongada. En estos casos, pueden resultar más eficiente administrar el propofol mediante bomba de infusión que hacerlo mediante bolo.
Aunque la gran mayoría de los estudios que evalúan la eficacia y la seguridad del propofol dirigido por el endoscopista sin anestesiólogos, se han realizado en pacientes a los que se ha practicado una gastroscopia y/o colonoscopia; existen varios estudios randomizados, comparativos con sedación tradicional, durante la CPRE o ecoendoscopia, en los que no hallan diferencias en las tasas de hipoxemia, bradicardia o necesidad de intervención sobre la vía aérea46,56–58. Por lo general, la CPRE y la ecoendoscopia tienen una mayor duración y un grado de complejidad superior que las técnicas endoscópicas básicas (gastroscopia y colonoscopia). Es probable que la sedación pueda ser administrada sin anestesiólogos en estos casos. Sin embargo, el soporte bibliográfico del que disponemos es todavía escaso, por lo que la asistencia de un anestesista debe ser considerada cuando se realice una CPRE o una ecoendoscopia.
Indicaciones relacionadas con factores de complejidad dependientes de los pacientesExisten determinados factores que pueden añadir complejidad a la endoscopia con sedación realizada sin anestesiólogo. En estos casos, y en función de los conocimientos, formación, experiencia y dotación en la monitorización, puede estar indicado que la sedación la realice un anestesiólogo45,59,60. Los factores de riesgo pueden clasificarse en aquellos que se relacionan con:
- -
Las características de los propios pacientes.
- -
La posibilidad de requerir una intubación orotraqueal.
- -
La edad pediátrica.
- -
Las edades extremas de los pacientes.
- -
Las enfermedades muy graves cardíacas: respiratorias, renales o hepáticas.
- -
El embarazo y el periodo de lactancia.
- -
La adicción o el abuso de drogas o de alcohol.
- -
Los pacientes que presentan un insuficiente grado de colaboración.
- -
Los pacientes con dificultades potenciales orgánicas o funcionales para la ventilación respiratoria.
- -
Las alteraciones en la configuración del cuello, como las que provoca la obesidad o los pacientes con un cuello corto.
- -
Las limitaciones en la extensión del cuello, como las que produce la espondilitis anquilopoyética o la reducción de la distancia entre el hueso hioides y el mentón inferior a 3cm.
- -
Las masas o los tumores en el cuello.
- -
Las alteraciones en la mandíbula como la micrognatia, la retrognatia o el trismus.
Finalmente, los pacientes con dificultades para la intubación orotraqueal. Dentro de este último apartado deben considerarse las siguientes situaciones:
- -
Los antecedentes de dificultades previas en la sedación o en la anestesia.
- -
Los antecedentes de apnea del sueño avanzada o estridor laríngeo.
- -
Las dismorfias en la anatomía facial.
Las alteraciones anatómicas de la cavidad bucal, como es una abertura bucal inferior a 3cm en una persona adulta, la presencia de unas piezas dentales incisivas muy protruyentes, la macroglosia, la hipertrofia tonsilar, la elevación de la arcada del paladar y la úvula indetectable.
La valoración de la vía aérea previa a la endoscopia pretende identificar aquellos pacientes que puedan tener dificultades en la ventilación con mascarilla o en la intubación orotraqueal. La clasificación de Mallampati, que valora la visualización de las estructuras anatómicas faríngeas, con el paciente en posición de pie o sentada y la boca completamente abierta, es útil y ampliamente utilizada37.
Factores de riesgo asociados a la posibilidad de requerir una intubación orotraquealDebe ser valorada en todo paciente antes de realizar una endoscopia con sedación, especialmente en la gastroscopia, la CPRE y la ecoendoscopia de tracto digestivo superior. Los pacientes que presentan hemorragia digestiva alta activa, con obstrucción o retención alimentaria del tracto digestivo superior, presentan un riesgo elevado de broncoaspiración. Debe de ser individualizada la situación clínica en cada paciente y determinar si la intubación orotraqueal, previa a la endoscopia, es necesaria. En tal caso, es imprescindible la colaboración del anestesiólogo.
También los pacientes obesos severos y los que presentan riesgo de depresión respiratoria grave, como los pacientes afectados de apnea del sueño grave, deben ser considerados de forma particular y determinada la posibilidad de realizar una intubación orotraqueal. Su realización dependerá de la situación clínica general del paciente, de la técnica endoscópica que se realice y de la duración de la misma.
Cuando concurran una o varias de estas situaciones o circunstancias, el riesgo de complicaciones asociadas con la sedación, como la broncoaspiración, la hipoxemia o la depresión cardiocirculatoria, pueden verse incrementadas de forma significativa, por lo que sería recomendable que se considerará la participación de un anestesiólogo.
Factores de riesgo asociados a la edad pediátricaLa base bibliográfica que sustenta la administración de propofol sin anestesiólogos se ha realizado básicamente en adultos. Existe poca información relativa a la sedación con propofol en pacientes en edad pediátrica, administrada por no anestesiólogos a los que se realiza una endoscopia digestiva61. En estos casos, la práctica habitual es que sean los anestesiólogos quienes administren la sedación. Los fármacos que se utilizan en la sedación para adultos son los mismos que en población pediátrica, pero entre otras características diferenciales está que la población pediátrica presenta unas necesidades de fármacos sedantes -entre ellos el propofol- superiores a las que requieren los adultos62. Otra característica diferencial es el acceso venoso, pues los niños requieren una técnica, unos conocimientos y unos materiales diferentes que los adultos. Por lo general, la técnica de sedación en niños muy pequeños consiste en conseguir el acceso venoso después de haber inducido una sedación con mascarilla e inhalación de un gas anestésico volátil.
Sedación en endoscopia digestiva: otras técnicas de sedación en endoscopiaEn la práctica clínica sistemática existe una amplia variedad de técnicas de sedación, que reflejan la diferente experiencia del endoscopista en relación con la sedación, las expectativas por parte del paciente, la diferente regulación del tipo de sedación utilizado según los protocolos del centro de trabajo del endoscopista y una falta de consenso sobre los agentes adecuados para la sedación en endoscopia digestiva. El endoscopista digestólogo debe escoger aquella técnica de sedación con la que se sienta más cómodo y que responda a las necesidades de sus pacientes. En cualquier caso debe adquirir los conocimientos y el entrenamiento adecuado en el uso de los diferentes fármacos sedantes que quiera utilizar y tener capacidad para recuperar al paciente del nivel más profundo de sedación al deseado.
Endoscopia sin sedaciónLa endoscopia puede realizarse, con éxito, sin sedación. No obstante, metanálisis63 de estudios64,65 que comparan la realización de endoscopia con y sin sedación demuestran que ésta proporciona una mayor tolerancia para el paciente y una mejor aceptación a repetir la misma técnica exploratoria (especialmente en las colonoscopias), proporcionando probablemente una mayor adherencia a los programas de cribado de cáncer de colon y de prevención en general.
Anestesia tópicaSe ha utilizado la anestesia tópica (inhaladores de lidocaína, tetracaína y benzocaína) en la realización de gastroscopias sin sedación, pero la utilización de anestésicos tópicos se ha asociado con efectos adversos raros pero importantes, como la aspiración pulmonar, reacciones anafilácticas y metahemoglobinemia. Un estudio reciente indica que añadir anestesia faríngea tópica a la sedación con propofol como monoterapia dirigida por el endoscopista se asocia a una reducción del reflejo nauseoso incluso aunque esto no tenga influencia en la facilidad del procedimiento o en la satisfacción hacia el mismo por parte del paciente y del endoscopista66.
Sedación con benzodiacepina solaEl midazolam y el diazepam son las benzodiacepinas más utilizadas en la sedación convencional para conseguir una sedación moderada. La ventaja de la utilización de las benzodiacepinas es la presencia de un antagonista específico (flumacenilo) que permite revertir rápidamente los efectos farmacológicos sedantes, en el caso de depresión respiratoria. La eficacia en la sedación es comparable entre el midazolam y el diazepam26,65,67. Un metanálisis63 de estudios que los comparan no muestra diferencias significativas en la valoración del endoscopista respecto a la colaboración del paciente ni en la del paciente en relación con el dolor por el procedimiento. Sin embargo, una elevada proporción de pacientes sedados con midazolam tenían una mayor satisfacción y una mayor amnesia a la prueba. Además, el tiempo de observación requerido para la recuperación tras el procedimiento era más corto cuando se utiliza midazolam que con diazepam.
Sedación con benzodiacepina más opiáceoLos opiáceos más utilizados son la meperidina y el fentanilo que tienen efectos analgésicos y sedantes. El antagonista específico de los opiáceos es la naloxona, que permite revertir rápidamente los efectos farmacológicos adversos, como la depresión respiratoria. El fentanilo actúa de forma más rápida, se elimina antes y produce menos náuseas que la meperidina. La combinación de benzodiacepinas y opiáceos produce un efecto sinérgico en la sedación. Un metanálisis63 de estudios que comparan midazolam y opiáceo frente a diazepam y opiáceo no detecta diferencias significativas en la incidencia de hipoxemia, en la necesidad de suplemento de oxígeno, en la satisfacción del endoscopista con el procedimiento ni en la proporción de pacientes con dolor o malestar. Existen pocos estudios que comparen la utilización de benzodiacepinas y opiáceo frente a midazolam solo, pero parece que no hay diferencias en relación con la tolerancia del paciente a la endoscopia ni en la adhesión a repetir la prueba67. En este mismo metanálisis63 tampoco se detectan diferencias significativas en el tiempo del procedimiento endoscópico ni en el de recuperación al comparar la sedación con midazolam frente a midazolam más opiáceos.
Sedación con propofolEl propofol tiene ventajas en relación con la sedación convencional, sobre todo en los procedimientos endoscópicos complejos de mayor duración (CPRE y USE), ya que con mayor facilidad se alcanzan niveles de sedación más profundos. Pero, a diferencia de las benzodiacepinas y opiáceos, no tiene un antagonista específico. Los estudios que han analizado comparativamente el propofol y la sedación convencional en cuanto a seguridad y eficacia indican que el propofol es comparable o superior a la sedación con benzodiacepinas y opiáceos57,64. Estos estudios no muestran diferencias significativas en el tiempo del procedimiento endoscópico, pero sí en relación con el tiempo de recuperación, siendo menor en los pacientes sedados con propofol. En relación con la seguridad, un metanálisis de 12 estudios aleatorios68 pone de manifiesto que el riesgo de complicaciones, como la hipoxemia e hipotensión, son similares para todos los procedimientos endoscópicos excepto en la colonoscopia, donde el riesgo es menor con el propofol. Por todo ello, en los últimos años, muchos investigadores aconsejan la utilización sistemática de sedación con propofol durante la endoscopia estándar ya que, con una eficacia y seguridad similar o superior a la sedación convencional, permite acortar el tiempo de recuperación y mejorar la eficiencia de las unidades de endoscopia. Sin embargo, puesto que tiene una mayor facilidad para inducir niveles más profundos de sedación y no se dispone de un antagonista específico, los endoscopistas y el personal de las unidades de endoscopia que decidan utilizar propofol deben adquirir la formación y experiencia necesarias antes de implementar un programa de sedación con este fármaco.
Sedación con propofol más agentes sedantes-hipnóticos (benzodiacepinas, opiáceos)El propofol se puede utilizar solo o en combinación con otros agentes sedantes-hipnóticos. Cuando se utiliza sin otros fármacos, se precisa una mayor dosis para conseguir un adecuado efecto sedante, lo cual puede comportar que se alcance un nivel más profundo de sedación del deseado y, por consiguiente, un mayor riesgo de que ocurran efectos adversos relacionados con la dosis, como la hipotensión, la depresión respiratoria o la bradicardia69. Estos efectos adversos podrían minimizarse con la combinación del propofol con otros agentes que induzcan analgesia y amnesia. El objetivo sería administrar una menor dosis de propofol, y conseguir niveles de sedación moderada, así como la amnesia y la analgesia más propias de los opiáceos y las benzodiacepinas. Esta forma de sedación se ha denominado sedación con propofol balanceada (balanced propofol sedation, BPS)28,35, que combina la administración sucesiva de pequeñas dosis de propofol con una única de inducción con benzodiacepinas y opiáceos bajo la dirección de un médico sin la especialidad de anestesiología. El objetivo de este método es alcanzar grados de sedación moderada para minimizar los riesgos de la sedación profunda con propofol. Varios estudios prospectivos27,70–72 han mostrado la seguridad y efectividad de esta metodología para la endoscopia diagnóstica bajo la supervisión del propio endoscopista y se ha propuesto, en algunos países, como una solución al problema legal suscitado con el uso del propofol por personal sin la especialidad de anestesiología.
Análisis coste-efectividad de la sedación en endoscopia digestivaPor definición, el análisis coste-efectividad debe permitir comparar entre sí políticas, programas o proyectos. En un estudio de estas características deberían confrontarse diversas alternativas con el principal objetivo de elegir la más adecuada para obtener un resultado concreto al coste menos elevado posible. Sin embargo, en el ámbito de la endoscopia digestiva, realizar un análisis de este tipo relacionado con la implementación de la sedoanalgesia es difícil porque el coste es dependiente de muchos factores que son variables entre las diversas unidades de endoscopia digestiva. El número de salas de exploración, el tipo de pruebas realizadas y el tipo de pacientes que acuden a cada unidad concreta condicionan enormemente la eficacia del modelo implantado y, en consecuencia, el coste que supone. De manera que hay modelos que pueden resultar enormemente eficaces en determinadas unidades y ser un fracaso en otras.
Si partimos de unidades en las que no se administran fármacos sedantes intravenosos para la realización de técnicas endoscópicas digestivas, la implementación de novo de sedación/sedoanalgesia va a suponer con toda seguridad un incremento de costes. Sea cual sea el modelo asistencial utilizado, se incrementarán los costes de farmacia, de material fungible (catéteres intravenosos, sistemas de infusión, etc.) y no fungible (sistemas de monitorización) y, siguiendo las recomendaciones de cualquier guía asistencial, de personal adicional. Sin embargo, la mejora en la eficiencia del sistema que se asocia a la utilización de sedación, en lo que se refiere a la compleción de las pruebas, necesidad de reprogramaciones, etc., compensará al menos parcialmente el gasto derivado directamente de ésta. Además la mejor tolerancia y satisfacción de los pacientes a los procedimientos endoscópicos es un parámetro de calidad percibida cuyo coste no puede determinarse en el sentido del beneficio material que produce, aunque si, cuando la sociedad evalúa externamente la unidad que proporciona este servició respecto a la que no lo hace.
En el momento actual ya nadie pone en duda la necesidad de sedar a los pacientes que van a recibir una endoscopia digestiva. El debate surge a la hora de determinar el modelo asistencial más seguro para los pacientes y que además tenga la relación coste-eficacia más adecuada. El objetivo de este análisis es exponer todos los factores con impacto económico que tienen relevancia a la hora de hacer un análisis coste-eficacia.
Selección de los fármacosEn la actualidad existe suficiente bibliografía que demuestra que el propofol, solo o en combinación con un opiáceo, es el fármaco de elección para este tipo de procedimientos. La sinergia farmacológica permite reducir dosis a la vez que conseguimos el mismo efecto. De entre los opiáceos más modernos, serían de elección los de vida media más corta, como el fentanilo, alfentanilo y remifentanilo, que tienen precios similares. El perfil farmacocinético y farmacodinámico más favorable por su rápida eliminación sería el remifentanilo con el inconveniente de requerir su administración en perfusión continua y tener un margen terapéutico estrecho que obliga, en general, a su administración tutelada por un anestesiólogo. También resulta adecuada la utilización de fentanilo puesto que por sus características farmacológicas es un fármaco más asequible cuando no se dispone de anestesistas en la unidad. Los sistemas más avanzados de perfusión continua (target controlled infusión) resultan más seguros y se asocian a un menor tiempo de recuperación ya que permiten trabajar con dosis más ajustada (mínima dosis eficaz)73.
La utilización del propofol en endoscopia ha planteado la controversia sobre quién debe administrarlo. Se han publicado estudios sobre sedación en endoscopia con propofol administrado por anestesiólogos, endoscopista más una enfermera especialmente entrenada, o bien simplemente por el endoscopista y la enfermera ayudante. Hay suficiente evidencia en la bibliografía que demuestra que la sedación con propofol por profesionales sanitarios con formación adecuada es segura, efectiva y superior a la combinación de opiáceos y benzodiacepinas en términos de satisfacción del paciente, parámetros de recuperación y coste74–77. No obstante, con el advenimiento de la aplicación cada vez más frecuente de sedación profunda con propofol, las distintas sociedades médicas recomiendan que el personal sanitario responsable de su administración y control tenga experiencia y formación adecuada en sedoanalgesia.
Modos de administraciónMuchos de los fármacos utilizados en este ámbito pueden ser administrados en bolo o en perfusión continua. El bolo no requiere que se dispongan de sistemas de perfusión ni de la colocación de alargaderas. Sin embargo, la administración en bolo puede ser menos segura y el paciente suele requerir una dosis total más elevada. Por otra parte, la administración en bolo puede obligar a repetir la dosis con el consiguiente aumento de manipulación del catéter venoso, lo cual puede tener una importancia considerable en el caso del propofol por el riesgo de infecciones si la manipulación no es la correcta, aunque también se han referido contaminaciones cuando se ha utilizado en perfusión en bomba de infusión78,79.
También habrá que imputar a este apartado el gasto en jeringuillas, agujas de carga y alargaderas, dependiendo de la técnica de sedación escogida. La única diferencia de material fungible entre el bolo y la perfusión son las alargaderas venosas en el caso de la perfusión. Por el contrario, en el caso de los bolos pueden ser necesarias más jeringuillas y agujas de carga. Otra variable que se debe tener en cuenta es la duración de la exploración endoscópica, ya que durante una gastroscopia diagnóstica uno o dos bolos de propofol serán generalmente suficientes, mientras que en técnicas endoscópicas de mayor duración el uso de bomba de perfusión es más adecuado, ya que evita repetir la infusión de bolos de forma continuada.
Aunque todavía no es de utilización clínica se han descrito otros sistemas de perfusión del propofol que podrían tener un lugar en el futuro con implicaciones en el coste del procedimiento. Recientemente se ha descrito la utilización de un ordenador que tras incluir los parámetros de situación clínica del paciente (ASA, variables clínicas de riesgo, etc.) monitoriza los parámetros hemodinámicos y respiratorios, a la vez que envía y evalúa la respuesta a estímulos vibratorios y auditivos para categorizar el nivel de sedación del paciente. En respuesta a estos parámetros, el sistema calcula y perfunde una dosis de propofol con el objetivo de mantener al paciente en niveles de sedación moderada o profunda. Un estudio publicado recientemente demuestra la efectividad y ventajas de este sistema en endoscopia diagnóstica en pacientes de bajo riesgo (ASA I-III) comparado con la sedación convencional con benzodiacepinas y opiáceos80. Un sistema de estas características si obtuviera la autorización legal pertinente, se comprobara su seguridad y tuviera un precio razonable, podría abaratar el coste puesto que, en teoría, se reduciría en parte el personal necesario para el control y administración de los sedantes.
MonitorizaciónCuando se procede a una sedación moderada-profunda, sea cual sea el fármaco utilizado o el personal que lo administra, todas las guías15–20 consideran obligada la monitorización básica con PA no invasiva y oximetría de pulso, y en pacientes con cardiopatía grave registro electrocardiográfico continuo. Este será un gasto común a todos los modelos e incluirá el precio de los monitores y el material fungible que se reduce a 3 parches para electrodos por paciente. La utilización de oxígeno suplementario, recomendable en todos los pacientes sometidos a sedación moderada-profunda, puede realizarse a través de cánulas nasales o del mismo bucal en el caso de endoscopia digestiva alta.
Valoración del paciente ante una sedación profundaCualquier paciente que va a recibir una sedación debe ser valorado por personal cualificado para ello para detectar los factores que puedan condicionar un mayor riesgo asociado a la sedación. Entre los diversos sistemas existentes, los cuestionarios de salud rellenados por el propio paciente o la valoración preanestésica telefónica pueden resultar eficaces a la vez que tienen un bajo coste. Según las recomendaciones de las sociedades de anestesia la visita preanestésica presencial con exploraciones complementarias solo sería recomendable en casos muy concretos habiendo sido demostrado con un bajo nivel de evidencia. Actualmente se puede considerar que una buena historia clínica, incluso vía telefónica, sustituye la visita preanestésica convencional, que no se ha demostrado hasta la fecha indispensable en este contexto81–83. La visita preanestésica sistemática, además, incrementaría innecesariamente los costes.
Gastos de personalEn este apartado, el análisis coste-beneficio de la sedación implica considerar los 2 modelos más comunes en nuestro medio:
Administración de la sedación guiada por el endoscopistaEn este caso, hay que tener en cuenta el coste de la formación del personal médico y de enfermería que va a dedicarse a la sedación. Actualmente existen cursos formativos con acreditación interna. También hay que añadir el coste del incremento de personal de enfermería ya que en algunos modelos consideran que la persona que está a cargo de la sedación no puede tener otra tarea. En caso de trabajar con enfermera o auxiliar compartida para asistir al endoscopista, habrá igualmente que incorporar el coste de este incremento de personal.
Por otra parte, hay que considerar en este modelo que, en situaciones muy concretas y/o ante determinadas circunstancias o en casos puntuales de especial riesgo relacionado con la sedación, resulta necesaria la presencia del anestesiólogo, cuyo coste adicional también debe ser tenido en cuenta.
Algunas guías actuales18–21 consideran recomendable la presencia del anestesiólogo en caso de endoscopia avanzada (variable según la unidad), pacientes ASA IV-V y en caso de presentar vía aérea difícil (alrededor de un 5-10% de la población general). No obstante, en los últimos años se han referido estudios sobre administración de propofol dirigida por el endoscopista en pacientes ASA III y IV84, en pacientes a los que se les realizan exploraciones de endoscopia terapéutica avanzada35,56,85, pacientes con apnea del sueño86 y obesidad o vía aérea difícil con buenos resultados de seguridad y eficacia87. Sin embargo, no existe ningún estudio comparativo entre sedación profunda con propofol dirigida por el propio endoscopista o bien guiada por el anestesiólogo en pacientes de alto riesgo, por lo que no se puede concluir que opción es la que tiene mayor eficacia en estas situaciones y, por ello, no es posible hacer un análisis de coste-efectividad de la sedación profunda con propofol en pacientes de alto riesgo.
Desde el punto de vista de personal, este modelo debe añadir el coste de una enfermera en cada sala de endoscopia, dependiendo directamente del endoscopista. En las exploraciones en las que el endoscopista lleve el endoscopio directamente y/o en pacientes ASA I-II sin factores de riesgo y ayudándose de una bomba de perfusión, la propia enfermera, junto a la auxiliar, podrían controlar la sedación y ayudar al endoscopista, como se ha publicado en estudios previos50. De esta forma, la enfermera se encargaría de la valoración presedación, control de los pacientes durante el procedimiento y administración de los sedantes en la gran mayoría de procedimientos. La presencia de un anestesiólogo quedaría limitada a los procedimientos de riesgo alto y a las técnicas terapéuticas de alta complejidad o en los que la intubación endotraqueal sea conveniente (pacientes con hemorragia digestiva activa, oclusión intestinal, riesgo de broncoaspiración).
Administración de la sedación guiada por el anestesiólogoEn este modelo asistencial, por una parte obviamos la necesidad de formación del personal y, por otra, la necesidad de prever el tipo de exploración y paciente puesto que se asumirá cualquier tipo de exploración y/o paciente, sin necesidad de reprogramación. Un anestesiólogo de presencia continuada en la unidad sería el responsable de la sedación no solo en los pacientes de alto riesgo, sino también en todos los procedimientos estándar.
En este modelo, y si se realiza la asistencia únicamente en una sala, trabajará el anestesiólogo «en solitario» y ello implica el coste del sueldo de un médico anestesiólogo por sala donde queramos implantar la técnica de sedación. Además, puede haber algún coste adicional dependiendo de la magnitud de la unidad relacionado con la necesidad de valoración de los pacientes, altas, informes, consultas, etc.
Si se trabaja en un área con mayor número de salas de trabajo, se requiere un equipo formado por el anestesista y el personal de enfermería dependiente del anestesiólogo. Por tanto, el modelo implica, junto al coste del anestesiólogo, el coste de enfermeras de anestesia que administrarán la sedación bajo la supervisión de un anestesiólogo. Las propias enfermeras de anestesia pueden realizar la valoración pre-anestésica. El ratio anestesiólogo-enfermera que establezca el propio equipo puede ser variable en función del tipo de procedimiento y de paciente. El coste, depende lógicamente de las salas de los que disponga la unidad, pero podemos decir que en grandes unidades en las que se realiza con frecuencia endoscopia avanzada, este modelo tiene un coste-eficacia menos elevado que en unidades más reducidas o con menor número de salas. El número de enfermeras necesarias para administrar la sedación puede ser similar al del modelo anterior y no requiere el coste añadido del anestesiólogo para los pacientes de riesgo. Este modelo se basa en el sistema “Nurse Assisted Propofol Sedation (NAPS)” utilizado por los americanos pero con un anestesiológico que supervisa las enfermeras que administran la anestesia.
En la actualidad no se han efectuado estudios comparativos diseñados específicamente para determinar cuál de los 2 modelos es más coste-efectivo. Ello depende de muchos factores como el tipo de unidades, el número de cubículos de trabajo, las características de los enfermos que han recibido endoscopia y el tipo de exploraciones efectuadas. El modelo de sedación dirigida por el anestesiólogo implica el coste de uno o varios anestesiólogos, dependiendo del número de salas que se adjudique a cada anestesiólogo, más enfermeras de anestesia para administrar la medicación y controlar al paciente.
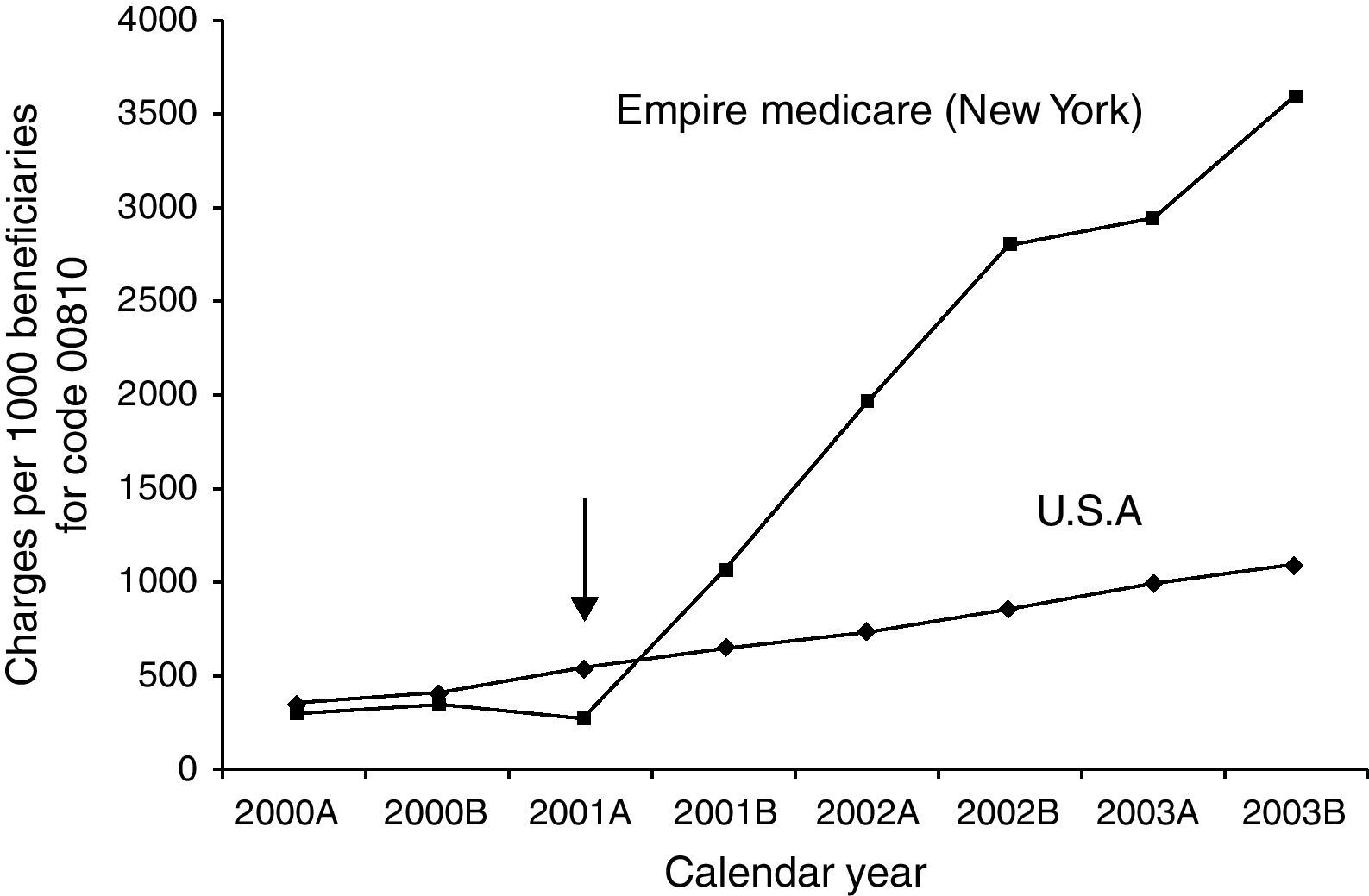
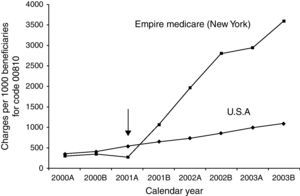
De forma indirecta, algunos estudios evalúan el coste de incorporar anestesiólogos a las unidades de endoscopia. En Estados Unidos se considera que se produce un incremento económico considerable en función de estudios de compañías aseguradoras de salud que analizan el coste de las exploraciones endoscópicas desde la incorporación de anestesiólogos en el estado de Nueva York, a partir del año 2001, respecto a los estados en donde la sedación se realizaba de forma convencional (benzodiacepinas y opiáceos dirigida por el endoscopista) (fig. 3). Con este incremento económico la colonoscopia de cribado dejaba de ser competitiva respecto a la colonografía por tomografía computorizada88,89. En el estudio de Rex et al.24 se hace una estimación del coste de mantener a los especialistas de anestesia, suponiendo que su presencia hubiera podido evitar el fallecimiento de los 4 pacientes reportados entre los 646.080 procedimientos sedados sin anestesiólogo. Estos autores calculan que el coste estimado de mantener anestesiólogos realizando la sedación con propofol sería de 5,3 millones de dólares por cada año de vida salvado, un coste que, en este estudio, se consideró inasumible.
En conclusión, si bien no hay estudios prospectivos comparando efectividad y coste en la sedación con propofol en endoscopia con y sin anestesiólogo, los datos disponibles sugieren que el coste puede ser superior cuando los anestesiólogos se responsabilizan de la sedación de una forma exclusiva (un anestesista por cada box de trabajo) o incluso en caso de supervisar a una enfermera de forma específica, mientras que estos costes se reducen cuando hay una enfermera que administra la sedación y la responsabilidad la asume el propio endoscopista. Estas diferencias en el coste económico de ambos modelos podrían ser especialmente relevantes en áreas de endoscopia con menor número de unidades de trabajo y un porcentaje de exploraciones y/o pacientes con menor grado de complejidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.