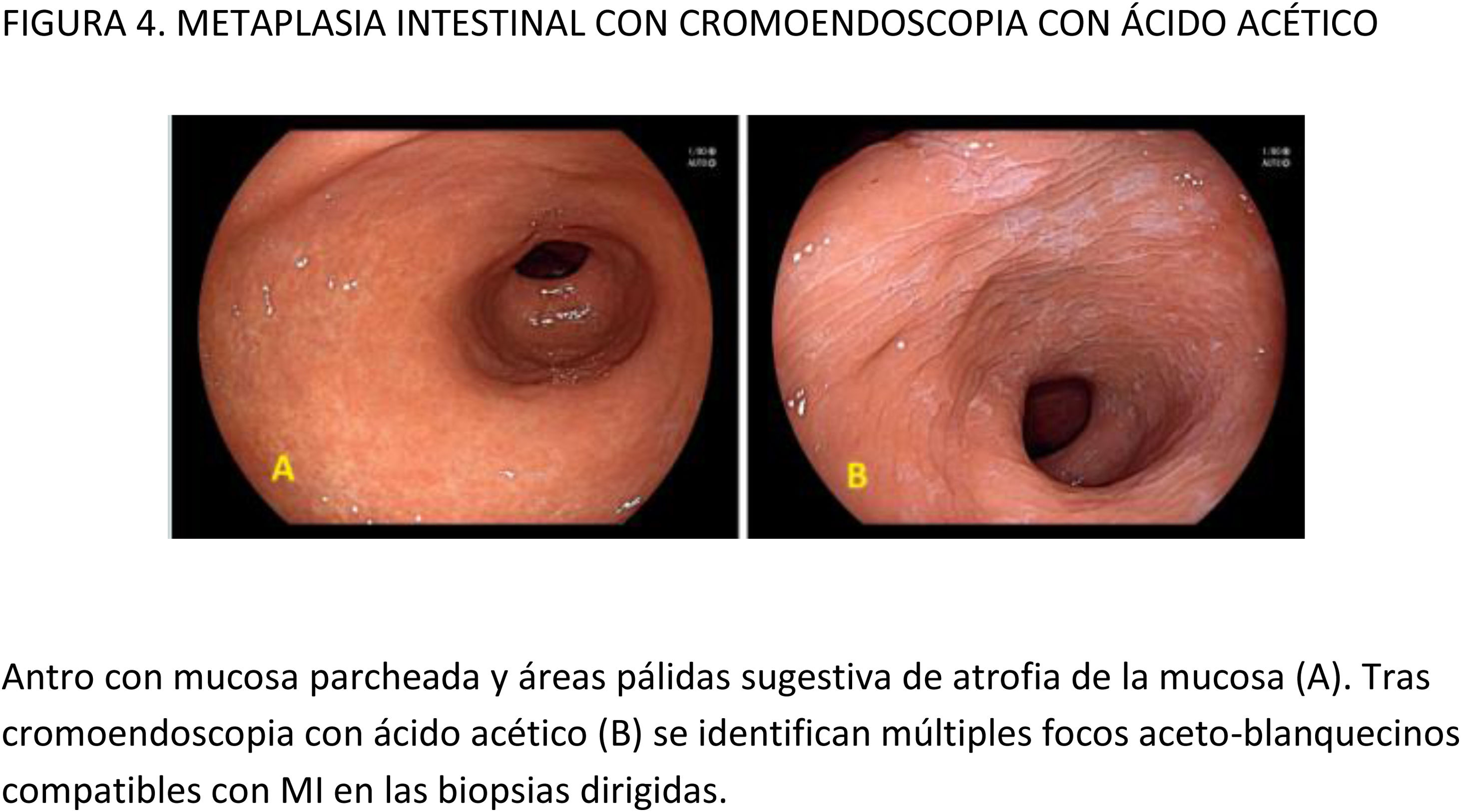
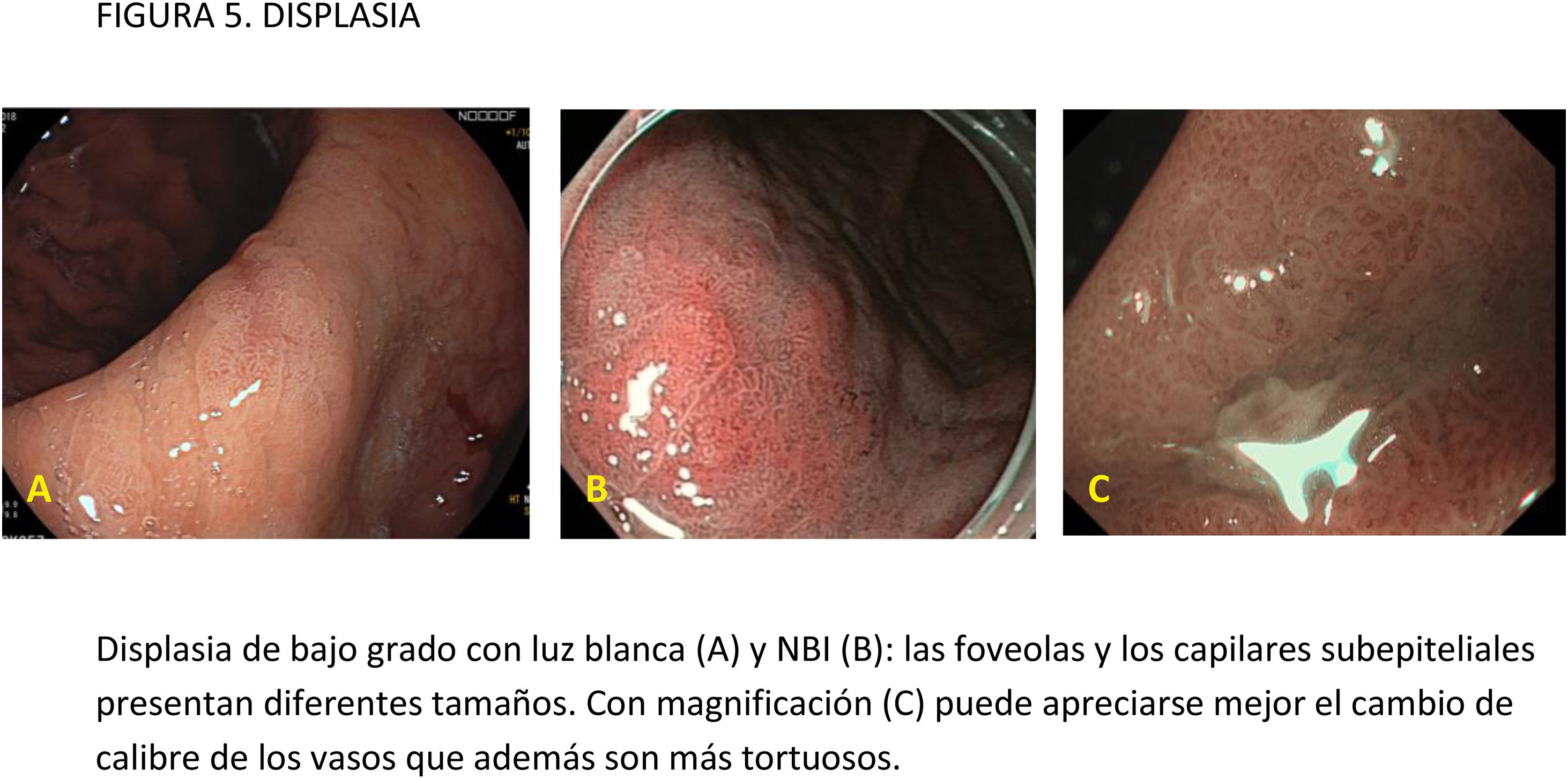
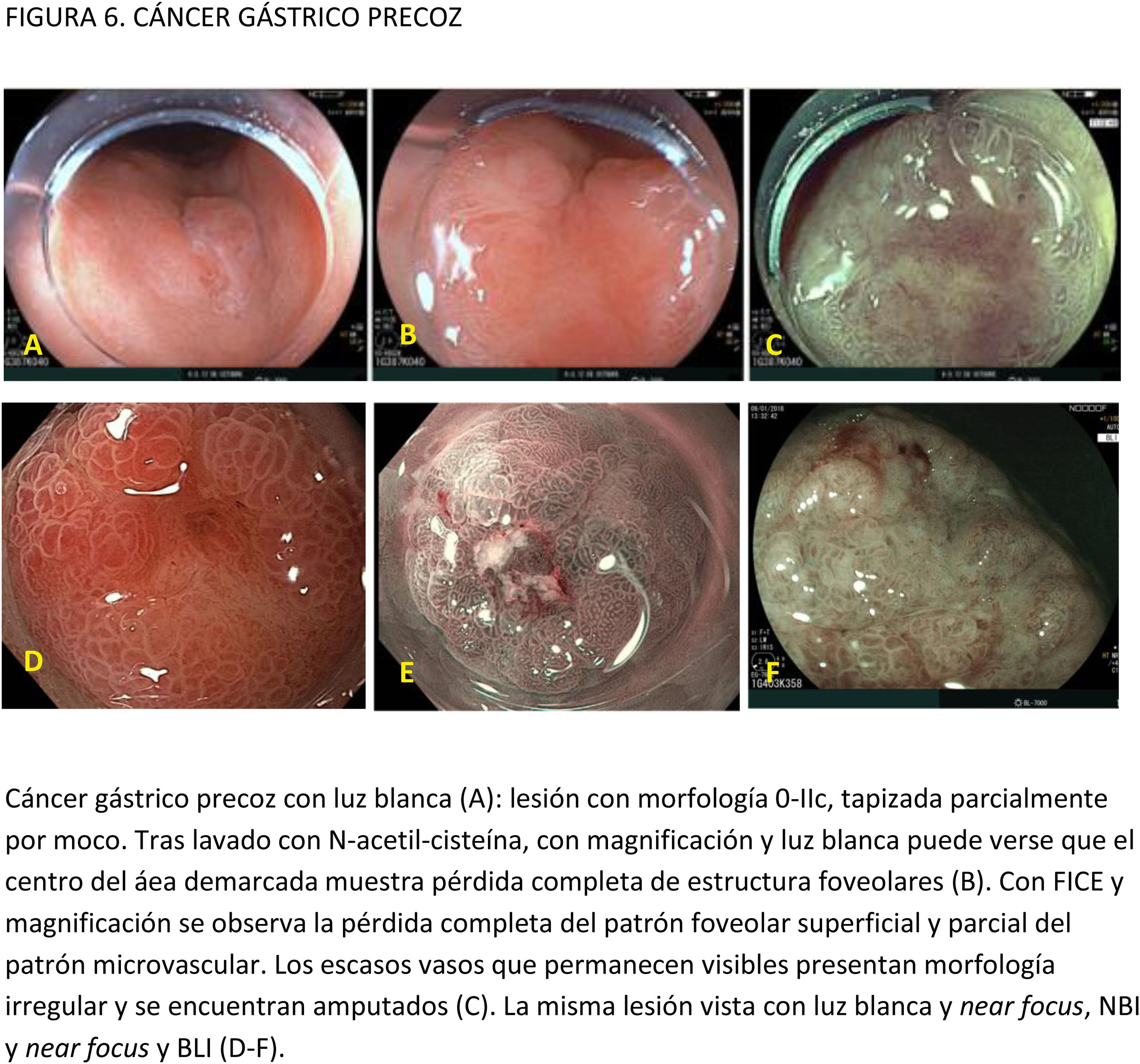
Este documento de posicionamiento, auspiciado por la Asociación Española de Gastroenterología, la Sociedad Española de Endoscopia Digestiva y la Sociedad Española de Anatomía Patológica, tiene como objetivo establecer recomendaciones para realizar una endoscopia digestiva (EDA) de calidad en la detección y vigilancia de lesiones precursoras de cáncer gástrico (LPCG) en poblaciones con incidencia baja, como la española. Para establecer la calidad de la evidencia y los niveles de recomendación se ha utilizado la metodología basada en el sistema GRADE (Grading of Recommendations Assessment, Development and Evaluation). Se obtuvo el consenso entre expertos mediante un método Delphi. El documento evalúa diferentes medidas para mejorar la calidad de la EDA en este contexto y hace recomendaciones de cómo evaluar y tratar las lesiones identificadas. Se recomienda que la EDA de vigilancia de LPCG sea realizada por endoscopistas con capacitación adecuada, administrando premedicación oral y uso de sedación. Para mejorar la identificación de LPCG se recomienda el uso de endoscopios de alta definición y cromoendoscopia convencional o digital, y para las biopsias debe utilizarse el NBI para dirigirlas a las áreas más sospechosas de metaplasia intestinal. En cuanto a la evaluación de las lesiones visibles, el riesgo de invasión de la submucosa debe evaluarse con endoscopios de magnificación y reservar la ecoendoscopia para aquellas con sospecha de invasión profunda. En las lesiones susceptibles de resección endoscópica, la disección endoscópica submucosa se considera la técnica de elección.
This position paper, sponsored by the Asociación Española de Gastroenterología [Spanish Association of Gastroenterology], the Sociedad Española de Endoscopia Digestiva [Spanish Gastrointestinal Endoscopy Society] and the Sociedad Española de Anatomía Patológica [Spanish Anatomical Pathology Society], aims to establish recommendations for performing an high quality upper gastrointestinal endoscopy for the screening of gastric cancer precursor lesions (GCPL) in low-incidence populations, such as the Spanish population. To establish the quality of the evidence and the levels of recommendation, we used the methodology based on the GRADE system (Grading of Recommendations Assessment, Development and Evaluation). We obtained a consensus among experts using a Delphi method. The document evaluates different measures to improve the quality of upper gastrointestinal endoscopy in this setting and makes recommendations on how to evaluate and treat the identified lesions. We recommend that upper gastrointestinal endoscopy for surveillance of GCPL should be performed by endoscopists with adequate training, administering oral premedication and use of sedation. To improve the identification of GCPL, we recommend the use of high definition endoscopes and conventional or digital chromoendoscopy and, for biopsies, NBI should be used to target the most suspicious areas of intestinal metaplasia. Regarding the evaluation of visible lesions, the risk of submucosal invasion should be evaluated with magnifying endoscopes and endoscopic ultrasound should be reserved for those with suspected deep invasion. In lesions amenable to endoscopic resection, submucosal endoscopic dissection is considered the technique of choice.
El cáncer gástrico (CG) es la segunda neoplasia gastrointestinal más frecuente. En nuestro país, como en la mayoría de países europeos, la incidencia de CG se sitúa en un nivel considerado como bajo. En el año 2018 se estimaron 7.765 nuevos casos de CG, con una tasa de incidencia ajustada por edad a la población mundial de 9,2 casos/100.000 habitantes en hombres y 4,3/100.000 habitantes en mujeres1.
La endoscopia digestiva alta (EDA) es el patrón oro para el diagnóstico del CG y las lesiones precursoras. A pesar del creciente interés en el tema de la calidad en EDA demostrado por la aparición de diferentes guías y documentos de posicionamiento2-5, actualmente la calidad de la EDA es baja de acuerdo a los indicadores de los que disponemos. Así, datos recientes muestran que en los países occidentales hasta el 14% de CG no fueron diagnosticados en una EDA en los 3años previos, siendo este porcentaje del 9% en nuestro medio6,7. Estos datos muestran la necesidad de mejorar la calidad de las exploraciones.
Los objetivos del presente documento de posicionamiento son:
- 1.
Describir los requerimientos mínimos de una EDA de alta calidad incluyendo los requerimientos para la detección y la vigilancia de las lesiones precursoras del CG (LPCG) y la detección de CG precoz (CGP).
- 2.
Describir cómo actuar ante una lesión visible.
Quedan fuera del ámbito de este documento la evaluación endoscópica del esófago de Barrett y las recomendaciones sobre vigilancia endoscópica de las LPCG (recogidas en otro documento de consenso)8. También quedan fuera los requisitos que debe tener el informe de anatomía patológica de evaluación de estas lesiones. Este documento de posicionamiento surge como una colaboración de la Asociación Española de Gastroenterología (AEG), la Sociedad Española de Endoscopia Digestiva (SEED) y la Sociedad Española de Anatomía Patológica (SEAP) con el fin de aunar criterios y recomendaciones tanto para gastroenterólogos clínicos como para endoscopistas y patólogos.
MétodosSe constituyó un grupo de trabajo formado por expertos de estas sociedades y metodólogos para la búsqueda y revisión de la evidencia. El grupo de trabajo propuso las preguntas relevantes desde el punto de vista clínico a las que responde el documento. Se ha determinado como objetivo principal describir las características de la EDA para una óptima detección de LPCG.
La búsqueda de artículos se realizó en función de las diferentes preguntas siguiendo la siguiente estrategia: se priorizó la identificación de revisiones sistemáticas y otros documentos de síntesis crítica de la literatura científica, y en una segunda fase se buscaron estudios individuales, ensayos clínicos aleatorizados (ECA) y estudios observacionales. En cuanto a las bases de datos electrónicas consultadas, nos centramos en MEDLINE (accedido mediante PubMed).
Para establecer los niveles de evidencia y grados de recomendación de las diferentes preguntas evaluadas en este documento se ha utilizado la metodología basada en el sistema GRADE (Grading of Recommendations Assessment, Development and Evaluation Working Group)9. En este sentido, para establecer el nivel de las recomendaciones hemos considerado, además de la calidad de la evidencia, el balance entre beneficios y riesgos, los costes y los valores y preferencias de las personas.
Una vez realizadas las recomendaciones, se ha evaluado el acuerdo entre los miembros del grupo de trabajo. El consenso se obtuvo utilizando el método Delphi. Las recomendaciones fueron evaluadas por los miembros del panel mediante una escala Likert (1: completamente en desacuerdo; 2: en desacuerdo; 3: dudoso o con reparos; 4: de acuerdo; 5: completamente de acuerdo). En caso de desacuerdo se reformularon y votaron nuevamente las recomendaciones. Se presentan y fundamentan las que han obtenido un acuerdo promedio final ≥4. La primera ronda del consenso Delphi se llevó a cabo en noviembre de 2019 utilizando las herramientas electrónicas de captura de datos REDCap alojadas en la AEG (www.aegastro.es)10. Tras reformular las recomendaciones con acuerdo <4 se realizó una segunda ronda en una videoconferencia el día 14 de octubre de 2020. Las recomendaciones finales, junto con la evaluación de la evidencia, la fuerza de la recomendación y el grado de acuerdo, se muestran en la tabla 1. Se incluye asimismo un anexo con imágenes representativas de las LPCG y CGP. El documento ha sido aprobado por las juntas directivas de las tres sociedades científicas implicadas en el documento de posicionamiento.
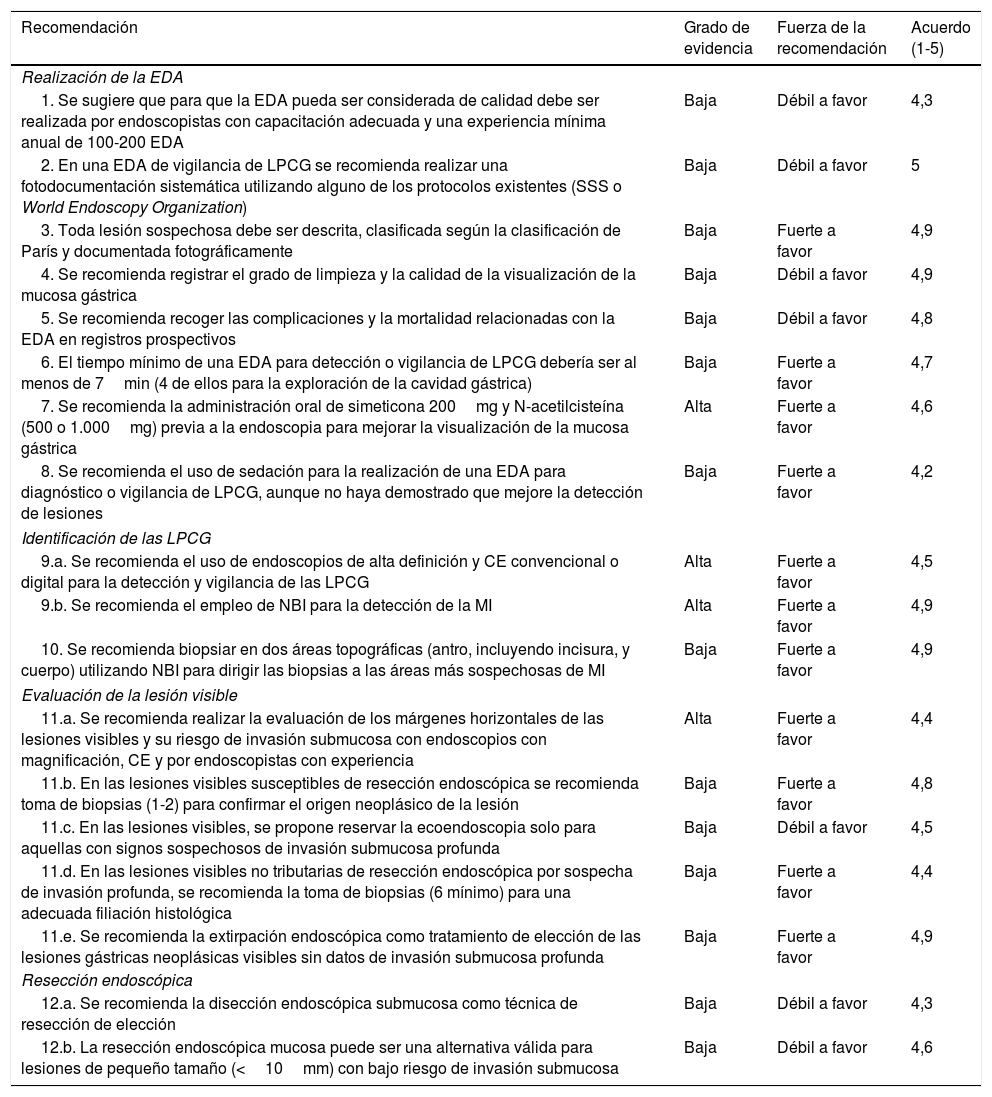
Resumen de las recomendaciones
| Recomendación | Grado de evidencia | Fuerza de la recomendación | Acuerdo (1-5) |
|---|---|---|---|
| Realización de la EDA | |||
| 1. Se sugiere que para que la EDA pueda ser considerada de calidad debe ser realizada por endoscopistas con capacitación adecuada y una experiencia mínima anual de 100-200 EDA | Baja | Débil a favor | 4,3 |
| 2. En una EDA de vigilancia de LPCG se recomienda realizar una fotodocumentación sistemática utilizando alguno de los protocolos existentes (SSS o World Endoscopy Organization) | Baja | Débil a favor | 5 |
| 3. Toda lesión sospechosa debe ser descrita, clasificada según la clasificación de París y documentada fotográficamente | Baja | Fuerte a favor | 4,9 |
| 4. Se recomienda registrar el grado de limpieza y la calidad de la visualización de la mucosa gástrica | Baja | Débil a favor | 4,9 |
| 5. Se recomienda recoger las complicaciones y la mortalidad relacionadas con la EDA en registros prospectivos | Baja | Débil a favor | 4,8 |
| 6. El tiempo mínimo de una EDA para detección o vigilancia de LPCG debería ser al menos de 7min (4 de ellos para la exploración de la cavidad gástrica) | Baja | Fuerte a favor | 4,7 |
| 7. Se recomienda la administración oral de simeticona 200mg y N-acetilcisteína (500 o 1.000mg) previa a la endoscopia para mejorar la visualización de la mucosa gástrica | Alta | Fuerte a favor | 4,6 |
| 8. Se recomienda el uso de sedación para la realización de una EDA para diagnóstico o vigilancia de LPCG, aunque no haya demostrado que mejore la detección de lesiones | Baja | Fuerte a favor | 4,2 |
| Identificación de las LPCG | |||
| 9.a. Se recomienda el uso de endoscopios de alta definición y CE convencional o digital para la detección y vigilancia de las LPCG | Alta | Fuerte a favor | 4,5 |
| 9.b. Se recomienda el empleo de NBI para la detección de la MI | Alta | Fuerte a favor | 4,9 |
| 10. Se recomienda biopsiar en dos áreas topográficas (antro, incluyendo incisura, y cuerpo) utilizando NBI para dirigir las biopsias a las áreas más sospechosas de MI | Baja | Fuerte a favor | 4,9 |
| Evaluación de la lesión visible | |||
| 11.a. Se recomienda realizar la evaluación de los márgenes horizontales de las lesiones visibles y su riesgo de invasión submucosa con endoscopios con magnificación, CE y por endoscopistas con experiencia | Alta | Fuerte a favor | 4,4 |
| 11.b. En las lesiones visibles susceptibles de resección endoscópica se recomienda toma de biopsias (1-2) para confirmar el origen neoplásico de la lesión | Baja | Fuerte a favor | 4,8 |
| 11.c. En las lesiones visibles, se propone reservar la ecoendoscopia solo para aquellas con signos sospechosos de invasión submucosa profunda | Baja | Débil a favor | 4,5 |
| 11.d. En las lesiones visibles no tributarias de resección endoscópica por sospecha de invasión profunda, se recomienda la toma de biopsias (6 mínimo) para una adecuada filiación histológica | Baja | Fuerte a favor | 4,4 |
| 11.e. Se recomienda la extirpación endoscópica como tratamiento de elección de las lesiones gástricas neoplásicas visibles sin datos de invasión submucosa profunda | Baja | Fuerte a favor | 4,9 |
| Resección endoscópica | |||
| 12.a. Se recomienda la disección endoscópica submucosa como técnica de resección de elección | Baja | Débil a favor | 4,3 |
| 12.b. La resección endoscópica mucosa puede ser una alternativa válida para lesiones de pequeño tamaño (<10mm) con bajo riesgo de invasión submucosa | Baja | Débil a favor | 4,6 |
El grupo de expertos seleccionó y dio respuesta a las siguientes preguntas:
Experiencia del endoscopista- 1.
¿Cuál debe ser la experiencia de un endoscopista para realizar una EDA de calidad?
Se sugiere que para que la EDA pueda ser considerada de calidad debe ser realizada por endoscopistas con capacitación adecuada y una experiencia mínima anual de 100-200 EDA.
Calidad de la evidencia: baja. Grado de recomendación: débil a favor.
Acuerdo: 4,3.
EvidenciaUna gastroscopia de calidad debe empezar por la adecuada formación del endoscopista. Esto incluye el conocimiento de las indicaciones, una buena técnica y sistemática de exploración y la elaboración de un informe completo que refleje los hallazgos o la ausencia de estos. Debemos tener en cuenta que las lesiones en el tracto digestivo alto son más difíciles de detectar que en el colon y más complejas de delimitar y caracterizar. Por ello, el número de endoscopias altas del endoscopista para una EDA de alta calidad debe estar por encima del exigido para la colonoscopia. En la literatura no existe consenso sobre cuál debe ser el mínimo de EDA recomendable para alcanzar y mantener la competencia en EDA. El número de endoscopias mínimo recomendado es muy variable en función de los estudios realizados y oscila entre 100 y 200 exploraciones11,12. En el caso de la colonoscopia, existen datos de que una interrupción durante el aprendizaje produce un empeoramiento de la competencia13. Por extrapolación, parece razonable recomendar también en la EDA la realización continuada y un mínimo de EDA diagnósticas de alta calidad anuales para mantener la competencia.
Por otro lado, la detección de LPCG tiene una gran variabilidad interobservador cuando solo se utiliza luz blanca. En los últimos años se ha demostrado que la utilización de cromoendoscopia (CE) virtual no solo mejora la detección sino también disminuye esta variabilidad14. Un programa de entrenamiento on-line con 200 vídeos y con un adecuado feedback obtuvo una mejoría tanto en el diagnóstico de metaplasia intestinal (MI) como de displasia, alcanzando una especificidad mayor del 80% y del 90% al final del entrenamiento, respectivamente. Estos resultados pudieron observarse en la displasia incluso después de los 20 primeros vídeos15. El valor del entrenamiento on-line para el diagnóstico de CGP ha sido demostrado en un ECA multicéntrico internacional en el que participaron 332 endoscopistas de 35 países16.
Opinión de expertoAunque existen pocos datos sobre el número de gastroscopias que se considera necesario para garantizar la realización de una EDA de calidad, parece razonable recomendar un mínimo de 100-200 anuales. Ya se ha comentado que una EDA de calidad comienza con una adecuada formación del endoscopista, pero también es muy importante que todos los detalles de la exploración queden recogidos en el informe. En este sentido, la Sociedad Española de Patología Digestiva (SEPD) ha publicado recientemente una guía en la que se describen todos los pasos de la EDA17.
En cuanto al dominio de la técnica de CE, no existen recomendaciones específicas, pero parece que un entrenamiento on-line con imágenes y un adecuado feedback podría ser suficiente. En este sentido, la organización de cursos tanto a nivel local como internacional es necesaria y sería bien recibida.
Fotodocumentación- 2.
¿Qué imágenes deben obtenerse en una EDA para vigilancia de LPCG?
En una EDA para vigilancia de LPCG se recomienda realizar una fotodocumentación sistemática utilizando alguno de los protocolos existentes (SSS o Wold Endoscopy Organization).
Calidad de la evidencia: baja. Grado de recomendación: débil a favor.
Acuerdo: 5.
EvidenciaPara lograr un examen completo del tracto digestivo alto se deben visualizar una serie de puntos de referencia. El procedimiento debe comenzar en el esfínter esofágico superior y finalizar en la segunda porción duodenal. Se deben visualizar el esófago superior, la unión gastroesofágica, el fundus, el cuerpo gástrico, la incisura, el antro, el bulbo duodenal y el duodeno distal. Se debe realizar una maniobra de retroversión para explorar el fundus en el 100% de los pacientes. En un análisis sobre 111.962 endoscopias, la fotodocumentación de la ampolla de Vater se asoció de forma independiente con una mayor tasa de detección de lesiones neoplásicas (odds ratio [OR] 1,33, intervalo de confianza [IC] del 95%: 1,03-1,70)18. Un estudio retrospectivo incluyó 54.889 pacientes a los que se realizó una gastroscopia para cribado de CG con el objetivo de identificar indicadores de calidad de la EDA relacionados con el hallazgo de CGP. En el análisis multivariante los porcentajes de detección de lesiones subepiteliales gástricas y de divertículos gástricos se asociaron de forma independiente con la visualización de CGP19.
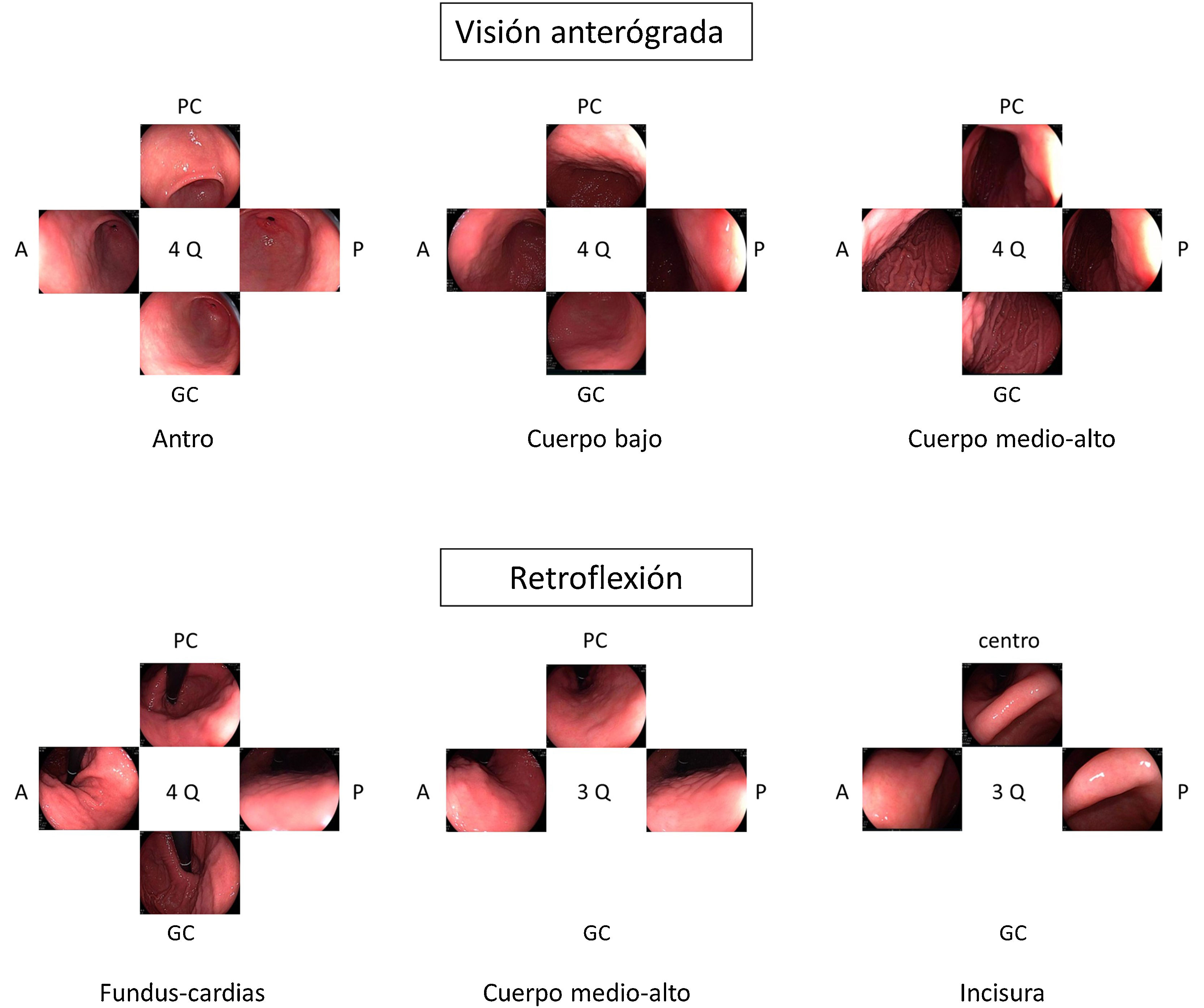
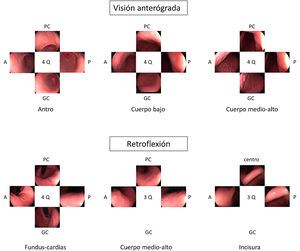
Diversas guías sugieren que la toma de imágenes fomenta la exploración cuidadosa y la limpieza de la mucosa asegurando un examen completo3,4. Cuando se está realizando una vigilancia de LPCG se recomienda realizar un mapeo fotográfico más extenso siguiendo el Systematic Screening Protocol for the Stomach (SSS) (fig. 1), que contempla 22 fotografías con el estómago bien distendido y limpio20. Más recientemente, la World Endoscopy Organization (WEO) ha publicado un documento de posicionamiento en el que propone un protocolo muy parecido con 21 fotografías en total21. En el caso de una EDA inicial fuera del contexto de vigilancia, la guía europea recomienda realizar 5 fotografías de la cavidad gástrica así como de las anomalías detectadas3.
Opinión de expertoSi bien no existen datos que respalden que la toma sistemática de imágenes mejore el rendimiento diagnóstico de la endoscopia, es razonable pensar que una toma exhaustiva de imágenes implica una exploración más detallada de la mucosa gástrica. En Japón, donde la incidencia de CGP es alta, desde hace muchos años se realiza una exploración sistemática para visualizar toda la mucosa y evitar dejar áreas sin explorar. Esta exploración sistemática consiste en tres fases: distender bien con la insuflación, eliminar el moco adherido a la mucosa con lavados con agua y antiespumante y, finalmente, mapear toda la mucosa con el SSS. Más recientemente, la WEO ha propuesto otra sistemática de documentación con fotografías del estómago que es muy parecida a la SSS pero que hace menos fotografías de la incisura. Como no se dispone de evidencia científica para recomendar una u otra estrategia, en la EDA de vigilancia de LPCG se considera que lo importante es seguir alguna de las sistemáticas propuestas en ellas.
Documentación de las lesiones- 3.
¿Cómo se deben documentar las lesiones detectadas en la endoscopia?
Toda lesión debe ser descrita, clasificada según la clasificación de París y documentada fotográficamente.
Calidad de la evidencia: baja. Grado de recomendación: fuerte a favor.
Acuerdo: 4,9.
EvidenciaNo existe.
Opinión de expertoCuando se localice una lesión sugestiva de LPCG/CGP, se deberá reflejar en el informe endoscópico como mínimo la ubicación anatómica de la misma y la distancia a un punto de referencia fijo (como por ejemplo la arcada dentaria). Deben describirse también el número de lesiones y el tamaño y la morfología de cada una de ellas, siguiendo las recomendaciones de la Minimal Standard Terminology (MST 3.0) (www.worldendo.org/guidelines)22. Debe describirse también cualquier anomalía adicional de la mucosa. La estandarización en los informes de endoscopia ayuda a la toma de decisiones; por lo tanto, recomendamos que cuando se detecte una lesión maligna, su morfología se describa de acuerdo con la clasificación de París23 y se obtengan imágenes de ella.
Grado de limpieza- 4.
¿Es necesario registrar el grado de limpieza y la calidad de la visualización de la EDA?
Se recomienda registrar el grado de limpieza y la calidad de la visualización de la mucosa gástrica.
Calidad de la evidencia: baja. Grado de recomendación: débil a favor.
Acuerdo: 4,9.
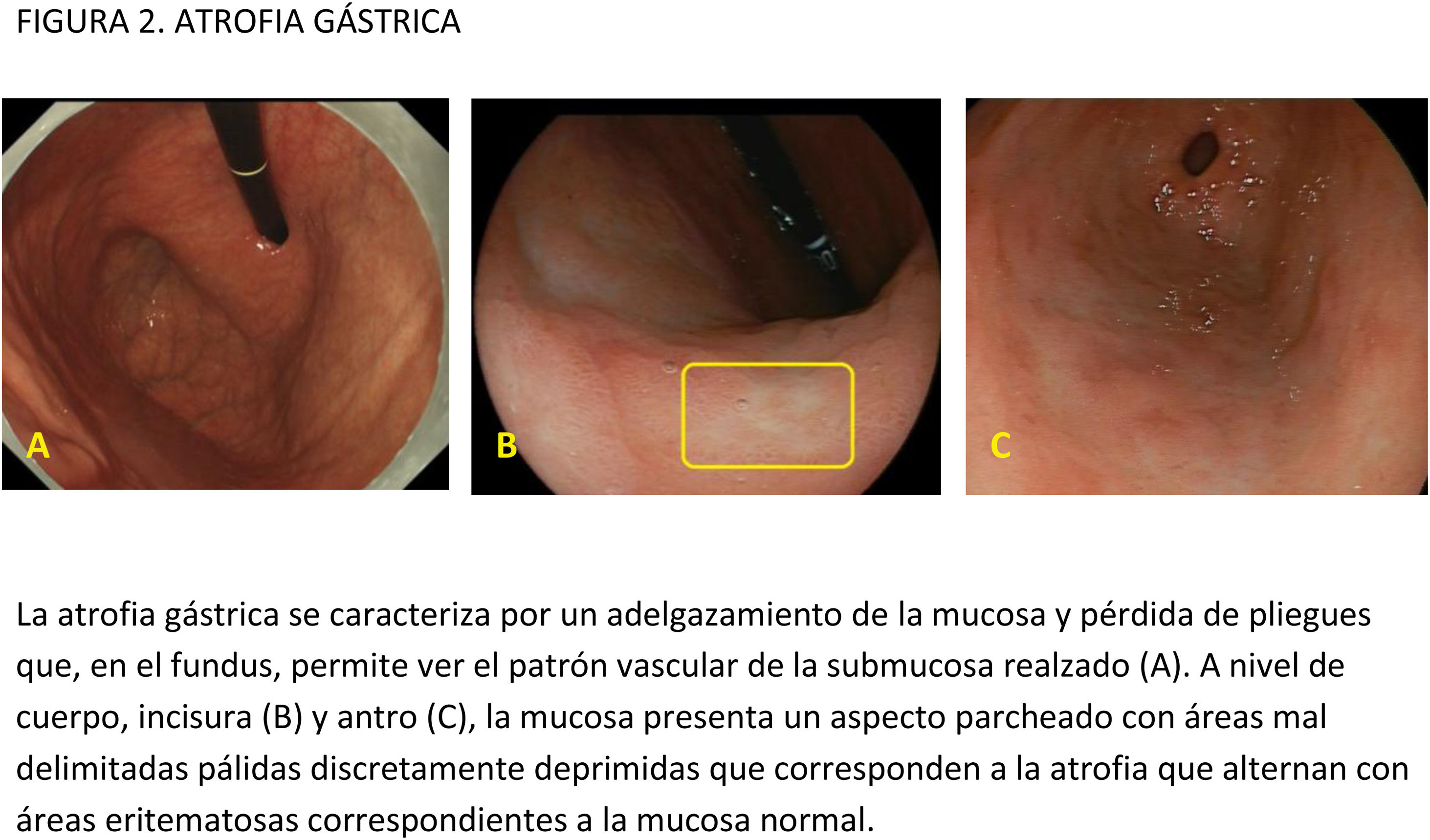
EvidenciaPara poder diagnosticar LPCG/CGP en la mucosa gástrica es necesario inspeccionarla libre de burbujas, moco y residuos. A diferencia de la colonoscopia, la calidad de la preparación gástrica no se suele recoger de forma rutinaria y, de hecho, no existen escalas validadas que se utilicen a nivel asistencial. En los estudios realizados para evaluar el efecto de la premedicación sobre la visibilidad de la mucosa gástrica se ha utilizado la escala propuesta por Kuo y posteriormente modificada por Chang24-26. Esta escala cuantifica la limpieza del estómago en cuatro segmentos: el antro, el cuerpo gástrico bajo, el cuerpo gástrico alto y el fundus. Para cada segmento establece una puntuación entre 1 (limpieza perfecta) y 4 (gran cantidad de moco que requiere más de 50ml de agua para eliminarlo), obteniéndose una puntuación entre 4 y 16.
Opinión de expertoLa limpieza gástrica debería ser clasificada según una escala validada y debería quedar reflejada en el informe endoscópico. Se necesitan estudios para definir y validar la escala de limpieza más adecuada. De forma similar a la escala de Boston utilizada en la colonoscopia, la valoración del grado de limpieza debería realizarse después de los lavados para reflejar el grado de visibilidad de la mucosa (nivel 1: ausencia de moco adherido y espuma y visibilidad de toda la mucosa; nivel 2: delgada capa de moco y algo de espuma que no impiden la visibilidad; nivel 3: presencia de moco y espuma que impiden evaluar algunas áreas de la mucosa; nivel 4: mucosa no evaluable por restos alimentarios, moco y/o espuma). Esta valoración debería hacerse por segmentos o áreas y se podría añadir como información adicional el porcentaje de superficie mucosa que no puede ser valorada. Por último, si es imposible alcanzar una visualización completa y correcta de la mucosa gástrica después del lavado, debería emitirse una recomendación de si el procedimiento requiere ser repetido4.
Registro de complicaciones- 5.
¿Se deben documentar las complicaciones de la EDA?
Se recomienda recoger las complicaciones y la mortalidad relacionadas con la EDA en registros prospectivos.
Calidad de la evidencia: baja. Grado de recomendación: débil a favor.
Acuerdo: 4,8.
EvidenciaLas complicaciones graves relacionadas con la EDA diagnóstica son poco frecuentes e incluyen incidentes cardiopulmonares e infecciones27. La perforación y la hemorragia son más habituales en las EDA terapéuticas, especialmente en la disección submucosa endoscópica (DSE) por ser la técnica más demandante desde el punto de vista técnico. Según un metaanálisis reciente sobre los resultados de la DSE gástrica en Europa28, la tasa de complicaciones globales es del 9,5%, incluyendo hemorragia (5,8%), perforación (3,4%) y estenosis (0,35%). Un total de 3 (0,26%) pacientes murieron en el mes posterior a la disección, pero en ningún caso hubo una relación directa con el procedimiento.
Opinión de expertoUna de las claves para controlar la calidad del programa de endoscopia de un centro es tener constancia de las complicaciones, y para ello es necesario disponer de registros prospectivos. La American Society of Gastrointestinal Endoscopy (ASGE) propone la recogida de las complicaciones como un parámetro de calidad posprocedimiento27, y no solo de las complicaciones inmediatas sino también de las diferidas (entre 14 y 30días). Sería igualmente muy deseable auditar la proporción de complicaciones específica de cada uno de los endoscopistas que la forman, con vistas a tomar medidas formativas y correctivas cuando dicha tasa se aleje de lo esperable. Debido a que las complicaciones más frecuentes (perforación y hemorragia) se producen en el contexto de EDA terapéutica, es poco probable que hallemos este tipo de complicaciones en una EDA diagnóstica, pero pueden ocurrir algunos incidentes como los relacionados con la sedación4.
Tiempo de visualización- 6.
¿Cuál debe ser el tiempo de visualización mínimo de la cavidad gástrica en una EDA para detección de LPCG?
El tiempo mínimo de una EDA para detección de LPCG debería ser al menos de 7min, dedicando 4 de ellos para la exploración de la cavidad gástrica.
Calidad de la evidencia: baja. Grado de recomendación: fuerte a favor.
Acuerdo: 4,7.
EvidenciaLa iniciativa de la European Society of Gastrointestinal Endoscopy (ESGE) para mejorar la calidad de la gastroscopia publicada en 2016 recomienda dedicar al menos 7min para la realización de una EDA desde la intubación a la extubación29. Esta recomendación se basa en un estudio retrospectivo de cohortes en el que se evaluó la relación entre el tiempo de exploración y el diagnóstico de lesiones30. En este estudio se evaluaron 837 pacientes con síntomas digestivos pero sin antecedente de CG ni endoscopias previas. El tiempo medio de exploración fue de 6,6min para las gastroscopias sin hallazgos y sin obtención de biopsias. En base a este resultado establecieron un punto de corte en 7min y observaron que los endoscopistas «lentos» detectaban el doble de lesiones gástricas (MI, atrofia, displasia o cáncer) que los rápidos y tres veces más displasia y cáncer30. Otro estudio de cohortes posterior corroboró la importancia del tiempo para aumentar la detección de lesiones, aunque en este caso el punto de corte fue de 3min31.
No hay estudios que hayan evaluado si un mayor tiempo de visualización durante las EDA de vigilancia aumenta la detección de CGP. Sin embargo, un estudio reciente realizado en Corea del Sur evaluó el impacto del tiempo en la detección de lesiones sincrónicas antes de realizar el tratamiento endoscópico32. De 83 pacientes con lesiones sincrónicas, 46 fueron identificadas antes de la resección de la lesión índice. En este grupo, la duración media de la endoscopia fue de 6,5min, frente a 3,8min que duraron las gastroscopias en las que las lesiones sincrónicas se detectaron en la endoscopia realizada un año después.
Opinión de expertoEl nivel de evidencia que soporta la duración óptima de una gastroscopia diagnóstica es muy bajo30,31,33. Aunque no existen estudios que hayan evaluado la duración óptima de una gastroscopia de vigilancia, la recomendación de una duración de 7min parece razonable en base a los dos estudios mencionados anteriormente30,32. Adicionalmente, Veitch et al. recomiendan dedicar un mínimo de 4min a la exploración de un estómago de tamaño estándar (730cm2) para descartar la existencia de CGP33. Dado que el incremento propuesto de la duración prácticamente no afecta al número de exploraciones que podrían realizar las unidades de endoscopia, y el escaso riesgo que supone para el paciente, este panel de expertos se decanta por una recomendación fuerte a favor.
Uso de premedicación con mucolíticos y antiespumantes- 7.
¿El uso de antiespumantes y mucolíticos mejora la detección de LPCG/CGP?
Se recomienda la administración oral de simeticona 200mg y N-acetilcisteína (500 o 1.000mg) previa a la endoscopia para mejorar la visualización de la mucosa gástrica.
Calidad de la evidencia: alta. Grado de recomendación: fuerte a favor.
Acuerdo: 4,6.
EvidenciaLa utilización de premedicación oral en combinaciones de antiespumantes y mucolíticos (simeticona más N-acetilcisteína o simeticona más pronasa) mejora la visualización de la mucosa gástrica25,34,35. Según los resultados del ensayo clínico de Monrroy et al.25, la visualización de la mucosa gástrica mejora con la administración por vía oral de simeticona 200mg asociada a N-acetilcisteína previa a la endoscopia. En el análisis post-hoc de este ensayo, en el que se incluyeron 5 grupos (3 con pre-medicación: simeticona, simeticona +N-acetilcisteína 500, simeticona +N-acetilcisteína 1.000 y 2 grupos control: agua y no intervención), se observó una mayor detección de lesiones en la gastroscopia cuando se compararon los grupos de premedicación con el grupo control con agua sola (32% vs 14%, p=0,02). Esta diferencia no se mantuvo cuando se compararon los grupos de premedicación con el de no intervención. Sin embargo, estos resultados deben interpretarse con cautela, debido a que el estudio no fue diseñado con el objetivo de detectar lesiones. No hubo diferencias en los tiempos de exploración ni en los efectos adversos. En otro ECA y enmascarado, realizado por Liu et al.36 en 2018 la premedicación con simeticona y pronasa mejoró la visibilidad de la mucosa gástrica, pero sin aumentar la tasa de detección de lesiones preneoplásicas.
En el metaanálisis publicado por Chen et al.37, la simeticona incrementó la visibilidad de la mucosa gástrica. Sin embargo, esta visualización no mejoró al añadir N-acetilcisteína o pronasa a la simeticona. De forma similar, en el ensayo de Elvas et al.38 tampoco se detectaron diferencias respecto a la visualización de la mucosa entre el grupo de simeticona sola y simeticona con N-acetilcisteína. No obstante, esta asociación podría disminuir la necesidad de lavados con agua durante el procedimiento39. Finalmente, en el ECA de Zhang et al.35 de 2018 (grupo control frente a simeticona +pronasa) no se observaron diferencias en el diagnóstico de lesiones <5mm (erosiones, pólipos, ulceras…), pero en el grupo de premedicación se incrementó el número de pacientes en los que se realizaron biopsias (19,7% vs 31,1%; p=0,001) y de LPCG diagnosticadas.
La vía de administración de la premedicación acostumbra a ser oral, con un volumen de 100ml administrado entre 10 y 20min antes de la exploración40. En estudios en los que la simeticona se administra a través del canal de trabajo de los endoscopios se han demostrado residuos de este material no absorbible que dificultan el procesamiento de los endoscopios y favorecen el crecimiento bacteriano en el canal de los endoscopios. Por lo tanto, es aconsejable reducir al mínimo su administración a través del endoscopio y usar la menor dosis posible41,42. No hay estudios que hayan demostrado residuos de simeticona cuando se utiliza como premedicación oral previa al procedimiento, aunque parece razonable tener también precaución durante su uso.
Opinión de expertoEl empleo de premedicación con mucolíticos y antiespumantes mejora la visualización de la mucosa gástrica, aunque existen resultados discordantes cuando se valora el uso de las combinaciones de simeticona respecto al uso de simeticona sola. El estudio de Zhang et al.35 sugiere que la mejora de la visualización hace que se aumente el número de biopsias y, por lo tanto, el diagnóstico de LPCG. Sin embargo, en el estudio la toma de biopsias no estaba protocolizada y no sabemos si la preparación con simeticona influyó en la obtención de biopsias dirigidas. Por otro lado, no se ha demostrado claramente el beneficio en la detección de lesiones. Hay también discrepancias respecto a la pauta de premedicación más eficaz. En base al ECA realizado por Monrroy et al.25, la combinación más eficaz parece ser simeticona 200mg y N-acetilcisteína (500 o 1.000mg) administrada por vía oral 20min antes de la gastroscopia. No se han demostrado complicaciones secundarias a la premedicación oral durante la gastroscopia realizada con sedación profunda, por lo que la utilización de propofol no contraindicaría la utilización de preparados previos a la gastroscopia para mejorar la visualización de la mucosa35.
Uso de sedación- 8.
¿La sedación mejora la detección de LPCG/CGP?
Se recomienda el uso de sedación para la realización de una EDA para diagnóstico o vigilancia de LPCG aunque no haya demostrado mejorar la detección.
Calidad de la evidencia: baja. Grado de recomendación: fuerte a favor.
Acuerdo: 4,2.
EvidenciaLa mayoría de las guías clínicas recomiendan sedación para la EDA43,44. En un ECA doble ciego45, la sedación con midazolam mejoró la percepción del procedimiento por parte del paciente, disminuyendo su ansiedad previa y aumentando su colaboración y aceptación en el caso de tener que repetirla. El propofol se asocia con mayor satisfacción del endoscopista y una recuperación más rápida, sin diferencias en la satisfacción del paciente ni en la seguridad respecto a otros fármacos46,47. En otro estudio aleatorizado y enmascarado48, al revisar los vídeos de las EDA se observó una mejor calidad de la gastroscopia percibida por los endoscopistas en pacientes sedados con propofol frente a midazolam. De todos los parámetros evaluados, la visualización completa del antro y de la curvatura menor en retroflexión fueron claramente superiores en el grupo sedado con propofol. Además, durante la grabación de las exploraciones se pudo emplear más tiempo en la exploración endoscópica debido a la mejor tolerancia de los pacientes a la distensión gástrica.
En cuanto al efecto de la sedación en la detección de lesiones, solo ha sido evaluado en un estudio retrospectivo49 que observó un incremento significativo en la detección de pólipos gástricos, sobre todo los situados en cuerpo gástrico y fundus en pacientes sedados con propofol frente a no sedados. Aun reconociendo el débil soporte científico respecto a la influencia de la sedación sobre la detección de lesiones, el consenso asiático sobre los estándares diagnósticos de la EDA2 recomienda el empleo de sedación para mejorar la tasa de detección de neoplasias tempranas esofagogástricas, y la British Society of Gastroenterology (BSG) y la Association of Upper Gastrointestinal Surgeons of Great Britain and Ireland (AUGIS)4 aconsejan también, con un grado fuerte de recomendación, el empleo de la sedación como parte de una EDA de calidad.
Opinión de expertoLa sedación permite una exploración más prolongada, mejora la percepción del procedimiento por parte del endoscopista y del paciente, disminuye la ansiedad del paciente y aumenta la aceptación para repetir la exploración. Esto permitiría incrementar el cumplimiento de los pacientes con las recomendaciones de seguimiento aconsejadas y mejorar la eficacia de las gastroscopias de vigilancia.
Técnica de visualización- 9.
¿Cuál es la técnica de imagen de elección para la detección de LPCG/CGP?
Se recomienda el uso de endoscopios de alta definición y cromoendoscopia convencional o digital para la detección y vigilancia de las LPCG.
Calidad de la evidencia: alta. Grado de recomendación: fuerte a favor.
Acuerdo: 4,5.
Se recomienda el empleo de Narrow Band Imaging para la detección de la MI.
Calidad de la evidencia: alta. Grado de recomendación fuerte a favor.
Acuerdo: 4,9.
EvidenciaExisten dos tipos de técnicas de imagen mejorada: las técnicas de tinción con empleo de colorantes (cromoendoscopia [CE] convencional) y los sistemas específicos (digitales) incluidos en los equipos de endoscopia disponibles en el mercado: narrow band imaging (NBI), flexible spectral imaging color enhancement (FICE), i-Scan, blue laser imaging (BLI) y linked color imaging (LCI). Todas ellas se han estudiado tanto para detectar como para caracterizar las LPCG y el CGP.
CE convencional en la detección de LPCG/CGP. Se han empleado para este fin tanto el azul de metileno como el índigo carmín o el ácido acético, así como la combinación de estas dos últimas (bicromoendoscopia [biCE]).
La CE convencional mostró un mayor porcentaje de detección de lesiones gástricas cuando se comparó con la imagen de luz blanca (ILB) en un metaanálisis50 que incluyó 699 pacientes y 902 lesiones. La CE presentó una sensibilidad del 90% y una especificidad del 82% para el diagnóstico tanto de LPCG como de CGP. Cuando se estratificó el análisis por la histología, la precisión diagnóstica fue superior a la ILB en ambos casos (LPCG: 98,4% vs. 81%; CGP: 86,6% vs. 54,9%).
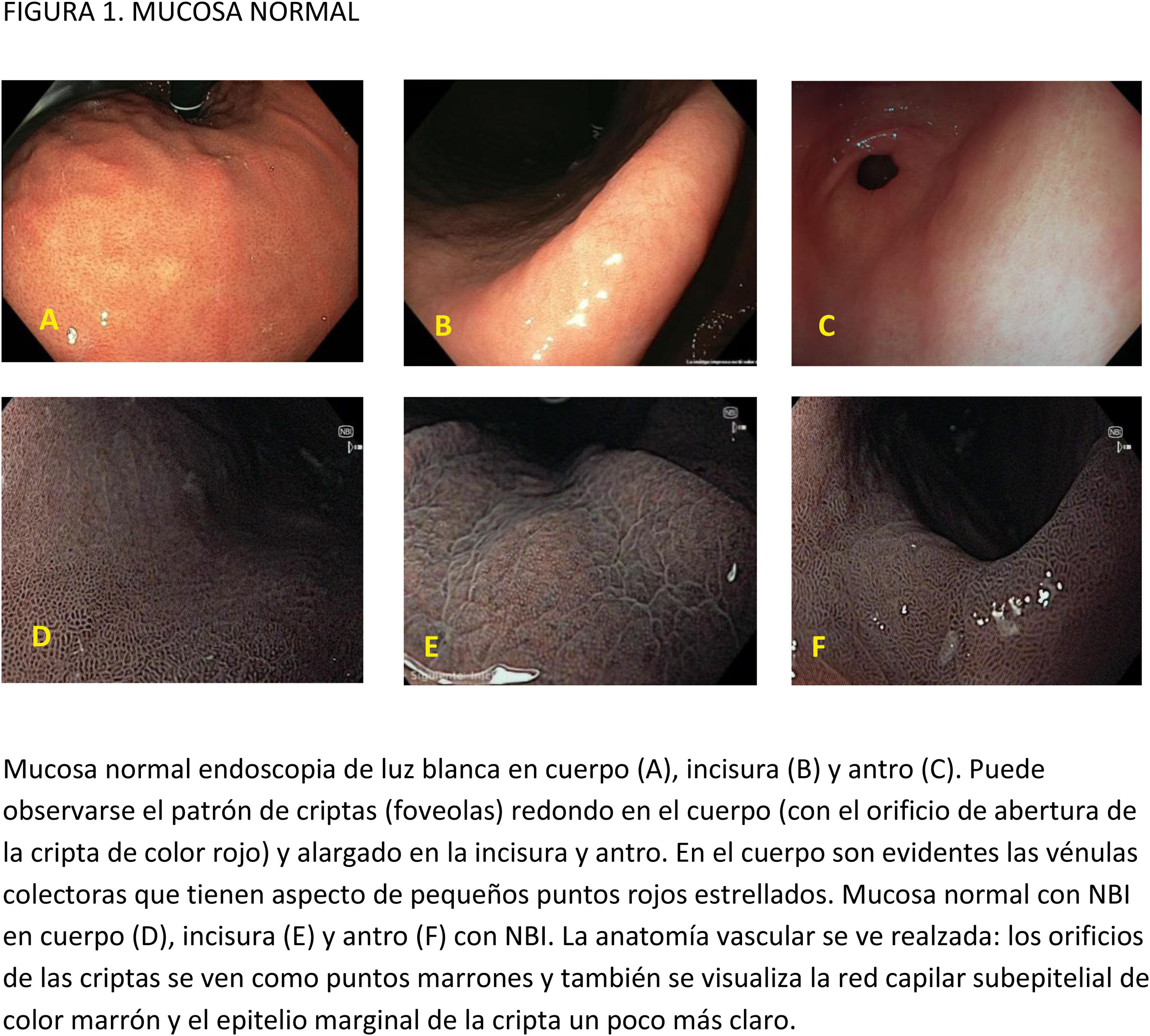
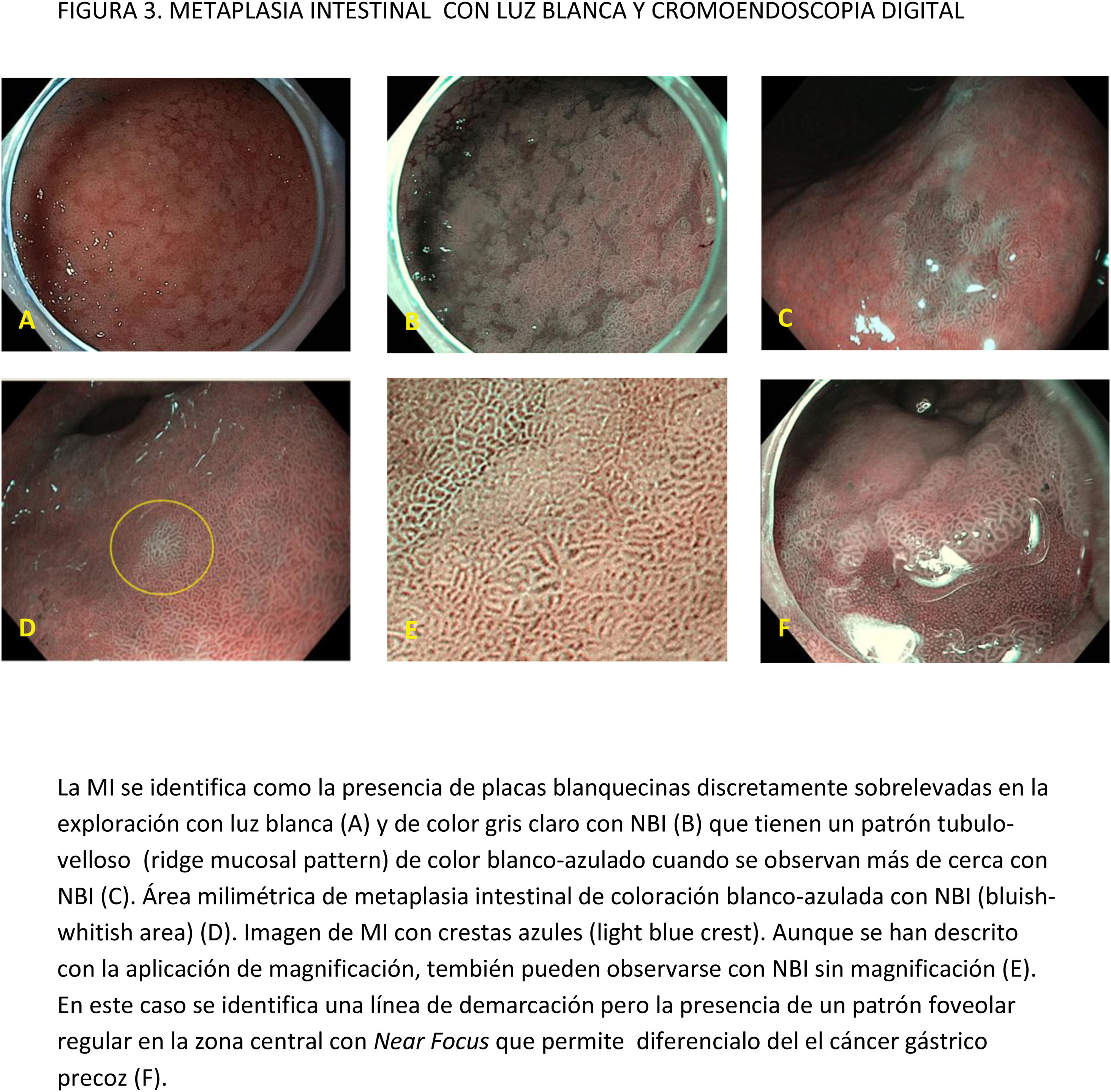
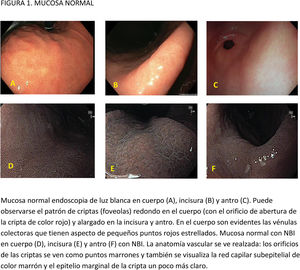
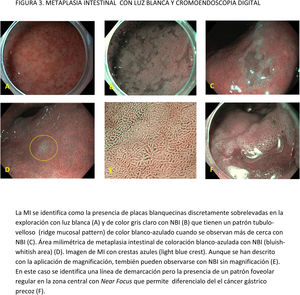
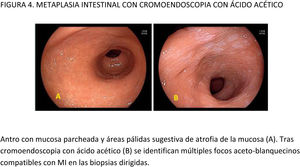
CE digital en la detección de LPCG. Para la MI se han descrito patrones ópticos específicos usando cromoendoscopia digital sin magnificación: el patrón en forma de crestas o tubulovelloso (ridge mucosal pattern) y las áreas blanquecino-azuladas (bluish-whitish areas). Ambos patrones se han descrito tanto con NBI como con BLI. Con la adición de magnificación al NBI se han descrito además otros signos: las crestas azul claro (light blue crest), la banda turbia marginal (marginal turbid band) y la presencia de sustancia blanca opaca (white opaque substance). En un metaanálisis que evaluó estos marcadores para el diagnóstico de MI la mayor sensibilidad y especificidad se obtuvo con la presencia de crestas azul claro (79 y 95%, respectivamente)51.
Cuando se ha comparado la ILB con el NBI para la detección de MI, un ECA multicéntrico mostró un mayor porcentaje de detección de este tipo de LPCG en el grupo NBI (17,7% vs 7,7%)52. La sensibilidad y especificidad fueron del 59,1 y 98,6% con ILB y del 92,3 y 94,3% con NBI, respectivamente.
Con la intención de hacer más reproducible el diagnóstico de MI con NBI, se ha propuesto una clasificación endoscópica que puntúa su presencia o ausencia en cinco áreas diferentes de la mucosa53. El sistema de puntuación obtenido (EGGIM) puntúa entre 0 (normal sin áreas de MI) y 10 (extensa MI en todas las áreas de la mucosa gástrica) (tabla 2). La exactitud diagnóstica de la extensión de la MI pasó a ser del 83% con ILB al 94% con NBI. El beneficio del NBI fue mayor en los estadios OLGIMIII/IV. Esta clasificación endoscópica EGGIM se ha validado muy recientemente54, y el punto de corte óptimo para detectar esas lesiones OLGIMIII/IV fue un EGGIM>4. Además, podría ser apropiada para estratificar el riesgo individual de desarrollar CG55.
En cuanto al empleo adicional de magnificación con NBI (M-NBI) para el diagnóstico de MI, la precisión diagnóstica fue similar cuando se comparó con estudios en que no se disponía de magnificación según un reciente metaanálisis56 De hecho, el marcador más adecuado y fácilmente disponible en todos los centros resultó ser el patrón mucoso tubulovelloso sin magnificación adicional (sensibilidad del 88% y especificidad del 97%).
Por lo que se refiere a la detección de MI con otras tecnologías, como el BLI o el LCI, en este mismo metaanálisis se observaron adecuada sensibilidad y especificidad cuando el BLI se empleó junto a magnificación (89 y 97%, respectivamente). Sin embargo, se trata de un único estudio, lo que no permite extraer conclusiones definitivas. En cuanto al LCI sin magnificación, la sensibilidad y la especificidad globales para detectar MI en los dos estudios incluidos fueron del 73 y 92%, respectivamente57,58.
La adición de Near Focus al NBI mejora la identificación de MI gástrica extensa. Así, Lage et al.59 observaron que la adición de NBI y Near Focus incrementan la precisión de la ILB, que pasa del 60 al 73%. La sensibilidad y la especificidad para el diagnóstico endoscópico de MI extensa fueron del 92 y 96%, respectivamente.
CE digital en la detección del CGP. Con la ILB sin magnificación, las lesiones sospechosas de CGP se muestran como áreas con márgenes, coloración o superficie irregulares.
Dos ECA han comparado NBI de segunda generación sin magnificación e ILB para detectar CG. El estudio de Ang et al.52 no mostró mayor incidencia de CG en los pacientes aleatorizados a NBI frente al grupo de ILB en una población asiática de sujetos de más de 50años sometidos a gastroscopia de cribado o diagnóstica (2,4% en el grupo ILB y 1% NBI; p=0,19). En otro ECA más reciente60, en una población muy seleccionada (pacientes de alto riesgo y en un área de alta incidencia de CG), el porcentaje de detección de CG no mostró diferencias significativas entre los grupos (ILB: 1,9% vs. NBI 2,3%; p=0,41). La proporción de lesiones no detectadas en la primera exploración tampoco mostró diferencias estadísticamente significativas cuando la primera exploración fue con ILB (27,5%) o con NBI (22,4%). La sensibilidad y la especificidad para detectar CGP fueron del 80 y 88%, respectivamente, con la ILB, y del 76,8 y 91% con NBI. Por tanto, en esta población muy seleccionada de pacientes con elevada probabilidad pre-test de CGP, NBI sin magnificación no mostró una clara mejoría en la detección de CG precoz comparado con la ILB.
Opinión de expertoLos diferentes estudios publicados muestran de manera consistente que las diferentes técnicas de CE, convencional o digital, incrementan la precisión diagnóstica para detectar LPCG cuando se compara con ILB.
Aunque la calidad de la evidencia científica disponible sobre la utilidad de la CE convencional en la detección de LPCG y CGP es alta, la mayoría de los estudios incluidos son de origen asiático, su calidad metodológica es heterogénea, el número de pacientes es relativamente bajo y el tipo de tinciones empleadas es muy variado (azul de metileno, índigo carmín y biCE).
De todos los sistemas de CE digital, el NBI es el más estudiado para la detección de MI y ha mostrado consistentemente un incremento de la sensibilidad y la especificidad en comparación con la ILB. Los otros sistemas disponibles actualmente no han sido ampliamente estudiados por el momento, aunque es posible que presenten resultados muy parecidos (especialmente el BLI).
Finalmente, la CE con NBI de segunda generación, sin magnificación, no ha demostrado mejoría en la detección de CGP cuando se ha comparado con ILB en manos de expertos y áreas de alta incidencia. Parece, por tanto, que el factor más determinante para la detección de CGP es un adecuado entrenamiento del endoscopista a la hora de localizar alteraciones en la superficie mucosa con la ILB tales como irregularidad, áreas deprimidas o cambios de coloración.
Diagnóstico histológico y evaluación de la extensión de la MI- 10.
¿Qué protocolo de biopsias se recomienda para el diagnóstico y la evaluación de la extensión de la MI?
Se recomienda biopsiar en dos áreas topográficas (antro, incluyendo incisura, y cuerpo) utilizando NBI para dirigir las biopsias a las áreas más sospechosas de MI.
Calidad de la evidencia: baja. Grado de recomendación: fuerte a favor.
Acuerdo: 4,9.
EvidenciaEl estudio histológico de las muestras obtenidas mediante biopsia endoscópica es el patrón oro del diagnóstico de las LPCG. La evidencia actual sugiere que las biopsias guiadas por CE, convencional o digital, combinadas con el mapeo aleatorio son el método ideal para detectar las LPCG50. Siguiendo esta estrategia, en el estudio de Buxbaum et al.61 se detectó el 100% de pacientes con MI y el 95% de las áreas con MI. La explicación es que las biopsias aleatorias detectan algunos casos que no son identificados con NBI y, por otro lado, en manos expertas las biopsias dirigidas con NBI incrementan la capacidad diagnóstica del mapeo aleatorio. El protocolo más ampliamente aceptado es el actualizado de Sydney62, que recomienda obtener al menos 5 biopsias: 2 de antro (una de curvatura menor y otra de la mayor), a 3cm del píloro; 2 del cuerpo (una de curvatura menor y otra de la mayor), a unos 4cm de la incisura, y una de la incisura angularis. Las biopsias deben de ser inmediatamente sumergidas en una solución fijadora adecuada y enviarse en al menos dos recipientes por separado e indicando la localización/procedencia, uno para las de antro/incisura y otro para las de cuerpo. Este protocolo de biopsias permite el diagnóstico de H.pylori y estadificar a los pacientes con MI y atrofia. Diversos estudios63,64 apoyan el protocolo mínimo de 5 biopsias, pero advierten que con este número podrían dejar de detectarse algunas lesiones premalignas. De hecho, algunas guías, como la de la ASGE, recomiendan obtener 7-12 biopsias aleatorias65.
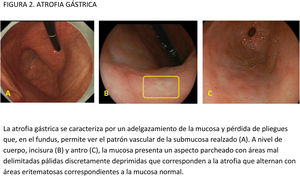
La utilidad de añadir una biopsia de la incisura también es un tema controvertido. Aunque esta localización ha sido considerada un área de aparición temprana de atrofia o metaplasia, con mayor prevalencia de lesiones premalignas y más fiable para el diagnóstico de atrofia y MI que el antro o el cuerpo64,66, otros estudios concluyen que las biopsias de la incisura añaden poca información a las obtenidas del cuerpo y antro. Así, una revisión retrospectiva de más de 400.000 biopsias gástricas concluye que la valoración de la incisura aportó una información diagnóstica adicional mínima a la toma de 4 biopsias (2 corporales y 2 antrales), que fue la estrategia que mostró mayor rendimiento diagnóstico67. De forma parecida, una revisión de las biopsias gástricas obtenidas según el protocolo actualizado de Sydney en 272 pacientes de un área con riesgo bajo de CG, encontró que la MI se localizaba de forma aislada en la incisura solo en el 3,3% de los casos68. Por el contrario, otros autores69,70 observan que las biopsias de la incisura predicen mejor la severidad de la gastritis que el resto de la mucosa gástrica. Isajevs et al.70 observaron que la atrofia más intensa y la MI eran más frecuentes en la incisura que en el antro o en el cuerpo, y que la exclusión de la valoración histológica de la incisura conducía a una infravaloración en la estadificación del 18% para OLGA y del 4% para OLGIM (esta cifra llegaba al 30-35% en estadios OLGIM/OLGA avanzados). Así mismo, Varbanova et al.71 describen que el 8% de los casos con atrofia y el 3% de los que tenían MI no habrían sido correctamente identificados si no se hubiese biopsiado la incisura, y el estadio de OLGA/OLGIM habría sido significativamente menos avanzado. En consonancia con estos estudios, Kim et al.72 encuentran que incluir biopsias de la incisura evita infraestadificar la gravedad de la gastritis, lo que no ocurre cuando se añaden biopsias de las caras anterior o posterior del cuerpo o del antro. Finalmente, otro estudio en pacientes con alto riesgo de CG por antecedentes familiares detectó una infraestadificación en el 15 y el 30% de los casos si no se incluían biopsias de la incisura en comparación con la aplicación de los sistemas OLGA/OLGIM originales73. En cuanto a la toma de biopsias aleatorias, se recomienda biopsiar áreas mucosas planas, puesto que las zonas protruidas con patrón de superficie y vascular regular pueden representar islotes de mucosa conservada que falseen la existencia de atrofia74.
Opinión de expertoActualmente existe una discrepancia entre las diferentes guías clínicas a la hora de recomendar un protocolo para la toma de biopsias gástricas. Si bien el sistema de Sydney original no incluía biopsias de la incisura, su actualización posterior lo recomienda, al igual que lo hace el Consenso de MaastrichtIV75. La realización del protocolo de Sydney incluyendo la incisura permite realizar la estratificación del riesgo basándose en el sistema OLGIM. La actualización de la guía MAPSII sigue recomendando un mínimo de 4 biopsias (2 en antro y 2 en cuerpo) pero reconoce que la valoración histológica de la incisura puede considerarse para aumentar el diagnóstico de lesiones premalignas, especialmente cuando no puedan tomarse biopsias dirigidas con CE76.
Si en la gastroscopia índice o diagnóstica no se realizó una toma de biopsias adecuadas o se enviaron todas en el mismo contenedor y el diagnóstico de MI se realizó de forma incidental, se recomienda repetir la exploración endoscópica utilizando CE para obtener un mapeo histológico adecuado76, al menos en los pacientes con riesgo elevado de CG. En los pacientes con riesgo medio de CG la decisión de repetir la gastroscopia debe individualizarse en función de la edad, las comorbilidades, las preferencias, etc. La recomendación más aceptada es obtener al menos 5 biopsias (2 de antro, 2 de cuerpo y una de la incisura) que deben enviarse en al menos dos contenedores (cuerpo y antro/incisura), y se debería indicar si las biopsias han sido aleatorias o dirigidas a las zonas sospechosas de MI.
Lesión visible- 11.
¿Cómo debe evaluarse una lesión visible?
Se recomienda realizar la evaluación de los márgenes horizontales de las lesiones visibles y su riesgo de invasión submucosa con endoscopios con magnificación, CE y por endoscopistas con experiencia.
Calidad de la evidencia: alta. Grado de recomendación: fuerte a favor.
Acuerdo: 4,4.
En las lesiones visibles susceptibles de resección endoscópica se recomienda toma de biopsias (1-2) para confirmar el origen neoplásico de la lesión
Calidad de la evidencia: baja. Grado de recomendación: fuerte a favor.
Acuerdo: 4,8.
En las lesiones visibles se propone reservar la ecoendoscopia solo para aquellas con signos sospechosos de invasión submucosa profunda.
Calidad de la evidencia: baja. Grado de recomendación: débil a favor.
Acuerdo: 4,5.
En las lesiones visibles no tributarias de resección endoscópica por sospecha de invasión profunda, se recomienda la toma de biopsias (6 mínimo) para una adecuada filiación histológica.
Calidad de la evidencia: baja. Grado de recomendación: fuerte a favor.
Acuerdo: 4,4.
Se recomienda la extirpación endoscópica como tratamiento de elección de las lesiones gástricas neoplásicas visibles sin datos de invasión submucosa profunda.
Calidad de la evidencia: baja. Grado de recomendación: fuerte a favor.
Acuerdo: 4,9.
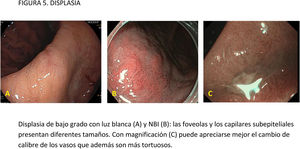
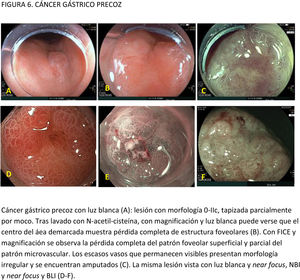
EvidenciaEl primer paso ante una lesión visible es una adecuada valoración óptica. Estudios observacionales y ECA indican que la precisión diagnóstica en la evaluación de lesiones gástricas se incrementa con sistemas de aprendizaje y la experiencia del endoscopista16,77,78. La utilización de CE convencional ha demostrado contribuir a una mejor delimitación de los márgenes laterales de la lesión, especialmente en casos de tumores bien diferenciados79-81. Un ECA reciente en el que se incluyeron 343 pacientes concluye que la CE con índigo carmín sin magnificación y la M-NBI tienen una precisión similar para delimitar los márgenes laterales del CGP (85,7 vs. 88%, respectivamente; p=0,63)82.
La gran mayoría de los estudios publicados emplean magnificación para el diagnóstico y caracterización de la displasia y el CGP. La lesión se evalúa empleando, por lo general, la clasificación «vessel plus surface» (patrón microvascular y/o superficial irregulares en el interior de una línea de demarcación). La evidencia disponible sobre el uso de magnificación con CE digital para la caracterización de lesiones visibles procede de estudios observacionales, ECA y varios metaanálisis83-85. La mayoría de los estudios se han centrado en M-NBI, aunque también existen investigaciones con otros sistemas de CE digital86-88. Todos ellos señalan que estos sistemas, empleados con magnificación, mejoran la capacidad de identificar y delimitar los márgenes horizontales con una precisión diagnóstica por encima del 85-90% e identifican algunos signos que sugieren infiltración de la submucosa, como la dilatación de los vasos o la presencia de vasos con diferentes calibres84,86,88-94. En el publicado por Hu et al.83, la sensibilidad y la especificidad fueron del 86 y 96% con M-NBI y del 56 y 79% con ILB. El rendimiento diagnóstico del M-NBI se vio influenciado negativamente por la morfología deprimida de la lesión y un tamaño <10mm. En el metaanálisis de Zhang et al.84 la sensibilidad y la especificidad fueron del 83 y 96% con M-NBI y del 48 y 67% con ILB. Más recientemente, el metaanálisis publicado por Rodríguez-Carrasco et al.56 confirma la tendencia al uso de magnificación para esta indicación, dado que solo se incluyeron dos estudios (de un total de 19) en los que no se empleó. Además, este estudio mostró que con M-NBI se incrementa la especificidad (98% vs. 94%) a costa de un descenso en la sensibilidad (86% vs. 94%) cuando se compara con ILB.
En lo que respecta a la CE digital sin magnificación, no se han encontrado estudios que evalúen su precisión para establecer los márgenes laterales y el riesgo de invasión submucosa profunda.
Con ILB, estudios observacionales indican que la presencia de ulceración, superficie irregular, tamaño >3cm, falta de distensión con insuflación, enrojecimiento marcado, presencia de excavación, convergencia o interrupción abrupta de los pliegues gástricos y la presencia de bordes significativamente elevados son signos que sugieren invasión submucosa profunda95-99. La ecoendoscopia es útil en la estadificación locorregional de las neoplasias gástricas, aunque su precisión en las neoplasias superficiales para discriminar el grado de invasión submucosa es moderada de acuerdo a un metaanálisis con metodología Cochrane (T1a vs. T1b, sensibilidad 87%, especificidad 75%)100. La ecoendoscopia puede tanto infraestimar como sobreestimar el grado de invasión de la pared gástrica, así como proporcionar falsos positivos y negativos en la estadificación ganglionar101. Por este motivo, tanto la ESGE como la Japan Gastroenterological Endoscopy Society (JGES) no recomiendan su uso de forma rutinaria, aunque podría ser útil en la toma de decisiones en lesiones limítrofes con factores de riesgo de invasión submucosa102,103.
El número óptimo de biopsias de una lesión gástrica sigue siendo motivo de controversia. La tendencia actual en las lesiones potencialmente resecables es realizar un menor número de biopsias con el objetivo de prevenir la aparición de fibrosis que pueda dificultar la extirpación endoscópica2,102. Un ECA asiático ha demostrado que la toma de 4 biopsias antes de la disección endoscópica submucosa obtiene mejores resultados en términos de eficiencia diagnóstica104. Un estudio observacional en pacientes con CG avanzado concluyó que la toma de 3-4 biopsias es suficiente para un adecuado diagnóstico histológico105. Sin embargo, otros autores no han encontrado un beneficio claro en el incremento del número de biopsias, por lo que defienden una política más restrictiva de biopsias limitada a la zona más sospechosa tras una inspección minuciosa con CE106. Para garantizar que la muestra sea suficiente para realizar estudios moleculares, la guía británica sobre calidad de la EDA recomienda obtener un mínimo de 6 biopsias, idealmente de diferentes zonas de la lesión4,107.
Opinión de expertoEl primer paso ante una lesión visible es una inspección óptica minuciosa con el objetivo de predecir la histología, delimitar los márgenes horizontales y estimar el riesgo de invasión submucosa profunda. Dicha valoración debe ser realizada por endoscopistas con experiencia en el diagnóstico, con endoscopios de alta definición utilizando CE digital y con magnificación.
Existen varios metaanálisis que han demostrado la utilidad de M-NBI para diagnosticar y caracterizar el CGP. En nuestro medio, disponer de gastroscopios que integren magnificación, en especial en los centros en los que se realicen técnicas avanzadas de resección de CGP, queda respaldado por la evidencia científica.
La toma de biopsias en las lesiones visibles siempre es necesaria, bien para confirmar el origen neoplásico y no inflamatorio de las lesiones susceptibles de tratamiento endoscópico, o bien para realizar un diagnóstico histológico preciso cuando la lesión infiltra la submucosa profunda y se descarta el tratamiento endoscópico. En los casos con alta sospecha de malignidad por la presencia de las características descritas (patrón microvascular y/o superficial irregulares en el interior de una línea de demarcación) y con biopsias negativas para displasia o cáncer, es necesaria una nueva evaluación endoscópica e histológica de la lesión.
- 12.
¿Qué técnica de resección endoscópica se recomienda?
Se recomienda la disección endoscópica submucosa como técnica de resección de elección.
Calidad de la evidencia: baja. Grado de recomendación: débil a favor.
Acuerdo: 4,3.
La resección endoscópica mucosa puede ser una alternativa válida para lesiones de pequeño tamaño (<10mm) con bajo riesgo de invasión submucosa.
Calidad de la evidencia: baja. Grado de recomendación: débil a favor.
Acuerdo: 4,6.
EvidenciaResultados de un metaanálisis muestran que la infraestimación de la displasia en las biopsias es frecuente, y hasta un tercio de las lesiones son diagnosticadas de displasia de alto grado o carcinoma invasivo tras la extirpación108. Por ello, las guías recomiendan la resección endoscópica de las lesiones visibles ya sea con técnica de resección mucosa endoscópica (RME) o DSE. La RME y la DSE no han sido comparadas en ECA. Numerosos estudios observacionales sintetizados en cuatro metaanálisis coinciden en que la DSE consigue un mayor porcentaje de resección en bloque, resección R0 y un menor porcentaje de recurrencia. En contrapartida, la DSE se asocia a un mayor tiempo del procedimiento y a un incremento del riesgo de perforación, sin que se hayan detectado diferencias significativas en el riesgo de hemorragia tras el procedimiento ni en la supervivencia global109-112. Aunque la mayoría de estudios son de origen asiático, ya se dispone de series prospectivas europeas que obtienen resultados equiparables113,114. En lesiones <10mm con bajo riesgo de invasión profunda, las ventajas de la DSE sobre la RME no han sido firmemente establecidas, por lo que actualmente las guías de práctica clínica de la ESGE y la JGES aceptan a la RME como una alternativa válida102,103.
No existen ECA que comparen la extirpación endoscópica del CG precoz frente al tratamiento quirúrgico. La evidencia disponible proviene de estudios observacionales, en su mayoría unicéntricos y retrospectivos. En el año 2015 se publica un metaanálisis que analiza 11 cohortes retrospectivas con 2.654 pacientes. El tratamiento endoscópico se asoció a una menor morbilidad, sin que se detectaran diferencias estadísticamente significativas en términos de mortalidad periprocedimiento, recurrencia local y supervivencia a 5años115. En el año 2019 se han publicado tres metaanálisis que indican que la DSE se asocia a una menor morbilidad, sin diferencias significativas en términos de supervivencia global, aunque el tratamiento endoscópico se asoció a una mayor recurrencia local116-118. No obstante, con una vigilancia adecuada, la gran mayoría de las recurrencias pueden ser tratadas con intención curativa119.
Opinión de expertoEl tratamiento endoscópico obtiene resultados de curación oncológica similares a la cirugía con una menor morbilidad. Es fundamental tener en cuenta el sesgo de selección en la interpretación de los resultados a favor de la RME frente a la DSE en términos de seguridad, ya que las lesiones tratadas con RME suelen ser de menor tamaño y complejidad. Además, la mayoría de las perforaciones durante la DSE pueden ser tratadas endoscópicamente y no requieren tratamiento quirúrgico. Por último, la DSE es una técnica compleja con una curva de aprendizaje larga, por lo que para su implementación es necesaria una adecuada formación siguiendo las recomendaciones de las principales sociedades científicas6,103,120,121. Según la ESGE, tras un período de entrenamiento que implica la observación de casos realizados por expertos y la implicación como asistente de dichos expertos en la práctica clínica, se debe pasar a realizar aprendizaje guiado en modelo animal. Finalmente, se realizarán casos de escasa dificultad, supervisado, en la práctica clínica. Para mantener un nivel de experiencia suficiente, la recomendación de esta Sociedad es realizar >25DSE/año, independientemente del órgano en que se lleve a cabo la técnica122.
ConclusionesEste documento de posicionamiento sobre la calidad de la EDA para la detección y vigilancia de las LPCG es el resultado del trabajo de un grupo de expertos gastroenterólogos, endoscopistas y patólogos que han intentado dar su punto de vista basándose en el conocimiento actual. Aunque la evidencia en muchas de las preguntas planteadas es baja, se ha conseguido dar una serie de recomendaciones que permitirán mejorar la calidad de la EDA y, por consiguiente, mejorar la capacidad para diagnosticar LPCG en nuestro medio, así como estandarizar su manejo y seguimiento.
FinanciaciónEste documento de posicionamiento no ha contado con financiación externa.
Glòria Fernández Esparrach ha recibido financiación del Instituto de Salud CarlosIII a través del proyecto PI17/00894 (cofinanciado por el Fondo Europeo de Desarrollo Regional «Una manera de hacer Europa»/«Invirtiendo en tu futuro»).
Joaquín Cubiella ha recibido financiación del Instituto de Salud CarlosIII a través del proyecto PI17/00837 (cofinanciado por el Fondo Europeo de Desarrollo Regional «Una manera de hacer Europa»/«Invirtiendo en tu futuro»).
Conflicto de interesesGlòria Fernández-Esparrach ha recibido honorarios por reuniones de asesoramiento de CDx Diagnostics y por organización de cursos de Olympus y Norgine.
José Carlos Marín-Gabriel ha recibido honorarios por conferencias de Olympus, Norgine y Casen Recordati.
Xavier Calvet ha recibido becas para investigación de Abott, MSD y Vifor; honorarios por reuniones de asesoramiento de Abott, MSD, Takeda, Pfizer, Janssen y VIFOR, y ha dado conferencias para Abott, MSD, Janssen, Pfizer, Takeda y Allergan.
El resto de autores no declaran conflicto de intereses.