DISFUNCIÓN VENTRICULAR DIASTÓLICA IZQUIERDA
El incremento de la rigidez y del grosor del ventrículo izquierdo y su escasa relajación constituyen el principal punto de convergencia fisiopatológica de ciertos procesos patológicos, tales como la miocardiopatía hipertrófica y las enfermedades restrictivas cardíacas. Sin embargo, las anomalías en la función diastólica también pueden limitar la función cardíaca y expresarse clínicamente en pacientes con insuficiencia cardíaca congestiva en fase dilatada, tanto en aquellos que presentan una fracción de eyección conservada como en los que la tienen disminuida. En la disfunción diastólica aislada del ventrículo izquierdo, la velocidad de llenado ventricular se encuentra alterada, en tanto que está conservada la capacidad de eyección o capacidad expulsiva del ventrículo izquierdo (función sistólica normal). Esta situación puede preceder a la disfunción sistólica ventricular izquierda, en la cual la capacidad de vaciamiento ventricular es reducida y se acompaña del incremento del volumen diastólico (especialmente con reducciones de la fracción de eyección hasta cifras inferiores al 45%).
La disfunción diastólica implica en su concepto un cambio en la propiedad del miocardio que consiste en la pérdida de la capacidad del ventrículo izquierdo para gestionar un volumen diastólico adecuado ya sea en reposo o durante el ejercicio, a pesar de mantener presiones de llenado en el límite normal. En la diástole, la «succión ventricular», que es consecuencia de la propiedad elástica activa (elastic recoil) del miocardio, determina un llenado ventricular rápido en la fase rápida de la diástole. Una reducción de la propiedad elástica ventricular da lugar a un incremento del volumen de sangre en la aurícula izquierda y, en consecuencia, en los capilares pulmonares. Por tanto, el gradiente de presión transmitral está aumentado y la contribución auricular al llenado ventricular aumenta en un intento de restablecer un adecuado volumen diastólico ventricular.
La reducción de la distensibilidad del ventrículo izquierdo es un factor que contribuye al desarrollo de la disfunción diastólica. Entre los mecanismos posibles de relajación alterada cabe destacar el incremento del grosor de la pared ventricular, posiblemente secundario a hipertrofia y/o fibrosis1.
ASPECTOS FISIOLÓGICOS DE LA DIÁSTOLE
El desplazamiento del calcio al interior de la célula representa el elemento crucial en el mecanismo de la contracción del miocardiocito. El calcio entra en la célula miocárdica por medio de los canales del calcio de la membrana plasmática. Una vez dentro del citoplasma, es almacenado y luego liberado por el retículo sarcoplásmico, lo que da lugar al entrecruzamiento de los filamentos de actina y de miosina; entonces se produce la contracción celular.
La diástole es un fenómeno activo. Requiere un gasto energético durante el cual la relajación ventricular se sigue de un llenado ventricular eficiente, capaz de activar la sístole siguiente, como se describe en la ley de Frank-Starling. En otras palabras, la relajación es el proceso que determina una rápida desaparición de la tensión muscular que se había desarrollado durante la sístole y que tiene como objetivo conseguir el llenado ventricular a menor presión.
El proceso de relajación está constituido por un componente activo y por uno pasivo. El primero depende principalmente de la salida del calcio de los microfilamentos y del citosol, gran parte del cual regresa al retículo sarcoplásmico. El proceso requiere energía y, por lo tanto, consume adenosintrifosfato. El calcio también puede trasladarse al exterior de la célula muscular por medio del intercambiador sodio-calcio.
En la relajación participa también un componente pasivo. Durante la contracción las proteínas estructurales dentro de la célula muscular están comprimidas, mientras los filamentos de actina/miosina se acortan. Tan pronto como la presión sistólica de estos filamentos disminuye, estas proteínas retornan a la posición precedente, con lo que se desarrolla un proceso conocido como elastic recoil o restitución de las fuerzas.
La diástole puede subdividirse en 4 fases: a) relajación isovolumétrica; b) llenado precoz; d) diastasis, y d) llenado tardío, este último debido a la contracción auricular. La fase de relajación isovolumétrica, durante la cual el volumen del ventrículo no se modifica, transcurre desde el cierre de la válvula aórtica hasta la apertura de la válvula mitral. La fase de llenado precoz se inicia después de la apertura de la válvula mitral y se ve favorecida por las propiedades elásticas de la pared ventricular y por el gradiente generado entre la aurícula y el ventrículo izquierdos. Cuando se alcanza el equilibrio de presión entre las 2 cavidades izquierdas, comienza la fase de diastasis, durante la cual el flujo ventricular decrece notablemente. La sístole auricular restituye el gradiente de presión entre las 2 cavidades cardíacas, con lo que se cumple el llamado atrial-kick o fase de llenado ventricular tardío2 (tabla I).
DETERMINACIÓN DE LA FUNCIÓN DIASTÓLICA
La ecocardiografía Doppler, mediante el análisis de la velocidad del flujo transmitral, es una técnica estándar que permite el registro y el estudio del espectro del desplazamiento miocárdico durante el ciclo cardíaco. Se ha propuesto para la evaluación de la función ventricular izquierda sistólica y diastólica. Durante la fase precoz de la diástole, la presión del ventrículo izquierdo normalmente es inferior a la de la aurícula izquierda, con lo que se genera un incremento de la velocidad del flujo sanguíneo transmitral (onda E). Durante la fase media de la diástole, el flujo sanguíneo se desacelera cuando se ha obtenido el equilibrio de presión. La contracción auricular durante la fase tardía de la diástole causa la aceleración del flujo transmitral hasta un segundo pico (onda A), normalmente de menor amplitud que la onda E. La velocidad diastólica tardía (onda A) corresponde a la sístole auricular. El análisis Doppler de las velocidades absolutas de las ondas E y A, y la relación entre ellas (E/A), permite obtener otros parámetros derivados relativos a la función diastólica, tales como el tiempo de aceleración de la onda E, tiempo de desaceleración (TD) de la onda E y el tiempo de relajación isovolumétrico (TRIV). En sujetos sanos de mediana edad el perfil transmitral normal está representado por una relación E/A superior a 1 y un TD inferior a 200 ms3.
La ecocardiografía ofrece además información útil sobre la estructura cardíaca. Un miocardio con mayor grosor normalmente implica un ventrículo de mayor rigidez. Con la ecocardiografía, además, es posible determinar el grosor de la pared ventricular mediante la suma del grosor de la pared posterior más el grosor del septo interventricular (grosor de la pared del ventrículo izquierdo). En este sentido, un incremento del TRIV y una deceleración de la onda E, con el consiguiente aumento de la relación E/A, indican una dificultad de llenado del ventrículo izquierdo o bien un incremento del grosor ventricular. Por lo tanto, un mayor grosor ventricular podría implicar que la mayor rigidez es debida a la hipertrofia miocárdica4 (fig. 1).
Fig. 1. Disfunción diastólica y ejemplo de perfil Doppler transmitral patológico.
Es importante considerar, a efectos de una apropiada interpretación de las modificaciones del perfil del flujo transmitral, el efecto de la edad sobre la velocidad del influjo.
En el Framingham Heart Study, que analizaba los índices Doppler del ventrículo izquierdo en sujetos normales, Benjamin et al5 observaron que con el aumento de edad el pico de la onda E disminuía, la velocidad de la onda A aumentaba y, por lo tanto, se producía una disminución de la relación E/A. En consecuencia, una relación E/A inferior a 1 podría indicar una situación clínica patológica en un paciente de 40 años, mientras que constituye un resultado esperado para un sujeto normal de 70 años6 (tabla II).
SITUACIONES CLÍNICAS CON FUNCIÓN DIASTÓLICA ALTERADA
Entre las situaciones fisiológicas y clínicas que típicamente afectan a la relajación ventricular destacan el envejecimiento (presbicardia), la isquemia, la fibrosis miocárdica, la miocardiopatía diabética, las conectivopatías y la hipertrofia concéntrica ventricular izquierda.
En estos últimos años, sin embargo, se han ido acumulando evidencias de que la disfunción diastólica es una expresión clínica presente también en pacientes con cirrosis hepática, con independencia de su etiología. Este fenómeno representa sólo una parte del espectro de las anormalidades cardíacas observadas en pacientes con cirrosis hepática, que actualmente se conoce con el término de «miocardiopatía cirrótica»7.
DISFUNCIÓN DIASTÓLICA EN LA CIRROSIS
A pesar de los numerosos estudios hemodinámicos y ecocardiográficos que han investigado extensamente la función sistólica en reposo y tras esfuerzo en pacientes cirróticos durante los diferentes estadios de la enfermedad8,9, sólo recientemente se está prestando atención al problema de la disfunción diastólica en esta enfermedad.
En las fases precoces de las enfermedades cardíacas, las anormalidades diastólicas preceden a las alteraciones sistólicas. Algunos autores han descrito cambios en el llenado del ventrículo izquierdo asociados a un incremento del grosor de la pared ventricular en pacientes cirróticos con y sin ascitis. El típico perfil de disfunción diastólica está constituido por una reducción del pico de la onda E con un aumento de la contribución auricular en el llenado ventricular (onda A), y la reducción en la relación E/A. Los hallazgos ecocardiográficos de este tipo en pacientes cirróticos indican claramente la presencia de una disfunción diastólica en esta enfermedad. Se ha observado que esta alteración es más acentuada en los pacientes que presentan ascitis. Entre los factores que se han involucrado en la patogenia de la disfunción diastólica de la cirrosis destaca el incremento de la presión intratorácica secundaria a la elevación diafragmática por acumulación de líquido en la cavidad peritoneal. Sin embargo, la demostración de que esta alteración también se observa en ausencia de ascitis apunta a la intervención de factores no mecánicos, entre los que se han propuesto factores neurohumorales, óxido nítrico, factor de necrosis tumoral alfa, expansión del volumen circulante, endotoxinas, ácidos biliares y disfunción de los receptores betaadrenérgicos.
En un estudio de Pozzi et al10, en pacientes cirróticos se comprobó una clara alteración de la función diastólica del ventrículo izquierdo asociada a un aumento del grosor parietal ventricular. La función sistólica estaba preservada. Estos hallazgos eran independientes de la presencia de ascitis. No obstante, en los pacientes con ascitis a tensión, la velocidad de la onda A estaba intensamente aumentada, la relación E/A notablemente reducida y el TD de la onda E, muy aumentado. La extracción rápida del líquido ascítico por paracentesis total se asoció a una reducción de la velocidad de la onda A y a un incremento de la relación E/A, hasta cifras similares a las de los pacientes sin ascitis, pero aún distintas de las de los controles sanos. A tenor de estos datos, es improbable que la disfunción diastólica de la cirrosis sea consecuencia de los efectos tóxicos inducidos por el etanol en el músculo cardíaco o que esté en relación con la presencia de ascitis. Para investigar si la toxicidad inducida por el etanol era la causante de las alteraciones en la función y estructura cardíacas en los pacientes cirróticos con y sin ascitis, se analizaron por separado los datos del grupo de pacientes con cirrosis de etiología alcohólica y el de aquéllos con cirrosis posvírica. El grosor de la pared del ventrículo izquierdo y la relación E/A eran similares en ambos grupos (0,94 ± 0,23 frente a 0,94 ± 0,19, respectivamente). No obstante, considerando que la función cardíaca en los pacientes alcohólicos se normaliza tras una abstinencia de 6 meses y que los datos de este análisis en ambos grupos se obtuvieron tras un largo período de abstinencia, su interpretación es difícil. Finalmente, otro aspecto importante es que la miocardiopatía alcohólica se caracteriza por la dilatación ventricular asociada a una notable reducción de la función sistólica, hecho no observado en los pacientes cirróticos estudiados. De acuerdo con estos datos, los autores señalan que un factor importante en la reducción de la relación E/A en la cirrosis hepática es el incremento del grosor de la pared del ventrículo izquierdo.
Estudios autópsicos recientes han evidenciado la existencia de alteraciones cardíacas en la cirrosis, entre ellas hipertrofia miocárdica, edema del miocardiocito, fibrosis, vacuolización nuclear y exudación. Dado que la mayor parte de estas observaciones se obtuvieron en pacientes con cirrosis alcohólica y en una época en la que se desconocía la etiología vírica (sobre todo el virus de la hepatitis C), se dedujo que tales anomalías cardíacas eran secundarias a miocardiopatía alcohólica latente o manifiesta. Lunseth et al11 han observado en un estudio autópsico que los estadios precoces o moderados de la cirrosis hepática parecían presentar una hipertrofia miocárdica más evidente que en fases más avanzadas de la enfermedad, independientemente de la etiología de la enfermedad. Estos resultados aparentemente paradójicos encuentran confirmación en el estudio de Pozzi et al y en el de otros autores (tabla III)12-16. Se ha propuesto que en los pacientes ascíticos el uso crónico del tratamiento antialdosterónico podría ejercer un efecto protector a través de diversos mecanismos, entre ellos una contracción del volumen circulante, la remodelación cardíaca, la inhibición de la captación de noradrenalina y de la posible hiperplasia tisular.
En otro estudio en el que se evaluaba mediante ecocardiografía la disfunción diastólica del ventrículo izquierdo en 42 pacientes (edad media: 59 años) con cirrosis hepática (en la mitad de los casos de etiología alcohólica, clases B-C de la clasificación de Child-Pugh), Finucci et al17 demostraron un aumento del volumen de eyección sistólico, del volumen telediastólico izquierdo, del volumen auricular izquierdo, del pico de velocidad de la onda A y del TD de la onda E y una disminución de la relación E/A (1,02 frente a 1,22). Contrariamente a lo observado por Pozzi et al, en este estudio la relación E/A era mayor y el TD resultaba más corto en pacientes con ascitis intensa que en pacientes con escasa ascitis o sin ella (seudonormalización). El incremento del volumen auricular izquierdo y del volumen telediastólico del ventrículo izquierdo constituye la expresión clínica del aumento de la precarga; de este modo se excluye que la reducción en la poscarga sea un factor causal de la reducción de la relación E/A observada. Los autores interpretan que las alteraciones diastólicas en los pacientes con ascitis a tensión se deben a la compresión mecánica que ejerce la gran acumulación de líquido ascítico. Este estudio, sin embargo, no proporciona ningún dato relativo al grosor de la pared del ventrículo izquierdo. Al igual que Pozzi et al, Finucci et al no observaron diferencias en los parámetros del llenado diastólico transmitral en función de la etiología de la cirrosis.
Wong et al12 han examinado la relación existente entre la estructura cardíaca, anormalidades funcionales y la retención renal de sodio en pacientes cirróticos. En el estudio se incluyó a 35 pacientes con cirrosis y una edad media de 52 años, 16 en fase preascítica y la mayor parte con cirrosis alcohólica. Se realizaron a toda la muestra una angiografía usando radioisótopos para examinar la función sistólica y ecocardiografía para el estudio de la fun ción diastólica. El estudio confirmaba un incremento del diámetro diastólico de la aurícula izquierda, una fracción de eyección normal con valores más altos en pacientes preascíticos y, ciertamente, alteración de los parámetros de la función diastólica.
A diferencia de lo observado por Finucci et al y confirmando parcialmente los resultados de Pozzi et al, en este estudio el TRIV era más prolongado en los pacientes cirróticos, independientemente de la presencia de ascitis, con una reducción significativa de la relación E/A sólo en los pacientes ascíticos. El grosor del septo interventricular y de la pared posterior de ventrículo izquierdo estaba aumentado en todos los pacientes. Los autores señalaron que los pacientes ascíticos presentaban un mayor grosor de la pared ventricular izquierda y una relación E/A reducida, lo que indicaría una mayor resistencia al retorno venoso en relación con lo observado en pacientes preascíticos. Se comprobó, además, que en los pacientes ascíticos el aumento de la fracción de eyección en realidad se debía a la relación existente entre la reducción del volumen de eyección sistólica y la reducción del volumen telediastólico. Se demostraba que los pacientes con cirrosis descompensada presentaban una disminución de la precarga y la poscarga (reducción de las resistencias vasculares periféricas), además de una contractilidad ventricular anormal que determinaba un indecuado volumen de eyección sistólica. La eyección sistólica cardíaca se mantenía gracias a un incremento de la frecuencia cardíaca. Por el contrario, los pacientes preascíticos presentaban una eyección sistólica adecuada en relación con la precarga, que se encontraba preservada o discretamente aumentada. Estas variaciones cardiovasculares podrían participar en la patogenia de la circulación hiperdinámica y de la retención de sodio que se producen en la cirrosis en estadios avanzados.
En otro estudio del mismo grupo13 se correlaciona la disfunción diastólica de la cirrosis con las concentraciones plasmáticas del fragmento N terminal del péptido natriurético atrial un producto de clivaje del péptido natriurético auricular (ANP) y del péptido natriurético cerebral (BNP). Estos factores humorales se han propuesto como marcadores sensibles de enfermedad cardíaca en estadios precoces. El BNP se sintetiza en su mayor parte en los miocitos del ventrículo izquierdo en respuesta a sobrecargas de volumen o a un aumento de la presión telediastólica, mientras que el ANP se sintetiza fundamentalmente en la aurícula izquierda y su aumento refleja un incremento de la presión auricular. Aunque antes de iniciar este estudio se interrumpió el tratamiento con fármacos vasodilatadores y diuréticos, no es posible asegurar que el uso previo de agentes bloqueadores beta o de espironolactona no influyó en los resultados relativos a la estructura y la función miocárdicas. Se observó un incremento significativo del grosor del septo interventricular en cirróticos con y sin ascitis en comparación con controles sanos, pero no se apreciaron diferencias en el grosor de la pared posterior del ventrículo izquierdo entre estos 3 grupos. La relación E/A estaba reducida en los pacientes cirróticos (1,19 en cirróticos preascíticos; 1,18 en pacientes ascíticos; 1,4 en los controles). Sin embargo, estas diferencias no fueron estadísticamente significativas. El TRIV estaba prolongado y el TD significativamente aumentado. Además, en este estudio los parámetros de llenado diastólico estaban alterados. Se observó asimismo un relajamiento del ventrículo izquierdo más lento y un llenado ventricular inadecuado, asociado a un aumento del grosor de las paredes ventriculares. El BNP y el fragmento N-terminal del ANP se encontraban aumentados en todos los pacientes ascíticos. A pesar de que los pacientes preascíticos considerados como grupo no mostraban incrementos significativos en los valores del BNP, un subanálisis ha revelado que en realidad en dicho grupo la mitad de los pacientes presentaban incrementos en las concentraciones de BNP. Los títulos plasmáticos de BNP se correlacionaban con algunos parámetros de disfunción diastólica. Dado que el BNP es un marcador temprano de disfunción ventricular, cabría pensar que sólo algunos de los pacientes no ascíticos presentan disfunción diastólica. La correlación entre el BNP y los índices de disfunción diastólica indica que este péptido es más sensible que el fragmento N-terminal del ANP como marcador de enfermedad cardíaca en la cirrosis. Estos hechos y la falta de síntomas clínicos (en la mayor parte, consecuencia de los efectos protectores de la disminución de la resistencia vascular periférica) justifican probablemente la adopción del BNP, junto a los parámetros ecocardiográficos de disfunción diastólica, en el diagnóstico de la disfunción cardíaca en la cirrosis.
Parcialmente divergentes son los resultados de Valeriano et al14, al menos en lo que concierne a los pacientes ascíticos. En un estudio, los autores evaluaron a 40 pacientes con cirrosis, 20 sin ascitis y 20 con ascitis moderada o grave, que necesitaban dosis significativas de furosemida y/o antialdosterónicos antes de la determinación de los parámetros ecocardiográficos. En el 60% de los pacientes la cirrosis era de etiología no alcohólica. La relación E/A se hallaba significativamente reducida en pacientes ascíticos, pero era normal en los preascíticos. Los autores, al no encontrar diferencias de grosor en las paredes ventriculares, recalcan el protagonismo de los factores mecánicos (presión intratorácica aumentada y sobreelevación diafragmática) secundarios a la presencia de ascitis en la falta de una adecuada relajación ventricular. Debería considerarse la posible relación de estos resultados con la administración crónica de antialdosterónicos y, por tanto, en futuros estudios debería establecerse el papel potencial del bloqueo crónico de la aldosterona en la remodelación cardíaca en la cirrosis.
FISIOPATOLOGÍA DE LA DISFUNCIÓN DIASTÓLICA EN LA CIRROSIS
Dado que la principal anomalía que conduce a la disfunción diastólica en la cirrosis parece ser el incremento de la masa cardíaca, la fisiopatología subyacente es una hipertrofia ventricular. La hipertrofia cardíaca se debe a un aumento de tamaño del miocardiocito. La remodelación estructural cardíaca es consecuencia de un aumento de depósito de colágeno en el intersticio. Esto determina una mayor rigidez miocárdica y, en consecuencia, una alteración en la contractilidad, relajación y conductibilidad. Estudios experimentales18 han demostrado que el crecimiento del miocito está estrechamente relacionado con la carga ventricular, tanto de presión como de volumen. En el curso de la cirrosis, la hipertrofia y el incremento del grosor del miocardio pueden representar una respuesta adaptativa a una expansión crónica del volumen circulante debida a la retención de sodio y agua. Dicha retención comienza en la fase preascítica de la enfermedad y progresivamente se hace más intensa, a pesar del deterioro de la enfermedad hepática. Por otro lado, el crecimiento del miocito podría ser secundario a los efectos tróficos de varios sistemas hormonales sobre el miocardio. Por el contrario, el depósito anómalo de colágeno, expresión de una síntesis aumentada, se ve además influido por la elevación neurohormonal, con independencia de variaciones hemodinámicas. Las hormonas que participan en la fibrogenia cardíaca son los sistemas renina-angiostensina-aldosterona y nervioso simpático. De hecho, se ha obser-vado fibrosis miocárdica en presencia de elevadas concentraciones plasmáticas de angiotensina II y aldosterona. Por otro lado, existen evidencias de regresión de la fibrosis tras la administración prolongada de antagonistas de la angiotensina II o de antialdosterónicos, con independencia de variaciones hemodinámicas19.
Más recientemente, De et al15 han estudiado el papel de la hipertensión portal en la fisiopatología de la disfunción diastólica. Estos autores examinaron a un grupo de pacientes cirróticos jóvenes (20-40 años) con o sin ascitis, así como a pacientes con características similares a los incluidos en los estudios citados previamente. En este estudio se incluyó también a sujetos con fibrosis portal no cirrótica y con hipertensión portal idiopática (un modelo humano de hipertensión portal presinusoidal con función hepatocelular normal, que no es infrecuente en la India), al fin de poder determinar con mayor precisión el papel de la hipertensión portal en ausencia de disfunción hepática. Debe subrayarse que ningún paciente recibía antialdosterónicos antes del estudio. Los resultados de éste confirmaron la presencia de disfunción diastólica: la relación E/A estaba intensamente reducida en los pacientes cirróticos ascíticos. Sin embargo, los pacientes con fibrosis portal no cirrótica también presentaban evidencias de disfunción diastólica caracterizada por reducción del cociente E/A y un TD de la onda E prolongado. La masa ventricular izquierda estaba aumentada en todos los pacientes en relación con los controles, y era mayor en los pacientes cirróticos. El diámetro de la aurícula izquierda estaba muy aumentado en pacientes ascíticos. En pacientes con hipertensión portal no cirrótica la alteración en el relajamiento ventricular observado era similar a la observada en pacientes cirróticos, lo que subrayaría el papel de la hipertensión portal en la patogenia de las alteraciones funcionales y estructurales del corazón. Es importante resaltar que existió una correlación inversa entre las concentraciones plasmáticas de aldosterona y la relación E/A en pacientes cirróticos, lo que induce a pensar que la hipertensión portal puede actuar a través de la hiperactividad del sistema renina-angiotensina-aldosterona.
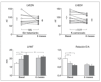
En un estudio reciente Pozzi et al16 han confirmado la existencia de un tráfico nervioso simpático muscular incrementado mediante técnicas microneurográficas, un aumento del grosor de la pared ventricular izquierda y una reducción de la relación E/A en un grupo seleccionado de pacientes con cirrosis posvírica en estadio A de Child-Pugh (edad media: 58 años), pequeñas varices esofágicas e hipertensión portal clínicamente significativa. En estos pacientes, a quienes se había inducido un bloqueo de la aldosterona mediante la administración de canrenoato de potasio, se observó un descenso moderado del gradiente de presión venosa hepática, así como una reducción sirelación con los controles no tratados. No se observó ningún cambio en la relación E/A (fig. 2).
Fig. 2. Efectos del tratamiento durante 6 meses con k-canrenoato (negro) frente a ningún tratamiento (gris) en pacientes con cirrosis e hipertensión portal (pequeñas varices esofágicas). Arriba: modificaciones en el volumen ventricular izquierdo (LVEDV). Abajo: variaciones en el grosor ventricular izquierdo (LVWT) y en el perfil Doppler transmitral (relación ondas E/A). NS: no significativo. *p < 0,05; **p < 0,01. (Tomada de Pozzi et al16.)
En un reciente estudio de La Villa et al20, cuyo objetivo fue examinar los efectos de la postura sobre las variables ecocardiográficas en un pequeño grupo de pacientes con cirrosis posvírica en fase preascítica (edad media: 61 años) y varices esofágicas pequeñas, se observó una disminución de la relación E/A respecto a los sujetos controles. El tratamiento con canrenona, otro antagonista de la aldosterona, reducía el volumen plasmático y mejoraba la respuesta cardíaca alterada a los cambios posturales. Sin embargo, no se observaban mejorías en la función diastólica.
SIGNIFICADO CLÍNICO DE LA DISFUNCIÓN DIASTÓLICA EN LA CIRROSIS
A pesar del reconocimiento de la miocardiopatía cirrótica, se ha cuestionado su significado clínico, dada la infrecuencia de descompensación cardíaca en la cirrosis. Sin embargo, existen distintas evidencias de una reducida reserva funcional cardíaca en la cirrosis, especialmente en respuesta al estrés. Muchos pacientes presentan astenia, que puede ser secundaria a la reducida capacidad de adaptación cardíaca al ejercicio, como consecuencia de la miocardiopatía cirrótica. La astenia crónica y la incapacidad de trabajar influyen en la calidad de vida del paciente. Además, existen casos esporádicos de muerte súbita debido a la descompensación cardíaca después del trasplante de hígado, tras la derivación portosistémica intrahepática transyugular o tras la realización de derivaciones portocava quirúrgicas, procedimientos actualmente utilizados para tratar las complicaciones de la cirrosis y de la insuficiencia hepática21. Cada uno de estos procedimientos determina un aumento imprevisto de la precarga a un corazón rígido y con la capacidad de relajación alterada. En algunos pacientes cirróticos, la disfunción diastólica podría ser suficiente para determinar edema pulmonar y descompensación cardíaca. En este sentido, Huonker et al22 han evidenciado un aumento del 200% en las presiones de la arteria pulmonar y de las cavidades derechas del corazón 9 h después de la derivación portocava intrahepática por vía transyugular. Por lo tanto, este incremento de las presiones se debe a la aumentada precarga en presencia de disfunción diastólica.
En conclusión, la cardiomiopatía cirrótica no representa simplemente una curiosidad médica, sino que es una entidad clínica que merece investigaciones futuras destinadas a una mejor definición de su fisiopatología. Una vez aclarados los mecanismos patogénicos, serán necesarios estudios a largo plazo para identificar potenciales tratamientos y verificar sus beneficios clínicos.