El hígado es un órgano privilegiado, con una menor incidencia de rechazo que otros órganos trasplantados. Sin embargo, los regímenes inmunosupresores siguen siendo necesarios para controlar la respuesta de los linfocitos alorreactivos después del trasplante. Estos tratamientos pueden dar lugar a complicaciones severas, como infecciones, cáncer, enfermedades cardiovasculares e insuficiencia renal crónica. En el trasplante clínico existe una evidencia cada vez mayor de que algunos pacientes con trasplante hepático (TH) en los que se retira la inmunosupresión (IS) mantienen una función hepática normal, lo cual indica la posibilidad de la existencia de tolerancia. Esta estrategia es posible hasta en un 25-33% de los receptores de un TH. Una serie de observaciones experimentales y clínicas indican que los injertos hepáticos pueden tener propiedades «tolerogénicas» para otros órganos. En el ámbito clínico la tolerancia clínica operacional (TCO) se define como la ausencia de rechazo agudo o crónico y la supervivencia del injerto con función e histología normales, en un paciente inmunocompetente sin IS, generalmente después de la retirada exitosa de IS. Los mecanismos exactos involucrados en la tolerancia son todavía desconocidos, aunque los estudios en modelos animales indican una posible acción de las células T reguladoras (Treg). Datos recientes han demostrado un aumento de la frecuencia de células T CD4+ CD25high y de la expresión de FoxP3 durante la retirada de IS en los pacientes tolerantes con TH. Los datos obtenidos del estudio del perfil transcripcional en sangre periférica en los pacientes con TH sin IS señalan que existe una huella de tolerancia, que podría utilizarse para identificar los receptores de TH tolerantes y que las células del sistema inmune innato parecen tener un papel importante en el mantenimiento de la TCO después del TH.
The liver is a privileged organ and has a lower incidence of rejection than other organs. However, immunosuppressive regimens are still required to control the alloreactive T-lymphocyte response after transplantation. These treatments may lead to severe complications, such as infectious diseases, cancers, cardiovascular diseases and chronic renal insufficiency. In clinical transplantation there is increasing evidence that some liver transplant recipients who cease taking immunosuppressive (IS) drugs maintain allograft function, suggesting that tolerance is already present. This strategy is feasible in 25–33% of liver transplant recipients. A series of experimental and clinical observations indicates that liver allografts can even provide “tolerogenic” properties for other organ grafts. In the clinical setting, clinical operational tolerance (COT) is defined as the absence of acute and chronic rejection and graft survival with normal function and histology in an IS-free, fully immunocompetent host, usually as an end result of a successful attempt at IS withdrawal. The exact mechanisms involved in achieving transplant tolerance remain unknown, although animal models suggest a possible role for regulatory T cells (Treg). Recent data have demonstrated an increase in the frequency of CD4+ CD25high T cells and FoxP3 transcripts during IS withdrawal in operationally tolerant liver transplant recipients. The data obtained from transcriptional profiling of the peripheral blood of IS-free liver transplant recipients suggest that there is a molecular signature of tolerance that could be employed to identify tolerant liver transplant recipients and that innate immune cells are likely to play a major role in the maintenance of COT after liver transplantation.
El trasplante hepático (TH) es el tratamiento más eficaz de las enfermedades hepáticas agudas y crónicas de carácter irreversible, consiguiendo una supervivencia superior al 85 y 70% al año y a los 5 años, respectivamente1,2. Con la introducción de los nuevos fármacos inmunosupresores, como la ciclosporina (Cs) y el tacrolimus (TAC), la incidencia de rechazo agudo y crónico ha disminuido de forma considerable, permitiendo además una disminución en la utilización de los esteroides, evitando sus efectos secundarios. Sin embargo, la toxicidad asociada con el uso crónico de estos fármacos anticalcineurínicos es importante, condicionando la aparición de hipertensión arterial, hiperlipidemia, diabetes, insuficiencia renal y tumores de novo en los pacientes trasplantados3,4.
Es un hecho conocido que el TH alogénico en especies animales como el cerdo y entre ciertas combinaciones de ratas y ratones puede realizarse sin inmunosupresión (IS)5–7. Esta observación experimental en animales y la posibilidad de retirar completamente los fármacos inmunosupresores en grupos de pacientes seleccionados con TH8–12 permiten afirmar que el hígado es un órgano inmunológicamente privilegiado13, habiéndose comprobado que puede tolerarse tras el trasplante con menor inmunosupresión y que, en ocasiones, es posible retirar completamente los fármacos inmunosupresores sin daño histológico de rechazo, lo que se define como tolerancia clínica operacional (TCO)12,14.
Numerosos datos en experimentación animal15 apoyan la posibilidad de inducir tolerancia en pacientes sometidos a trasplante de órganos. Aunque la inducción de tolerancia sería el objetivo ideal, la heterogeneidad de combinaciones posibles entre donante y receptor, el estado inmune del receptor, la enfermedad de base del paciente trasplantado y las consecuencias imprevisibles de las infecciones hacen que una tolerancia estable sea extremadamente difícil de alcanzar en todos los pacientes16. Algunas experiencias en el ámbito del trasplante renal han obtenido un éxito parcial, pero a costa de requerir regímenes de condicionamiento inmunosupresor agresivos que limitan su aplicabilidad clínica17,18. En el ámbito del TH los estudios clínicos se han centrado en conocer los factores que favorecen o determinan la tolerancia espontánea o la tolerancia tras la retirada de los fármacos inmunosupresores.
Los mecanismos implicados en el rechazo y en la tolerancia de los órganos trasplantados son complejos y no bien conocidos, siendo actualmente los estudios de inmunotolerancia uno de los retos más importantes de investigación en el campo del trasplante. Diversos estudios han puesto de manifiesto el papel trascendente que tienen las células reguladoras del sistema inmune para determinar la aparición de tolerancia. Sin embargo, esta función no ha sido analizada hasta el momento actual, de forma prospectiva, en pacientes con TH ni en otro tipo de trasplantes de órganos o tejidos en humanos.
En el campo del TH, una línea de trabajo desarrollada para conocer cómo evitar la inmunosupresión ha sido la investigación de biomarcadores capaces de identificar la TCO. Dichos biomarcadores podrían ser la base de una guía que sirviera a los médicos implicados en el trasplante para retirar o minimizar la IS. Sin embargo, hasta el momento, ninguno de estos estudios de retirada de IS ha podido establecer una herramienta diagnóstica útil que identifique los pacientes con TCO.
En el contexto del TH clínico existen diversos motivos que confieren un gran interés al estudio de la TCO: a) es conocida la ausencia de consecuencias negativas del rechazo agudo precoz a largo plazo; b) la resolución espontánea, en ocasiones, de los episodios de rechazo sin necesidad de IS adicional; c) la extremada baja frecuencia de rechazo crónico; d) la posibilidad de retirar completamente la IS en algunos pacientes con TH sin que se produzca el rechazo del órgano, y e) la retirada de IS podría mejorar el perfil de complicaciones renales y cardiovasculares.
Pese al avance acontecido en los últimos años en TCO, sería necesario definir de forma controlada y prospectiva diversos aspectos que surgen como preguntas desde la cabecera del enfermo. Basándonos en la experiencia clínica y en el manejo de los pacientes con TH nos planteamos las siguientes cuestiones clínicas: 1) ¿Es posible retirar la IS en los pacientes con TH?; 2) ¿Es peligroso para el paciente someterle a un protocolo de retirada de IS?; 3) ¿Es beneficiosa para el paciente la retirada de IS?; 4) ¿Existe algún parámetro que permita reconocer durante el proceso de retirada de IS al grupo de pacientes en los que podremos completar la retirada de IS?; 5) ¿Es el quimerismo de células endoteliales hepáticas un fenómeno relacionado con la TCO?, y 6) ¿Qué papel tienen las células T reguladoras en el desarrollo de la TCO?
En este contexto nos proponemos revisar, en el ámbito del TH, los mecanismos básicos de la tolerancia, los datos sobre los protocolos de retirada de IS y los biomarcadores de tolerancia estudiados hasta el momento.
Definiciones de toleranciaDesde un punto de vista inmunológico la tolerancia es definida como un estado de no reactividad inmune frente a antígenos específicos y que se mantiene indefinidamente en ausencia de IS; es la llamada tolerancia inmunológica. En modelos experimentales, la tolerancia es inducida por terapias dirigidas a la producción de deleción de células T alorreactivas citotóxicas y/o hacia la generación de células T reguladoras. En estos modelos, los receptores con tolerancia a un órgano son capaces de aceptar un segundo injerto del mismo receptor sin IS, pero rechazan rápidamente injertos de terceros no relacionados. Además, en los animales tolerantes las células T tienen una baja respuesta frente al donante y, en modelos de tolerancia periférica, pueden transmitir la tolerancia cuando se inyectan dentro de huéspedes vírgenes. La tolerancia inmunológica es una demostración formal de la posibilidad de tolerancia en animales y es difícil de aplicar en la clínica. En el ámbito clínico se ha definido la tolerancia operacional19 o tolerancia clínica operacional (TCO)14 para designar aquella situación en la que existe función normal del injerto y ausencia de rechazo agudo o crónico en un paciente inmunocompetente, al que se le retiró completamente la inmunosupresión. Una situación real en la práctica clínica es la de pacientes con IS en dosis significativamente reducidas con buena función del injerto. Esta situación se define como tolerancia de mínima IS (Prope Tolerance o almost Tolerance)16 y generalmente puede seguir o no un tratamiento previo con IS deplecionante de linfocitos.
Bases experimentales del fenómeno de toleranciaEl concepto de tolerancia a los órganos trasplantados fue descrito por primera vez de forma experimental en 1953 por Billingham, Brent y Medawar20. En su artículo publicado en 1953 en la revista Nature, titulado «Activity acquired tolerance of foreing cells», los autores comienzan el artículo con la siguiente frase: «Los experimentos que se describirán en este artículo proporcionan una solución −en el presente solamente una solución “de laboratorio”− al problema de cómo conseguir que homoinjertos de tejidos sean inmunológicamente aceptables al huésped que normalmente reaccionaría contra ellos». En realidad, todo parte de la observación de Owen, que en 1945 publica en Science sus hallazgos en ganado bovino, donde estudiaba los grupos sanguíneos21. Cuando se producían partos dobles de gemelos dicigóticos, que comparten la circulación placentaria, cada gemelo compartía sangre del otro gemelo por intercambio de sangre durante la etapa fetal, produciéndose una quimera hematopoyética. Previamente, Medawar y Billingham habían observado que se toleraban los trasplantes de piel entre gemelos dicigóticos de vacuno. Esto tenía importancia en el ámbito de la agricultura, puesto que la hembra gemela dicigótica es habitualmente infértil (fenómeno freemartin). Medawar conoció los trabajos de Owen a raíz de una publicación de F.M. Burnet y F. Fenner en 1949 donde se nombra por primera vez el artículo de Owen y se acuña el término «tolerancia», distinguiendo entre el reconocimiento de lo propio (self-markers) y la respuesta a los antígenos extraños. Pero es Medawar en 1953 el que desarrolla los primeros trabajos en los que se induce tolerancia y que le valieron el Premio Nobel de Fisiología y Medicina en 1960, compartido con F.M. Burnet. La investigación, realizada por Ruppert Billingham, Lesli Brent y Peter Medawar, consistió en la inyección de una suspensión de células de testículo, riñón y bazo de una cepa de ratón adulto (A-line mouse) a una rata de la cepa CBA embarazada de 6 embriones. La inyección se realizó a los embriones, con una aguja hipodérmica hasta las membranas fetales a través del útero. Ocho semanas después de nacer los ratones, se les trasplantó piel de un donante adulto de la misma cepa A albino, y se observó tolerancia y supervivencia del injerto cutáneo a largo plazo en 3 de los 5 ratones trasplantados. Posteriormente, a dos de los ratones tolerantes se les inyectó por vía intraperitoneal una mezcla de fragmentos triturados de ganglios linfáticos de una misma cepa que ellos (CBA), que habían sido inmunizados previamente con piel de la cepa A. Los injertos cutáneos se rechazaron en 2-3 días después de haber sobrevivido normalmente durante 77 y 101 días. Los autores concluyeron:
- 1.
Los ratones nunca desarrollan, o lo hacen en grado limitado, el poder de reaccionar contra aloantígenos inoculados en la vida fetal. Los animales inoculados así no solamente son tolerantes a los antígenos inoculados, sino también a injertos de piel trasplantados en la vida adulta del mismo donante o de un donante de la misma constitución antigénica.
- 2.
La tolerancia inmunológicamente adquirida es específica. Los ratones tolerantes a un donante conservan la capacidad de reaccionar contra injertos de donantes con diferente constitución antigénica.
- 3.
La tolerancia adquirida es debida a una insuficiencia específica de la respuesta inmunológica y no depende de las propiedades del antígeno.
Este mismo grupo de investigadores describió que el rechazo primario de aloinjertos estaba mediado por linfocitos y así sentaron las bases inmunológicas del rechazo de los injertos. Tras el primer rechazo, un segundo injerto de piel del mismo haplotipo era rechazado de una forma más agresiva. Es decir, las células T sensibilizadas en la primera exposición al antígeno guardaban memoria inmunológica. Además, la transferencia de estas células a ratones naïve que nunca recibieron un injerto confería a estos la capacidad de rechazar de forma más rápida y eficiente. De esta manera, Medawar y su grupo demostraron que el componente hematopoyético era un elemento clave no sólo en la inducción de tolerancia, sino también la causa última del rechazo de órganos.
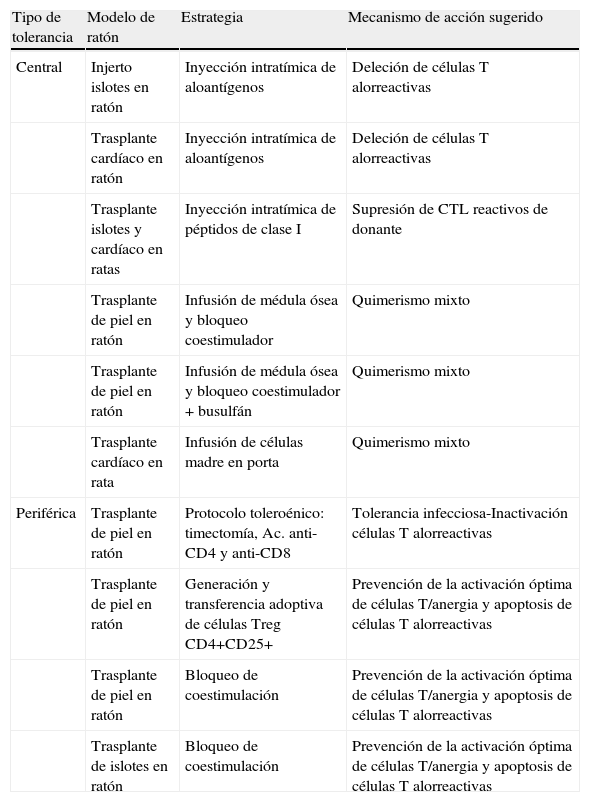
Los hallazgos del grupo de Medawar sirvieron para establecer modelos experimentales animales para la investigación en el campo de la tolerancia en el trasplante de órganos. Conforme progresaban estos estudios, el trasplante de órganos iba pasando de ser un hecho experimental a ser una opción terapéutica real. Estos modelos animales han explorado distintos aspectos relacionados con el rechazo y la tolerancia que se resumen en la tabla 122.
Estrategias de inducción de tolerancia en modelos de ratón (adaptada de Kingsley ChI et al, ref. 15).
| Tipo de tolerancia | Modelo de ratón | Estrategia | Mecanismo de acción sugerido |
| Central | Injerto islotes en ratón | Inyección intratímica de aloantígenos | Deleción de células T alorreactivas |
| Trasplante cardíaco en ratón | Inyección intratímica de aloantígenos | Deleción de células T alorreactivas | |
| Trasplante islotes y cardíaco en ratas | Inyección intratímica de péptidos de clase I | Supresión de CTL reactivos de donante | |
| Trasplante de piel en ratón | Infusión de médula ósea y bloqueo coestimulador | Quimerismo mixto | |
| Trasplante de piel en ratón | Infusión de médula ósea y bloqueo coestimulador + busulfán | Quimerismo mixto | |
| Trasplante cardíaco en rata | Infusión de células madre en porta | Quimerismo mixto | |
| Periférica | Trasplante de piel en ratón | Protocolo toleroénico: timectomía, Ac. anti-CD4 y anti-CD8 | Tolerancia infecciosa-Inactivación células T alorreactivas |
| Trasplante de piel en ratón | Generación y transferencia adoptiva de células Treg CD4+CD25+ | Prevención de la activación óptima de células T/anergia y apoptosis de células T alorreactivas | |
| Trasplante de piel en ratón | Bloqueo de coestimulación | Prevención de la activación óptima de células T/anergia y apoptosis de células T alorreactivas | |
| Trasplante de islotes en ratón | Bloqueo de coestimulación | Prevención de la activación óptima de células T/anergia y apoptosis de células T alorreactivas |
A pesar de que los órganos trasplantados se rechazan frecuentemente, un hallazgo inusual en los estudios experimentales es que, en ausencia de inmunosupresión, un TH es aceptado a menudo, a pesar de una discordancia en el sistema MHC. Este fenómeno fue inicialmente observado por Calne5 en cerdos. En su trabajo, publicado en 1969, los cerdos trasplantados con hígados de otros cerdos no emparentados sobrevivieron de forma prolongada sin inmunosupresión y cerdos similares rechazaban los trasplantes de piel, riñón y corazón rápidamente. Además, el TH protegía del rechazo de trasplantes de piel, riñón y corazón del mismo donante, pero no de otros donantes, tal como demostraron posteriormente otros autores23,24. En este estudio ya se especulaba que el hígado podía inducir tolerancia inmunológica en los cerdos. Este fenómeno de aceptación espontánea de un hígado trasplantado ocurre en una gran variedad de especies de mamíferos, incluyendo diversas cepas de ratones7, ratas25, cerdos no emparentados y primates5. Mucho más sorprendente es la reversibilidad del rechazo de injertos cardíacos26, de páncreas27 o de piel7 mediante el TH. Los hígados trasplantados actuarían así como inmunosupresores. Estos hallazgos demuestran que los modelos de tolerancia del TH son modelos muy eficaces en demostrar la tolerancia periférica en el trasplante. Además estos experimentos demuestran que el hígado, además de ser aceptado espontáneamente cuando se trasplanta, puede inducir tolerancia específica a trasplantes sucesivos de otros tejidos y tener efecto inmunosupresor, revirtiendo el rechazo de un órgano previamente trasplantado (corazón, páncreas y piel) de la misma cepa. Aun sin inmunosupresión, en estos experimentos se observa que existe un periodo de rechazo previo a la tolerancia, que en vez de destruir el injerto, revierte de manera espontánea. La base fisiopatológica de este fenómeno ha sido estudiada de forma extensa y actualmente conocemos que la activación inmune es imprescindible para la inducción de tolerancia en el TH28.
El hígado como órgano inmune privilegiadoLa estructura del hígado tiene profundas implicaciones para su función inmune. El hígado está expuesto continuamente a grandes cantidades de antígenos que llegan fundamentalmente a través del sistema portal. Aproximadamente un 30% de la sangre total pasa por el hígado cada minuto, transportando al hígado cerca de 108 linfocitos periféricos en 24h29.
El hígado, por sus propiedades anatómicas e inmunológicas, es un lugar donde los antígenos del tracto gastrointestinal y los aloantígenos, cuando se trata de un hígado trasplantado, son presentados por una compleja red de células sinusoidales y células presentadoras de antígeno (CPA) a los linfocitos. La población de linfocitos hepáticos es rica en NK (natural killer) y NKT (natural killer T cells), jugando un papel crítico como primera defensa contra los patógenos, modulando la lesión hepática y el reclutamiento de linfocitos circulantes. Recientemente se ha podido documentar la existencia de un porcentaje alto de linfocitos no convencionales en el hígado, que raramente se presentan en sangre periférica, incluyendo NK, NKT expresando el receptor de células T (TCR) γδ (célula T γδ y Vα24JαQ TCR) y células dendríticas (CD). Estas células NKT γδ tienen propiedades inmunorreguladoras y parecen reconocer CD1d, expresado en la superficie de las CPA (células de Kupffer), y en los hepatocitos16. Las células NK (CD3_CD16+CD56+) representan hasta un 45% de los linfocitos hepáticos, mientras que sólo suponen un 5-15% de las células mononucleares periféricas. Estas células NK parecen liberar señales negativas hacia los linfocitos T del receptor cuando migran al hígado después del TH (TH), contribuyendo a la tolerancia del injerto hepático.
El contexto en el que se presentan los antígenos en el hígado a los linfocitos T favorece un ambiente tolerogénico. Este depende de la naturaleza de las CPA del hígado donante, de la presencia o ausencia de moléculas coestimuladoras y del microambiente de citocinas. En particular, las CPA hepáticas tienen una capacidad constitutiva de inducir respuestas tolerogénicas en los linfocitos T30.
Las células endoteliales sinusoidales hepáticas (CESH) tienen un fenotipo único que expresa marcadores típicos de células de tipo mieloide (CD1,CD4,CD11c). Dichas CESH tienen parecido con CD inmaduras, constituyendo un nuevo tipo de CPA órgano-específica. Los linfocitos CD4+ activados por las CESH son incapaces de diferenciarse hacia células Th1 (productoras de IL-2), y expresan altos niveles de la IL-10 inmunosupresora31. Además, los linfocitos CD8+ estimulados por las CESH no pueden responder a nuevas estimulaciones antigénicas30.
Diversos estudios han planteado la cuestión sobre la renovación de las células endoteliales en los órganos trasplantados y su relación con la tolerancia o el rechazo. El recambio endotelial se ha demostrado en corazón32, riñones33, y en el hígado trasplantado34. Lagaaij et al33 demostraron que, tras el trasplante renal, el recambio endotelial de las células endoteliales del donante por células endoteliales del receptor se correlacionaba con rechazo vascular. Se ha propuesto que, en el hígado trasplantado, el recambio endotelial por células endoteliales del donante procedentes de células de médula ósea podría favorecer la tolerancia del injerto34,35. Sin embargo, se pudo demostrar posteriormente que el quimerismo endotelial en el injerto hepático no se relaciona con la inducción de tolerancia en los pacientes trasplantados hepáticos después de la retirada completa de inmunosupresión8.
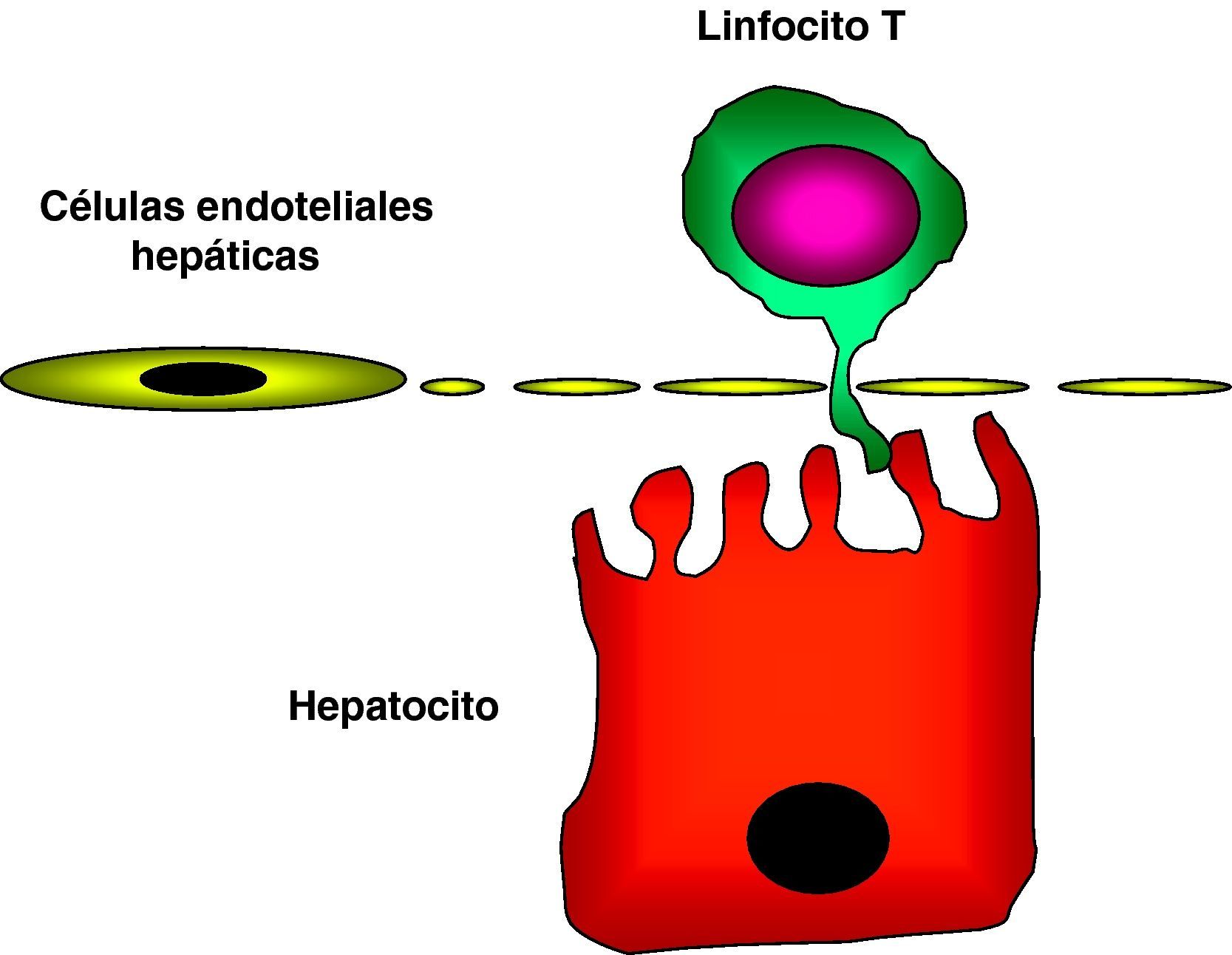
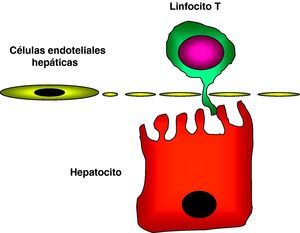
Recientemente, se demostró que la capacidad del hígado de inducir tolerancia se debe, en parte, a la capacidad de activación in situ de los linfocitos T. Es conocida la capacidad de los hepatocitos como células presentadoras de antígenos tolerogénicas. En contra del dogma que establece que los linfocitos T naïve no pueden interactuar con células parenquimatosas fuera de los órganos linfoides, se ha podido observar que los linfocitos intrahepáticos y los linfocitos CD8+ naïve circulantes pueden interactuar con los hepatocitos a través de extensiones citoplasmáticas que pueden penetrar a través de las fenestraciones de las CESH36 (fig. 1). Esta activación local de los linfocitos T por medio de los hepatocitos concede un papel importante a los hepatocitos como CPA y da lugar al desarrollo de tolerancia dentro del hígado37.
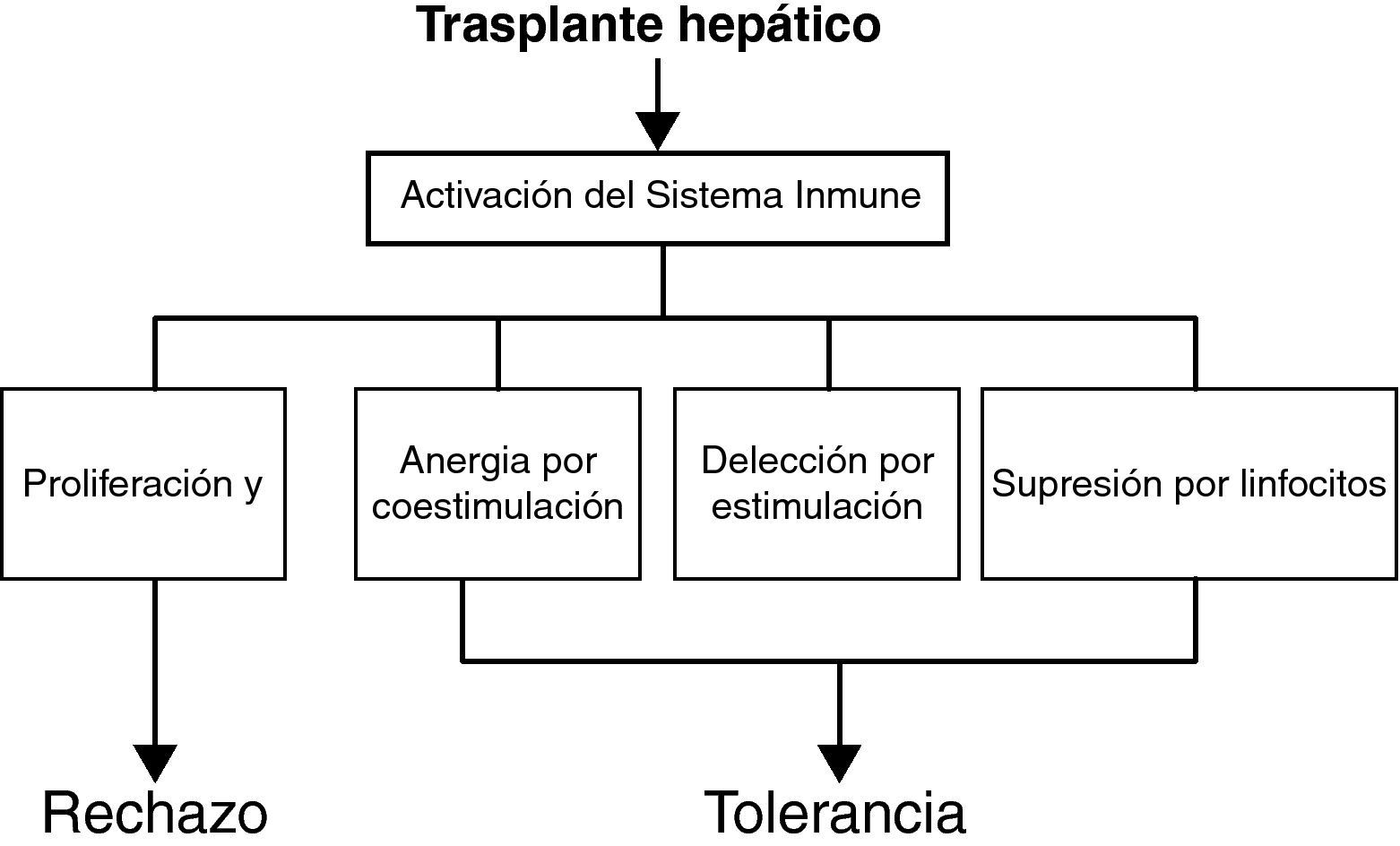
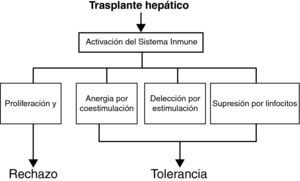
Mecanismos de tolerancia en el trasplante hepáticoParadigma dualístico de la toleranciaAunque los mecanismos exactos que establecen y mantienen la tolerancia de los órganos trasplantados no son bien conocidos, los distintos estudios de tolerancia en animales, y menos en humanos, demuestran que la tolerancia es un proceso activo y muy regulado. El proceso de activación inmune (proliferación y diferenciación de linfocitos) ocurre normalmente como una respuesta inmune al injerto hepático. Este proceso natural de respuesta puede resultar en dos vías de comportamiento distintas (fig. 2): 1) una vía (o grupo de vías) inmune dirigida a la destrucción del injerto (vía del rechazo), y 2) una vía (o grupo de vías) orientada hacia la tolerancia (vía tolerogénica). Este paradigma dualístico postula la existencia de mecanismos comunes inducidos por el injerto hepático que dan lugar a rechazo o tolerancia, dependiendo del balance cuantitativo entre ambas vías28. Los mecanismos inmunes exactos que subyacen la vía de la tolerancia no son totalmente conocidos, pero pueden incluir los siguientes fenómenos38: 1) deleción por apoptosis clonal de linfocitos T específicos de donante (tolerancia central o periférica), y 2) tolerancia periférica (regulación, anergia por coestimulación deficiente, deleción por activación repetida).
Tolerancia centralLos fenómenos de tolerancia central se desarrollan fundamentalmente en el timo. Las células precursoras de los linfocitos T procedentes de las stem cell de la médula ósea maduran en el timo y aprenden a distinguir lo propio de lo extraño. Durante el proceso de diferenciación de las células T, los precursores linfoides CD4−CD8− se convierten en células T doble positivas CD4+CD8+ y posteriormente en CD4+TCR+si se presentaron a moléculas HLA de clase II, o se convierten a CD8+TCR+si se presentaron a moléculas HLA de clase I. Cuando la unión del linfocito T al complejo péptido-moléculas HLA presentado por las células epiteliales tímicas se realiza con un TCR linfocitario de baja afinidad se produce la llamada «selección positiva», que permite la supervivencia de dichos linfocitos, que pasan al torrente circulatorio para colonizar los órganos linfoides secundarios. Por el contrario, los linfocitos con receptores que se unen con alta afinidad a estos complejos experimentan muerte celular por apoptosis (selección negativa)39. Algunos linfocitos autorreactivos escapan a la periferia y, por este motivo, es necesario contemplar la existencia de mecanismos reguladores naturales periféricos que puedan controlar este tipo de autorreactividad. Estos mecanismos reguladores han recobrado una relevancia fundamental en la investigación del trasplante y la autoinmunidad, y están mediados por células T reguladoras y células dendríticas tolerogénicas.
El fundamento de la estrategia de inducción de tolerancia mediante el trasplante de médula ósea se basa en el establecimiento de un quimerismo hematopoyético mixto. Cuando el timo del receptor se coloniza por DC del donante se produce un quimerismo central. Durante el proceso de diferenciación de las células T en el timo, las CD del donante podrían participar en la purga de linfocitos T alorreactivos a través de selección negativa o deleción clonal y así generar un repertorio de células T tolerantes frente a lo propio y a los aloantígenos del donante40. Sin embargo, si no se produce una deleción completa de linfocitos alorreactivos a través del quimerismo mixto después del trasplante de médula ósea, persiste la posibilidad de rechazo y la tolerancia sólo es posible si se desarrollan mecanismos inmunorreguladores que controlen dichos linfocitos41,42.
La aplicación clínica de los modelos animales de trasplante de médula ósea con protocolos de acondicionamiento con irradiación linfoide total, o con protocolos no mieloablativos, ya sea con anticuerpos deplecionantes anti-CD4 y anti-CD40L o con proteínas de fusión CTLA4-IG que inhiben la unión CD28 con CD80 o CD86, es difícil de establecer. Desde las primeras experiencias de Monaco et al43 en trasplante renal, se han realizado diversos estudios en trasplante de hígado, páncreas, corazón y pulmón44, pero sin conseguir tolerancia completa. Quedan por resolver todavía muchos problemas y, en especial, se debe conseguir la depleción de las células alorreactivas periféricas que escapan a la deleción central tras el quimerismo central conseguido con la transfusión de células de médula ósea45.
Tolerancia periféricaCélulas reguladoras y toleranciaEn los modelos de tolerancia espontánea del injerto hepático se produce precozmente una activación importante de los linfocitos del receptor en los órganos linfoides secundarios y una posterior deleción por agotamiento de los mismos28. El estímulo es producido por la gran cantidad de leucocitos del donante que migran rápidamente a los tejidos linfoides y estimulan la producción de grandes cantidades de IL-2 e IFN-γ por parte de los linfocitos CD4 del receptor, agotándose y muriendo posteriormente por apoptosis46.
Además de los mecanismos descritos de muerte celular inducida por activación, y otros mecanismos de tolerancia como la anergia o la desviación inmune o ignorancia, la presencia de células reguladoras parece jugar un papel central en los mecanismos de tolerancia hacia los órganos trasplantados47. Se han identificado diversos subtipos de células T reguladoras: células T CD4+CD25+ supresoras, células T reguladoras tipo 1 (Tr1) productoras de IL-10, células Th3 productoras de transforming growth factor-β-producing (TGF-β), células NKT, CD8+CD28−CD27+ y CD4−CD8−48,49.
Los linfocitos T reguladores CD4+CD25+, junto a los NKT, aparecen de forma espontánea en el timo, ejercen su actividad inmunorreguladora de forma innata y su efecto no parece ser antígeno-dependiente50. Las células T reguladoras CD4+CD25+ fueron descritas por Sakaguchi et al en 199051 observando que suponían el 5-15% de las células CD4+ periféricas. Este tipo de células T reguladoras expresa también fenotipo de memoria (CD45RAnegCD45RO+CD45RBlow), CTLA-4 o CD152 y GITR (glucocorticoid-induced tumor necrosis factor receptor). Recientemente se demostró que un marcador discriminativo de células T reguladoras CD4+CD25+ era el factor de transcripción Foxp352. Las células T reguladoras CD4+CD25+ disminuyen la respuesta inmune alterando la respuesta T alogénica, la producción de anticuerpos, la secreción de citocinas y la presentación antigénica53. Este tipo de células reguladoras, además de inhibir la capacidad citolítica de los linfocitos T efectores, convierten otras células T respondedoras CD4+CD25− mediante contacto intercelular, a fenotipo regulador, amplificando el efecto supresor de las células reguladoras (tolerancia infecciosa54. Este tipo de linfocitos T reguladores inducidos en sangre periférica suprimen la respuesta alogénica a través de mediadores solubles como la IL-10 y/o TGF-β55.
El hecho de que las células T reguladoras CD4+CD25+ de sangre periférica de humanos sean capaces de suprimir la respuesta a aloantígenos56 ha despertado interés en la generación de este tipo de células como una herramienta terapéutica que induzca tolerancia en trasplantes. Un ejemplo de ello sería estimular de forma repetitiva las células T naïve con CD inmaduras, lo cual induce la producción de linfocitos T reguladores CD4+CD25+57.
Recientemente se ha podido observar en sangre periférica de los pacientes con TH y tolerancia operacional (tolerancia sin inmunosupresión después de varios años con la misma) un incremento de células CD4+CD5+high+foxp358,59. Este hallazgo, junto a la mayor expresión de genes codificadores de células Tγδ, receptores NK y de proteínas involucradas en la finalización de proliferación59, parece constituir una huella de los pacientes trasplantados hepáticos capaces de tolerar la retirada de inmunosupresión.
Células dendríticas y toleranciaLas células dendríticas tienen un papel crucial en el establecimiento de tolerancia tanto central como periférica. En la periferia, las CD inducen tolerancia a través de la neutralización de linfocitos T reactivos (deleción, anergia o inactivación). Además las CD inmaduras son capaces de inducir linfocitos T reguladores CD4+CD25+ de una forma antígeno-específica60. La generación de CD tolerogénicas mediante diversas estrategias, como la utilización de rapamicina61, podría inducir tolerancia como se ha demostrado en modelos animales. Clásicamente se ha considerado, por un lado, la existencia de CD monocitoides (CD1) que inducen una respuesta Th1 (IL-2) y, por otro, la de CD plasmocitoides (CD2) que inducen respuesta Th2 (IL-10)62. En trasplantados hepáticos a los que se pudo retirar la inmunosupresión de forma definitiva, se observó que existía una proporción de precursores inmaduros de CD2 mayor que en los que no toleraban la retirada de inmunosupresión63, aunque este hallazgo no ha sido confirmado por otros autores59.
Quimerismo y toleranciaEl concepto de microquimerismo natural (estado en el que células alogénicas hematopoyéticas coexisten con células del receptor) que aparece después del trasplante de órganos sólidos fue sugerido por observaciones clínicas en las que el receptor de un riñón de un donante con pruebas cutáneas positivas adquiría dicha positividad, que era negativa antes del trasplante64. En 1992 Starzl et al65 describieron un bajo nivel de leucocitos del donante en receptores humanos de riñón e hígado a los que el trasplante se había realizado hasta 30 años antes. Starzl sugirió que la respuesta mutua de leucocitos de donante y receptor coexistiendo causaba agotamiento clonal seguido de deleción periférica clonal de las células alorreactivas y de las células T del donante66. El fenómeno del microquimerismo se asoció con la existencia de tolerancia, pero se ha cuestionado posteriormente y actualmente se interpreta más como una consecuencia que como la causa de la tolerancia de los injertos67.
El hígado tiene una gran población de células hematopoyéticas que migran después del trasplante, por lo que se piensa que ocasiona un mayor grado de microquimerismo de stem cells y de leucocitos atípicos como las CD, que inducen hiporrespuesta de los linfocitos T alorreactivos, pero este mecanismo tolerogénico es distinto al propuesto por Starzl28.
Experiencia clínica en tolerancia clínica operacionalLos casos de TCO pueden clasificarse en 4 grupos de acuerdo a la estrategia de retirada de IS (tablas 2–5). El primer grupo, que representa el más importante, identifica los casos de retirada de IS sin la utilización de ningún tratamiento previo. El segundo grupo incluye los casos de retirada de IS después de tratamiento con moléculas tolerogénicas. El tercer grupo comprende aquellos casos de retirada de IS después de una terapia celular tolerogénica. Finalmente, en el cuarto grupo se describen los casos de TCO desarrollada después de un trasplante de médula ósea.
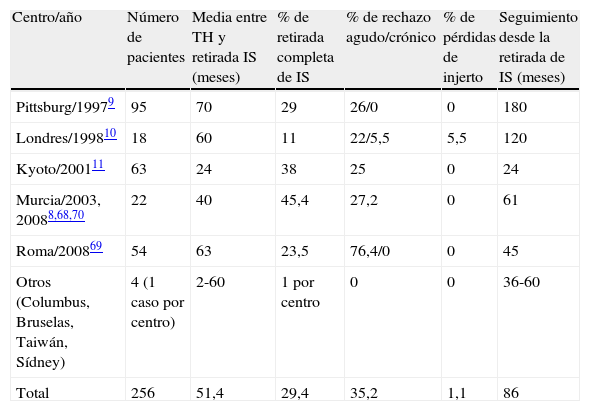
Experiencia clínica en tolerancia clínica operacional sin protocolos tolerogénicos.
| Centro/año | Número de pacientes | Media entre TH y retirada IS (meses) | % de retirada completa de IS | % de rechazo agudo/crónico | % de pérdidas de injerto | Seguimiento desde la retirada de IS (meses) |
| Pittsburg/19979 | 95 | 70 | 29 | 26/0 | 0 | 180 |
| Londres/199810 | 18 | 60 | 11 | 22/5,5 | 5,5 | 120 |
| Kyoto/200111 | 63 | 24 | 38 | 25 | 0 | 24 |
| Murcia/2003, 20088,68,70 | 22 | 40 | 45,4 | 27,2 | 0 | 61 |
| Roma/200869 | 54 | 63 | 23,5 | 76,4/0 | 0 | 45 |
| Otros (Columbus, Bruselas, Taiwán, Sídney) | 4 (1 caso por centro) | 2-60 | 1 por centro | 0 | 0 | 36-60 |
| Total | 256 | 51,4 | 29,4 | 35,2 | 1,1 | 86 |
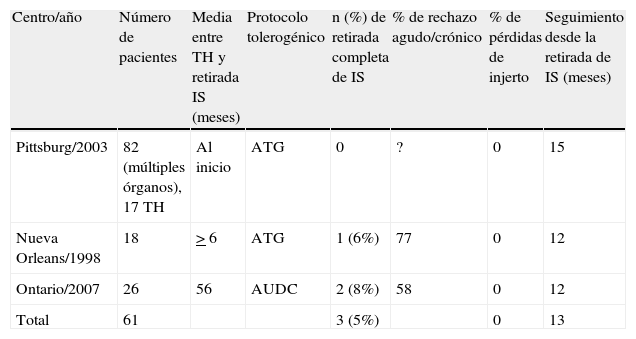
Protocolos tolerogénicos basados en terapias moleculares.
| Centro/año | Número de pacientes | Media entre TH y retirada IS (meses) | Protocolo tolerogénico | n (%) de retirada completa de IS | % de rechazo agudo/crónico | % de pérdidas de injerto | Seguimiento desde la retirada de IS (meses) |
| Pittsburg/2003 | 82 (múltiples órganos), 17 TH | Al inicio | ATG | 0 | ? | 0 | 15 |
| Nueva Orleans/1998 | 18 | > 6 | ATG | 1 (6%) | 77 | 0 | 12 |
| Ontario/2007 | 26 | 56 | AUDC | 2 (8%) | 58 | 0 | 12 |
| Total | 61 | 3 (5%) | 0 | 13 |
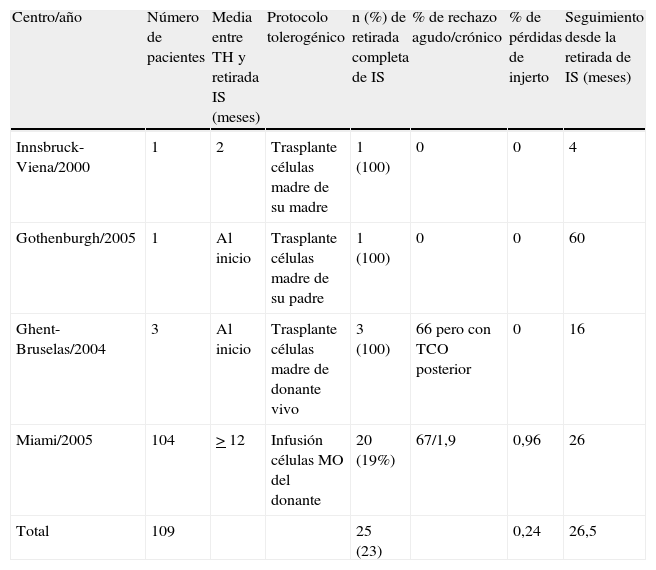
Protocolos tolerogénicos basados en terapias celulares.
| Centro/año | Número de pacientes | Media entre TH y retirada IS (meses) | Protocolo tolerogénico | n (%) de retirada completa de IS | % de rechazo agudo/crónico | % de pérdidas de injerto | Seguimiento desde la retirada de IS (meses) |
| Innsbruck-Viena/2000 | 1 | 2 | Trasplante células madre de su madre | 1 (100) | 0 | 0 | 4 |
| Gothenburgh/2005 | 1 | Al inicio | Trasplante células madre de su padre | 1 (100) | 0 | 0 | 60 |
| Ghent-Bruselas/2004 | 3 | Al inicio | Trasplante células madre de donante vivo | 3 (100) | 66 pero con TCO posterior | 0 | 16 |
| Miami/2005 | 104 | > 12 | Infusión células MO del donante | 20 (19%) | 67/1,9 | 0,96 | 26 |
| Total | 109 | 25 (23) | 0,24 | 26,5 |
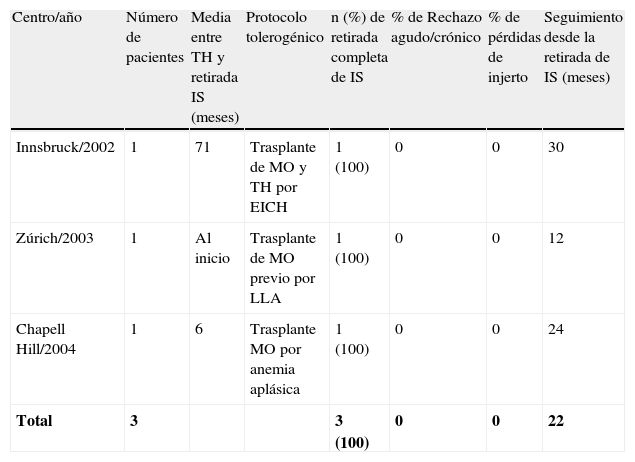
Trasplante de médula ósea previo al TH por enfermedad hematológica.
| Centro/año | Número de pacientes | Media entre TH y retirada IS (meses) | Protocolo tolerogénico | n (%) de retirada completa de IS | % de Rechazo agudo/crónico | % de pérdidas de injerto | Seguimiento desde la retirada de IS (meses) |
| Innsbruck/2002 | 1 | 71 | Trasplante de MO y TH por EICH | 1 (100) | 0 | 0 | 30 |
| Zúrich/2003 | 1 | Al inicio | Trasplante de MO previo por LLA | 1 (100) | 0 | 0 | 12 |
| Chapell Hill/2004 | 1 | 6 | Trasplante MO por anemia aplásica | 1 (100) | 0 | 0 | 24 |
| Total | 3 | 3 (100) | 0 | 0 | 22 |
Sin duda los protocolos de retirada intencionada de IS en el TH sin utilización de tratamientos supuestamente tolerogénicos son los más importantes en número y de ellos se ha establecido la prueba de concepto de la TCO (tabla 2). Globalmente la TCO se pudo obtener en cerca del 30% de los pacientes, todos ellos seleccionados por distintos motivos, generalmente por efectos adversos de la medicación inmunosupresora. Estos estudios son de gran importancia dado que demuestran la posibilidad real de retirar completamente la IS en un grupo importante de pacientes con TH. En algunos de estos estudios se pudo demostrar un beneficio clínico a corto plazo, con mejoría de los parámetros de riesgo cardiovascular y de la función renal68,69. Sin embargo, en casi ninguno de estos estudios se identificaron los mecanismos responsables para el mantenimiento del estado de tolerancia, excepto en un estudio donde se pudo observar un aumento de células reguladoras CD4+CD5+high+ y de la expresión de mRNA de FoxP3 durante y antes de alcanzar el estado de tolerancia70. El tiempo que pueda mantenerse la TCO no es bien conocido, dado el corto periodo de observación en la mayoría de los estudios, y la posibilidad de que pueda desarrollarse un grado leve de daño tisular en el injerto hepático no puede descartarse71.
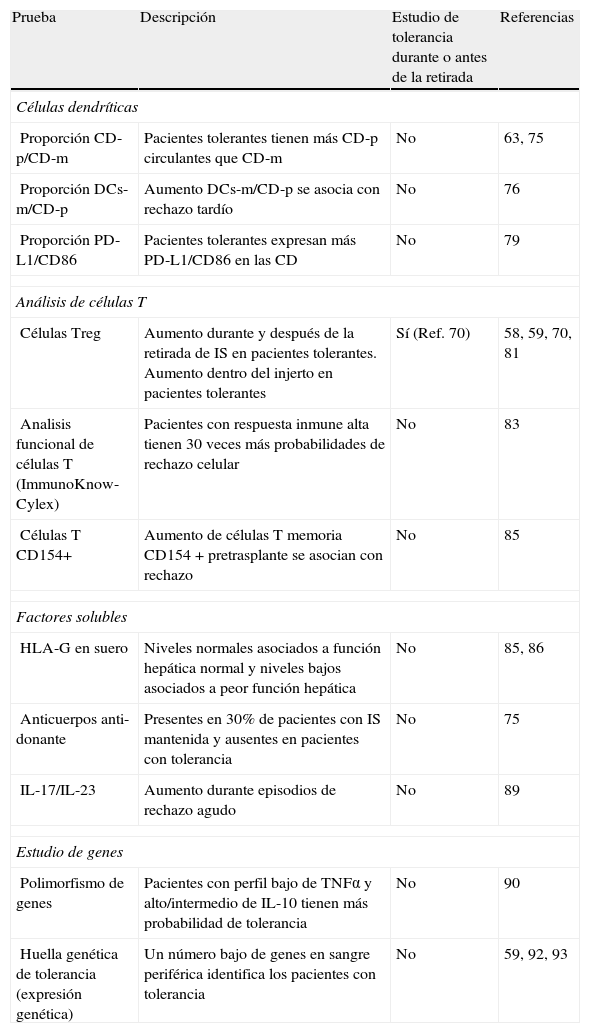
Monitorización de la tolerancia en el trasplante hepáticoBases generales de la monitorización inmunológica en el TH y pruebas de monitorizaciónLa evaluación clínica de la tolerancia en el TH se ha limitado a la valoración de laboratorio de la función del injerto. Otras herramientas son la monitorización histológica mediante biopsia hepática. Hasta el momento, no existe una prueba fiable que permita definir de forma exacta la posibilidad de TCO. Sin embargo, en los últimos años se han investigado diversos biomarcadores muy prometedores que incluyen el estudio de los distintos subtipos de células dendríticas, análisis funcional de células T, estudio de HLA-G y de anticuerpos específicos de donante y estudios de expresión genética mediante microarray. Los resultados de estos biomarcadores de tolerancia están dando información importante que podría hacernos comprender algunos aspectos de la tolerancia en el ámbito del TH (tabla 6). Estas pruebas varían considerablemente en cuanto a su dificultad, precisión, especificidad, reproducibilidad, coste y tipo de información relevante sobre la regulación del sistema inmune. Estos ensayos se realizan, en su mayoría, en sangre periférica, pero existen posibilidades para su aplicación en estudios en el propio tejido hepático, especialmente para el estudio de la expresión genética en el injerto hepático72.
Biomarcadores de tolerancia en el TH.
| Prueba | Descripción | Estudio de tolerancia durante o antes de la retirada | Referencias |
| Células dendríticas | |||
| Proporción CD-p/CD-m | Pacientes tolerantes tienen más CD-p circulantes que CD-m | No | 63, 75 |
| Proporción DCs-m/CD-p | Aumento DCs-m/CD-p se asocia con rechazo tardío | No | 76 |
| Proporción PD-L1/CD86 | Pacientes tolerantes expresan más PD-L1/CD86 en las CD | No | 79 |
| Análisis de células T | |||
| Células Treg | Aumento durante y después de la retirada de IS en pacientes tolerantes. Aumento dentro del injerto en pacientes tolerantes | Sí (Ref. 70) | 58, 59, 70, 81 |
| Analisis funcional de células T (ImmunoKnow-Cylex) | Pacientes con respuesta inmune alta tienen 30 veces más probabilidades de rechazo celular | No | 83 |
| Células T CD154+ | Aumento de células T memoria CD154+pretrasplante se asocian con rechazo | No | 85 |
| Factores solubles | |||
| HLA-G en suero | Niveles normales asociados a función hepática normal y niveles bajos asociados a peor función hepática | No | 85, 86 |
| Anticuerpos anti-donante | Presentes en 30% de pacientes con IS mantenida y ausentes en pacientes con tolerancia | No | 75 |
| IL-17/IL-23 | Aumento durante episodios de rechazo agudo | No | 89 |
| Estudio de genes | |||
| Polimorfismo de genes | Pacientes con perfil bajo de TNFα y alto/intermedio de IL-10 tienen más probabilidad de tolerancia | No | 90 |
| Huella genética de tolerancia (expresión genética) | Un número bajo de genes en sangre periférica identifica los pacientes con tolerancia | No | 59, 92, 93 |
Las CD son un componente fundamental del sistema inmune innato que, dependiendo de distintos factores microambientales (citocinas, productos microbianos, factores endógenos, quimocinas e interacción con otras células), induce y regula diversas respuestas inmunes. Existen 2 subtipos mayores de CD en humanos tanto en sangre como en tejidos: las células dendríticas convencionales mieloides (CD-m) y las células dendríticas plasmocitoides (CD-p). La expresión en su superficie de moléculas coestimuladoras (CD40, CD80, CD86) y moléculas correguladoras (programmed death ligand-1 [PD-L1]; inducible costimulator ligand [ICOSL]), y su diferente secreción de citocinas proinflamatorias y antiinflamatorias, determina su capacidad para inducir la activación de las células T o para regular la función de las células T.
En humanos, las DC-p (que son también las células principales productoras de IFN-1) y las CD-m (ambas HLA-DR+) pueden identificarse en sangre en función de su diferente expresión de antígenos de superficie (DC-p: CD11c−CD123+ blood DC Ag [BDCA]2+; CD-m: CD11c+ CD123−BDCA1+). Aunque ambos tipos tienen propiedades tolerogénicas en las personas sanas, existen evidencias de que las CD-p, más que las CD-m, podrían inducir tolerancia73,74. Debido a las propiedades tolerogénicas de las CD-p, Mazariegos et al63 demostraron un aumento de CD-p (respecto a las CD-m) en pacientes con TH y TCO y en aquellos pacientes en retirada de IS con respecto a aquellos pacientes con IS a dosis habituales. Además, se demostró un aumento de la fracción CD-p2:CD-p1 en los pacientes con TCO respecto a los pacientes con IS mantenida. Distintos fármacos inmunosupresores no influyeron en el número de CD-p2 ni en la fracción CD-p2:CD-p1, lo que apoyaría la validez de esta prueba en la identificación de pacientes con TCO75. No obstante, estos resultados no han sido reproducidos por otros autores59. Gupta et al76 han demostrado recientemente en niños que recibieron globulina anti-timocitos humanos de conejo que una proporción DC-m/DC-p elevada se asocia con rechazo del injerto hepático tardío, pero no precoz.
Dado que la función de las CD y el resultado de la interacción célula T-CD puede depender de las señales coestimuladoras y correguladoras expresadas por las CD, el grupo de Pittsburg liderado por Mazariegos analizó la hipótesis de que la prevalencia de la expresión de moléculas coinhibidoras en las CD podría ayudar a identificar los pacientes con TCO. Las señales PD-L1/PD-1 regulan negativamente la activación de los linfocitos T y promueven supervivencia del injerto77,78. Los autores analizaron la expresión de PD-L1/CD86 en CD de los pacientes con TCO, en retirada de IS o con IS convencional. Los resultados demostraron que los pacientes con TCO expresaron una alta proporción de PD-L1/CD86 en las CD-p y ninguna en las CD-m que fue mayor que en los pacientes con IS, relacionándose con una elevada incidencia de Treg CD4+CD25+Foxp3+79. Los autores proponen este parámetro como potencialmente útil para detectar aquellos pacientes con bajo riesgo de rechazo, que podrían ser buenos candidatos para retirar la IS.
Análisis de células T reguladorasSe han descrito una mayor frecuencia de células CD4+CD25+Foxp3+ en pacientes tolerantes con trasplante renal80 y niños con TH de cadáver o de donante vivo58,59,79. El estudio más reciente sobre este tipo de células Treg, realizado, por primera vez de forma longitudinal, demostró que las células CD4+CD5+high+ y la expresión de mRNA de FoxP3 aumentaron durante y antes de alcanzar el estado de tolerancia70. La expresión de FoxP3 se ha estudiado también en el injerto hepático, encontrando un aumento en los pacientes con TCO cuando se comparó con pacientes con TH estables con IS81. Aunque el significado biológico de estos hallazgos no está todavía bien definido, en conjunto sugiere que las células T CD4+CD25+Foxp3+ podrían estar implicadas en el desarrollo o mantenimiento del estado de TCO en el TH.
La población de células T CD8+CD28− tiene propiedades supresoras. Aunque no existen estudios que analicen una asociación entre la población de células CD8+CD28− y tolerancia, sí se ha podido demostrar una asociación entre una mayor frecuencia de esta población y un menor grado de rechazo en pacientes con TH y trasplante renal82. Además, los pacientes con un aumento de esta población disminuyeron la IS de forma más eficaz.
Li Y et al58 han descrito una menor frecuencia de células NKT Vα24+Vβ11high en niños con TH de donante vivo y TCO comparando con controles sanos.
En conjunto, todos estos datos sugieren que el análisis de células T en sangre periférica, en especial las células Treg, puede ayudar a identificar a los pacientes que podrían ser candidatos para una retirada segura de la IS.
Análisis funcional de las células TLa prueba de ImmunoKnow (Cylex), que mide la producción de ATP en las células CD4+ circulantes tras estimulación 15-18h con fitohemaglutinina, fue analizada por Kowalski et al83 en receptores de diversos trasplantes (riñón, riñón-páncreas, hígado e intestino delgado). Se observó que una respuesta fuerte (más ATP intracelular) tenía 30 veces más riesgo de rechazo y una respuesta baja (menos ATP intracelular), 12 veces más probabilidades de infección. En un reciente estudio84, realizado en el Hospital Clínico de Barcelona en 84 pacientes trasplantados (50 renales y 34 hepáticos), la mayoría de los pacientes estaban en la zona de respuesta inmune moderada durante el periodo de mantenimiento. Los niveles de ATP intracelular fueron menores en los pacientes con infecciones. En ninguno de los 10 de 22 pacientes que retiraron de forma completa la IS se encontró ATP intracelular en la zona de fuerte respuesta inmune (riesgo de rechazo). En este estudio, el valor de esta prueba fue mayor para identificar aquellos pacientes con riesgo de infección (seguridad) que aquellos con riesgo de rechazo (eficacia) (comunicación personal). Esta prueba no se ha utilizado para predecir o monitorizar la TCO.
La interacción CD40-CD154 (CDL) es importante en la interacción entre las células presentadoras de antígeno y las células T (señal 2 coestimuladora), y tiene un papel crítico en la evolución en el trasplante de órganos experimental. En un reciente estudio prospectivo con pacientes con TH, se demostró que la presencia de células T citotóxicas (CTL) de memoria CD154+ específicas de donante se asociaba con rechazo (sensibilidad/especificidad: 92,3/84,6%). Una presencia elevada de estas células pretrasplante se asoció con un riesgo mayor de rechazo85. Tampoco se han analizado estas células para monitorizar la retirada de IS.
Análisis de HLA-GEn los pacientes con TH, altos niveles de HLA-G soluble se correlacionan de forma positiva con pruebas de función hepática normales, mientras que su descenso se sigue rápidamente de un deterioro de la función hepática86. Estos datos indican que un aumento de HLA-G soluble inmediatamente después del TH se asocia a una menor incidencia de rechazo, debido a los efectos inmunosupresores de HLA-G. Datos no publicados todavía del grupo de Mazariegos de Pittsburg han demostrado una mayor expresión de HLA-G en las CD circulantes de los pacientes pediátricos con TH y TCO, en comparación con los pacientes con IS87. Deben realizarse más estudios que demuestren el valor pronóstico en el trasplante de órganos sólidos.
Anticuerpos antidonanteShapiro et al88 publicaron que la monitorización seriada de AAD en pacientes con trasplante renal tratados con alemtuzumab podía servir para predecir el rechazo después de la retirada de IS. Además, la interrupción de la retirada de IS en aquellos pacientes que desarrollan AAD puede llevar a su desaparición y mantenimiento de una buena función renal.
En pacientes con TH y TCO los AAD están ausentes y estaban presentes en 5/17 pacientes con IS mantenida75.
Niveles en suero de IL-17 e IL-23La IL-17 y la IL-23 tienen un papel proinflamatorio. Recientemente Fabrega et al89 demostraron que los niveles séricos de IL-23 e IL-17 en pacientes con rechazo y sin rechazo fueron similares en el periodo postrasplante inmediato, aumentando durante los episodios de rechazo agudo. Este hecho podría apoyar la idea de monitorizar estas IL durante la retirada de IS.
Polimorfismos de genesLa presencia de diferencias en fenotipos genéticos podría dar lugar a respuestas aloinmunes diferentes. Por ello se han analizado diversos polimorfismos genéticos de citocinas, quimocinas, moléculas de adhesión, moléculas coestimuladoras y receptores que tienen un papel importante en la respuesta aloinmune.
Los pacientes pediátricos con TH y un perfil genético bajo de TNFα y alto/intermedio de IL-10 son más susceptibles de retirada completa de IS o mantenimiento con bajas dosis de IS90. Este hallazgo sugiere que el análisis de SNp podría ayudar a identificar pacientes susceptibles de TCO.
Se han descrito polimorfismos en el receptor Toll-like (TLR) 2 (Arg753Gln) y TLR4 (Asp299Gly y/o Thr399Ile). En el TH se describió que el polimorfismo homocigoto Arg753Gln de TLR2 se asocia con fracaso del injerto y mortalidad después del TH en pacientes con hepatopatía crónica por virus C91.
Expresión de genes y perfil transcripcional (análisis de Microarray)En el campo del TH la TCO (que puede ocurrir hasta en un 20-30% de los pacientes) es más frecuente que en el ámbito del trasplante renal. Este hecho ha dado lugar a la posibilidad de estudiar más pacientes con TH y TCO que en pacientes con trasplante renal. El primer estudio utilizando el perfil de expresión de genes con microarray en el TH en humanos lo realizaron Martinez-Llordella et al59 en el año 2007. En este estudio, se compararon muestras de células mononucleares en sangre periférica (CMSP) de 16 pacientes con TCO y 16 pacientes no tolerantes con TH, utilizando microarray comercial Affymetrix de análisis de oligonucleótidos de genoma completo. El grupo de receptores no tolerantes eran pacientes en los que se intentó la retirada de IS y fracasó debido a la aparición de rechazo agudo y el análisis genético se realizó una vez resuelto el episodio y cuando los pacientes recibían IS a dosis convencionales. La comparación de los pacientes con TCO y aquellos no tolerantes dio lugar a un perfil de expresión genética diferente en un total de 628 genes. Se validaron 22 genes mediante qPCR, confirmando la tendencia de expresión en el microarray. Entre los genes más destacados se encontró una mayor expresión de transcripción específica de células T γδ y varios genes relacionados con células NK. En los pacientes no tolerantes se observó una mayor expresión de genes asociados con estrés celular y respuestas inflamatorias. La mayor expresión de genes proinflamatorios estaba restringida a pacientes con virus C, lo que parece indicar que la diferencia en expresión genética podría estar relacionada con el efecto de la IS sobre la patogenia de la hepatitis C más que a un efecto sobre un estado de tolerancia. Los estudios de inmunofenotipado, realizados en paralelo, revelaron un mayor aumento de células T γδ, células T γδ δ1TCR+ y células CD4+CD25+FoxP3+ en los pacientes con TCO con respecto a los pacientes no tolerantes.
Inmediatamente, a continuación de la anterior publicación, Kawasaki et al92 publicaron un estudio similar comparando los perfiles de expresión genética en CMSP de 11 receptores de TH con TCO (> 6 meses sin IS) con los de 11 personas sanas. Utilizaron la plataforma comercial Agilent de microarray cDNA con 12.814 genes. Los autores encontraron 717 genes diferentemente expresados, muchos de los cuales estaban relacionados con la respuesta inmune. Diez genes se seleccionaron para validación mediante PCR (utilizando una técnica de PCR convencional semicuantitativa) y los resultados se correlacionaron con los obtenidos con los array.
El mismo equipo del Hospital Clínico de Barcelona, dirigido por Sánchez-Fueyo, en colaboración con nuestro grupo de Murcia y otros 2 grupos europeos de Bélgica e Italia, publicó recientemente un segundo estudio en el que los experimentos de expresión genética mediante microarray y qPCR se expandieron para analizar una población más amplia de pacientes con TH con TCO y de pacientes no tolerantes93. Los experimentos de microarray Affymetrix se realizaron, en primer lugar, en un grupo de entrenamiento de 17 pacientes con TCO y 21 con IS, encontrando 2.482 genes diferentemente expresados entre ambas condiciones. Posteriormente se utilizaron diferentes algoritmos predictivos bioinformáticos para definir clasificadores genéticos mediante pequeños grupos de genes. Los genes más informativos mediante estos clasificadores fueron validados mediante qPCR. Estos análisis identificaron 3 huellas de genes (que contenían 2, 6 y 7 genes, respectivamente) que podían clasificar adecuadamente la mayoría de las muestras incluidas en el grupo de entrenamiento (error de clasificación: 3-6%). Además, estas huellas fueron analizadas en una cohorte independiente de 11 pacientes con TCO y 12 pacientes no tolerantes con IS pudiendo clasificar a los pacientes con un error de entre el 13 y el 17%. La expresión de estos genes relacionados con tolerancia se midió, también, en un grupo de pacientes estables con IS, clasificando al 26% como potencialmente tolerantes (una proporción que es similar al porcentaje de pacientes con TCO entre los receptores de TH). El análisis funcional de los genes expresados diferencialmente identificó las señales celulares de NK como las vías moleculares asociadas con tolerancia. Este hallazgo se correlacionó con la expresión de genes medido en función de los distintos subtipos de CMSP. Se demostró que tanto el número de NK como de células T γδ se correlacionó con la expresión de 314 y 438 de los 2.482 genes de tolerancia respectivamente. Los biomarcadores de transcripción encontrados en este estudio están siendo validados, actualmente, en un estudio prospectivo multicéntrico europeo de retirada de IS (financiado por la Unión Europea bajo el consorcio RISET, www.risetfp6.org). En este estudio se analiza la expresión genética antes de la retirada de IS en pacientes con TH.
ConclusionesLa mayoría de los pacientes con TH necesitan dosis bajas de IS para mantener una función normal del injerto. Además un número significativo de pacientes con TH seleccionados pueden retirar completamente los fármacos IS alcanzando la llamada tolerancia clínica operacional.
El hígado tiene unas propiedades tolerogénicas particulares que le permiten ser aceptado espontáneamente en algunas especies animales. Este proceso de tolerancia espontánea es un proceso activo dependiente de la transferencia de leucocitos del donante transportados con el hígado. La migración dentro del sistema linfoide del receptor da lugar a una activación inmune precoz de los linfocitos del receptor con la sucesiva deleción por agotamiento. Un mecanismo muy importante en la inducción de tolerancia es la supresión de la respuesta alogénica por linfocitos T reguladores. El microquimerismo leucocitario ha sido cuestionado como un mecanismo primordial en el mantenimiento de tolerancia.
En el contexto clínico, será importante monitorizar diversos parámetros inmunológicos de forma sistemática antes y después del trasplante, para poder identificar los fenotipos y quizás los polimorfismos genéticos que se asocian con la tolerancia del injerto.
Actualmente existen diversos estudios en marcha que analizan este aspecto, dirigidos a conocer parámetros que en un paciente concreto nos permitan predecir si podrá ser tolerante a la retirada de inmunosupresión tras un periodo de adaptación al nuevo órgano trasplantado. Las tecnologías del estudio completo del genoma, y, en particular, las tecnologías de alto rendimiento de expresión genética, son una base de gran oportunidad para estudio de los mecanismos y de la monitorización de la tolerancia. Estas tecnologías, junto a diversos biomarcadores señalados anteriormente, podrían ayudar a establecer algoritmos de decisión a la hora de plantear la retirada programada de IS en el TH.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.