INTRODUCCIÓN
El carcinoma epidermoide esofágico (CEE) es la segunda neoplasia esofágica más frecuente del total de las neoplasias esofágicas, por detrás del adenocarcinoma. Se encuentra en el grupo de los 10 cánceres más frecuentes a escala mundial, con unos 300.000 casos nuevos por año1. Su aparición va ligada a varios factores de riesgo descritos en la bibliografía, principalmente el tabaquismo, el alcoholismo y una historia previa de neoplasias de cabeza o cuello. No obstante, su incidencia tiende a disminuir lentamente, en contraste con el aumento lento y paulatino del adenocarcinoma. Aun cuando existe una tendencia epidemiológica decreciente, no se puede soslayar la trascendencia clínica del CEE. A pesar de los avances de los últimos años en el tratamiento del CEE localmente avanzado, debidos a una mejor selección de los pacientes para un tratamiento quirúrgico, al descenso de la morbimortalidad postoperatoria y a la aplicación de nuevos protocolos terapéuticos basados en radioquimioterapia neoadyuvante (tratamiento multimodal) o adyuvante2, la supervivencia a los 5 años sigue siendo pobre, inferior a un 20%. Por tanto, no se puede considerar satisfactorio el tratamiento actual del CEE y no parece que a corto o medio plazo vayan a surgir nuevos tratamientos que permitan un ascenso sustancial de la esperanza de vida de estos pacientes. No se debe olvidar que la pieza fundamental en el rompecabezas terapéutico del CEE es la cirugía. Los principales factores de riesgo en los pacientes afectados de un CEE son el tabaquismo y el alcoholismo, condiciones que asocian una comorbilidad significativa (p. ej., neumopatía crónica, cardiopatía isquémica, cirrosis hepática, neoplasias metacrónicas) y que colocan al paciente en un nivel de riesgo quirúrgico elevado o incluso inaceptable, que puede coartar las posibilidades de un tratamiento con intención curativa. Por lo tanto, a la pregunta de qué podemos hacer en la actualidad para disminuir la mortalidad de este cáncer sólo cabe la respuesta de la prevención. La identificación de sujetos de riesgo es el primer paso de la prevención, para en un segundo paso implementar medidas de prevención secundaria en estos grupos de riesgo. Se debe conocer en qué grupos de pacientes se puede obtener el mayor beneficio y qué pruebas diagnósticas se deben aplicar para la detección de lesiones premalignas o neoplasias tempranas3. Sólo una pronta detección de la enfermedad puede aumentar las posibilidades de supervivencia del paciente. Esta labor se antoja muy difícil si consideramos que, según una encuesta europea realizada en 22 países, sólo el 0,7% de las 6.719 lesiones de cáncer esofágico detectadas entre los años 1976 y 1980 eran tempranas4 (afectación máxima hasta la submucosa). No parece que en las casi 3 décadas posteriores a la recogida de esos datos se hayan tomado medidas para que la situación pueda ser significativamente mejor a día de hoy.
En el presente artículo se revisarán los siguientes aspectos: a) factores epidemiológicos relacionados con el CEE; b) justificación del cribado del CEE; c) técnicas aplicadas en el cribado, y d) finalmente se comentará brevemente la resección endoscópica mucosa como método diagnóstico y terapéutico en el CEE intramucoso.
EPIDEMIOLOGÍA Y FACTORES DE RIESGO
El CEE muestra gran variabilidad en su incidencia en función de la localización geográfica o de la raza consideradas. En los últimos 30 años ha sido la neoplasia esofágica más frecuente, pero el hecho de que su incidencia haya permanecido estable y el ascenso mantenido de la incidencia del adenocarcinoma lo han relegado a una segunda posición en países occidentales5.
Las regiones que presentan mayores tasas de incidencia y mortalidad por CEE en el mundo son las provincias de Henan, Hebei, Jiangsu y Shanxi en el norte de China, Transkei en Sudáfrica y Golestán en Irán, con cifras que llegan hasta los 700 casos por 100.000 habitantes-año (Linxian, China)6. Estos valores contrastan con los registrados en Estados Unidos o en Europa, con cifras inferiores a los 17 casos por 100.000 habitantes-año. No obstante, en Europa hay zonas con una mayor incidencia, como la región francesa de Calvados7.
El CEE es una neoplasia que afecta preferentemente a varones entre los 60 y 70 años de edad. Esta mayor incidencia en el sexo masculino es patente en los países occidentales, donde el tabaco o el alcohol son los factores de riesgo en el 90% de los CEE. En los países asiáticos de mayor incidencia, las diferencias entre los sexos masculino y femenino son menos evidentes, con un menor protagonismo del alcohol o el tabaco8, lo que puede traducir la exposición a los mismos factores carcinógenos de ambos sexos1. El CEE puede afectar en mayor medida a ciertos grupos raciales. Así, en Estados Unidos se ha observado una mayor incidencia en la población de color frente a la caucasiana, con una tasa de mortalidad 3 veces superior7. Es probable que un mayor consumo de alcohol y tabaco, asociado a menudo a factores socioeconómicos, pueda explicar estas diferencias9.
Varios son los factores involucrados en la etiopatogenia del CEE. El tabaco es un factor reconocido en varios estudios de casos y controles. El riesgo aumenta con el tiempo de consumo y con la magnitud del consumo diario, y es mayor riesgo entre los fumadores de pipa y cigarros. El cese del hábito tabáquico se puede seguir de un descenso del riesgo transcurridos al menos unos 10 años10.
El alcohol es el cofactor más importante con el tabaco en la aparición del CEE. El riesgo es dependiente de la dosis y el mayor riesgo de CEE se asocia al consumo de bebidas destiladas o ingeridas a elevada temperatura7,11-14. La interacción conjunta de tabaquismo y consumo de alcohol incrementa el riesgo de carcinogénesis, de modo que existe un mayor riesgo de CEE o displasia sincrónicos y expresión de p53 en la mucosa esofágica15,16. De la misma manera, el abandono del consumo de alcohol se sigue de un descenso del riesgo de presentar cáncer de esófago transcurridos más de 10 años. Si se suprimen ambos hábitos, tabáquico y enólico, cuyo efecto es sinérgico, se estima un descenso del riesgo de hasta un 70% tras 5-9 años de abstinencia12,13.
Otro marcador de riesgo para el desarrollo de CEE es una historia previa de cáncer de cabeza o cuello (CCC)17,18. Este dato refleja el hecho de que ambos tipos de neoplasia comparten factores de riesgo (tabaquismo y enolismo). En un estudio realizado en Francia19, se efectuaron endoscopias digestivas altas de cribado con un intervalo bianual en 1.560 pacientes afectados de un CCC en un período de 10 años. Se detectaron 49 casos de CEE en fase inicial (T1 o in situ) y se estimó un intervalo temporal mediano de 47 meses entre el diagnóstico del CCC y la detección del CEE, intervalo mayor que el comunicado por Kohmura et al20 (menos de 3 años). Los tumores orofaríngeos fueron los que asociaban un mayor riesgo de CCC metacrónico. En otro trabajo alemán21 realizado recientemente, se efectuaron panendoscopias orales de cribado en sujetos con historia previa de CCC. Se detectaron 10 pacientes con displasia y 11 casos con carcinoma (un 6,8 y un 7,4%, respectivamente). Fukuzawa et al22 encontraron 7 casos de CEE entre 56 pacientes con cáncer de la cavidad oral, lo que supone un porcentaje elevado de casos de CEE entre este grupo de riesgo (12,5%).
También se ha observado que los pacientes con historia de un CEE tienen un riesgo mayor de desarrollar un CCC. Shimizu et al23 efectuaron cribado esofágico y otorrinolaringológico a 99 pacientes con historia de CEE tratados mediante mucosectomía. En 5 de estos 99 pacientes (5,1%) se detectó una neoplasia metacrónica de cabeza y cuello. Watanabe et al24 observaron que la realización de cribado mediante faringolaringoscopia en pacientes varones consumidores de alcohol y con historia previa de CEE incrementaba la supervivencia al detectar el CCC en fase temprana.
La acalasia es otra entidad con riesgo de desarrollar CEE. Su patogenia no acaba de comprenderse, aunque se especula que la estasis alimentaria en el esófago podría favorecer la aparición del CEE17. Varios estudios publicados previamente han mostrado un riesgo entre 0 y 140 veces superior al de la población general, con un intervalo temporal entre el síntoma inicial de la acalasia y el desarrollo de cáncer que oscila entre 9 y 32 años25. Brucher et al25 hacen notar que el retraso en el diagnóstico de la acalasia (en su estudio, el tiempo transcurrido entre el inicio de los síntomas y el diagnóstico es de 8,5 años) puede suponer que, en el momento del diagnóstico, los pacientes ya se encuentren en riesgo de desarrollar cáncer. No parece que el tipo de tratamiento aplicado en la acalasia module el riesgo de cáncer.
La lesión esofágica provocada por agentes cáusticos tiene un potencial premaligno, al describrirse la aparición de CEE unos 40 años después de la agresión cáustica. La neo-plasia se adelanta en el tiempo cuanto mayor es la edad del paciente en el momento de la lesión cáustica26,27.
La exposición previa a radiación con fines terapéuticos se ha relacionado con el cáncer de esófago28,29. En un estudio de cohortes retrospectivo en el que se midió la asociación entre radiación por cáncer de mama y cáncer de esófago en una población de 220.806 mujeres29, se observó un riesgo relativo para el desarrollo de CEE a los 10 años de la irradiación de 5,42. Este riesgo aumentaba a 7,59 en las pacientes que habían recibido irradiación en la mitad interna de la mama. El período de latencia puede ser muy amplio (hasta 30 años)28.
El tipo de dieta ingerida, bien por un mecanismo local o sistémico, puede modificar el riesgo de CEE. La ingesta de frutas (cítricos) y verduras, vitaminas C y E, niacina, betacarotenos, pescado, productos lácteos y ácidos grasos monoinsaturados (aceite de oliva) se ha asociado con un efecto protector frente al CEE. En cambio, se ha asociado un incremento del riesgo con el consumo de carne, grasas saturadas o líquidos muy calientes como las sopas o ciertos licores1,11,13,30-33. Probablemente los efectos de la dieta sobre el CEE sean más evidentes en grupos sociales con una bajo situación socioeconómica o en países de elevada incidencia donde existen carencias nutricionales34-37.
Otras entidades se han asociado con el desarrollo posterior de un CEE (tabla I), si bien por su infrecuencia no se comentarán en detalle17.
Se ha apreciado un incremento del riesgo de presentar un cáncer aerodigestivo superior (y, por tanto, de CEE) en sujetos pertenecientes a familias con agregación de estas neoplasias. Probablemente este riesgo se deba a una interacción entre factores ambientales (tabaco o alcohol) y alteraciones genéticas (polimorfismos de la glutatión-S-transferasa, alteraciones del gen FHIT o polimorfismos de la aldehído deshidrogenasa 2). Los polimorfismos de la aldehído deshidrogenasa 2 se han relacionado con un mayor riesgo de CEE junto con el consumo de alcohol, al existir un mayor riesgo de lesiones esofágicas multicéntricas y metacrónicas, en relación con un fenómeno denominado «cancerización de campo» (field cancerization)38-45.
CRIBADO DEL CARCINOMA EPIDERMOIDE ESOFÁGICO
Los síntomas clínicos del cáncer esofágico dependen fundamentalmente del compromiso en el descenso del bolo alimentario a lo largo del esófago. En otras palabras, se requiere un volumen tumoral significativo para producir un obstáculo y la disfagia consiguiente. En este estadio, la neoplasia esofágica ya suele encontrarse en una fase avanzada, ya que las neoplasias esofágicas tienden a diseminarse por vía linfática desde fases tempranas. Esto se debe a que en el esófago los vasos linfáticos se encuentran en la mucosa, a diferencia de otras localizaciones del tubo digestivo, donde se localizan sólo más allá de la muscularis mucosae. Desgraciadamente, la ausencia de síntomas es un hallazgo habitual del CEE temprano (hasta un 45% de los pacientes pueden ser asintomáticos46), ya que suele tratarse de neoplasias planas o deprimidas, aunque las de tipo protruido pueden manifestarse como disfagia. En Japón, durante el período 1998-1999, un 35% de los cánceres esofágicos clasificados como Tis o T1 fueron descubiertos mediante cribado, mientras que un 33% se detectó al manifestar síntomas clínicos47. Otros síntomas del cáncer esofágico precoz son la odinofagia, el dolor torácico, la impactación alimentaria o las molestias centrotorácicas inespecíficas6,32,46,47-49. Si a esto unimos la baja incidencia de la enfermedad y la ausencia de signos específicos o de alarma, es comprensible la gran dificultad para diagnosticar un cáncer esofágico de forma temprana.
El cribado poblacional para el diagnóstico temprano de una neoplasia debe cumplir las siguientes premisas: a) detectable en fase premaligna o maligna temprana; b) curso prolongado asintomático; c) incremento de la supervivencia con el diagnóstico temprano; d) elevada prevalencia en la población general; e) técnica diagnóstica aceptable que resulte de baja o nula morbilidad; f) tratamiento eficaz que incremente la supervivencia, y g) cribado coste-efectivo.
Enfermedad detectable en fase premaligna
El CEE puede detectarse tempranamente mediante diferentes métodos como la citología esofágica abrasiva, la detección de sangre oculta en secreciones gástricas o la cromoendoscopia32,50,51. La displasia esofágica parece ser la lesión previa al desarrollo del CEE temprano. Suele estar presente en proximidad a CEE tempranos y existe relación entre el grado de displasia y la coexistencia con CEE. Asimismo, es más probable encontrar displasia esofágica en pacientes con CEE multicéntrico52. Con la endoscopia convencional se pueden diagnosticar lesiones tempranas mediante la visualización de cambios de coloración o irregularidades en la superficie mucosa53,54, aunque un porcentaje variable de lesiones según los estudios publicados sólo se diagnostican con el empleo de cromoendoscopia, como se explicará posteriormente.
Historia natural prolongada
La secuencia displasia-CEE temprano-CEE invasivo pa-rece tener una evolución prolongada53. En una serie de 23 pacientes con CEE temprano no tratado por la negativa del paciente, en quienes se realizó un seguimiento mediante citología, esofagografía baritada y fibrogastroscopia, se observó una supervivencia a los 5 años del 78%. En 12 de los casos la enfermedad permaneció en fase temprana tras un período de 74,4 ± 27,3 meses, mientras que se mostró avanzada en los restantes 11 pacientes tras un seguimiento de 55 ± 29 meses32,55. En otra serie, Guanrei et al56 realizaron un seguimiento endoscópico a 90 pacientes que rehusaron tratamiento de un CEE temprano. Tras un seguimiento de 19-78 meses, 52 pacientes (58%) presentaban enfermedad esofágica temprana, 8 casos evolucionaron a un cáncer avanzado y 27 fallecieron por cáncer con una supervivencia mediana de 53,2 meses. La supervivencia mediana de toda la serie fue de 75 meses56. Si bien se ha estimado que la progresión desde un CEE in situ a un CEE invasivo puede extenderse a un período de 4-5 años en China56, en Japón se ha apuntado un período de evolución más corto (2 años)57. Se desconoce la evolución temporal de los CEE in situ en los países occidentales. Probablemente, aunque no se ha demostrado, los diferentes factores implicados en el proceso de carcinogénesis y su peso relativo de acuerdo con la localización geográfica, la etnia o el nivel socioeconómico pueden influir en el tiempo de evolución entre lesiones tempranas y avanzadas.
Incremento de la supervivencia con el diagnóstico temprano
Las neoplasias confinadas a la mucosa tienen una muy baja incidencia de metástasis linfáticas (2%) y vasculares (hasta un 8%), por lo que podría obtenerse la curación mediante un tratamiento local (p. ej., mucosectomía) y alcanzarse una supervivencia a los 5 años superior al 85%, cifra 4 veces superior a la supervivencia del cáncer esofágico avanzado, que es del 20%. En cambio, si las neoplasias afectan a la submucosa, la probabilidad de invasión linfática y vascular se eleva significativamente (hasta un 40 y un 80%, respectivamente) y se debe ofrecer al paciente otras posibilidades terapéuticas32,46. En este estadio, la supervivencia a los 5 años desciende hasta el 40-50%. Por tanto, se debe considerar cáncer esofágico temprano al que se limita a la mucosa y debe ser el principal objetivo de detección del cribado del CEE.
Elevada prevalencia en la población general
Con excepción de las áreas de mayor incidencia a escala mundial, el CEE es una neoplasia infrecuente en la población general y por ello no resulta adecuada para realizar un programa de cribado poblacional. De hecho, la mayoría de las publicaciones sobre diagnóstico temprano del CEE se centran en grupos de riesgo. Las publicaciones referentes al cribado del CEE en población general se han efectuado fundamentalmente en China, país con la mayor incidencia de CEE y donde se realiza cribado de masas en las regiones más afectadas6,32,54-56.
Técnica diagnóstica aceptable y con baja morbilidad
En los países con elevada incidencia se han empleado diversas técnicas para el cribado del CEE y habitualmente desde un enfoque de cribado de masas en la población general. Trasladando el cribado a poblaciones occidentales de riesgo, con una menor incidencia, muy probablemente sea la cromoendoscopia el método diagnóstico más sencillo y práctico para el cribado del CEE. Como se expondrá más adelante, la técnica endoscópica no es compleja, no difiere sustancialmente de la endoscopia diagnóstica convencional y no añade morbilidad al procedimiento.
Tratamiento eficaz para incrementar la supervivencia
Se dispone de varias opciones terapéuticas para el manejo del CEE temprano, principalmente la resección endoscópica mucosa (REM) o mucosectomía, el tratamiento fotodinámico endoscópico y la cirugía. Cada una de estas opciones puede complementar a otra, si bien se dispone de mayor experiencia con la REM y la cirugía.
Coste-efectividad del cribado
No existen estudios que demuestren que un programa de diagnóstico precoz del CEE pueda ser beneficioso en términos de coste-efectividad. No obstante, la detección temprana puede ofrecer una mayor probabilidad de curación y puede suponer un ahorro de los costes derivados de tratamientos complementarios o paliativos, punto este que tiene una especial importancia en los países con mayor incidencia y en vías de desarrollo34. Los pacientes con riesgo de sufrir un CEE pueden presentar comorbilidad asociada y la atención médica derivada de esta comorbilidad puede generar unos costes que minimicen el ahorro obtenido por un programa de cribado para el CEE.
MÉTODOS DE CRIBADO: CITOLOGÍA, CROMOENDOSCOPIA Y OTROS
Hasta el momento no se han podido detectar marcadores analíticos (antígeno carcinoembrionario, alfafetoproteína, gonadotropina coriónica, CA-19.9, CA-50)58,59.
La radiología baritada de doble contraste permite detectar el cáncer esofágico en pacientes sintomáticos, pero la sensibilidad para el cáncer en fases iniciales es baja incluso en centros especializados (alrededor del 50%)60,61.
Se han empleado 3 técnicas para el cribado del CEE: a) citología exfoliativa; b) detección de sangre oculta en secreciones gástricas, y c) cromoendoscopia fundamentalmente con tinción de Lugol.
Citología exfoliativa
Existen 2 tipos de dispositivos. Uno consiste en un balón unido a un tubo con doble luz; el balón desinflado se ingiere y se pasa hasta el estómago. Entonces se infla con aire hasta alcanzar un tamaño de 2-3 3-5 cm, y se va retirando hasta el esófago cervical. Finalmente se aplica el balón sobre los porta y se preparan las muestras para estudio. Éste es el método más ampliamente utilizado en China. El segundo es una cápsula que contiene un material esponjoso; en contacto con el medio ácido, la cápsula se disuelve y permite la expansión de la esponja, que al ser retirada posibilita la exfoliación y recogida de muestras de células esofágicas. Ambos métodos se compararon en un estudio en población asintomática de la región de Linxian en China62. El método del balón fue positivo para atipia indeterminada indicativa de neoplasia, displasia de bajo o alto grado o cáncer en el 28% de los sujetos, frente a un 13% con el método de la esponja. Histológicamente hubo displasia escamosa en el 28% de los sujetos, y cáncer en el 4%. La sensibilidad y especificidad para el diagnóstico de displasia o cáncer fue del 47 y el 81% para el balón, y del 24 y el 92% para la esponja, respectivamente. Los resultados de este estudio indican que, aunque la citología exfoliativa no es un método óptimo para el cribado de CEE por su baja sensibilidad, permite detectar casi la mitad de lesiones significativas. Sus mayores ventajas son la sencillez del método y su bajo coste. Las mejoras en el diseño de los dispositivos, como el aumento de su abrasividad (y, por tanto, de la cantidad de muestra obtenida) o de la superficie de contacto, podrían elevar la sensibilidad. El método del balón fue empleado también en 2 estudios diferentes en veteranos estadounidenses63,64; el primero incluyó a población sintomática y el segundo sólo a personas asintomáticas con factores de riesgo para CEE. Los resultados del primer estudio mostraron una sensibilidad y especificidad para cáncer superiores al 90%. En el segundo estudio, sin embargo, se concluyó que este método de cribado no es útil en la población norteamericana, por la baja prevalencia de CEE, y también por la baja especificidad del diagnóstico citológico de displasia, que en la mayoría de casos es realmente debida a esofagitis. Aunque el principal objetivo de un método de cribado es que sea muy sensible, una muy baja especificidad generalmente eleva los costes de forma desmesurada. Por lo tanto, en países occidentales donde la prevalencia de CEE es baja, para realizar programas de cribado deben considerarse sólo métodos muy sensibles y en grupos de riesgo.
Detección de sangre oculta en secreciones gástricas
El empleo de este método se basa en que la mayor parte de las neoplasias afectan al epitelio superficial y que en ellas se producen pérdidas hemáticas no visibles, pero detectables, de forma análoga al estudio de sangre oculta en heces para la detección del cáncer colorrectal. Este método permite detectar neoplasias esofágicas y gástricas, sin poder discriminar entre ellas. Consta de una pequeña cápsula de 8 6 mm unida a un hilo de nailon de 80 cm. La cápsula se traga con la ayuda de agua y se mantiene entre 3 y 5 min en el estómago; posteriormente se recupera tirando del hilo. Ante un resultado positivo debe repetirse la prueba y, en caso de confirmarse la positividad, debe efectuarse un estudio endoscópico. Un estudio realizado en 11 provincias de China en más de 233.000 individuos encontró positividad en un 12% de ellos65. Se detectó cáncer en esófago, cardias o estómago en un 3,4% de los sometidos a endoscopia, y globalmente en un 0,25% de toda la población de estudio. La sensibilidad del test no se conoce porque no existen estudios que hayan realizado endoscopia en personas con resultado negativo.
Cromoendoscopia
Lugol
La cromoendoscopia se considera actualmente el método de elección para el cribado de CEE en la población con factores de riesgo para desarrollar esta neoplasia. Su aplicación se basa en que determinadas tinciones endoscópicas, que se detallan a continuación (figs. 1 y 2), pueden facilitar la detección de neoplasias, bien por ser captadas por la lesión o, al contrario, por contrastar su falta de tinción con la de la mucosa normal circundante, que sí capta el colorante.
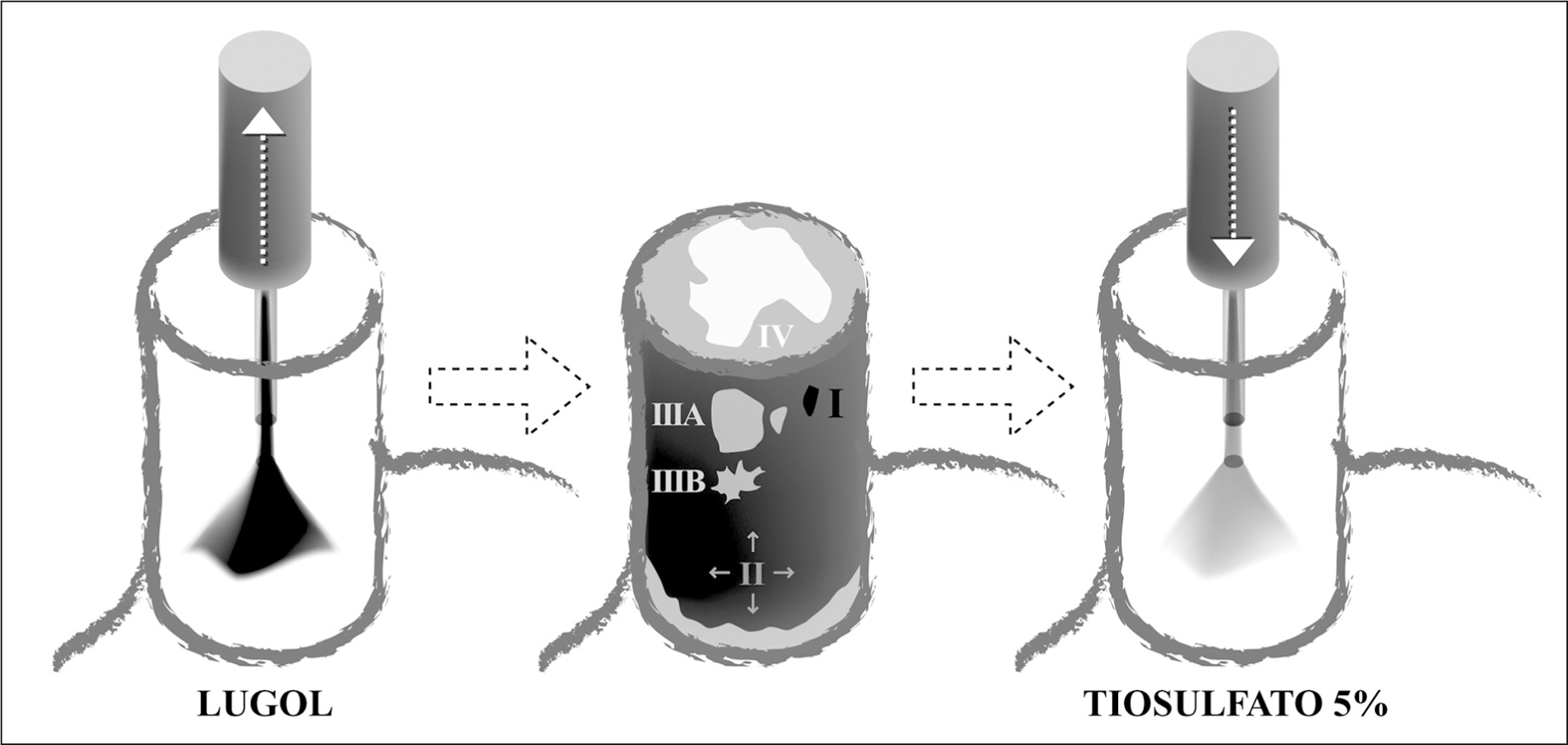
Fig. 1. Técnica de aplicación de la solución de Lugol y patrones de tinción: se instila Lugol mediante catéter tipo aerosol desde cardias hasta 20-25 cm desde incisivos (izqda.). Inmediatamente después de la aplicación pueden observarse los patrones de tinción. Opcionalmente puede realizarse lavado con agua o con tiosulfato sódico antes de proceder a observar los patrones, para obtener una imagen más clara (centro). Se aplica tiosulfato sódico en sentido proximal-distal, para reducir las molestias secundarias al Lugol (dcha.).
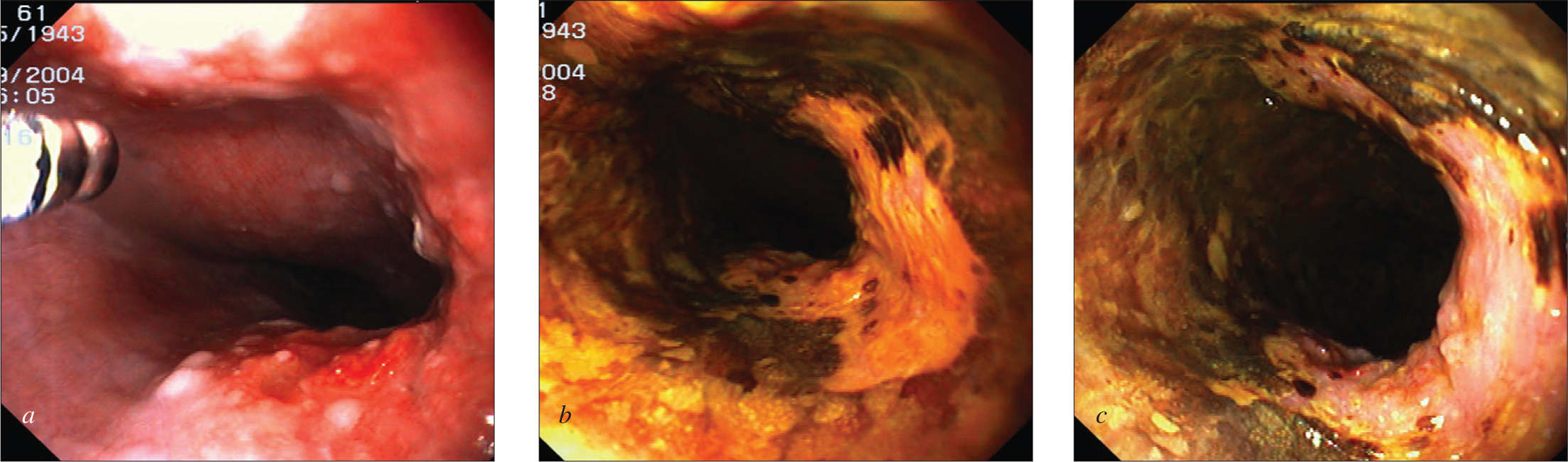
Fig. 2. Cromoendoscopia en paciente con acalasia sometido a cromoendoscopia con Lugol para vigilancia de cáncer epidermoide de esófago.Aspecto endoscópico convencional (a), que muestra irregularidad mucosa con nodularidad, sin poder determinarse con exactitud la extensión en superficie de la lesión. Tras la aplicación de Lugol al 2% (b), la lesión aparece más extensa, afectando a dos tercios de la circunferencia. El aspecto endoscópico indica invasión en la submucosa (c).
La tinción más ampliamente utilizada es la de Lugol, que se compone de yoduro potásico y yodo y se emplea a una dilución del 1-4%. En 1933, Schiller66 describió su aplicación para mejorar el diagnóstico de la neoplasia de cérvix. En los años sesenta y setenta se describió su uso para el diagnóstico de lesiones esofágicas67-69. El empleo de tinción de Lugol para el diagnóstico precoz del CEE se basa en su supuesta capacidad para teñir de marrón el glucógeno intraepitelial, aunque este efecto no ha sido claramente demostrado70. Las células inmaduras, entre ellas las neoplásicas, tienen menor contenido de glucógeno que las de la mucosa normal, por lo que captan menos tinción de Lugol, y la mucosa correspondiente aparece como áreas hipocaptantes (blanquecinas o amarillentas) en comparación con la mucosa esofágica normal, que queda teñida de color marrón. En los estudios publicados la respuesta a la tinción se considera positiva (captación normal) o negativa (zonas no captantes). Sin embargo, podría ser útil definir más detalladamente las características (color, forma, tamaño y número) de las zonas no captantes, tal como muestran los estudios que se mencionan a continuación. Mori et al71 estudiaron piezas de esofaguectomía que tiñeron con Lugol y determinaron 4 patrones de tinción, para después compararlos con el sustrato anatomopatológico: I (hipercaptación, marrón muy oscuro), II (captación de mucosa normal, marrón), III (hipocaptación, amarillento) y IV (hipocaptación, blanquecino). Las lesiones tipo I correspondían a acantosis glucogénica. La gran mayoría de las lesiones con patrones II o III eran lesiones inflamatorias o de displasia leve. Sin embargo, más del 90% de las lesiones con displasia grave o cáncer mostraron un patrón tipo IV; aquellas que mostraron patrón III tenían una transición con la mucosa normal (tipo II) muy patente, a diferencia de las lesiones tipo III de otra naturaleza, con una transición menos definida. Kawamura et al72, en un estudio similar, emplearon una clasificación análoga pero diferenciando entre IIIA y IIIB si el margen estaba poco definido o bien definido, respectivamente (fig. 1). También ellos encontraron que el 91% de las lesiones de displasia de alto grado o cáncer invasivo mostraban un patrón IIIB o IV. Estimaron histológicamente el contenido celular de glucógeno mediante tinción de ácido paraaminosalicílico y comprobaron que la concentración de glucógeno disminuía progresivamente desde las lesiones de tipo IIIA hasta las de tipo IV. Muto et al40 estudiaron a 389 pacientes con CCC sometidos a endoscopia de cribado con tinción de Lugol y analizaron la relación entre la existencia de múltiples lesiones (> 10) no captantes de Lugol, la morfología irregular o no de estas lesiones y el riesgo de presentar CEE sincrónico o metacrónico. Observaron que la existencia de múltiples lesiones no captantes de morfología irregular representaba un factor de riesgo independiente para la existencia de cáncer esofágico (odds ratio [OR] = 24).
La técnica consiste en aplicar la solución de Lugol mediante un catéter tipo aerosol al final de la exploración sobre la mucosa esofágica, no siendo estrictamente necesario realizar lavados con agua o sustancias mucolíticas, a diferencia de la cromoendoscopia con azul de metileno en el esófago de Barrett73. Se recomienda no aplicar el Lugol en esófago cervical para evitar su paso a la vía respiratoria. Asimismo, la aplicación de Lugol está contraindicada en casos de sospecha de hipertiroidismo e hipersensibilidad al yodo. Se recomienda aspirar el exceso de Lugol del esófago y el que se acumula en estómago para reducir el riesgo de broncoaspiración. Inmediatamente después de la aplicación, la mucosa esofágica normal capta el Lugol y adopta una coloración marrón. Se observa entonces la posible existencia de áreas no teñidas, su patrón de tinción, tamaño y morfología, para determinar qué lesiones se deben biopsiar. Se tomarán muestras de las lesiones mayores de 5 mm, y de las menores sólo si su aspecto es sospechoso por las características explicadas previamente. Al finalizar la observación se aplica tiosulfato sódico al 5%, que en un estudio controlado demostró disminuir las molestias (pirosis y dolor) producidas por el Lugol74. Se ha señalado que la aplicación de tiosulfato sódico a baja concentración (2,5%) proporcionaría un mayor contraste de las zonas no captantes, lo cual podría mejorar el diagnóstico; este contraste se realza especialmente si se realiza una segunda aplicación de Lugol75. Sin embargo, los resultados de este estudio descriptivo no se han evaluado en investigaciones posteriores, por lo que no puede recomendarse esta estrategia. La aplicación de cromoendoscopia con Lugol prolonga la exploración en una media de menos de 10 min76,77.
Estudios con Lugol en grupos de riesgo
Alcohol-tabaco. El trabajo más amplio de cribado en alcohólicos incluyó a 629 pacientes, asintomáticos desde el punto de vista digestivo, a los que se aplicó Lugol tras el examen endoscópico convencional14. Se evidenciaron lesiones no teñidas en 162 pacientes (25,8%). En 21 pacientes se detectó la presencia de carcinoma epidermoide superficial, lo que suponía una prevalencia del 3,3%. En este estudio todos los cánceres eran de tipo superficial y el 66% no se habría diagnosticado si no se hubiera empleado la tinción de Lugol. Los factores de riesgo asociados a la presencia de cáncer superficial fueron el consumo de bebidas con mayor graduación alcohólica (whisky y shochu; OR = 2,9), y el consumo de más de 30 cigarrillos/día (OR = 3,8). En otro estudio japonés en individuos con consumo elevado de alcohol de larga evolución se detectaron lesiones neoplásicas en el 3,9%. El 38% de las lesiones neoplásicas sólo se detectaron tras la aplicación de Lugol, al resultar todas ellas intraepiteliales78.
En un estudio francés79 se investigó la influencia del empleo de Lugol en el cribado de cáncer esofágico en 158 pacientes (151 varones), entre los cuales había fumadores y consumidores de alcohol. Se detectó CEE en el 8,2% de ellos. En este estudio sólo el 18% de las lesiones se detectaron gracias al Lugol y el resto fue evidente con endoscopia convencional, lo cual podría estar en relación con que la mayoría de los pacientes incluidos (84%) presentaba síntomas atribuibles a enfermedad esofágica. No obstante, esta técnica permitió identificar el margen de las lesiones con mayor claridad. La extensión de las lesiones tras la aplicación de Lugol fue aproximadamente 10 veces mayor que la aparente con la exploración endoscópica convencional79.
Fagundes et al76 incluyeron a sujetos con consumo elevado de tabaco, alcohol y mate (infusión caliente muy popular en el sur de Brasil, Argentina y Uruguay) durante más de 10 años, en quienes la endoscopia convencional no había revelado lesiones indicativas de neoplasia. Después de aplicar Lugol, biopsiaron las lesiones no teñidas mayores de 5 mm, y también mucosa normalmente teñida del tercio medio esofágico. Se detectaron lesiones no teñidas en un 12,2% de los individuos. El examen histológico reveló la existencia de displasia en un 6,9% de los sujetos (aproximadamente en la mitad de ellos se trataba de displasia de alto grado). En este estudio la cromoendoscopia con Lugol para el diagnóstico de displasia mostró una sensibilidad del 46%, una especificidad del 90%, un valor predictivo positivo del 26% y un valor predictivo negativo del 96%. Sin embargo, los autores no indican cuál era el grado de la displasia en las lesiones no detectadas con Lugol, y basándonos en el estudio mencionado previamente71 se puede sospechar que se tratara de lesiones de bajo grado.
Cáncer de cabeza y cuello. En la serie más amplia (389 pacientes), Muto et al40 encontraron una prevalencia de cáncer esofágico del 14%, y un 3% adicional desarrolló CEE en el seguimiento. De forma importante, el 55% de los sujetos que con la aplicación de Lugol mostraban múltiples lesiones hipocaptantes irregulares de más de 10 mm presentaron CEE. Tanto la presencia de estas lesiones como el consumo excesivo de alcohol fueron factores de riesgo independientes para la presencia de CEE. En otros 5 estudios que incluyeron en total a 649 sujetos con antecedentes de CCC la prevalencia de CEE fue del 5-12,7%, y el 55-80% de las lesiones se detectaron sólo tras la aplicación de Lugol. Además, en el 1-5,2% de los pacientes se detectó cáncer gástrico80-82. Aunque la distribución de la localización de las lesiones primarias (cabeza y cuello) fue variable en los diversos estudios, la localización laríngea fue infrecuente en todos.
En otro estudio83 se aplicó cromoendoscopia con Lugol en varones con cáncer primario extraesofágico de cualquier localización (entre ellos, fundamentalmente, cáncer gástrico, colorrectal, CCC y pulmonar), para investigar la posible existencia de CEE. Se detectó CEE en un 2,7% de los pacientes, y en el 78% de los casos la lesión era intramucosa. Incluso excluyendo a aquellos con CCC primario, la prevalencia de CEE fue de un 2,1%. El 70% de los pacientes del grupo de estudio consumía alcohol en exceso, y el 48% fumaba. Para evitar ese factor de confusión se estudió a un grupo control de sujetos con consumo de alcohol y/o tabaco; la prevalencia de CEE en este grupo fue del 0,3%, significativamente inferior a la del grupo de estudio. Por lo tanto, la cromoendoscopia con Lugol podría tener también un papel para diagnosticar CEE en pacientes con tumores primarios de otras localizaciones. Se necesitan más estudios para definir qué tipo de neoplasias primarias, aparte de las de cabeza y cuello, presenta un mayor riesgo de multiplicidad, así como para conocer qué factores epidemiológicos o ambientales representan factores de riesgo.
Regiones con alta incidencia de CEE. En China se han realizado numerosos estudios, basados fundamentalmente en la citología exfoliativa, en los que se somete a endoscopia con Lugol a aquellos con resultado positivo. En un importante estudio reciente se han comunicado los resultados sobre más de 24.000 sujetos sometidos a endoscopia por citología exfoliativa. Se observó que, empleando la estrategia citología exfoliativa-endoscopia con Lugol, más del 30% de CEE detectados resultaban de tipo superficial, y en ellos se conseguía una tasa de curación a los 5 años próxima al 90%84.
En un estudio en la población china, Dawsey et al6 aplicaron tinción con Lugol a 225 personas sometidas previamente a citología exfoliativa con balón, con diagnóstico citológico de displasia o cáncer. La sensibilidad para detectar displasia de alto grado o cáncer fue del 62% con la endoscopia convencional y del 96% con Lugol, mientras que la especificidad descendió del 79 al 63% por la detección de lesiones no neoplásicas no teñidas con Lugol. Aunque todas las lesiones invasivas (a lámina propia mucosa o más profunda) se detectaron con endoscopia convencional, aproximadamente la mitad de las displasias moderadas y la cuarta parte de las displasias de alto grado se identificaron sólo tras la aplicación de Lugol; además, en el 80% de las lesiones de displasia de alto grado o cáncer el Lugol permitió una mejor delimitación de su extensión o margen. Se ha comunicado recientemente la experiencia en Golestán (Irán) con endoscopia convencional, pero no con Lugol85. No existen estudios publicados respecto de la existencia de programas de cribado en la zona de alto riesgo de Sudáfrica.
Azul de toluidina
El azul de toluidina es un colorante que tiñe las células con elevado contenido en ADN y, por tanto, las células displásicas y neoplásicas86. No es una tinción específica para la neoplasia de tipo epidermoide, ya que puede teñir también epitelio columnar, tejido inflamatorio y secreciones digestivas. Por ello deben realizarse lavados transendoscópicos antes de aplicar la tinción70, y también 1 min después de su aplicación para lavar el exceso de tinción. Existen muchos menos estudios con azul de toluidina que con Lugol para el estudio del CEE, probablemente porque la técnica entraña mayor complejidad y por la posibilidad de efectos adversos relevantes (vómitos, metahemoglobinemia y agranulocitosis). Su rendimiento, sin embargo, parece equiparable al del Lugol. Así, en un estudio francés de vigilancia en consumidores de alcohol y tabaco asintomáticos, se aplicó azul de toluidina al 1% según la técnica descrita por Monnier et al87,88. Se detectó CEE superficial en el 2% y displasia en el 15%. La sensibilidad de la tinción para el diagnóstico de displasia o cáncer fue del 82% y la especificidad del 76%.
Resección endoscópica mucosa o mucosectomía
La mucosectomía o REM se ha aplicado en lesiones neoplásicas benignas o malignas tempranas de esófago, estómago y colon89. En cuanto al estudio del CEE, debe considerarse una técnica complementaria a la cromoendoscopia con Lugol, ya que va a permitir detectar lesiones neoplá-sicas intramucosas para las que la REM se considera la técnica más adecuada de diagnóstico y tratamiento. Consiste en la extirpación de la capa mucosa y parcialmente de la submucosa, tras haber inyectado suficiente suero fisiológico en la submucosa. Existen varias técnicas, que no van a explicarse en este texto, pero hay una revisión completa reciente de Makuuchi90 a la que se remite al lector. Está indicada en el tratamiento del CEE intramucoso que no llega a afectar a la muscularis mucosae. Es necesario realizar una estadificación previa a la REM para estimar la profundidad de la invasión, lo que puede conseguirse con una elevada exactitud (en torno al 80%) tanto con la endoscopia y Lugol como con la ultrasonografía endoscópica de alta resolución, tal como se afirma en un reciente estudio del grupo europeo con mayor experiencia en esta área91. En otro trabajo de este grupo sobre 39 pacientes no hubo complicaciones graves y la supervivencia estimada a los 5 años en pacientes con CEE intramucoso fue del 90%92. En resumen, es un tratamiento idóneo para neoplasias mucosas, si bien se han de tener en cuenta ciertas características de la lesión primaria, como el tamaño, la morfología o el grado de diferenciación, que pueden impedir la aplicación de la técnica (tabla II)93. La REM puede considerarse un tratamiento con baja morbilidad (riesgo de perforación, hemorragia y estenosis esofágica del 0,5, el 1,4 y el 3,8%, respectivamente)47.