El esófago de Barrett (EB) es el principal factor de riesgo para el desarrollo de adenocarcinoma de esófago (ACE). La incidencia y la mortalidad de este cáncer han aumentado en el mundo occidental en los últimos años. El impacto del diagnóstico precoz es importante porque la mortalidad del ACE es elevada a pesar de los tratamientos y produce un gran consumo de recursos económicos. La detección del ACE en estadios precoces aumenta la supervivencia de estos pacientes. El seguimiento endoscópico periódico de los pacientes con EB está indicado por todas las asociaciones científicas gastroenterológicas en un intento de detectar el cáncer en un estadio temprano y potencialmente curable. Hoy en día, tanto los intervalos de seguimiento como la necesidad de su realización en pacientes sin displasia o displasia de bajo grado se encuentran en debate. En esta revisión presentamos la evidencia disponible para ayudar a la toma de decisiones.
Barrett's esophagus (BE) is the main recognized risk factor for the development of esophageal adenocarcinoma (EAC). The incidence of this cancer and its associated mortality has increased in developed countries during the last few years. Detection of EAC at earlier stages could potentially improve survival dramatically in these patients, which is especially important as mortality from EAC remains high despite the available treatments. Therefore, endoscopic surveillance is an attractive option for patients with Barrett's esophagus. Consequently, periodic endoscopic surveillance is recommended by all the International Gastroenterology Societies in an attempt to detect EAC at an early and potentially curable stage. Currently, the frequency of endoscopic surveillance and its need in Barrett's esophagus with low-grade dysplasia or without dysplasia are under discussion. This review presents the available evidence in order to assist clinicians in the decision-making process.
El esófago de Barrett (EB) es el principal factor de riesgo para el desarrollo de adenocarcinoma de esófago (ACE). La incidencia de este cáncer ha aumentado en el mundo occidental en un 600% en los últimos 25 años. Este incremento se ha acompañado de un aumento de la tasa de mortalidad de 2 a 15 personas por millón durante el mismo periodo de tiempo1. A pesar de este incremento y aunque el riesgo de ACE o muerte por EB es bajo de manera individual, el impacto que tiene el diagnóstico precoz en los pacientes es importante porque la mortalidad del ACE todavía es muy alta a pesar de los tratamientos y produce un gran consumo de recursos económicos para los diferentes sistemas sanitarios. La supervivencia del ACE está inversamente relacionada con la profundidad de la invasión tumoral, así como con la presencia de nódulos linfáticos metastásicos2. Así pues, la detección del ACE en estadios precoces aumenta de manera importante la supervivencia de estos pacientes3. La asociación del EB con el desarrollo de ACE y el pobre pronóstico del adenocarcinoma avanzado hacen del seguimiento endoscópico una opción importante para los pacientes con EB, y en este sentido todas las asociaciones científicas gastroenterológicas recomiendan el seguimiento endoscópico periódico en un intento de detectar el cáncer en un estadio temprano y potencialmente curable. Hoy en día, tanto los intervalos de seguimiento como la necesidad de su realización en pacientes sin displasia o displasia de bajo grado se encuentran en intenso debate por parte de las diferentes sociedades científicas. En esta revisión presentamos la evidencia actual disponible para ayudar a la toma de decisiones y realizamos una introducción hacia futuras estrategias que se podrían instaurar en próximos años.
¿Qué pacientes son candidatos al seguimiento endoscópico?Solo los pacientes con un diagnóstico seguro de EB son candidatos al seguimiento endoscópico. El diagnóstico de EB se establece cuando el epitelio escamoso estratificado es reemplazado por un epitelio columnar metaplásico que predispone al desarrollo de displasia y, secundariamente, de cáncer4–7. Esta definición tiene 2 problemas a la hora de trasladarla a la práctica clínica. En primer lugar no existe un límite universalmente aceptado, validado y preciso que determine dónde termina el esófago y, por consiguiente, no es posible averiguar el tipo de epitelio que delimita el esófago más distal. Por lo tanto, no es posible verificar si el epitelio columnar de tipo gástrico encontrado en el esófago distal es metaplásico, lo cual adquiere relevancia cuando se intenta establecer el diagnóstico de EB en pacientes con epitelio metaplásico columnar corto.
Se han descrito 3 tipos de epitelio columnar en el EB: a) epitelio de tipo fundus gástrico; b) epitelio de tipo cardias compuesto por células secretoras de mucosa, y c) epitelio de tipo intestinal que contiene células caliciformes. En el momento actual la metaplasia intestinal es la única que ha demostrado predisponer a la displasia. Sin embargo, no existe acuerdo universal para incluir a la metaplasia intestinal como un criterio diagnóstico de EB. La British Society of Gastroenterology no requiere la confirmación histológica de metaplasia intestinal en el esófago para establecer el diagnóstico de EB8,9. En Japón, la metaplasia intestinal tampoco se requiere para diagnosticar EB, de hecho fue el primer país que propuso que el EB se puede diagnosticar en ausencia de células caliciformes. Existen evidencias que indiquen que el epitelio tipo cardial contiene anomalías en el ADN similares a las encontradas la metaplasia intestinal y que pudieran predisponer al cáncer10–12. En uno de esos estudios, 141 pacientes a los que se practicó resección endoscópica mucosa (EMR) por adenocarcinomas en estadio precoz, el 71% tenía epitelio de tipo cardial y no intestinal, adyacente al cáncer, y el 57% no tenía metaplasia intestinal en absoluto en la pieza resecada por EMR12. Actualmente existen autores que piden una revisión de las guías actuales basándose en la nueva evidencia emergente para incluir como EB aquel en el que no existen células caliciformes13. Sin embargo, las guías de consenso actuales14 hablan de que hay suficientes razones prácticas para no adoptar esta recomendación en este momento: en primer lugar por el gran aumento en el número de pacientes que pasarían a ser etiquetados como EB, lo que aumentaría a su vez de manera exponencial los costes. En segundo lugar, los intervalos de seguimiento e incluso la necesidad de los mismos en los Barrett con metaplasia intestinal está todavía en debate y dependen directamente de la longitud del segmento metaplásico y la mayoría de los segmentos con epitelio tipo cardial son menores de 3cm. Por lo tanto, las sociedades científicas solo recomiendan en la actualidad el seguimiento endoscópico de los pacientes con metaplasia intestinal, con una predisposición al cáncer bien demostrada, que cumplan, por tanto, los criterios establecidos de diagnóstico de EB.
¿Mejora el seguimiento endoscópico la supervivencia del paciente con esófago de Barrett?El seguimiento endoscópico se ha propuesto para los pacientes con EB con la premisa de que esta práctica reducirá las muertes por ACE y de ese modo aumentará la supervivencia. Las guías clínicas recomiendan la vigilancia endoscópica en intervalos que varían según el grado de displasia que presente el epitelio metaplásico.
Corley et al.15 estudiaron los resultados de 589 pacientes con ACE o de cardias diagnosticados entre 1990 y 1998. Solo se diagnosticaron 23 pacientes, los cuales conocían tener EB al menos 6 meses antes del cáncer, en 15 se descubrió el cáncer durante el seguimiento endoscópico mientras que a 8 se les diagnosticó en una endoscopia realizada por presentar síntomas relacionados con el cáncer de esófago. Los pacientes cuyos tumores se descubrieron durante la vigilancia endoscópica tenían cánceres en estadios más precoces y tenían una supervivencia a 2 años mayor comparada con aquellos cuyos tumores eran sintomáticos (73,3 vs 12,5%; p = 0,02).
Cooper et al.16 estudiaron una cohorte de 1.633 pacientes que tenían ACE o cáncer de cardias. Identificaron aquellos a los que se había realizado endoscopia más de un año antes de que se diagnosticara el cáncer y encontraron que solo se había realizado en el 9,7% de los pacientes, y solo el 3,7% tenía EB identificado más de un año antes del diagnóstico del cáncer. Sin embargo, un diagnóstico previo de EB se asociaba con un estadio precoz del cáncer y con mayor probabilidad de tratamiento curativo con esofagectomía. La mediana de supervivencia de los pacientes con ACE y endoscopia previa fue de 7 meses en comparación con 5 meses para aquellos que no tenían endoscopia previa (p < 0,01).
Un análisis más reciente de Cooper et al.17 incluyó 2.754 pacientes con diagnóstico nuevo de ACE. Demostraron que tener una endoscopia realizada entre 3 años y 6 meses antes del diagnóstico de cáncer se asociaba con una mejora en la mediana de la supervivencia de 7 meses (en los pacientes sin endoscopia previa) hasta 11 meses, con una disminución significativa añadida en el hazard ratio para el endpoint de mortalidad.
En un estudio retrospectivo, controlado realizado por Rubenstein et al. usando una base de datos de veteranos estadounidenses identificaron 155 pacientes que presentaban enfermedad por reflujo gastroesofágico (ERGE) asociado a ACE18. Aunque los 25 pacientes que tenían una endoscopia realizada entre uno y 5 años antes del diagnóstico de cáncer tenían tumores en un estadio más bajo que los 130 pacientes a los que no se les había realizado endoscopia en el mismo periodo de tiempo, no había diferencias significativas en cuanto a la supervivencia de los 2 grupos.
En resumen, la evidencia para apoyar la vigilancia endoscópica como un medio para mejorar la supervivencia de los pacientes que desarrollan neoplasia sobre un esófago de Barrett depende de datos administrativos examinados retrospectivamente. Esta evidencia indica que la vigilancia endoscópica puede reducir la mortalidad del ACE a través de la detección precoz del mismo. Sin embargo, conviene añadir que estos estudios observacionales están sujetos a numerosos sesgos, entre ellos el sesgo de anticipación, que pudieran exagerar los beneficios de la vigilancia endoscópica.
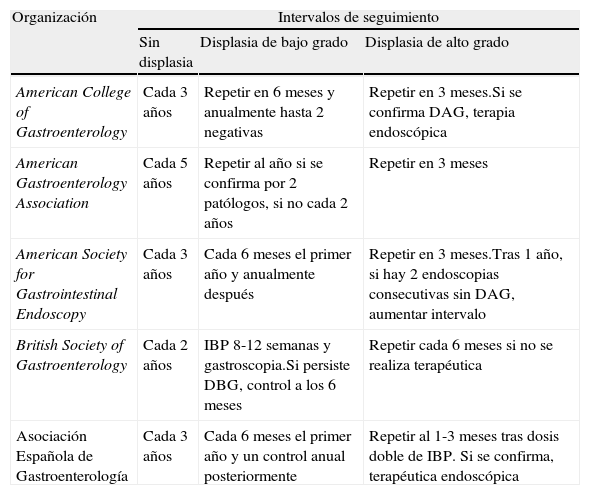
¿Con qué frecuencia se debe realizar la vigilancia endoscópica?Como se ha mencionado, la evidencia sobre la que se sustenta la vigilancia endoscópica es limitada lo que ocasiona que sea difícil hacer recomendaciones significativas y precisas en cuanto a los intervalos óptimos en los que se debe realizar la endoscopia. La mayoría de las guías basan los intervalos de seguimiento en un riesgo asumido de 0,5% por año. Este riesgo viene determinado por un metaanálisis19 realizado en el año 2000 en el que se reconoció que el sesgo de publicación llevó a una sobrestimación del riesgo. Desai et al.20 han publicado recientemente un metaanálisis en el que concluyen que el riesgo es de 0,33% por año, resaltando la necesidad de una profunda reevaluación de la utilidad y el coste-efectividad de las estrategias actuales de seguimiento de los pacientes con EB sin displasia. Esto hace que en la actualidad estos intervalos vengan determinados por la presencia y el grado de displasia, y que hayan sido propuestos de manera un tanto arbitraria ya que nunca han estado sujetos a un ensayo clínico lo cual hace que haya discrepancias entre las guías clínicas de las diversas sociedades científicas gastroenterológicas (tabla 1).
Intervalos de seguimiento para esófago de Barrett según las diferentes sociedades científicas
| Organización | Intervalos de seguimiento | ||
| Sin displasia | Displasia de bajo grado | Displasia de alto grado | |
| American College of Gastroenterology | Cada 3 años | Repetir en 6 meses y anualmente hasta 2 negativas | Repetir en 3 meses.Si se confirma DAG, terapia endoscópica |
| American Gastroenterology Association | Cada 5 años | Repetir al año si se confirma por 2 patólogos, si no cada 2 años | Repetir en 3 meses |
| American Society for Gastrointestinal Endoscopy | Cada 3 años | Cada 6 meses el primer año y anualmente después | Repetir en 3 meses.Tras 1 año, si hay 2 endoscopias consecutivas sin DAG, aumentar intervalo |
| British Society of Gastroenterology | Cada 2 años | IBP 8-12 semanas y gastroscopia.Si persiste DBG, control a los 6 meses | Repetir cada 6 meses si no se realiza terapéutica |
| Asociación Española de Gastroenterología | Cada 3 años | Cada 6 meses el primer año y un control anual posteriormente | Repetir al 1-3 meses tras dosis doble de IBP. Si se confirma, terapéutica endoscópica |
Así, tanto el American College of Gastroenterology y la American Society for Gastrointestinal Endoscopy recomiendan la vigilancia endoscópica cada 3 años tras 2 exploraciones negativas para displasia en el primer año del diagnóstico de EB en pacientes sin displasia21,22, mientras que la American Gastroenterological Association (AGA) recomienda un intervalo entre 3-5 años y la British Society of Gastroenterology recomienda el seguimiento cada 2 años14,23.
Si se encuentra displasia de bajo grado (DBG) en la biopsia la recomendación es que debería ser confirmada por 2 expertos patólogos debido a la gran variabilidad interobservador en la interpretación de estas biopsias. Ante el hallazgo de displasia de bajo grado y en el caso de ser un paciente que no está en tratamiento con inhibidores de la bomba de protones (IBP) parece recomendable comenzar con una terapia a altas dosis de IBP con la intención de reducir los cambios inflamatorios y regenerativos que pueden hacer complicado aseverar el diagnóstico patológico y, a continuación, repetir la endoscopia. En esta categoría las guías americanas son más uniformes y recomiendan vigilancia endoscópica en un intervalo de 6-12 meses hasta que no se encuentre displasia en 2 endoscopias consecutivas14,21,22. Desafortunadamente, los datos disponibles sobre la progresión desde la DBG a displasia de alto grado (DAG) o ACE presentan una gran variabilidad (0,6-13,4%)24. Recientemente se ha publicado un estudio multicéntrico25 en que se incluyen 210 pacientes con DBG con un seguimiento medio de 6 años. El riesgo de desarrollar adenocarcinoma fue de 0,44% y de desarrollar DAG del 1,6%. Los autores concluyeron que de manera global el riesgo de evolución de pacientes con DBG a adenocarcinoma es similar al de los pacientes sin displasia y no encontraron ningún factor de riesgo asociado a una mayor evolución, sugiriendo una revisión de las guías con un aumento del intervalo de seguimiento de estos pacientes hasta 2 años.
Si se encuentra DAG la recomendación homogénea de las guías de práctica clínica hasta ahora es la de realización de endoscopia a los 3 meses, sin embargo estas recomendaciones son susceptibles de variar en los próximos años por el rápido desarrollo de las técnicas ablativas endoscópicas. Es bien conocido que, concomitantemente con la displasia de alto grado, pueden existir focos de adenocarcinoma que no somos capaces de detectar debido a la limitación de la toma de biopsias. Estudios previos han publicado tasas de fallo en diagnóstico de DAG/adenocarcinoma del 15-20% siguiendo el protocolo actual25–28. A su vez, la adherencia al protocolo de Seatle por parte de los endoscopistas en la toma de biopsias es de solo el 50% en algunos estudios29,30. Existe evidencia de que la ablación endoscópica de los pacientes con displasia de alto grado se asocia a una disminución de la incidencia de ACE31 y es además coste-efectiva32. Esto conduce a pensar que la estrategia más acertada en estos pacientes sea la de confirmar la displasia de alto grado por un patólogo experto y posteriormente realizar la ablación endoscópica del epitelio displásico. En conclusión, los ensayos controlados, prospectivos aleatorizados han establecido que la ablación endoscópica es superior al tratamiento con PPI para prevenir la progresión desde DAG a ACE14 y podría ser considerada como primera opción terapéutica en pacientes añosos y con comorbilidades en los que el riesgo de la esofagectomía es elevado.
La vigilancia endoscópica en los pacientes con EB es un desafío clínico y económico en la actualidad teniendo en cuenta la baja tasa de progresión a DAG/ACE en los pacientes sin displasia (0,63% año) y el porcentaje de pacientes libre de cáncer a los 5 (98,6%) y 10 (97,1%) años de seguimiento33. El potencial elevado número de pacientes con EB, dada una prevalencia estimada en la población de un 1,6%34, es una barrera para una eficiente y coste-efectiva vigilancia endoscópica.
En este sentido se han publicado en los últimos años algunos estudios para valorar si la vigilancia endoscópica es coste-efectiva no solo en los pacientes sin displasia, sino también en los pacientes con displasia de bajo grado ya que hay datos que señalan que la tasa de progresión a ACE en estos pacientes es similar a la de los pacientes sin displasia (0,44%/año)25. En un estudio diseñaron un modelo para determinar si la ablación endoscópica del EB es una opción coste-efectiva para reducir la mortalidad por ACE32. Concluyeron que la ablación era la mejor estrategia para el tratamiento de los pacientes con displasia de alto grado y que también puede ser la estrategia preferente en los pacientes sin displasia y DBG, aunque el coste-eficacia de esta estrategia es dependiente de la eficacia a largo plazo y de si se puede suspender la vigilancia endoscópica tras el procedimiento ablativo. Por lo tanto, son necesarios estudios a largo plazo con este endpoint específico para poder afirmar que esta estrategia es coste-efectiva.
En una revisión publicada por Hirst et al.35 se llevaron a cabo evaluaciones económicas de las estrategias de vigilancia endoscópica para pacientes con EB sin displasia. Los autores concluyeron que hasta que no aparezcan nuevas técnicas que mejoren la supervivencia ajustada por calidad de vida otorgada por la vigilancia endoscópica, esta estrategia probablemente no es coste-efectiva.
En este aspecto, se están realizando estudios para identificar los factores predictivos de progresión a ACE (clínicos, demográficos y biomarcadores) que puedan ayudar a centrar la vigilancia endoscópica o la ablación en aquellos pacientes con mayor riesgo de progresión. Este tema se revisa en un apartado específico más abajo.
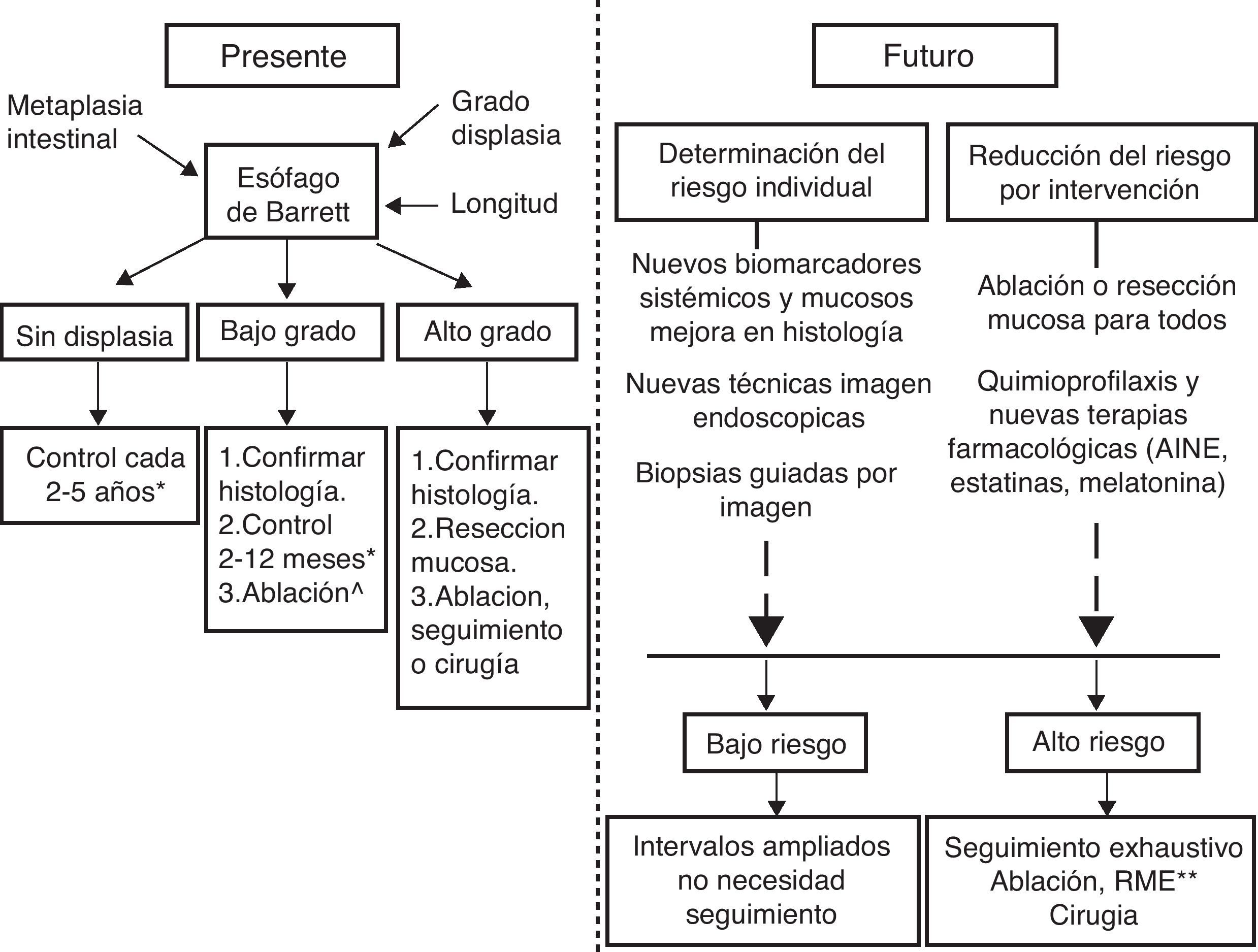
En conclusión, el debate acerca de si la vigilancia endoscópica es coste-efectiva, sobre todo en los pacientes con EB sin displasia y displasia de bajo grado, sigue vigente. Por el momento, y a pesar de ello, dado que la detección precoz de displasia de alto grado y AC en el paciente individual mejora su pronóstico, parece razonable llevar a cabo la vigilancia endoscópica en los intervalos máximos propuestos por las guías clínicas hasta que dispongamos de marcadores de progresión a ACE validados y una mayor experiencia y resultados de seguimiento a largo plazo de la efectividad con las técnicas ablativas (fig. 1).
¿Cómo debe realizarse el seguimiento endoscópico?El objetivo de la vigilancia endoscópica es detectar la displasia o el cáncer de manera precoz. Es importante controlar el reflujo gastroesofágico con terapia antisecretora para eliminar los síntomas y para reducir la inflamación producida por este, la cual hace difícil distinguir la displasia de los cambios regenerativos. La presencia de esofagitis erosiva es una contraindicación para la toma de biopsias. En el momento de la endoscopia el esófago debe ser examinado primero con luz blanca de alta resolución localizando, previamente a la toma de biopsias, los lugares clave como la unión esofagogástrica, la unión escamocolumnar o la presencia de hernia de hiato. No se recomienda el uso de técnicas como la cromoendoscopia o la cromoendoscopia electrónica (por ejemplo, NBI) de rutina aunque pueden ser útiles, sobre todo la cromoendoscopia electrónica36, para guiar la toma de biopsias en los pacientes con displasia conocida o en los que se han detectado irregularidades en la mucosa, las cuales han demostrado estar asociadas con displasia y ser un factor de riesgo para el desarrollo de ACE37. Dado que la distribución de la mucosa displásica y neoplásica es parcheada en el EB se recomienda obtener biopsias sistemáticas de los 4 cuadrantes en intervalos de 2cm a lo largo de toda la longitud del EB comenzando por margen más cercano a los pliegues gástricos y continuando hasta la zona de transición del epitelio escamocolumnar.
Existe evidencia de que la toma de biopsias con un intervalo de 1 cm junto con la toma de biopsia de las lesiones visibles es más efectiva en la detección de ACE en los pacientes con displasia de alto grado, método conocido como «protocolo de Seattle»38, el cual las guías recomiendan seguir también en pacientes con displasia conocida. Existe evidencia a través de un estudio prospectivo de que la instauración de un protocolo riguroso similar al anterior aumenta el número de casos de displasia de alto grado y de cáncer invasivo39.
La realización de un protocolo sistemático de toma de biopsias ha demostrado detectar más displasia y más cáncer precoz que las biopsias aleatorias para este fin40.
Sin embargo, la realidad en las unidades de endoscopia es que la vigilancia no se realiza de manera tan rigurosa. Un estudio retrospectivo llevado a cabo en Holanda reveló que la adherencia al protocolo de Seattle era buena (79%) para los casos en los cuales el segmento metaplásico no superaba los 5cm de longitud pero disminuía hasta el 30% en los casos en los que el segmento metaplásico medía entre 10 y 15cm41.
Asimismo, en un estudio estadounidense de 2245 pacientes con EB se comprobó que la adherencia al protocolo de Seattle era del 51% de los casos42. Como en el anterior estudio, la adherencia era inversamente proporcional a la longitud del epitelio metaplásico. Además, la no adherencia al protocolo se asociaba con un descenso significativo en la detección de displasia. Estos estudios señalan que aunque la adherencia a los protocolos de vigilancia recomendados se asocia a mayores tasas de detección de displasia, muchos gastroenterólogos no se adhieren a los mismos y esta adherencia parece ser peor en aquellos pacientes con mayor riesgo de desarrollar ACE (pacientes con segmento extenso de metaplasia).
En resumen, la utilización de un protocolo sistemático de toma de biopsias ha demostrado detectar displasia y cáncer precoz de manera eficaz. Sin embargo, la adherencia a este tipo de protocolos por parte de los gastroenterólogos dista mucho de ser óptima. Muy posiblemente en los próximos años la mejora de los aparatos de endoscopia y el uso de nuevas técnicas de imagen y, sobre todo, la validación de biomarcadores nos ayuden a detectar con mayor precisión aquellos pacientes con más riesgo de progresión con el fin de seleccionar mejor a los pacientes candidatos a seguimiento endoscópico de aquellos subsidiarios de terapias ablativas.
¿Podemos utilizar biomarcadores en lugar de displasia para estratificar el riesgo del esófago de Barret?En los últimos años se han propuesto algunos biomarcadores individuales o paneles de ellos para predecir el riesgo de progresión neoplásica y, por lo tanto, la necesidad de vigilancia endoscópica más exhaustiva o tratamiento más agresivo en los pacientes con EB. En general, estos biomarcadores reflejan las anomalías en el ADN adquiridas durante el proceso de carcinogénesis. Estos biomarcadores todavía no han sido validados en estudios prospectivos, controlados. Algunos biomarcadores prometedores que han sido evaluados son la pérdida de heterocigosidad de 17p (17pLOH), aneuploidía/tetraploidía y paneles de biomarcadores que incluyen los anteriores, así como la pérdida de heterocigosidad de 9p y la metilación de algunos genes supresores de tumores como p16. Existen datos que indican que la aneuploidía/tetraploidía, 17p LOH y los biomarcadores basados en la metilación de genes supresores de tumores pueden ser superiores a la histología aislada para estratificar el riesgo de aquellos pacientes con EB cuya biopsia inicial no mostraba displasia o mostraba displasia de bajo grado43–46. Es posible que en un futuro estos biomarcadores sean usados para determinar qué pacientes con EB se beneficiarán de vigilancia endoscópica más exhaustiva o de técnicas ablativas, pero por el momento el uso sistemático de los biomarcadores en lugar del grado de displasia para estratificar el riesgo en pacientes con EB no puede recomendarse.
ConclusiónEl EB aumenta el riesgo de desarrollar adenocarcinoma de ACE dependiendo sobre todo del grado de displasia y de la longitud del mismo. El seguimiento endoscópico de estos pacientes es una práctica establecida, pero la frecuencia de los intervalos de seguimiento no se encuentra avalada por evidencia proveniente de ensayos controlados y aleatorizados. Por lo tanto, se encuentra sujeta a interpretación y no existe un criterio uniforme entre las diferentes sociedades científicas. Diferentes estudios observacionales indican que el seguimiento endoscópico del EB es una estrategia apropiada, ya que ha demostrado mejoría en la supervivencia de los ACE detectados en el seguimiento con respecto a los detectados tras la aparición de síntomas. El debate actual se traslada fundamentalmente a establecer los intervalos de seguimiento más adecuados y, sobre todo, a identificar los pacientes con mayor riesgo de desarrollar ACE, que son los que se beneficiarían de un seguimiento más exhaustivo, mientras parece razonable aumentar los intervalos de seguimiento en los pacientes con bajo riesgo de progresión, reduciendo de esta manera los costes y mejorando la calidad de vida de los pacientes. La evidencia emergente más reciente indica que el riesgo de progresión de los pacientes con EB sin displasia e incluso de pacientes con DBG hacia DAG/ACE es muy reducida. Por lo tanto, creemos necesaria una revisión de las guías de práctica clínica actuales adaptándose a la evidencia disponible y aumentando los intervalos de seguimiento en pacientes con bajo riesgo. El desarrollo de las técnicas endoscópicas, la mejora en la toma de muestras, la creación de paneles de biomarcadores y la realización de estudios controlados aleatorizados a largo plazo en los próximos años podrían aportar los datos necesarios para hacer un seguimiento más individualizado dependiendo de las características individuales de cada paciente, y no solo dependiendo del grado de displasia y la longitud del EB.
Conflicto de interesesEl autor Dr. Angel Lanas declara haber participado en comités de estudios multicéntricos llevados a cabo por Bayer, AstraZeneca y Roche, y en reuniones científicas organizadas por Pfizer.