Durante años ha sido habitual, con técnicas de RT-PCR para el ARN-VHC, expresar como menores del límite inferior de cuantificación (< LIC) tanto las cargas virales indetectables como las detectables < LIC. Ello podría causar error en el manejo de algunos pacientes.
ObjetivoAnalizar la frecuencia e impacto clínico de considerar negativos los ARN-VHC detectables pero no cuantificables.
MétodosAnálisis retrospectivo de las determinaciones de ARN-VHC del período 2009-2011 (Cobas/Taqman, LIC: 15UI/ml) diferenciando las cargas indetectables de las < LIC.
ResultadosSe analizaron 2.432 muestras de ARN-VHC en 1.371 pacientes encontrando 26 ARN < 15 (1,07%) en 23 pacientes (1,68%). Los ARN <15 predominaron en pacientes en tratamiento: 23 de 216 determinaciones de ARN-VHC (10,6%) y 20 de 88 pacientes (22,7%). El análisis del impacto clínico mostró: a) 2 pacientes informados de ARN-VHC < 15 tuvieron ARN cuantificables posteriormente; b) 8 de 9 pacientes (88,9%) con ARN < 15 solo en semana 4 de tratamiento alcanzaron RVS; c) los 3 pacientes con ARN < 15 en semana 12 y 48 semanas de tratamiento recidivaron; d) los 4 pacientes con ARN < 15 en semana 24 y/o posteriores fracasaron, y e) en 5 pacientes el impacto clínico fue nulo o no evaluable.
ConclusionesEl ARN < LIC indica viremia y asimilarlo a ARN-VHC negativo puede inducir a error en el manejo de la infección. Los ARN < LIC son especialmente prevalentes en pacientes en tratamiento. La edición de los resultados de la cuantificación del ARN-VHC debe ser clara, diferenciando la indetectabilidad de la positividad pero señalando esta cuando no sea cuantificable.
For years many clinical laboratories have routinely classified undetectable and unquantifiable levels of hepatitis C virus RNA (HCV-RNA) determined by RT-PCR as below limit of quantification (BLOQ). This practice might result in erroneous clinical decisions.
AimTo assess the frequency and clinical relevance of assuming that samples that are BLOQ are negative.
Material and methodWe performed a retrospective analysis of RNA determinations performed between 2009 and 2011 (Cobas/Taqman, lower LOQ: 15 IU/ml). We distinguished between samples classified as «undetectable» and those classified as «<1.50E+01IU/mL» (BLOQ).
ResultsWe analyzed 2.432 HCV-RNA measurements in 1.371 patients. RNA was BLOQ in 26 samples (1.07%) from 23 patients (1.68%). BLOQ results were highly prevalent among patients receiving Peg-Riba: 23 of 216 samples (10.6%) from 20 of 88 patients receiving treatment (22.7%). The clinical impact of BLOQ RNA samples was as follows: a) 2 patients initially considered to have negative results subsequently showed quantifiable RNA; b) 8 of 9 patients (88.9%) with BLOQ RNA at week 4 of treatment later showed sustained viral response; c) 3 patients with BLOQ RNA at weeks 12 and 48 of treatment relapsed; d) 4 patients with BLOQ RNA at week 24 and/or later had partial or breakthrough treatment responses, and e) in 5 patients the impact were null or could not be ascertained.
ConclusionsThis study suggests that BLOQ HCV-RNA indicates viremia and that equating a BLOQ result with a negative result can lead to treatment errors. BLOQ results are highly prevalent in on-treatment patients. The results of HCV-RNA quantification should be classified clearly, distinguishing between undetectable levels and levels that are BLOQ.
La cuantificación del ARN del virus de la hepatitis C (ARN-VHC) es una herramienta imprescindible para el control del tratamiento antiviral1, estando las técnicas comerciales de PCR en tiempo real, que cuantifican valores del orden de 10-20UI/ml2–7, ampliamente introducidas en el ámbito asistencial. Los métodos de cuantificación presentan un intervalo de linealidad definido por un valor límite inferior (LIC) y un valor límite superior (LSC) que son calculados por el fabricante y sus recomendaciones son seguidas por los laboratorios clínicos que aplican estas técnicas. Así, un resultado expresado como inferior al LIC (< 15UI/ml en la versión de la plataforma automatizada COBAS AMPLIPREP™/COBAS-TaqMan™3–5 utilizada en nuestro centro) debe entenderse como un resultado detectable no cuantificable, al estar el valor en UI/ml obtenido por debajo del rango de linealidad pero no del límite de detección (LD). Expresar los resultados de viremia indetectable de la misma manera que los resultados inferiores al LIC, una práctica extendida hasta hace poco tiempo en muchos laboratorios, podría inducir a errores en el manejo de algunos pacientes. Ello podría ocurrir tanto en el diagnóstico de la infección como al valorar la cinética viral durante el tratamiento de la hepatitis C.
ObjetivoDiferenciar las determinaciones de ARN-VHC indetectables de aquellas detectables inferiores al LIC en el período 2009-2011, cuantificar la frecuencia de estas últimas y analizar si su asimilación a viremia negativa pudo haber tenido significación clínica al haber inducido errores diagnósticos o de manejo terapéutico de los pacientes.
Pacientes y métodoPacientesA efectos asistenciales, los servicios de Aparato Digestivo y de Análisis Clínicos del Hospital de Girona Doctor Josep Trueta cubren un área de población en torno a las 200.000 personas.
Pacientes con algún ARN < 15 UI/mlSe han analizado retrospectivamente todas las cuantificaciones del ARN-VHC realizadas entre el 1 de enero de 2009 y el 31 de marzo de 2011 y prospectivamente desde esta última fecha hasta el 31 de diciembre del mismo año. De los resultados expresados como < 15UI/ml se han diferenciado, a través de la revisión retrospectiva de los registros de los valores de Ct (umbral crítico) de los ensayos, los resultados detectables pero no cuantificables (no cuantificables, < 15UI/ml, < LIC) de los indetectables.
Una vez identificadas las muestras < 15UI/ml, se revisaron los cursos clínicos y analíticos de estos pacientes y, tras analizar sus circunstancias clínicas y/o de manejo terapéutico, se identificaron diferentes grupos de posible impacto clínico. La revisión de las historias clínicas de los pacientes se hizo de acuerdo con las normas de acceso a los programas informáticos oficiales o siguiendo el circuito oficial de solicitud y en las zonas reservadas a tal fin en el archivo de historias clínicas del Hospital de Girona Doctor Josep Trueta.
Grupo controlAl corresponder la mayoría de las cargas virales con ARN < 15 UI/ml a pacientes con hepatitis crónica C (HCC) en tratamiento con interferón pegilado y ribavirina (PR), este grupo se ha comparado con un grupo control formado por el resto de pacientes en tratamiento por HCC que tuviesen algún ARN-VHC estudiado en el mismo período 2009-2011 y en los que las cargas virales informadas como < 15UI/ml fueron cargas indetectables. Al tratarse de pacientes que recibieron tratamiento en un período fijo de tiempo y según práctica clínica real, muchos de ellos no tuvieron disponibles todos los estudios de carga viral necesarios para un control preciso del tratamiento guiado por la respuesta. Los resultados de ARN-VHC no encontrados para esta revisión retrospectiva se han considerado no realizados. Ello ha limitado las comparaciones entre ambos grupos por lo que al impacto clínico de tener una carga viral < 15UI/ml se refiere.
FrecuenciasLa frecuencia de la detección del ARN-VHC detectable < 15UI/ml se ha referido al número total de muestras y al de pacientes estudiados en el período 2009-2011.
La frecuencia de detección de ARN < 15UI/ml por pacientes también se ha referido al número total de los pacientes tratados por hepatitis C que tuviesen alguna determinación de carga viral en el período del estudio.
Análisis clínicosLa cuantificación del ARN viral se realizó mediante la plataforma automatizada COBAS AMPLIPREP™/COBAS-TaqMan™ (CAP-CTM) HCV Test, con LIC en 15UI/ml. El CAP-CTM HCV Test muestra sus resultados como: a) diana indetectable; b) diana detectable pero no cuantificable, fijándose el LIC en 15UI/ml; c) diana de cuantificación variable entre 15 y 49UI/ml y linealidad satisfactoria entre 49 y 69.000.000 (LSC) UI/ml, y d) diana no cuantificable por encima del LSC. Esta técnica se venía aplicando en el Servicio de Análisis Clínicos desde mediados del año 2008. En ningún momento, desde la implementación del CAP-CTM HCV Test hasta la actualidad, el Servicio de Análisis Clínicos del Hospital de Girona Doctor Josep Trueta ha conocido problema alguno relativo a una sospecha de falsa positividad de la técnica por parte de los facultativos solicitantes.
DefinicionesLas definiciones de respuesta viral en semana 4 (respuesta viral rápida [RVR]), respuesta viral en semana 12 (respuesta viral precoz [RVP] tanto parcial como total), breakthrough y respuesta viral sostenida [RVS]) son las habituales de las guías de consenso y práctica clínica para el tratamiento de la hepatitis crónica C con PR8.
Los términos ARN < LIC, ARN-VHC no cuantificable, ARN detectable pero no cuantificable, ARN < 15UI/ml, ARN <15 o ARN no cuantificable se han utilizado de forma indistinta a lo largo del artículo.
Análisis estadísticoSe ha utilizado estadística descriptiva, el test de chi al cuadrado con tablas de contingencia para comparación de variables cualitativas y la t de Student o la prueba de Mann-Whitney para comparación de variables cuantitativas.
ResultadosLa revisión retrospectiva de las determinaciones cuantitativas del ARN-VHC en el período comprendido entre el 1 de enero de 2009 y el 31 de marzo de 2011 detectó 22 pacientes con al menos una determinación de ARN-VHC < 15UI/ml. Desde el 1 de abril hasta el 31 de diciembre de 2011 se identificó de forma prospectiva una nueva paciente (paciente 19), genotipo 1 con ARN-VHC < 15UI/ml en semana 12 de tratamiento (3.529 UI/ml en semana 4 e indetectable en semana 24, lo que supuso alargar su tratamiento hasta la semana 72). Así, se identificaron un total de 23 pacientes con 26 determinaciones de ARN-VHC informadas como < 15UI/ml en el citado período de tiempo.
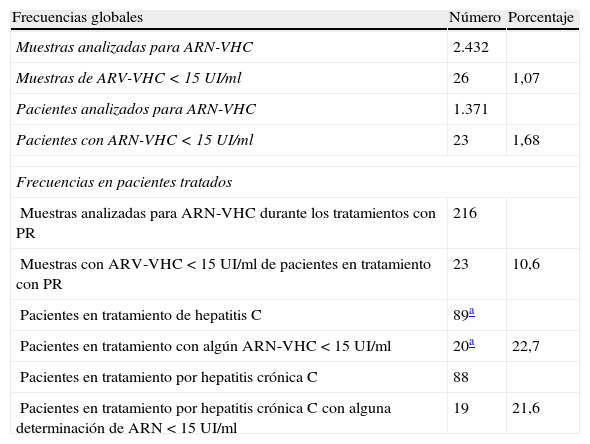
Frecuencias y perfil de los pacientesLa tabla 1 muestra las frecuencias relativas de la detección de ARN-VHC < 15UI/ml. En el período 2009-2011, el Servicio de Análisis Clínicos del Hospital Universitario de Girona realizó 2.432 determinaciones de carga viral del VHC en 1.371 pacientes de su área de influencia asistencial. Se detectaron 26 muestras de ARN-VHC < 15UI/ml (1,07%) correspondientes a 23 de dichos pacientes (1,68%). De los 23 pacientes, 20 estaban en tratamiento antiviral (uno por hepatitis aguda y 19 por hepatitis crónica) y solo en 2 la detección del ARN-VHC < 15UI/ml tuvo lugar en estudios de infección de hepatitis C. El paciente restante estaba en evolución de una hepatitis aguda C que no necesitó tratamiento.
Frecuencia de detección de ARN-VHC < 15UI/ml en el período 2009-2011
| Frecuencias globales | Número | Porcentaje |
| Muestras analizadas para ARN-VHC | 2.432 | |
| Muestras de ARV-VHC < 15UI/ml | 26 | 1,07 |
| Pacientes analizados para ARN-VHC | 1.371 | |
| Pacientes con ARN-VHC < 15UI/ml | 23 | 1,68 |
| Frecuencias en pacientes tratados | ||
| Muestras analizadas para ARN-VHC durante los tratamientos con PR | 216 | |
| Muestras con ARV-VHC < 15UI/ml de pacientes en tratamiento con PR | 23 | 10,6 |
| Pacientes en tratamiento de hepatitis C | 89a | |
| Pacientes en tratamiento con algún ARN-VHC < 15UI/ml | 20a | 22,7 |
| Pacientes en tratamiento por hepatitis crónica C | 88 | |
| Pacientes en tratamiento por hepatitis crónica C con alguna determinación de ARN < 15UI/ml | 19 | 21,6 |
PR: IFN-pegilado+ribavirina.
La detección de ARN-VHC < 15UI/ml fue especialmente frecuente en pacientes que recibían tratamiento antiviral. Tuvo lugar en el 22,7% de los pacientes tratados y en el 10,6% de las determinaciones de ARN-VHC obtenidas durante los tratamientos realizados en el citado período de tiempo (tabla 1).
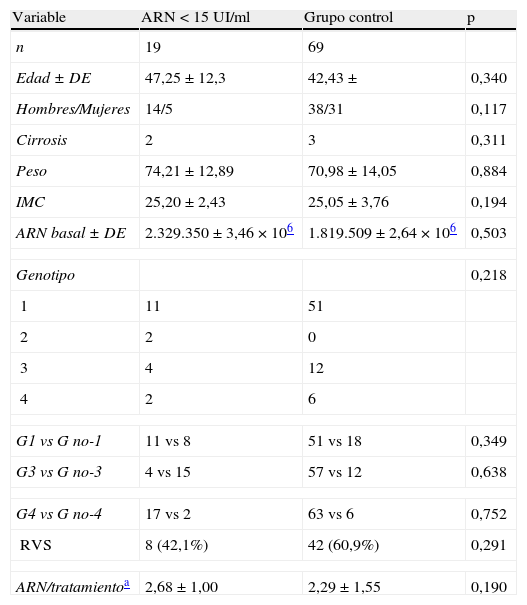
No existieron diferencias en las variables demográficas, clínicas y virológicas entre los pacientes tratados que tuvieron alguna carga viral < 15UI/ml y en quienes no las presentaron (grupo control). Aunque la RVS analizada según intención de tratamiento fue inferior en el grupo con ARN < 15UI/ml y el número de estudios de carga viral superior, estas diferencias no tuvieron significación estadística (tabla 2).
Grupo ARN < 15UI/ml vs grupo control
| Variable | ARN<15 UI/ml | Grupo control | p |
| n | 19 | 69 | |
| Edad±DE | 47,25±12,3 | 42,43± | 0,340 |
| Hombres/Mujeres | 14/5 | 38/31 | 0,117 |
| Cirrosis | 2 | 3 | 0,311 |
| Peso | 74,21±12,89 | 70,98±14,05 | 0,884 |
| IMC | 25,20±2,43 | 25,05±3,76 | 0,194 |
| ARN basal±DE | 2.329.350±3,46×106 | 1.819.509±2,64×106 | 0,503 |
| Genotipo | 0,218 | ||
| 1 | 11 | 51 | |
| 2 | 2 | 0 | |
| 3 | 4 | 12 | |
| 4 | 2 | 6 | |
| G1 vs G no-1 | 11 vs 8 | 51 vs 18 | 0,349 |
| G3 vs G no-3 | 4 vs 15 | 57 vs 12 | 0,638 |
| G4 vs G no-4 | 17 vs 2 | 63 vs 6 | 0,752 |
| RVS | 8 (42,1%) | 42 (60,9%) | 0,291 |
| ARN/tratamientoa | 2,68±1,00 | 2,29±1,55 | 0,190 |
IMC: índice de masa corporal; RVS: respuesta viral sostenida.
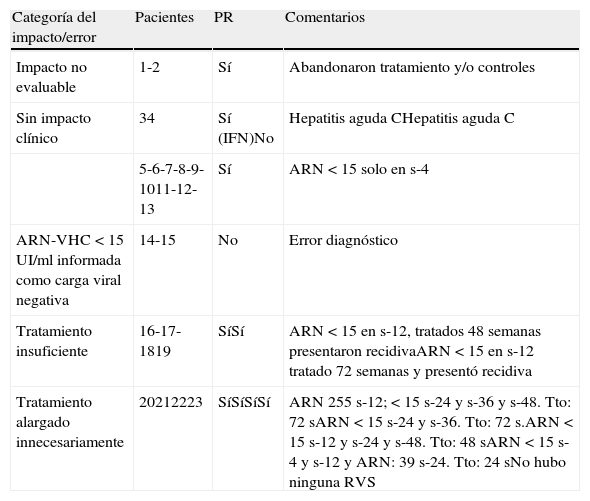
La tabla 3 muestra el análisis de las diversas causas por las que considerar negativa una carga viral < 15UI/ml podría afectar desfavorablemente al manejo de algunos pacientes con HCC.
[Sj1] Impacto clínico de considerar negativo el ARN-VHC detectable no cuantificable (< 15UI/ml)
| Categoría del impacto/error | Pacientes | PR | Comentarios |
| Impacto no evaluable | 1-2 | Sí | Abandonaron tratamiento y/o controles |
| Sin impacto clínico | 34 | Sí (IFN)No | Hepatitis aguda CHepatitis aguda C |
| 5-6-7-8-9-1011-12-13 | Sí | ARN < 15 solo en s-4 | |
| ARN-VHC < 15 UI/ml informada como carga viral negativa | 14-15 | No | Error diagnóstico |
| Tratamiento insuficiente | 16-17-1819 | SíSí | ARN < 15 en s-12, tratados 48 semanas presentaron recidivaARN<15 en s-12 tratado 72 semanas y presentó recidiva |
| Tratamiento alargado innecesariamente | 20212223 | SíSíSíSí | ARN 255 s-12; < 15 s-24 y s-36 y s-48. Tto: 72 sARN < 15 s-24 y s-36. Tto: 72 s.ARN < 15 s-12 y s-24 y s-48. Tto: 48 sARN < 15 s-4 y s-12 y ARN: 39 s-24. Tto: 24 sNo hubo ninguna RVS |
PR: IFN-pegilado+ribavirina; s: semana; RVS: respuesta viral sostenida; Tto: duración del tratamiento.
Dos pacientes (1, 2) en tratamiento por HCC y ARN-VHC < 15 UI/ml (2 en semana 4 y 1 en semana 12), abandonaron el tratamiento y/o uno o más controles clínicos y/o analíticos. Ello imposibilitó el análisis del posible impacto clínico de estas viremias.
Sin impacto clínicoDe los 11 pacientes en los que se consideró ausencia de impacto clínico, uno (paciente 3) estaba en la semana 2 de tratamiento de una hepatitis aguda C (HAC) postransfusional y alcanzó RVS. Otro paciente (paciente 4) evolucionaba espontáneamente a la curación de una HAC de probable adquisición intrahospitalaria y actualmente lleva 3 años de ARN-VHC indetectable. Los 9 pacientes restantes (pacientes 5 al 13) presentaron determinaciones de carga viral < 15UI/ml solo en la semana 4 de tratamiento, alcanzando 8 de los 9 (88,9%) RVS. Esta tasa de RVS fue similar a la de los 23 pacientes del grupo control con ARN indetectable en semana 4 (81,1%) (p=0,6; NS) y ambas tasas fueron significativamente superiores a la obtenida en los 16 pacientes con ARN-VHC cuantificables en semana 4 (37,2%) (p=0,001 y p=0,006, respecto al grupo ARN < 15UI/ml y el grupo control, respectivamente).
Impacto clínico por viremias < 15 UI/ml informadas como negativasA 2 pacientes (14, 15) varones con antecedentes de ADVP, positivos para IgG-anti-VHC y no tratados de esta infección, se les informó de presentar una carga viral negativa en presencia de ARN-VHC < 15UI/ml. El primero de ellos, IgG anti-VIH positivo y carga VIH de 540 copias/ml, fue estudiado nuevamente 20 días más tarde y el ARN-VHC fue de 59UI/ml. El segundo paciente pudo ser recuperado 13 meses después del estudio inicial, mostrando un ARN-VHC de 250.000UI/ml, ser genotipo 3 y ALT de 166 U/l.
Impacto clínico por ARN < 15 UI/ml en semana 12Tres pacientes (16, 17 y 18) con ARN-VHC < 15UI/ml en semana 12 e indetectable en semana 24 y posteriores (RVP parcial y posibles respondedores lentos candidatos a tratamientos de 72 semanas) hicieron tratamientos de 48 semanas y todos recidivaron postratamiento. También recidivaron los 4 pacientes del grupo control que mostraron RVP parcial e hicieron solo 48 semanas de tratamiento. Por el contrario, los 13 pacientes del grupo control con ARN indetectable en semana 12 y posteriores (RVP completa) tuvieron una tasa de RVS del 84,6%. La tasa de RVS global de todos pacientes (42, de ambos grupos) que hicieron 48 semanas de tratamiento fue del 71,4%.
De forma adicional, la paciente 19, identificada de forma prospectiva en marzo de 2011, naïve, genotipo 1, ARN de 3.529 UI/ml en semana 4, ARN-VHC < 15UI/ml en semana 12, y a quien se alargó el tratamiento hasta la semana 72, mostró recidiva virológica y bioquímica en la semana 24 postratamiento.
Impacto clínico por ARN < 15UI/ml en semana 24 o posterioresEn 4 pacientes (20, 21, 22 y 23) la detección de ARN-VHC en semana 24 o posteriores hubiese sugerido la falta de respuesta y/o breakthrough, aconsejando la interrupción del tratamiento por falta de respuesta. Ninguno de ellos alcanzó la RVS. El paciente 23 fue el primero en quien se sospechó la importancia de discriminar entre resultado de ARN detectable < LIC o ARN indetectable. Así, ninguno de los 3 pacientes en quienes se detectó una carga viral < 15UI/ml en la semana 24 y/o posteriores alcanzó RVS pero sí lo consiguieron 6 de 7 pacientes del grupo control (85,7%) que hicieron tratamientos de 72 semanas y cuyo último ARN detectable y cuantificado ocurrió en semana 12.
DiscusiónEl análisis de esta serie confirma las instrucciones del fabricante indicando que un resultado de ARN-VHC mediante COBAS AMPLIPREP™/COBAS-TaqMan™ (CAP-CTM) detectable pero inferior al LIC (< 15UI/ml) es indicativo de viremia, muy baja pero real. Por lo tanto, asimilar un resultado de ARN-VHC < 15UI/ml a la indetectabilidad implica un serio riesgo de error diagnóstico o de manejo inadecuado de los pacientes tratados con PR.
La detección de ARN-VHC < 15UI/ml podría considerarse un hallazgo infrecuente: 1,07% de las muestras analizadas y 1,68% de los pacientes a quienes se solicitó una carga viral. Nuestro estudio confirma que, por el contrario, la detección de estas cargas virales es un fenómeno muy frecuente en los pacientes en tratamiento con PR: 10,6% de las muestras obtenidas durante el tratamiento y en el 22,5% de los pacientes en algún momento del mismo. Por lo tanto, es en los pacientes tratados donde debe prestarse especial atención a la detección viremias inferiores al LIC. En el análisis de Harrington et al., de los estudios de registro de telaprevir y boceprevir, en los que se puso un cuidado especial en diferenciar los ARN indetectables de los ARN no cuantificables, la detección de estas últimas cargas virales fue un fenómeno mucho más frecuente9. Tuvo lugar en el 52% de los pacientes del estudio SPRINT-2 de registro del boceprevir y en el 67% de los pacientes del estudio REALIZE de registro del telaprevir. En nuestra opinión, la explicación de estas diferencias respecto a nuestros resultados podría ser doble. Por una parte podría deberse al diferente LIC del COBAS AMPLIPREP™/COBAS-TaqMan™ de estos estudios (25UI/ml) y del nuestro (15UI/ml), teniendo todos un límite de detección de unos 10UI/ml. Otra explicación, no excluyente, podría estar en el bajo número de estudios de carga viral realizados durante el tratamiento en nuestros pacientes (216 determinaciones en 88 pacientes, 2,45 determinaciones de ARN/paciente en tratamiento). Podríamos, así, haber dejado inadvertidas otras determinaciones de ARN no cuantificable que pudiesen explicar algunos fracasos o recidivas postratamiento. Ello refuerza la necesidad de cumplimentar todos y cada uno de los controles de viremia, si queremos reducir recidivas y optimizar recursos terapéuticos.
Los 2 pacientes positivos para IgG-anti-VHC y ARN-VHC < 15 UI/ml ilustran de manera especial el posible error de considerar negativa una carga viral <15UI/ml. Ambos tenían antecedentes de ADVP, uno de ellos presentaba coinfección por VIH no controlada y ambos presentaron determinaciones de ARN-VHC cuantificables al ser estudiados posteriormente. Es posible que representen viremias obtenidas en fases muy precoces de la infección por el VHC más que viremias en los límites de la detección en ausencia de tratamiento antiviral.
La detección de ARN-VHC < 15UI/ml en la semana 4 no parece tener impacto clínico en la mayoría de los pacientes a efectos de manejo terapéutico. Los 9 pacientes incluidos en el grupo 2 mantuvieron cargas virales indetectables hasta el final del tratamiento y 8 alcanzaron RVS. Sarrazin et al. llegaron a la misma conclusión al comparar las tasas de RVR en muestras analizadas con el test cualitativo COBAS Amplicor™ HCV Test v2.0 (CA), con LIC < 50UI/ml10, y COBAS AMPLIPREP™/COBAS-TaqMan™ (CAP-CTM) y considerando para esta última técnica tanto niveles de detección de < 15UI/ml como la indetectabilidad. Los 3 niveles de definición de RVR considerados en su estudio (< 50UI/ml para el CA y < 15UI/ml e indetectabilidad para el CAP-CTM) acabaron por traducirse en las mismas tasas de RVS. Los autores señalaron que alcanzar niveles tan bajos de carga viral en la semana 4 indican una caída muy rápida de la viremia y, por lo tanto, de alta respuesta al tratamiento y concluyeron que puede aceptarse una carga viral detectable < 15U/ml con el CAP-CTM como criterio de RVR y utilizarla para acortar la duración de algunos tratamientos11. Nuestra revisión sugiere que la detección de cargas del VHC < LIC en semana 12 y posteriores en el tratamiento con PR son críticas para la toma de decisiones en el tratamiento dirigido según respuesta, algo también observado en el estudio de Sarrazin et al. en pacientes con genotipo 111. La evolución seguida por nuestros pacientes parece indicar que: a) un ARN-VHC < 15UI/ml en semana 12 e indetectable en semana 24 identifica respondedores lentos al tratamiento con PR, y la necesidad de alargarlo hasta la semana 72, y b) un ARN-VHC < 15UI/ml en semana 24 y/o posteriores indicaría falta de respuesta o breakthrough.
Estas consideraciones relativas al valor predictivo de las cargas virales < LIC en la terapia con PR son, en gran manera, superponibles a las obtenidas en paciente en terapia triple con inhibidores de la proteasa NS3/4A de primera generación, boceprevir y telaprevir. Las reglas de parada («futility rules»), mucho más complejas en terapia triple, han considerado imprescindible diferenciar el LIC del LD12–15. Tanto en los estudios en fase ii y fase iii de telaprevir como de boceprevir16–21, aquellos pacientes con cargas virales detectables < LIC (25UI/ml en su versión del CAP-CTM) en momentos clave del tratamiento guiado por la respuesta tuvieron RVS inferiores a aquellos en los que el ARN fue indetectable9. La ausencia de detección es utilizada como criterio para poder acortar el tratamiento en los pacientes no cirróticos, naïve, y recidivantes tras tratamiento doble (semanas 4 a 24 con telaprevir y semanas 8 a 28 con boceprevir) mientras que el ARN cuantificable (> 25UI/ml; LIC de estudios de registro: 25UI/ml) es criterio de no respuesta y parada del tratamiento tras 24 semanas de haber iniciado el tratamiento triple16–22.
Para los facultativos que asisten a pacientes con infección por los virus VHB, VHC y VIH ha sido práctica habitual, durante años, recibir resultados de carga viral expresados como < LIC. Sin embargo, y por lo que respecta al VHC, hay que considerar que en los resultados expresados como < LIC (< 15UI/ml en nuestra versión del CAP-CTM) el test se comportaría como un test cualitativo capaz de detectar viremias de hasta 10UI/ml2,3. Así, su límite de detección se acercaría al de otra técnica de sensibilidad extremadamente alta como la PCR cualitativa con amplificación mediada por transcripción (TMA-PCR) de Siemens, Versant®, cuyo límite inferior de detección es de 5-10UI/ml23–26. Hay, por lo tanto, razones muy sólidas, no solo de carácter clínico y terapéutico sino también de tecnología en el laboratorio de análisis clínicos para cambiar la expresión de los resultados de la carga viral del VHC de como se ha venido haciendo hasta la actualidad. Las técnicas de PCR en tiempo real son técnicas cuantitativas y como tal se ha diseñado la expresión de sus resultados. Sin embargo, es hora de que, al editar los resultados del ARN-VHC, se expresen de forma clara cualquiera de las 3 opciones posibles: a) ARN indetectable; b) ARN detectable pero no cuantificable (< LIC), y c) el valor numérico obtenido cuando la carga viral sea cuantificable.
Conflicto de interesesLos autores declaran no tener conflicto alguno de intereses.
Datos preliminares y parciales de este trabajo han sido presentados en forma de póster en el XXXVIII Congreso Anual de la Asociación Española para el Estudio del Hígado, Madrid: Acero Fernández D, Louvrie Freire R, Ferri Iglesias MJ, Lopez Nuñez C, Aldeguer Manté X. Considerar negativa una carga viral expresada como inferior al límite de cuantificación puede inducir a error en el diagnóstico y el manejo del tratamiento de la hepatitis crónica C (HCC). Gastroenterol Hepatol. 2013;36 (Espec Congr 1):77.