Una de las definiciones más populares de la tan nombrada «medicina basada en la evidencia» (MBE) es la de «la utilización consciente, explícita y juiciosa de la mejor evidencia clínica disponible para tomar decisiones sobre el cuidado de los pacientes». La práctica de la MBE significa, por tanto, la integración de la maestría clínica individual con las mejores evidencias científicas externas disponibles a partir de una investigación clínica. Aunque este último componente –la identificación de la evidencia– parece, en teoría, relativamente fácil de adquirir, en la práctica los profesionales sanitarios se ven desbordados por una cantidad de información imposible de manejar. Así, hoy más que nunca hay diversos motivos que hacen necesario gestionar correctamente el conocimiento. En primer lugar, sufrimos actualmente un exceso de información, habiendo pasado en tan sólo unos pocos años de no disponer de fuentes de información a nadar en una sobreabundancia que nos satura y que puede ser ciertamente contraproducente. Se calcula que se habrán realizado cientos de miles de ensayos clínicos aleatorizados sobre diferentes aspectos de la asistencia sanitaria desde 1948, año en el que se publicó el primero de estos estudios. Y el futuro se promete imparable en cuanto a la expansión continua de la información obtenida mediante la investigación. A modo de ejemplo del exceso de información al que nos vemos sometidos, si introducimos el término «enfermedad de Crohn» o Crohn’s disease en cualquiera de los buscadores de internet actualmente disponibles (Altavista, Yahoo, Google, etc.), encontraremos más de 2 millones de direcciones con información relacionada, lo que evidentemente supone una cifra desorbitada.
En segundo lugar, disponemos actualmente de un número inagotable de fuentes; así, se publican anualmente más de 25.000 revistas y más de 10 millones de referencias en MEDLINE. A modo de ejemplo, si introducimos de nuevo el término Crohn’s disease en la casilla de PubMed (el motor de búsqueda más conocido de MEDLINE), identificaremos más de 26.000 referencias bibliográficas relacionadas con esa enfermedad, lo que de nuevo supone una cifra realmente difícil de digerir. En este sentido, un médico que intente mantenerse al día sólo en su especialidad debería leer, teóricamente, más de 100 artículos completos cada semana, o más de 500 el día de vuelta de sus vacaciones de verano. Por otro lado, el tiempo disponible para la búsqueda de información y el estudio es cada vez más limitado. Como consecuencia de lo anterior, los conocimientos del médico se deterioran rápidamente tras finalizar la carrera de medicina (o el programa de formación continuada que posteriormente se haya llevado a cabo). Este hecho está magníficamente expresado en una figura ya clásica, donde el eje de ordenadas representa los conocimientos actualizados sobre el mejor tratamiento y el eje de abscisas los años desde la graduación, y se observa lo que se ha denominado una peligrosa «pendiente resbaladiza».
En tercer lugar, la calidad de las diversas fuentes de información es desigual, por lo que el problema al que nos enfrentamos no es sólo el exceso de información, sino el que la calidad de la mayoría de las fuentes es deficiente. Por último, los contenidos de las fuentes de información se quedan obsoletos rápidamente, lo que supone una limitación adicional de los sistemas actuales. Por tanto, necesitamos disponer de herramientas que nos permitan acceder a la información adecuada en términos de cantidad, calidad y actualidad.
VARIABILIDAD CLÍNICAEl clínico se enfrenta con frecuencia, en su actividad diaria ante un paciente concreto, a preguntas que le plantean dilemas diagnósticos o terapéuticos. No nos referimos a problemas que se nos presentan excepcionalmente, sino a las cuestiones de la práctica clínica habitual para las que no tenemos una respuesta clara. En este sentido, llama la atención que ante un mismo escenario clínico (p. ej., un paciente con unas características concretas bien definidas) la actitud médica varía notablemente entre unos profesionales y otros, lo que recalca el hecho de que la respuesta a dichas preguntas no es tan sencilla o no está tan clara.
Tomar decisiones consiste, también en medicina, en elegir una determinada acción tras sopesar los riesgos y beneficios que comportan las diversas alternativas posibles (siempre hay argumentos a favor y en contra de cualquier opción). Aunque todas las decisiones clínicas se toman en condiciones de incertidumbre, ésta será mayor o menor en función de la cantidad y la calidad de evidencias disponibles sobre el tema en cuestión. Una consecuencia de esta situación es la variabilidad clínica. En ocasiones, puede ser nuestra ignorancia la verdadera causa de que desconozcamos la respuesta a la pregunta que se nos plantea. Otras veces, puede que no haya estudios que aporten información sobre cuál debe ser la actitud más adecuada, tratándose en este caso de verdaderas lagunas de conocimiento. Sin embargo, en muchos casos el problema estriba en que hay un exceso de información, frecuentemente contradictoria, que hace difícil su integración coherente y la extracción de una conclusión clara y, por tanto, la elaboración de una respuesta bien definida. De este modo, la hipótesis más extendida en la actualidad relaciona la variabilidad con el grado de incertidumbre clínica que acompaña a las decisiones médicas. Dentro de dicha teoría, la discrecionalidad de las decisiones clínicas individuales, o los diferentes estilos de práctica, aparecen como principales responsables de tal incertidumbre. En ocasiones, el origen de las diferencias en la toma de decisiones sobre pacientes individuales puede encontrarse en presiones externas (cuando el profesional conoce el valor de las pruebas o tratamientos, pero emplea otras pautas), en los recursos y oferta de servicios (al no disponer de la técnica diagnóstica o del tratamiento recomendado se utiliza una alternativa) o en las preferencias del paciente (en la mayoría de los casos la decisión última la tiene éste, y sus valores y preferencias también cuentan, de forma que pueden hacer que las actitudes varíen significativamente de un caso a otro).
DIFICULTADES PARA GESTIONAR LA INFORMACIÓNPara poder gestionar adecuadamente la ingente información que con frecuencia se tiene sobre un determinado problema clínico, es preciso, en primer lugar, disponer de un tiempo del que en general carecemos. En segundo lugar, para identificar correctamente toda la evidencia científica disponible es preciso estar entrenados en la difícil tarea de la búsqueda bibliográfica exhaustiva. Además, es necesario disponer de habilidades de lectura crítica de la literatura, para poder no sólo encontrar los estudios publicados sobre un determinado tema, sino también evaluarlos críticamente y ponderar sus resultados en función de su calidad metodológica.
De la amplia variabilidad clínica observada y de la dificultad para gestionar e integrar la abundante información que con frecuencia existe sobre un determinado problema médico, surgió la necesidad de disponer de herramientas capaces de ofrecer la mejor información de forma simple, rápida y transparente. Así, se hacía patente la necesidad de disponer de una «herramienta» que, partiendo de una buena y reciente revisión bibliográfica, hiciera que nuestra práctica se basara en la mejor evidencia científica disponible, mejorara la calidad asistencial y disminuyera la variabilidad no justificada. Es en este escenario donde hacen su aparición en la década de los noventa las guías de práctica clínica (GPC), con la intención de mejorar la efectividad de las intervenciones y la calidad de la atención sanitaria, y disminuir las variaciones de la actividad médica ante un proceso concreto.
OBJETIVOSEl presente manuscrito versará sobre cómo localizar, elaborar, evaluar y utilizar GPC. Se plantearán preguntas de índole eminentemente práctica y se intentará dar respuesta a ellas con rigor y, a la vez, con claridad y practicidad. A lo largo de ese artículo se citarán diversos ejemplos prácticos, con la intención de hacer más ameno y docente el enfoque de cada uno de los aspectos. Gran parte de lo que se expondrá en esta revisión está basado en materiales incluidos en la web de Fisterra (www.fisterra.com) o en organismos compiladores, como GuíaSalud (www.guiasalud.es), textos de obligada consulta para todo aquél que quiera embarcarse, sin miedo al naufragio, en la preparación de una GPC. Cabe destacar especialmente, por su exhaustividad y claridad, el material publicado en Fisterra.com (Atención Primaria en la Red), que incluye una serie de artículos que forman parte de una actividad de formación continuada desarrollada en colaboración con la Red de investigación cooperativa sobre MBE y GuíaSalud, el portal que recopila las GPC elaboradas en el Sistema Nacional de Salud español.
¿QUÉ ES UNA GUÍA DE PRÁCTICA CLÍNICA? ¿CUÁLES SON SUS PRINCIPALES ATRIBUTOS?La definición habitualmente empleada es la propuesta por el Instituto de Medicina de Estados Unidos: «Un conjunto de recomendaciones desarrolladas de forma sistemática para ayudar a los profesionales y a los pacientes en la toma de decisiones sobre la atención sanitaria más apropiada, seleccionando las opciones diagnósticas o terapéuticas más adecuadas en el abordaje de un problema de salud o una afección clínica específica».
El primer aspecto que conviene destacar de esta definición es la expresión «recomendaciones», término que denota flexibilidad, en oposición al carácter más normativo de los protocolos. En este sentido, con frecuencia se comete el error conceptual de utilizar el término «guías» en documentos que realmente son «protocolos» internos de actuación de unidades asistenciales. Cabe recordar que los protocolos son de aplicación más local, inmediata, y autoaceptados por acuerdo buscando un beneficio convenido. Por su parte, las GPC elaboran recomendaciones flexibles para que puedan utilizarse en la toma de diferentes decisiones clínicas, teniendo en consideración la posibilidad de que pueda adaptarse a circunstancias individuales. Por tanto, una GPC debería tener en cuenta las diferencias poblacionales, geográficas, de acceso a los servicios sanitarios, así como las diferencias entre las expectativas y preferencias de los usuarios. En resumen, las GPC son recomendaciones que «aconsejan» cómo actuar en una circunstancia clínica determinada. No obstante, la decisión final sobre la actitud clínica seleccionada estará siempre en manos del médico, del paciente y de las circunstancias específicas que rodean a cada situación.
El segundo componente esencial de la definición de GPC es el de su desarrollo «sistemático». Ello indica que se trata de una acción planificada y reproducible. La formalización y el procedimiento sistemático deben estar en cada paso del manejo de la información, ya sea para localizarla, recopilarla, evaluarla, seleccionarla, sintetizarla, analizarla, interpretarla o exponerla. La amenaza de la validez del proceso puede aparecer en cada uno de estos pasos. Por tanto, el desarrollo de una GPC se deberá hacer siguiendo un proceso estructurado que incluye una revisión sistemática de la literatura científica, la evaluación de la calidad de la evidencia y la elaboración de recomendaciones ligadas a ésta.
El tercer término que cabría destacar es el de «ayudar en la toma de decisiones». En este sentido, las GPC son herramientas destinadas a facilitar la toma de decisiones clínicas, nunca a sustituir el juicio clínico del profesional sanitario y, por tanto, no son de obligado cumplimiento. Dicho de otro modo, la finalidad primordial de una GPC consiste en ofrecer al clínico una serie de directrices con las que poder resolver, a través de la evidencia científica, los problemas que surgen diariamente con los pacientes. También es importante señalar que aparece en la definición el término «paciente». Por tanto, se reconoce de forma expresa que los pacientes forman parte del proceso de la toma de decisiones. En este sentido, una GPC debe tener en cuenta resultados de mejora no sólo desde la perspectiva del médico, sino también del paciente. Muchas de las publicaciones médicas se centran en resultados que tienen un interés especial para el investigador, pero que pueden carecer de importancia para el paciente e incluso para el propio médico con actividad exclusivamente asistencial. Sin embargo, lo que realmente le importa al paciente –y consecuentemente al médico que le trata– es la evaluación de indicadores de resultados en salud clínicamente relevantes (p. ej., eventos prevenidos, tasas de supervivencia, medidas de la calidad de vida, etc.).
En la parte final de la definición se señala que una GPC va dirigida a solventar un problema clínico «específico». Dicho de otro modo, las GPC son documentos donde se plantean preguntas concretas y se presentan las mejores evidencias científicas disponibles. Así, organizan la información válida y útil, que previamente estaba fragmentada, en torno a un problema clínico específico; de este modo, las GPC otorgan valor a la evidencia global, no a estudios individuales por separado. Puesto que las GPC son herramientas diseñadas para solucionar problemas, su función principal debe ser ayudar a tomar decisiones en el momento y el lugar en que al clínico se le presentan las dudas.
Por último, según el Instituto de Medicina de Estados Unidos, los atributos que clásicamente se le exigen a una GPC son los siguientes: validez (que la GPC haya sido diseñada y realizada de modo que los resultados no estén sesgados), fiabilidad (que sea interpretada y utilizada por distintos profesionales de la misma manera), flexibilidad (que pueda acomodarse a las características individuales de los pacientes, las preferencias de clínicos y pacientes, y a las circunstancias locales), reproducibilidad (de modo que si un panel de expertos distinto utilizase la misma evidencia y el mismo método de elaboración, se obtendría una GPC similar), aplicabilidad clínica (tener perfectamente identificados a los pacientes y situaciones clínicas que permitan su uso en la práctica cotidiana), claridad (que emplee un lenguaje claro, defina los términos de modo preciso, y utilice una presentación lógica y fácil de seguir) y multidisciplinariedad (la GPC debe desarrollarse por un equipo que incluya tanto personal sanitario de las diversas especialidades en relación con el tema de la guía como pacientes).
En resumen, la aparición de las GPC supone un salto cualitativo en lo que se refiere a la producción de material científico sintetizado y evaluado críticamente. La GPC ideal debería proporcionarnos una información sencilla en su localización, adecuada al problema, válida, precisa, aplicable al paciente concreto, fácil de comprender y accesible en el punto de atención al paciente. Por una parte, las GPC constituyen un instrumento de enlace entre la investigación y la práctica clínica y, por otra, tratan de aproximar las recomendaciones a la realidad clínica.
¿CUÁNDO DEBEMOS PLANTEARNOS LA ELABORACIÓN O EL EMPLEO DE UNA GUÍA DE PRÁCTICA CLÍNICA?Entre los diferentes aspectos que pueden motivar la necesidad de elaborar o utilizar una GPC destacan los siguientes:
- 1.
Cuando hay una amplia variabilidad en la manera de abordar determinadas áreas de la práctica clínica.
- 2.
Ante determinados problemas de salud con gran impacto social y económico en los que no hay consenso a la hora de abordarlos y afectan a varios niveles asistenciales.
- 3.
Como criterio de selección complementario, se ha utilizado en algunos casos la valoración del impacto económico que genera el manejo de determinadas enfermedades.
Así, los problemas más susceptibles de mejorar mediante el desarrollo o implantación de una GPC serían los que presentasen elevada frecuencia y gravedad, variabilidad en la práctica clínica con un alto nivel de incertidumbre en la toma de decisiones, elevado impacto en los pacientes y alto consumo de recursos.
¿CÓMO SE PLANTEA UNA PREGUNTA SUSCEPTIBLE DE SER CONTESTADA POR UNA GUÍA DE PRÁCTICA CLÍNICA?En primer lugar, deberemos detectar los problemas clínicos que nos plantean incertidumbre y convertirlos en preguntas susceptibles de ser contestadas. Su redacción debe ser clara, precisa, sencilla y única, y su estructura debe contener los elementos recogidos en el acrónimo PICO: Problema o Paciente (de la que surge la pregunta), Intervención (que queremos analizar), Comparación (con otra intervención) y Desenlaces (Outcomes, resultados clínicos esperados). Por tanto, una GPC debe recoger el objetivo general que persigue, la afección clínica específica que aborda y la población diana a la que va dirigida, especificando los aspectos que permitan delimitar el tipo de población a la cual se puede aplicar.
A modo de ejemplo, una pregunta que podría incluirse dentro de una GPC dedicado a la enfermedad inflamatoria intestinal sería: «En el paciente con un brote leve-moderado de colitis ulcerosa (pacientes), ¿la combinación de 5-aminosalicilatos por vía oral y tópica es más eficaz que cada una de estas preparaciones aisladamente (intervenciones) para inducir la remisión clínica (resultado)?
¿QUIÉN DEBERÍA PARTICIPAR EN LA ELABORACIÓN DE UNA GUÍA DE PRÁCTICA CLÍNICA?Una GPC debe ser elaborada por un equipo multidisciplinario, de forma que tanto quienes se espera que la utilicen (médicos especialistas y de familia y personal de enfermería) como quienes van a beneficiarse por su uso (pacientes) desempeñen un papel importante en su concepción y desarrollo. Es evidente que la composición del grupo elaborador y redactor de una GPC influye notablemente en las recomendaciones, lo que recalca la necesidad de que sea multidisciplinario y que incluya a todos los estamentos implicados; sólo así será posible elaborar una GPC representativa y realista, condiciones necesarias para que las recomendaciones generadas sean válidas y se incorporen con éxito a la práctica clínica.
El número idóneo de personas que debe integrar el grupo elaborador de una GPC no está establecido, pero se ha estimado que 10 o 12 podría ser una cifra adecuada. Además, debería formar parte del proyecto el denominado «grupo técnico», constituido idealmente por una persona experta en revisiones sistemáticas, un especialista en documentación médica y un economista de la salud, además del soporte administrativo del grupo que se encarga de organizar las reuniones. En algunos temas específicos es conveniente incluir epidemiólogos o estadísticos. Por el contrario, no se incluirá en el grupo elaborador de una GPC a personas vinculadas a la industria farmacéutica o de productos médicos.
Una vez redactada la GPC, ha de ser sometida a una revisión externa que garantice la validez, la claridad y la aplicabilidad de los contenidos. Los revisores externos deben incluir personas con experiencia clínica, pero también expertos en metodología y, específicamente, en revisiones sistemáticas o desarrollo de GPC. Esto es así porque la revisión externa ha de realizarse tanto desde la perspectiva clínica como metodológica. Es importante también que entre los revisores externos se encuentren no sólo expertos en el tema que desarrolla la guía sino, más importante aún, usuarios potenciales de ésta (que serán representativos de los que realmente utilizarán la GPC).
Por último, es preciso recalcar que las GPC dan un nuevo protagonismo a los pacientes, ofreciéndoles la posibilidad de participar de forma más activa e informada en las decisiones que afectan a su salud. Son especialmente útiles las aportaciones de pacientes que, aunque no participen directamente en la elaboración de la GPC, al menos formen parte de la revisión final de ésta (debemos siempre tener presente que una pregunta o recomendación puede parecer de gran interés para el clínico y no serlo tanto para el paciente).
¿CÓMO EVALUAR LA CALIDAD DE LA EVIDENCIA Y ESTABLECER EL GRADO DE RECOMENDACIÓN DE UNA GUÍA DE PRÁCTICA CLÍNICA?La meta final en la elaboración de una GPC es establecer unas recomendaciones a partir de la interpretación de las pruebas científicas disponibles. Aunque se llega a estas recomendaciones a partir de un método de consenso que inevitablemente involucra valores de juicio por parte del grupo que elabora la GPC, este proceso debe ser sistemático, explícito y transparente, para que el juicio hecho a partir de las evidencias sea lo más claro posible.
En el desarrollo de una guía, los conceptos de calidad o nivel de evidencia y grado de recomendación forman el eje central de la definición de GPC basada en la evidencia, ya que son los instrumentos que intentan estandarizar y proporcionar a los clínicos reglas sólidas para valorar la investigación publicada, determinar su validez y resumir su utilidad en la práctica clínica. La calidad (o el nivel) de la evidencia indica hasta qué punto podemos confiar en que el estimador del efecto es correcto; además de dar importancia al diseño, la calidad de la evidencia viene dada por la metodología utilizada, de forma que cuanto más rigurosa sea, más válido y fiable será el resultado de la investigación y, por tanto, mayor será la robustez de las recomendaciones que se deriven de la síntesis de los estudios. Por su parte, la fuerza de la recomendación significa hasta qué punto podemos confiar en que poner en práctica una recomendación conllevará más beneficios que riesgos. De este modo, la formulación de las recomendacio nes que emitirán las GPC se harán en función del volumen, la consistencia y la posibilidad de generalización de la evidencia. Así, en función del rigor científico del diseño de los estudios, pueden construirse escalas de clasificación jerárquica de la evidencia, a partir de las cuales se establecen recomendaciones respecto a la adopción de un determinado procedimiento médico.
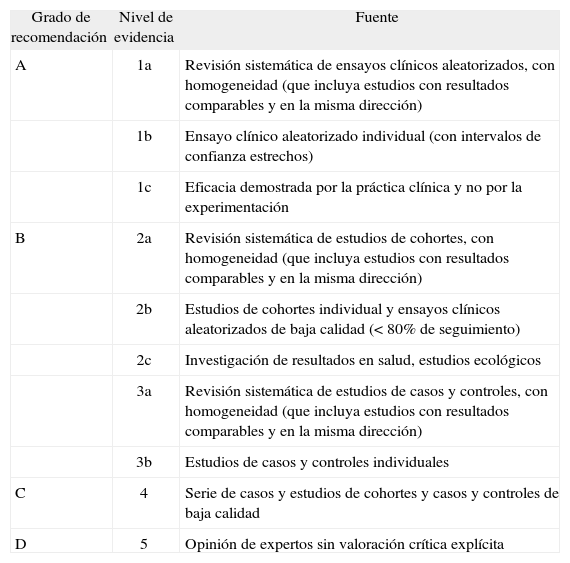
Diferentes instituciones y sociedades científicas han desarrollado diversos sistemas de clasificación para evaluar y estructurar la evidencia y establecer los grados de recomendación. Actualmente hay más de 100 sistemas de clasificación para valorar la calidad de la evidencia, aunque todos ellos son bastante similares entre sí. A modo de ejemplo, en la tabla I se incluye la clasificación propuesta por el Centre for Evidence-Based Medicine de Oxford (www.cebm.net) para los estudios sobre intervenciones terapéuticas, utilizada en el Programa de «Guías Clínicas en Gastroenterología» (www.guiasgastro.net) elaboradas por la Asociación Española de Gastroenterología. En esta clasificación se establecen 5 niveles de evidencia (1-5) y 4 grados de recomendación (A-D). El grado de recomendación A, el más alto, que es extremadamente recomendable, se corresponde con estudios de nivel 1. El grado de recomendación B, entendido como una recomendación favorable, se corresponde con estudios de nivel 2 o 3, o extrapolaciones de estudios de nivel 1. El grado de recomendación C, entendido como una recomendación favorable pero de forma no conclusiva, se corresponde con estudios de nivel 4 o extrapolaciones de estudios de nivel 2 o 3. El grado de recomendación D, el cual ni recomienda ni desaprueba la intervención que se ha de realizar, se corresponde con estudios de nivel 5 o estudios no concluyentes o inconsistentes de cualquier nivel. La clasificación del Centro de MBE de Oxford es muy completa, ya que incluye diferentes clasificaciones para cada tipo de pregunta (terapéutica, diagnóstico, pronóstico, factores de riesgo y evaluación económica) y, en función de cada una de ellas, valora el diseño de los estudios de manera específica. Como contrapartida, tiene el inconveniente de que no tiene en cuenta otros aspectos, aparte del diseño y la ejecución de los estudios, que son importantes a la hora de formular recomendaciones (véase más adelante, al describir el sistema GRADE).
Niveles de evidencia y grados de recomendación en los estudios sobre intervenciones terapéuticas según la clasificación propuesta por el Centre for Evidence-Based Medicine de Oxford (www.cebm.net)
| Grado de recomendación | Nivel de evidencia | Fuente |
| A | 1a | Revisión sistemática de ensayos clínicos aleatorizados, con homogeneidad (que incluya estudios con resultados comparables y en la misma dirección) |
| 1b | Ensayo clínico aleatorizado individual (con intervalos de confianza estrechos) | |
| 1c | Eficacia demostrada por la práctica clínica y no por la experimentación | |
| B | 2a | Revisión sistemática de estudios de cohortes, con homogeneidad (que incluya estudios con resultados comparables y en la misma dirección) |
| 2b | Estudios de cohortes individual y ensayos clínicos aleatorizados de baja calidad (< 80% de seguimiento) | |
| 2c | Investigación de resultados en salud, estudios ecológicos | |
| 3a | Revisión sistemática de estudios de casos y controles, con homogeneidad (que incluya estudios con resultados comparables y en la misma dirección) | |
| 3b | Estudios de casos y controles individuales | |
| C | 4 | Serie de casos y estudios de cohortes y casos y controles de baja calidad |
| D | 5 | Opinión de expertos sin valoración crítica explícita |
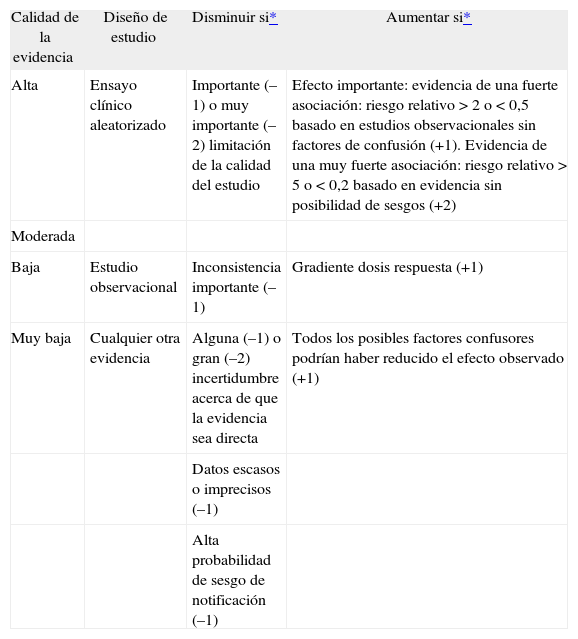
Las GPC son tan buenas como las evidencias y los juicios en las que están basadas. El objetivo de las diversas clasificaciones es facilitar la valoración de los juicios que hay detrás de las recomendaciones. Sin embargo, la proliferación de sistemas para evaluar y clasificar la evidencia y las diferentes interpretaciones de los grados de evidencia supone un problema para los evaluadores y usuarios. Desde el año 2000, con el objetivo de abordar las deficiencias de los actuales sistemas de clasificación, diversos integrantes de las diferentes instituciones que han desarrollado estas clasificaciones o elaboran GPC constituyeron el grupo de trabajo GRADE (Grading of Recommendations Assessment, Development and Evaluation). Este grupo tiene como objetivo construir y validar una clasificación que equilibre la sencillez con la necesidad de integrar todos los aspectos importantes a la hora de evaluar las evidencias y graduar las recomendaciones. El grupo GRADE publicó su primer artículo explicando en qué consiste esta clasificación en el año 2004 en la revista British Medical Journal; la traducción de este artículo al castellano se puede encontrar en la web del grupo GRADE (www.gradeworkinggroup.org).
Inicialmente, al igual que otros sistemas, GRADE comienza la evaluación de la evidencia por el diseño de los estudios. Su propuesta es comenzar valorando como «calidad alta» los ensayos clínicos aleatorizados, y como «calidad baja» los observacionales. No obstante, en el caso de los ensayos clínicos aleatorizados se sugieren 5 aspectos que pueden disminuir la calidad, y en el caso de los estudios observacionales se señalan 3 circunstancias que la pueden aumentar (tabla II). Así, de entre los aspectos que pueden disminuir la calidad de los ensayos clínicos aleatorizados se encuentran: a) limitaciones de la calidad del propio estudio (ausencia de ocultamiento de la secuencia de aleatorización, cegamiento inadecuado, pérdidas importantes, ausencia de análisis «por intención de tratar», etc.); b) resultados inconsistentes (estimaciones muy diferentes del efecto del tratamiento, es decir, presencia de heterogeneidad en los resultados); c) ausencia de evidencia directa (p. ej., cuando no se dispone de comparaciones directas entre 2 tratamientos, sino que la evidencia disponible proviene de una comparación indirecta de cada uno de los fármacos frente a placebo, o cuando existen grandes diferencias entre la población donde se pretende aplicar la GPC y la correspondiente a los estudios evaluados); d) imprecisión (cuando los estudios disponibles incluyen pocos eventos y pocos pacientes y, por tanto, los intervalos de confianza son amplios), y e) sesgo de notificación (cuando se tiene la duda razonable de que los autores no han incluido todos los estudios o todas las variables de resultado relevantes; esto debe sospecharse, por ejemplo, si se dispone de unos pocos estudios de pequeño tamaño y financiados por la industria).
Criterios GRADE (Grading of Recommendations Assessment, Development and Evaluation) para valorar la calidad de la evidencia
| Calidad de la evidencia | Diseño de estudio | Disminuir si* | Aumentar si* |
| Alta | Ensayo clínico aleatorizado | Importante (–1) o muy importante (–2) limitación de la calidad del estudio | Efecto importante: evidencia de una fuerte asociación: riesgo relativo > 2 o < 0,5 basado en estudios observacionales sin factores de confusión (+1). Evidencia de una muy fuerte asociación: riesgo relativo > 5 o < 0,2 basado en evidencia sin posibilidad de sesgos (+2) |
| Moderada | |||
| Baja | Estudio observacional | Inconsistencia importante (–1) | Gradiente dosis respuesta (+1) |
| Muy baja | Cualquier otra evidencia | Alguna (–1) o gran (–2) incertidumbre acerca de que la evidencia sea directa | Todos los posibles factores confusores podrían haber reducido el efecto observado (+1) |
| Datos escasos o imprecisos (–1) | |||
| Alta probabilidad de sesgo de notificación (–1) |
Según el sistema GRADE, la calidad de la evidencia en los diferentes estudios se debe evaluar para cada una de las variables de resultado importantes. Al final, deberán ser las variables críticas las que tengan un mayor peso a la hora de evaluar la calidad de forma global y, por tanto, las que determinarán las recomendaciones finales. Por ejemplo, si se pretende evaluar la eficacia de un determinado tratamiento en la colitis ulcerosa grave corticorresistente, las variables de resultado verdaderamente relevantes serán la mortalidad, la necesidad de cirugía (colectomía) o la remisión (sin embargo, otras variables como la respuesta [parcial] serán mucho menos importantes desde el punto de vista clínico); será, por tanto, la calidad de la evidencia disponible en relación con las primeras variables la que determinará las recomendaciones finales.
Para el sistema GRADE, la fuerza de las recomendaciones refleja hasta qué punto podemos confiar, para la población diana de una GPC, que si ponemos en práctica d icha recomendación conllevará más beneficios que riesgos. La graduación por este sistema es sencilla, pues sólo considera dos grandes grupos: recomendaciones «fuertes» y «débiles» (a favor o en contra). Una recomendación fuerte a favor indica que los beneficios claramente sobrepasan los riesgos y que la gran mayoría de personas bien informadas harían la misma elección. Una recomendación débil a favor indica que la mayoría de personas bien informadas harían la misma elección, aunque un grupo sustancial no la llevaría a cabo, y que los beneficios y los riesgos están equilibrados o son inciertos. Este mismo razonamiento se aplica a las recomendaciones en contra, ya sean fuertes o débiles.
Finalmente, debemos tener presente que la evidencia de la efectividad no siempre es suficiente a la hora de establecer recomendaciones. Por ejemplo, la elaboración de recomendaciones sobre tratamientos debe incluir la información disponible sobre circunstancias individuales, evidencia de los efectos adversos, cumplimiento y costes. En este sentido, como queda resumido en la tabla III, el sistema GRADE tiene en cuenta los siguientes factores al graduar la fuerza de las recomendaciones: a) el balance entre beneficios y riesgos; b) la calidad de la evidencia; c) los valores y preferencias, y d) los costes.
Factores a tener en cuenta al formular recomendaciones según el sistema GRADE
| Decisiones sobre la fuerza de la recomendación | |
| Factores que influyen en la fuerza de la recomendación | Ayuda para la decisión |
| Balance entre los beneficios y los efectos secundarios | Cuanto más grande sea la diferencia entre los beneficios y los efectos secundarios (daños), es más probable formular una recomendación fuerte |
| Calidad de la evidencia | Cuanto más alta sea la calidad, es más probable formular una recomendación fuerte |
| Valores y preferencias | Cuanta más variabilidad o incertidumbre en los valores y preferencias, es menos probable formular una recomendación fuerte |
| Costes (asignación de recursos) | Cuanto más elevados sean los costes de una intervención (más recursos asignados), es menos probable formular una recomendación fuerte |
Una GPC debe estar escrita en un estilo que permita ser entendido por personas no expertas en la materia que se evalúa. El formato de publicación de la GPC debe resultar atractivo para el lector, pues ello favorecerá su uso. Es fundamental que las recomendaciones estén formuladas de manera clara y sean fácilmente identificables dentro de la guía, pues muchos usuarios se centrarán exclusivamente en la lectura de éstas sin examinar el documento completo.
Además de la versión extensa o guía completa se pueden publicar diferentes versiones en formato más sencillo, como una guía resumida (formato breve con todas las recomendaciones por secciones del tema tratado con los principales algoritmos) o una guía rápida (toda la guía resumida mediante algoritmos o figuras en un formato muy breve y manejable en condiciones reales de práctica clínica).
No es imprescindible que en la guía completa publicada en formato papel aparezca una redacción exhaustiva de la revisión de la literatura médica, incluidas las estrategias de búsqueda, las tablas de evidencia, etc. Estos aspectos pueden estar disponibles en formato electrónico o en la página web donde esté ubicada la GPC, lo que permitirá el acceso a esta información detallada únicamente a los lectores interesados.
¿ES NECESARIO EVALUAR LOS RESULTADOS OBTENIDOS TRAS LA DIFUSIÓN DE UNA GUÍA DE PRÁCTICA CLÍNICA?El desarrollo de una buena GPC no garantiza que se emplee adecuadamente en la práctica clínica. Así, la evaluación de los resultados de una GPC es necesaria para objetivar la verdadera aplicación de la guía por parte de los clínicos y comprobar su verdadero impacto en la atención sanitaria de la población de interés. La evaluación de estos resultados nos permitirá detectar sus ventajas e inconvenientes, modificar la GPC si fuese necesario e identificar lagunas o aspectos no abordados que sería preciso introducir en futuras versiones. Por tanto, idealmente debería identificarse, en la propia GPC, la periodicidad y el procedimiento para dicha evaluación; en este sentido, debería incluir un listado de indicadores esenciales que permitan su uso para la evaluación de los resultados. Evidentemente, la utilidad y el impacto de una GPC debe evaluarse una vez transcurrido el tiempo apropiado tras su difusión e implementación. En resumen, el seguimiento de los efectos de una GPC es fundamental, especialmente en lo que se refiere al impacto que tiene la guía en los resultados en salud y también en su difusión e implementación.
¿ES PRECISO ACTUALIZAR UNA GUÍA DE PRÁCTICA CLÍNICA UNA VEZ ELABORADA?La ciencia, en general, y la medicina, en particular, avanzan a una velocidad vertiginosa, de modo que los contenidos de las fuentes de información, incluidas las GPC, se quedan obsoletos rápidamente. Por ello, deberíamos planificar, ya desde el principio, la revisión y la actualización de cualquier GPC, sin esperar a que ésta «caduque» (pocas cosas dan un aspecto tan pobre e inspiran tanta desconfianza como un material científico obsoleto). El mecanismo de actualización (cronología de la revisión, etc.) debería quedar explicitado ya en la primera versión de la guía. Mantener actualizada una GPC no es una tarea sencilla, pues implica la revisión periódica de la evidencia emergente y de otros aspectos que pueden crear la necesidad de revisar las recomendaciones emitidas. Por regla general se considera que la actualización de una GPC debe realizarse cada 3 años; actualmente, la disponibilidad de versiones electrónicas de las guías facilita enormemente la tarea de actualización, lo que debería permitir que ésta se realice en un menor intervalo de tiempo.
¿DÓNDE Y CÓMO PUEDO LOCALIZAR GUÍAS DE PRÁCTICA CLÍNICA?En este apartado se revisará cómo y dónde buscar GPC, así como estudios metodológicos y herramientas para elaborarlas, evaluarlas, adaptarlas e implementarlas. Gran parte de lo que se expondrá aquí está basado en el capítulo elaborado por Gutiérrez Ibarluzea y González Guitián, titulado «¿Cómo localizar GPC?», incluido en la web de Fisterra (www.fisterra.com) y que forma parte de una actividad de formación continuada desarrollada en colaboración con la Red de investigación cooperativa sobre MBE y GuíaSalud.
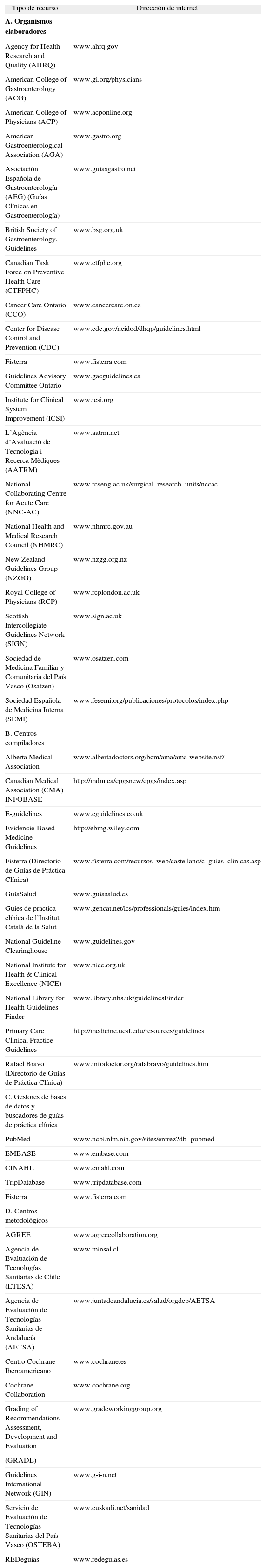
Los recursos disponibles para localizar GPC se pueden clasificar en 4 grandes grupos (tabla IV): a) organismos elaboradores; b) centros compiladores, registros o de almacenamiento (también conocidos como ClearingHouses); c) bases de datos genéricas, y d) centros metodológicos.
Recursos sobre guías de práctica clínica en internet
| Tipo de recurso | Dirección de internet |
| A. Organismos elaboradores | |
| Agency for Health Research and Quality (AHRQ) | www.ahrq.gov |
| American College of Gastroenterology (ACG) | www.gi.org/physicians |
| American College of Physicians (ACP) | www.acponline.org |
| American Gastroenterological Association (AGA) | www.gastro.org |
| Asociación Española de Gastroenterología (AEG) (Guías Clínicas en Gastroenterología) | www.guiasgastro.net |
| British Society of Gastroenterology, Guidelines | www.bsg.org.uk |
| Canadian Task Force on Preventive Health Care (CTFPHC) | www.ctfphc.org |
| Cancer Care Ontario (CCO) | www.cancercare.on.ca |
| Center for Disease Control and Prevention (CDC) | www.cdc.gov/ncidod/dhqp/guidelines.html |
| Fisterra | www.fisterra.com |
| Guidelines Advisory Committee Ontario | www.gacguidelines.ca |
| Institute for Clinical System Improvement (ICSI) | www.icsi.org |
| L’Agència d’Avaluació de Tecnologia i Recerca Mèdiques (AATRM) | www.aatrm.net |
| National Collaborating Centre for Acute Care (NNC-AC) | www.rcseng.ac.uk/surgical_research_units/nccac |
| National Health and Medical Research Council (NHMRC) | www.nhmrc.gov.au |
| New Zealand Guidelines Group (NZGG) | www.nzgg.org.nz |
| Royal College of Physicians (RCP) | www.rcplondon.ac.uk |
| Scottish Intercollegiate Guidelines Network (SIGN) | www.sign.ac.uk |
| Sociedad de Medicina Familiar y Comunitaria del País Vasco (Osatzen) | www.osatzen.com |
| Sociedad Española de Medicina Interna (SEMI) | www.fesemi.org/publicaciones/protocolos/index.php |
| B. Centros compiladores | |
| Alberta Medical Association | www.albertadoctors.org/bcm/ama/ama-website.nsf/ |
| Canadian Medical Association (CMA) INFOBASE | http://mdm.ca/cpgsnew/cpgs/index.asp |
| E-guidelines | www.eguidelines.co.uk |
| Evidencie-Based Medicine Guidelines | http://ebmg.wiley.com |
| Fisterra (Directorio de Guías de Práctica Clínica) | www.fisterra.com/recursos_web/castellano/c_guias_clinicas.asp |
| GuíaSalud | www.guiasalud.es |
| Guies de pràctica clínica de l’Institut Català de la Salut | www.gencat.net/ics/professionals/guies/index.htm |
| National Guideline Clearinghouse | www.guidelines.gov |
| National Institute for Health & Clinical Excellence (NICE) | www.nice.org.uk |
| National Library for Health Guidelines Finder | www.library.nhs.uk/guidelinesFinder |
| Primary Care Clinical Practice Guidelines | http://medicine.ucsf.edu/resources/guidelines |
| Rafael Bravo (Directorio de Guías de Práctica Clínica) | www.infodoctor.org/rafabravo/guidelines.htm |
| C. Gestores de bases de datos y buscadores de guías de práctica clínica | |
| PubMed | www.ncbi.nlm.nih.gov/sites/entrez?db=pubmed |
| EMBASE | www.embase.com |
| CINAHL | www.cinahl.com |
| TripDatabase | www.tripdatabase.com |
| Fisterra | www.fisterra.com |
| D. Centros metodológicos | |
| AGREE | www.agreecollaboration.org |
| Agencia de Evaluación de Tecnologías Sanitarias de Chile (ETESA) | www.minsal.cl |
| Agencia de Evaluación de Tecnologías Sanitarias de Andalucía (AETSA) | www.juntadeandalucia.es/salud/orgdep/AETSA |
| Centro Cochrane Iberoamericano | www.cochrane.es |
| Cochrane Collaboration | www.cochrane.org |
| Grading of Recommendations Assessment, Development and Evaluation | www.gradeworkinggroup.org |
| (GRADE) | |
| Guidelines International Network (GIN) | www.g-i-n.net |
| Servicio de Evaluación de Tecnologías Sanitarias del País Vasco (OSTEBA) | www.euskadi.net/sanidad |
| REDeguias | www.redeguias.es |
Modificado de: Gutiérrez Ibarluzea I, González Guitián C. ¿Cómo localizar guías de práctica clínica? Guías Clínicas. 2007;7 Supl 1:2.
Una estrategia eficiente de selección de GPC en internet debería iniciarse en entidades (ya sean organismos oficiales o asociaciones profesionales) elaboradoras de documentos de calidad contrastada; éste es un procedimiento rápido que no necesita, por lo general, la posterior valoración crítica de los resultados obtenidos. Sólo en caso de no encontrar una respuesta adecuada aucudiríamos a los diferentes directorios y almacenes de GPC disponibles en la red (segundo nivel). La forma más eficaz de buscar en éstos es mediante un metabuscador, en concreto TripDatabase. A diferencia del grupo anterior, aquí podemos recuperar información de calidad muy diversa, por lo que será necesario un proceso de valoración crítica posterior. Por último, únicamente si no encontramos una respuesta satisfactoria por los procedimientos anteriores estaría indicada una búsqueda en las bases de datos habituales (tercer nivel), como por ejemplo MEDLINE; en este caso también resulta obligada –más aún si cabe– la lectura crítica y la evaluación detallada de la literatura médica recuperada.
Organismos elaboradoresLa mayoría de las sociedades científicas internacionales elaboran GPC, aunque su número es todavía reducido. En España, las sociedades científicas y las agencias de evaluación de tecnologías sanitarias son los principales productores de GPC. Entre los organismos elaboradores destacan, por su calidad y utilidad, los siguientes (tabla IV):
- –
Agency for Health Research and Quality (AHRQ) (www.ahrq.gov). Esta agencia apoya el desarrollo de informes basados en la evidencia por medio de sus Evidence-based Practice Centers y la difusión de GPC a través de la National Guideline Clearinghouse.
- –
American College of Gastroenterology (ACG) (www.gi.org/physicians). El material del Colegio americano de Gastroenterología se publica en la revista American Journal of Gastroenterology e incluye, por ejemplo, una GPC sobre el tratamiento de la colitis ulcerosa en el paciente adulto.
- –
American College of Physicians (ACP) (www.acponline.org/index.html). Es el Colegio de médicos americano, en el que se engloban todas sus especialidades. Incluye GPC basadas en la evidencia, de elaboración propia. Se publican en la revista de la Sociedad, Annals of Internal Medicine.
- –
American Gastroenterological Association (AGA) (www.gastro.org). Es la página oficial de la Asociación Americana de Gastroenterología y sus contenidos se publican en la revista Gastroenterology. En el apartado denominado Medical Position Statements podemos encontrar una lista de enfermedades digestivas. A modo de ejemplo, en relación con la enfermedad inflamatoria intestinal se incluyen revisiones sobre la enfermedad de Crohn perianal o sobre el uso de diversos fármacos (corticoides, inmunomoduladores e infliximab) en la colitis ulcerosa y en la enfermedad de Crohn.
- –
Asociación Española de Gastroenterología (AEG) (www.guiasgastro.net). El programa de elaboración de GPC en Enfermedades Digestivas es fruto de una colaboración entre la Asociación Española de Gastroenterología, la Sociedad Española de Medicina Familiar y Comunitaria (semFYC) y el Centro Cochrane Iberoamericano. Las GPC, que se publican en la revista Gastroenterología y Hepatología, han sido revisadas externamente y cumplen criterios de calidad. Más adelante se explica con detalle este programa en un apartado dedicado específicamente a él.
- –
British Society of Gastroenterology Guidelines (www.bsg.org.uk). En este caso las GPC se publican en la revista Gut, órgano de expresión de la Sociedad Británica de Gastroenterología. Siguiendo el mismo ejemplo, aquí se incluye una GPC sobre el manejo de la enfermedad inflamatoria intestinal en los adultos, así como 3 artículos que incluyen el consenso al que ha llegado la European Crohn’s and Colitis Organisation (ECCO) sobre diversos aspectos de la enfermedad de Crohn (diagnóstico, tratamiento y algunas situaciones especiales).
- –
Canadian Task Force on Preventive Health Care (CTFPHC) (www.ctfphc.org). Esta página web está diseñada para ayudar a determinar la inclusión o exclusión, el contenido y la frecuencia de una variedad de intervenciones preventivas en salud, mediante el uso de las recomendaciones basadas en la evidencia de la CTFPHC.
- –
Cancer Care Ontario (CCO) (www.cancercare.on.ca). Esta web dispone de GPC basadas en la evidencia y resúmenes de evidencia sobre preguntas específicas relacionadas con el cáncer.
- –
Center for Disease Control and Prevention (CDC) (www.cdc.gov/ncidod/dhqp/guidelines.html). Incluye GPC relacionadas con la prevención de diversas infecciones.
- –
Fisterra (www.fisterra.com). Es un portal sanitario de reconocido prestigio en el ámbito estatal, que cuenta con acceso a recursos variados y con un apartado específico de GPC, enlaces tanto a GPC en sí como a organismos elaboradores, compiladores y recursos metodológicos en el ámbito de las GPC. Cuenta con un repositorio de protocolos o guías clínicas de elaboración propia sobre diferentes enfermedades con un claro ámbito de aplicación en la atención primaria. Podemos encontrar un directorio específicamente dedicado a GPC, en la que éstas se encuentran ordenadas alfabéticamente y por especialidad. En la tabla V se resumen las GPC sobre temas de aparato digestivo (en español) incluidas en el directorio de Fisterra.
TABLA V.Guías de práctica clínica sobre temas de aparato digestivo (en español) incluidas en Fisterra (www.fisterra.com)
Colecistitis aguda (www.fisterra.com/guias2/colecistitis.asp)
Colelitiasis (www.fisterra.com/guias2/colelitiasis.asp)
Diarrea crónica (www.fisterra.com/guias2/diarrea.asp)
Dispepsia (www.fisterra.com/guias2/dispepsia.asp)
Diverticulosis y diverticulitis (www.fisterra.com/guias2/diverticulos.asp)
Enfermedad celíaca (www.fisterra.com/guias2/celiaca.asp)
Enfermedad inflamatoria intestinal (www.fisterra.com/guias2/eii.asp)
Estreñimiento (www.fisterra.com/guias2/estrenimiento.asp)
Elevación de transaminasas (www.fisterra.com/guias2/transaminasas.asp)
Hemocromatosis (www.fisterra.com/guias2/hemocromatosis.asp)
Hemorroides (www.fisterra.com/guias2/hemorroides.asp)
Hepatitis B (www.fisterra.com/guias2/vhb.asp)
Hepatitis C (www.fisterra.com/guias2/vhc.asp)
Hipo persistente (www.fisterra.com/guias2/hipo.asp)
Marcadores de hepatitis (www.fisterra.com/guias2/mhepatitis.asp)
Pancreatitis aguda (www.fisterra.com/guias2/pancreatitis.asp)
Reflujo gastroesofágico (www.fisterra.com/guias2/erge.asp)
Ulcus péptico y Helicobacter pylori (www.fisterra.com/guias2/ulcera_peptica.asp)
- –
Guidelines Advisory Committee Ontario (www.gacguidelines. ca). Este organismo tiene como objetivo identificar, evaluar, recomendar y resumir GPC para su uso en Ontario (Canadá).
- –
Institute for Clinical System Improvement (ICSI) (www.icsi.org). Es un proyecto colaborativo de diferentes organizaciones de cuidados en salud de Estados Unidos. Es uno de los mayores productores de GPC mundiales. Cuenta con GPC cuya característica fundamental es la cuidadosa elaboración de los diagramas de flujo y algoritmos de decisiones clínicas.
- –
L’Agència d’Avaluació de Tecnologia i Recerca Mèdiques (AATRM) (www.aatrm.net). Es la página web de la Agencia catalana de evaluación de tecnologías sanitarias, primera agencia española del ramo, que cuenta con varias GPC y diversos recursos metodológicos.
- –
National Collaborating Centre for Acute Care (NNCAC) (www.rcseng.ac.uk/surgical_research_units/nccac). Es uno de los 7 centros de colaboración del National Institute for Health and Clinical Excellence (NICE) para el desarrollo de GPC, dependiente en este caso del Colegio de Cirujanos de Inglaterra.
- –
National Health and Medical Research Council (NHMRC) (www.nhmrc.gov.au). Es un promotor de la elaboración de GPC en Australia.
- –
New Zealand Guidelines Group (NZGG) (www.nzgg.org.nz). Página desarrollada por el National Health Committee (NHC) de Nueva Zelanda. Contiene tanto documentos de elaboración propia como asumidos por la organización (pero desarrollados en colaboración con otras organizaciones como AGREE).
- –
Royal College of Physicians (RCP) (www.rcplondon.ac.uk/college/ceeu/ceeu_guidelinesdb.asp). El Colegio de Médicos británico promueve la elaboración de GPC que siguen las directrices del Instrumento AGREE como estándares de calidad y para su validación.
- –
Scottish Intercollegiate Guidelines Network (SIGN) (www.sign.ac.uk). Es una red integrada por colegios de todas las especialidades médicas, así como de enfermería, farmacia, odontología y otras profesiones afines a la medicina de Escocia. Los temas de las GPC pueden ser propuestos por grupos o individuos, pero son finalmente seleccionados si se observa una variabilidad en la práctica médica que sustente su abordaje o una evidencia de calidad que determine la efectividad de unas intervenciones en comparación con otras. Estas GPC se elaboran exclusivamente a partir de revisiones sistemáticas de la literatura médica y se revisan cada 2 años. Todas las GPC del SIGN están disponibles en internet en formato pdf, a texto completo, y como guías de referencia rápida. Incluye además material de apoyo metodológico para grupos interesados en elaborar GPC, en lo que se llama instrumento SIGN50 (www.sign.ac.uk/guidelines/fulltext/50).
- –
Sociedad de Medicina Familiar y Comunitaria del País Vasco (Osatzen) (www.osatzen.com). Éste ha sido uno de los organismos pioneros en la elaboración de GPC de calidad en España.
- –
Sociedad Española de Medicina Interna (www.fesemi. org/publicaciones/protocolos/index.php). Incluye, hasta el momento, 9 GPC en medicina interna recopiladas en una publicación monográfica.
Los organismos compiladores recopilan GPC y los más representativos se resumen en la tabla IV:
- –
Alberta Medical Association (www.albertadoctors.org/ bcm/ama/ama-website.nsf). Este organismo canadiense tiene un Programa para la promoción, el desarrollo y la implementación de GPC basadas en la evidencia científica. En esta página web se encuentra un listado de GPC del que se pueden descargar tanto el resumen como el texto completo.
- –
INFOBASE (http://mdm.ca/cpgsnew/cpgs/index.asp). Es la base de datos de la Canadian Medical Association (CMA). Recopila guías elaboradas en Canadá, que son examinadas y valoradas para su inclusión con el instrumento AGREE. Fue el primer centro en facilitar acceso gratuito a GPC a través de internet. En la actualidad, la mayoría de las GPC y documentos relacionados incluidos en este centro están disponibles gratuitamente a texto completo a través de internet, y el resto disponen al menos de un resumen estructurado.
- –
E-guidelines (www.eguidelines.co.uk). Es la versión electrónica de Guidelines, donde se resumen GPC dirigidas a la atención primaria y la atención especializada. Tiene 3 entregas al año y está permanentemente actualizado. Tiene un diseño muy intuitivo y agradable. Se precisa suscripción para tener acceso a los materiales incluidos en esta web.
- –
Evidence-Based Medicine Guidelines (http://ebmg.wiley. com). Es una colección concisa y fácil de usar de GPC para atención primaria (incluye casi 1.000 guías que abarcan un amplio espectro de enfermedades). Se precisa suscripción para poder acceder a su contenido.
- –
Fisterra (Directorio de GPC) (www.fisterra.com/recursos_web/castellano/c_guias_clinicas.asp). Véase apartado previo (organismos elaboradores).
- –
GuíaSalud (www.guiasalud.es). Es el portal que recopila las GPC elaboradas en el Sistema Nacional de Salud español. Se revisa con detalle más adelante, en un apartado específicamente dedicado a este portal.
- –
Guies de pràctica clínica de l’Institut Català de la Salut (www.gencat.net/ics/professionals/guies/index.htm). Este centro compilador tiene como objetivo la mejora continua de la calidad, así como la promoción de la aplicación de la mejor evidencia científica en la práctica asistencial. Incluye en la actualidad 11 GPC, entre ellas una sobre dispepsia y Helicobacter pylori.
- –
National Guideline Clearinghouse (www.guidelines.gov). Es, actualmente, el centro compilador más amplio. Su cobertura es internacional, a diferencia de la Clearinghouse canadiense o británica, que se limitan a su área geográfica. Su misión es proporcionar a médicos, enfermeras y a otros profesionales de salud, proveedores y planificadores de servicios sanitarios y otros, un mecanismo accesible para obtener información objetiva y detallada de GPC, así como para favorecer su difusión y puesta en práctica. Exige a los centros productores, entre otros, un compromiso de actualización que aparece reflejado en la GPC. Proporciona enlaces a texto completo de las GPC cuando están disponibles electrónicamente. Incluye también una cuidada selección de bibliografía comentada sobre metodología y experiencias prácticas de elaboración, evaluación, diseminación e implementación de GPC.
- –
National Institute for Health and Clinical Excellence (NICE) (www.nice.org.uk). Es una organización independiente cuyo objetivo es promover la salud y prevenir la enfermedad. Abarca aspectos de salud pública, tecnologías sanitarias y práctica clínica. Incluye, por ejemplo, 46 GPC de enfermedades gastrointestinales, 12 de enfermedades hepáticas y 3 de enfermedades pancreáticas.
- –
National Library for Health Guidelines Finder (www.library. nhs.uk/guidelinesFinder). Se encuentra incluida en la Biblioteca Virtual del Servicio de Salud Británico y contiene más de 2.000 GPC elaboradas en el Reino Unido.
- –
Primary Care Clinical Practice Guidelines at University of California (http://medicine.ucsf.edu/resources/guidelines). Desarrollada por la escuela de medicina de la Universidad de California. Como su nombre indica, este recurso está dirigido específicamente a la atención primaria, por lo que la selección de GPC se realiza en términos de validez, utilidad y aplicabilidad para este colectivo. Una interesante aportación es la posibilidad de buscar las GPC referidas a los 25 diagnósticos que representan más de la mitad de las consultas de atención primaria (los denominados Top diagnoses).
- –
Rafael Bravo (Directorio de GPC) (www.infodoctor.org/ rafabravo/guidelines.htm). Se trata de un apartado dedicado específicamente a GPC y contiene enlaces a organismos elaboradores, centros compiladores y buscadores de GPC.
Las bases de datos recopilan GPC realizadas con metodología MBE, pero también indizan otras guías elaboradas meramente a partir de la opinión de expertos o consenso, de calidad muy diversa. Por tanto, como se ha mencionado previamente, será necesario establecer un proceso de valoración crítica posterior de la literatura médica recuperada. Así, las búsquedas realizadas en estas bases de datos no distinguen su calidad, lo que hace que se incluyan en la misma categoría documentos de diversa índole y metodología de elaboración.
Las grandes bases de datos bibliográficos para las ciencias de la salud (MEDLINE, EMBASE, CINAHL, etc.) ofrecen la posibilidad de efectuar amplias y exhaustivas búsquedas para localizar GPC y otro tipo de recomendaciones. Poseen la ventaja de su amplia difusión y fácil accesibilidad. Sin embargo, tienen la desventaja de que muchas GPC se encuentran en formato de literatura gris (esto es, documentación que se publica al margen de los canales habituales de comunicación, edición y divulgación científica) y por ello no se indizan en las grandes bases de datos. A continuación se revisan los gestores de bases de datos y buscadores de GPC más utilizados (tabla IV).
- –
PubMed (www.ncbi.nlm.nih.gov/sites/entrez?db=pubmed). Es el motor y gestor de búsqueda más popular, de acceso gratuito, dependiente de la National Library of Medicine. Puesto que las GPC se publican con frecuencia en revistas científicas (aunque no siempre), a través de la base de datos MEDLINE podremos recuperar este tipo de documentos siguiendo una determinada estrategia de búsqueda. Disponemos, en general, de dos opciones de búsqueda. La primera consiste en seleccionar la opción de «Limits» y, dentro del apartado «Type of Article», marcar la casilla Practice Guideline; también podemos seleccionar la opción Guideline dentro de la sección «More Publication Types». La segunda estrategia de búsqueda con PubMed consiste en emplear los términos MeSH (Medical Subject Heading Terms) en «PubMed Services» de la enfermedad en cuestión que estemos interesados y combinarlo con la expresión «Practice Guideline» como tipo de publicación (cuyo descriptor, publication type o su abreviatura «PT», debe ir situado entre corchetes inmediatamente después de dicha expresión). Así, por ejemplo, si queremos identificar GPC sobre la enfermedad de Crohn en PubMed construiríamos la siguiente estrategia de búsqueda: «Crohn disease[MeSH] and Practice Guideline[PT]». Con ella identificamos únicamente 31 documentos, lo que nos hace sospechar que esta estrategia de búsqueda no ha sido suficientemente exhaustiva. Si añadimos en los términos de búsqueda la expresión Guideline*[ TI] (indicando que se incluyan los artículos que tengan la palabra guideline o guidelines, debido al signo del truncamiento*, en el campo del «título»), se recuperarán ya 40 documentos.
- –
TripDatabase (www.tripdatabase.com). Este interesante recurso busca información en una gran diversidad de sedes de alta calidad relacionadas con la MBE. Es una excelente opción para iniciar una búsqueda de GPC. Una vez introducida la expresión correspondiente en la casilla de búsqueda y efectuada ésta, TripDatabase nos clasifica la información obtenida por apartados, entre los que se incluye el de GPC.
Aquí se incluyen los centros u organismos productores o en los que se pueden localizar publicaciones metodológicas relacionadas con el desarrollo de GPC. En algunas ocasiones son coincidentes con los centros u organismos elaboradores, en cuyo caso ya se habrán descrito previamente. Por tanto, en esta sección se incluirán fundamentalmente colaboraciones nacionales o internacionales que generan herramientas metodológicas válidas para los procesos de elaborar, evaluar, adaptar o implementar GPC.
- –
Appraisal of Guidelines Research and Evaluation Colaboración Agree (AGREE) (www.agreecollaboration.org). Es un instrumento genérico que procura un marco de análisis de la calidad metodológica de las GPC. Más adelante, en el apartado titulado «¿Cómo evaluar la calidad de una guía de práctica clínica?», se revisa con detalle esta interesante herramienta.
- –
Agencia de evaluación de tecnologías sanitarias de Chile (ETESA) (www.minsal.cl). Cuenta dentro de sus documentos metodológicos con una guía para la elaboración de GPC en castellano. Es de los pocos centros que incluyen materiales metodológicos de elaboración de GPC.
- –
Agencia de Evaluación de Tecnologías Sanitarias de Andalucía (www.juntadeandalucia.es/salud/orgdep/AETSA). Cuenta con varias GPC y directrices de producción propia, enfocadas a la introducción de pruebas genéticas, fármacos y nuevas tecnologías.
- –
Colaboración Cochrane (www.cochrane.org). Es una organización internacional sin ánimo de lucro que intenta ayudar a tomar decisiones clínicas y sanitarias bien fundamentadas preparando, manteniendo y divulgando revisiones sistemáticas sobre los efectos de la atención sanitaria. La herramienta fundamental para mantener actualizadas y difundir dichas revisiones sistemáticas es la Cochrane Library (www.update-software.com/publications/Cochrane). El Centro Cochrane Iberoamericano (www.cochrane. es) está ubicado en el Hospital de la Santa Creu i Sant Pau de Barcelona. Desde el año 2003, y gracias a una suscripción realizada por el Ministerio de Sanidad y Consumo, cualquier ciudadano puede consultar gratuitamente la revista electrónica Cochrane Library Plus, la cual contiene la versión en castellano de la Cochrane Library y otras publicaciones de interés (www.update-software.com/clibplus).
- –
Grading of Recommendations Assessment, Development and Evaluation (GRADE) Working Group (www.gradeworkinggroup.org). Como se ha revisado previamente con detalle (véase «¿Cómo evaluar la calidad de la evidencia y establecer el grado de recomendación de una GPC?»), este grupo tiene como objetivo construir y validar una clasificación que equilibre la sencillez con la necesidad de integrar todos los aspectos importantes a la hora de evaluar las evidencias y graduar las recomendaciones.
- –
Guidelines International Network (GIN) (www.g-in.net). Es una red internacional que promueve el desarrollo de GPC y su aplicación a la práctica. Es uno de los portales con mayor capacidad e información sobre aspectos metodológicos y de investigación en GPC.
- –
Servicio de Evaluación de Tecnologías Sanitarias del País Vasco (OSTEBA) (www.euskadi.net/sanidad). Cuenta con materiales metodológicos de GPC en su apartado de métodos y formación. Fueron responsables, junto con la Biblioteca Josep Laporte, de la traducción del Instrumento AGREE al castellano (véase más adelante) y de la elaboración del correspondiente manual de formación (ambos se pueden descargar en formato pdf en su página web).
- –
REDeguias (www.redeguias.es). Es una red de investigación sobre GPC. Es una de las líneas activas de la red temática de MBE. Se trata de una red financiada por el Instituto de Salud Carlos III, que tiene como objetivo la investigación acerca de la fiabilidad y consistencia de las GPC producidas en España, así como de las barreras que dificultan su implantación. Entre sus actividades destaca la elaboración de estrategias dirigidas a modificar las conductas profesionales derivadas de la implantación de GPC e incrementar su efectividad para conseguir mejorar la práctica clínica. Otros objetivos de REDeguias son desarrollar un registro nacional de GPC, controlar la calidad en la producción de éstas e investigar sobre resultados que permitan conocer cuál es el efecto de la implantación de las GPC.
GuíaSalud es una iniciativa que pretende mejorar la calidad de la atención sanitaria en el Sistema Nacional de Salud, en el que participan todas las comunidades autónomas del Estado. Su desarrollo se establece a través de un convenio entre la Agencia de Calidad del Sistema Nacional de Salud, dependiente del Ministerio de Sanidad y Consumo, y el Instituto Aragonés de la Salud (I+CS), que actúa como órgano gestor del proyecto. El proyecto Guía- Salud tiene como misiones desarrollar y poner a disposición del Sistema Nacional de Salud instrumentos de información, registro, selección, adaptación, implantación y actualización de GPC.
La herramienta clave del Proyecto GuíaSalud es el portal www.guiasalud.es, cuyo lanzamiento oficial fue en 2005. El objetivo fundamental de este portal es ofrecer un catálogo de GPC elaboradas o adaptadas en España, en cualquiera de las lenguas oficiales del Estado, y que cumplen con los criterios de inclusión definidos por el proyecto. Sus objetivos específicos son: a) facilitar el acceso y la utilización de los citados instrumentos y recursos; b) desarrollar redes de cooperación en la identificación de necesidades de formación y obstáculos prácticos en la adaptación e implantación de GPC, y c) establecer y consolidar una cultura de comunicación, comparación y difusión de buena práctica.
Otras actividades ofertadas por GuíaSalud son: a) formativas, con la intención de dar a conocer las GPC como herramientas para la toma de decisiones clínicas y para proporcionar habilidades en la evaluación, elaboración/ adaptación, difusión e implementación de GPC; b) asesoría y apoyo técnico orientados al desarrollo y a la utilización de GPC.
Los criterios de inclusión para las GPC han sido asumidos por todas las comunidades autónomas y están avalados por el comité científico. Estos criterios tienen por objetivo asegurar a los potenciales usuarios de las GPC incluidas en GuíaSalud unos mínimos de calidad y transparencia científica. Los 6 criterios de inclusión de GPC en el Catálogo del proyecto GuíaSalud son los siguientes:
- 1.
Las GPC deben incluir información para ayudar a profesionales de la salud o pacientes a tomar decisiones acerca de la atención adecuada para situaciones clínicas específicas.
- 2.
Las GPC deben haber sido producidas en España (en cualquiera de las lenguas oficiales del Estado; por instituciones públicas o privadas, sociedades profesionales, paneles de expertos e incluso grupos profesionales); las GPC producidas fuera de España podrán ser incluidas si han sido traducidas y respaldadas por cualquiera de las instituciones o grupos citados previamente.
- 3.
Las GPC deben haber sido producidas o actualizadas en los últimos 5 años.
- 4.
Los datos de los autores y la declaración de conflicto de interés deben aparecen de forma clara en la GPC.
- 5.
Los métodos de búsqueda de la evidencia científica utilizados deben estar descritos.
- 6.
Las recomendaciones de la GPC deben estar ligadas a referencias bibliográficas, de forma que puedan identificarse las fuentes y evidencias que las sustentan.
Dentro del Portal GuíaSalud se encuentra la sección denominada «Catálogo de GPC en el Sistema Nacional de Salud», donde el profesional sanitario puede acceder al listado de afecciones clínicas que agrupa a las GPC incluidas y realizar sencillas búsquedas por palabras contenidas en el título y objetivo general de la guía. Así, por ejemplo, las GPC relacionadas con la especialidad de aparato digestivo incluidas son: enfermedad por reflujo gastroesofágico, dispepsia, rectorragia, síndrome del intestino irritable, y recomendaciones para la valoración nutricional y el soporte nutricional especializado de los pacientes críticos.
¿EN QUÉ CONSISTE EL PROGRAMA DE «GUÍAS CLÍNICAS EN GASTROENTEROLOGÍA» DE LA ASOCIACIÓN ESPAÑOLA DE GASTROENTEROLOGÍA?Se trata de un proyecto de colaboración entre la Asociación Española de Gastroenterología (AEG), la Sociedad Española de Medicina de Familia y Comunitaria (semFYC) y el Centro Cochrane Iberoamericano. Como se señala en el documento de protocolo incluido en su página web (www.guiasgastro.net), en la última década se han introducido cambios sustanciales en la organización sanitaria y en la comunicación médica que han modificado los escenarios de la atención a los pacientes, incluidos los que presentan enfermedades digestivas. Entre los principales factores que han influido en este cambio podemos citar la implementación de centros de salud en atención primaria con médicos formados en el sistema MIR y con alta cualificación para la asistencia médica, y la desaparición progresiva de la figura del gastroenterólogo en el ámbito de la medicina ambulatoria y sin vinculación al centro hospitalario. Todos estos factores están promoviendo cambios muy importantes en la atención al paciente. Sin embargo, en una fase todavía de consolidación de muchos de estos cambios, ello también ha propiciado una elevada heterogeneidad de conductas médicas en nuestro país actualmente. Por ello, y con el objetivo de mejorar la calidad asistencial, es necesario emprender políticas de uniformización de conductas.
Por otra parte, la organización asistencial cada vez demanda una mejor conexión entre todos los niveles asistenciales con el fin de garantizar una atención integral con continuidad y coherencia entre los diferentes eslabones de la prestación médica. Para dar respuesta a esta necesidad de reorganización de la asistencia en el ámbito de las enfermedades digestivas nació este proyecto conjunto entre la AEG, la semFYC y el Centro Cochrane Iberoamericano, con la intención de analizar a partir de evidencias científicas y de criterios de aplicabilidad las conductas diagnósticas, terapéuticas y preventivas más recomendables en nuestro medio en el ámbito de las enfermedades digestivas más prevalentes y, a partir de ello, elaborar GPC específicas para estas enfermedades.
Una vez confeccionadas las GPC por parte del comité correspondiente, éstas son revisadas por médicos de familia de las diferentes comunidades autónomas para evaluar si se precisan algunas adaptaciones a la idiosincrasia u organización local del sistema sanitario. Esta metodología permite disponer de unas GPC de ámbito nacional en las cuales la mayoría de conductas son homogéneas para todo el territorio español, mientras que algunos aspectos de cada guía pueden ser mínimamente diferentes en función de la aplicabilidad de cada región sanitaria.
Las GPC disponibles en este Programa de «Guías Clínicas en Gastroenterología» se centran en las siguientes enfermedades: dispepsia, prevención del cáncer de colon, rectorragia y enfermedad por reflujo gastroesofágico.
¿CÓMO EVALUAR LA CALIDAD DE UNA GUÍA DE PRÁCTICA CLÍNICA? EL INSTRUMENTO AGREELa calidad de una GPC debe valorarse por medio de herramientas de evaluación que permitan decidir si puede recomendarse o implantarse. Se entiende por calidad la confianza en que se han evitado los sesgos potenciales producidos en su desarrollo o que han sido tenidos en cuenta y tratados apropiadamente y, por tanto, las recomendaciones tienen una validez –interna y externa– y son viables en la práctica clínica. La evaluación de la calidad de una GPC incluye criterios sobre los métodos utilizados en su desarrollo, sobre la claridad y la transparencia del producto, y sobre otros factores asociados a su aceptación, así como sobre el contenido de las recomendaciones finales.
Actualmente, la herramienta más aceptada para evaluar la calidad de las GPC es el instrumento AGREE (Appraisal of Guidelines Research and Evaluation; www.agreecollaboration. org/pdf/es.pdf), cuyo objetivo es proporcionar una estructura para la valoración –y también el desarrollo– de las GPC. Junto con el instrumento elaborado por Shaneyfelt et al, en 1999, es el único desarrollado para la evaluación de GPC que ha superado un proceso de validación. Un estudio comparativo entre estos 2 instrumentos demuestra que el AGREE, además de ser el que en este momento cuenta con mayor aceptación y presenta un formato más manejable, consigue realizar una agrupación de criterios más clara y completa. Está editado y validado en varios idiomas, incluido el castellano.
El AGREE es un instrumento de evaluación genérica (no valora específicamente los contenidos clínicos y sirve para cualquier especialidad o afección), y puede ser utilizado por productores usuarios de GPC, así como por decisores de políticas de salud. De hecho, fue desarrollado para ayudar a quienes elaboran GPC a seguir una metodología estructurada y sistemática, a los proveedores de cuidados de salud a evaluar GPC antes de adoptar sus recomendaciones en la práctica clínica y a los decisores de diferentes niveles y organismos a recomendar GPC para su uso en la práctica.
El instrumento AGREE consta de 23 ítems clave, agrupados en 6 áreas, cada una de las cuales pretende obtener información de un aspecto diferente relacionado con la calidad de éstas. Las áreas que evalúa el instrumento AGREE son las siguientes (tabla VI):
- 1.
Alcance y objetivos: se refiere al propósito general de la guía, a las preguntas clínicas específicas y a la población diana de pacientes.
- 2.
Participación de los implicados: se refiere al grado en el que la guía representa los puntos de vista de los usuarios a los que está destinada.
- 3.
Rigor en la elaboración: hace referencia al proceso utilizado para reunir y sintetizar la evidencia, así como a los métodos para formular las recomendaciones y para actualizarlas.
- 4.
Claridad y presentación: se ocupa del lenguaje y del formato de la guía.
- 5.
Aplicabilidad: hace referencia a las posibles implicaciones de la aplicación de la guía en aspectos organizativos, de comportamiento y de costes.
- 6.
Independencia editorial: tiene que ver con la independencia de las recomendaciones y el reconocimiento de los posibles conflictos de intereses por parte del grupo de desarrollo de la guía; de este modo habrá transparencia en el proceso y será posible evaluar si las recomendaciones finales de la guía se ven influidas por intereses creados.
Áreas e ítems que evalúa el instrumento AGREE
| Área 1. Alcance y objetivos |
|
| Área 2. Participación de los implicados |
|
| Área 3. Rigor en la elaboración |
|
| Área 4. Claridad y presentación |
|
| Área 5. Aplicabilidad |
|
| Área 6. Independencia editorial |
|
Los ítems incluidos en cada una de las 6 áreas mencionadas se resumen en la tabla VI. Los criterios se evalúan en una escala de Likert de 4 puntos. De este modo, cada ítem está graduado mediante una escala que va desde el 4 («Muy de acuerdo») hasta el 1 («Muy en desacuerdo»), con 2 puntos intermedios: 3 («De acuerdo») y 2 («En desacuerdo »). La escala mide la intensidad con la que un criterio (ítem) ha sido cumplido. Las puntuaciones de las 6 áreas son independientes y no deben ser agregadas en una única puntuación de calidad. Aunque las puntuaciones de las áreas pueden ser útiles para comparar guías y para apoyar la decisión sobre si utilizar o recomendar una GPC, no es posible establecer umbrales para dichas puntuaciones que identifiquen una guía como «buena» o como «mala». Al final del instrumento existe un apartado para realizar una evaluación global que, aunque subjetiva, tendrá en cuenta no sólo el rigor científico del proceso de elaboración, sino también las consideraciones prácticas de su aplicación. Contiene una serie de opciones: «Muy recomendada», «Recomendada (con condiciones o modificaciones) », «No recomendada» y «No se sabe».
La revisión detallada de cada uno de los criterios del instrumento AGREE escapa al objetivo del presente artículo, pero sí nos parece importante profundizar específicamente en los ítems del área 3 (Rigor en la elaboración), ya que ésta es una de las áreas más importantes y de ella depende en gran parte la calidad de la elaboración de la guía. A continuación se revisan brevemente dichos ítems. El ítem 8 valora si «Se han utilizado métodos sistemáticos para la búsqueda de la evidencia». Deberían aportarse los detalles de la estrategia utilizada para la búsqueda de la evidencia, incluyendo los términos de búsqueda usados, las fuentes consultadas y el rango de fechas cubierto. Por ejemplo, una estrategia de búsqueda adecuada incluiría bases de datos electrónicas (como MEDLINE, EMBASE o CINAHL), bases de datos de revisiones sistemáticas (como la Cochrane Library), búsqueda manual en revistas, revisión de comunicaciones de congresos y GPC.
El ítem 9 valora si «Los criterios para seleccionar la evidencia se describen con claridad». Para poder contestar afirmativamente, deberían detallarse claramente los criterios utilizados para incluir o excluir las evidencias identificadas por la búsqueda. Por ejemplo, al revisar la eficacia de la azatioprina en el mantenimiento de la remisión en la enfermedad de Crohn podemos decidir incluir únicamente evidencias procedentes de ensayos clínicos aleatorizados.
El ítem 10 evalúa si «Los métodos utilizados para formular las recomendaciones están claramente descritos». Debe haber una descripción de los métodos empleados para establecer las recomendaciones y de cómo se ha llegado a las decisiones finales. Los métodos incluyen, entre otros, un sistema de votación, técnicas formales de consenso (p. ej., empleando la metodología Delphi), etc. Finalmente, deben especificarse las áreas de desacuerdo y los métodos para resolverlas.
El ítem 11 valora si «Al formular las recomendaciones han sido considerados los beneficios en salud, los efectos secundarios y los riesgos». La guía debe considerar no sólo los beneficios, sino también los efectos secundarios y los riesgos de las recomendaciones. Por ejemplo, una guía para el manejo de la colitis ulcerosa debe incluir una discusión sobre los efectos globales en distintos resultados finales. Éstos deberían incluir no sólo la eficacia clínica (evaluada en términos de lograr la remisión, evitar la colectomía y prolongar la supervivencia) de cada uno de los tratamientos disponibles (5-aminosalicilatos, corticoides, inmunomoduladores tiopurínicos o fármacos biológicos), sino también los efectos adversos asociados a cada uno de ellos.
El ítem 12 evalúa si «Hay una relación explícita entre cada una de las recomendaciones y las evidencias en las que se basan». Cada recomendación debe enlazarse con una lista de referencias en las cuales se basa. Así, por ejemplo, cuando se señale que los inmunomoduladores tiopurínicos son efectivos en la enfermedad de Crohn corticodependiente y se establezca que la calidad de la evidencia es alta y la fuerza de la recomendación es fuerte (ambos aspectos clasificados según el sistema que finalmente hayamos elegido), se deberán especificar los estudios (en este caso los ensayos clínicos aleatorizados o la revisión sistemática que los sintetiza) en los que se basa esta conclusión.
El ítem 13 nos pregunta si «La guía ha sido revisada por expertos externos antes de su publicación». Las personas encargadas de esta revisión final no deben haber estado implicadas en el grupo de desarrollo y deben incluir algunos expertos en el área clínica y también algunos expertos en metodología. Además puede incluirse a los representantes de los pacientes.
Por último, el ítem 14 hace referencia a si «Se incluye un procedimiento para actualizar la guía». Las guías deben establecer claramente un procedimiento de actualización. Por ejemplo, pueden incluir un cronograma o un sistema para incorporar búsquedas bibliográficas actualizadas regularmente y realizar los cambios requeridos.
Finalmente, como cualquier herramienta, el instrumento AGREE no sólo tiene ventajas, sino también limitaciones. En primer lugar, para los profesionales que realizan asistencia, en ocasiones resulta complicado utilizar el instrumento AGREE para la valoración de una GPC, ya que frecuentemente se precisa tomar decisiones de una forma rápida, que no permite llevar a cabo todo el proceso de valoración que implica esta herramienta. En segundo lugar, cuanto mayor sea el número de personas que evalúen la guía, mayor será la fiabilidad de la evaluación, y se ha establecido un número mínimo de 4 para su aplicación; sin embargo, en la práctica puede resultar complicado que coincidan 4 profesionales con la formación específica para ello, por lo que este sistema resulta poco ágil. En tercer lugar, la valoración completa de una GPC de calidad puede requerir, por término medio, 1-2 h, lo cual vuelve a resultar poco ágil para los profesionales que realizan únicamente asistencia. Por último, el instrumento AGREE no incluye criterios para evaluar la implementación de las GPC; no obstante, de alguna manera sí tiene en cuenta los aspectos relativos a la implementación, ya que exige tanto la realización de una prueba piloto antes de la difusión de la guía para probar su aceptación como la elaboración por parte de los autores de indicadores que faciliten la evaluación posterior de los efectos de su aplicación.
¿QUÉ LIMITACIONES TIENEN LAS GUÍAS DE PRÁCTICA CLÍNICA?El entusiasmo desmedido por las GPC debe ser ponderado por los datos procedentes del mundo «real», que nos indican que una GPC no es la panacea para alcanzar una calidad asistencial excelente y reducir a cero la variabilidad en la práctica clínica. Las GPC tienen numerosas limitaciones, y ser conscientes de su existencia nos hará ser realistas en cuanto a las expectativas sobre sus efectos beneficiosos:
- 1.
En primer lugar, debemos tener presente que no siempre es necesario desarrollar una GPC para dar respuesta a un problema clínico. La GPC representa únicamente una de las opciones disponibles dirigidas a mejorar la atención a nuestros pacientes, pero no siempre es la alternativa más efectiva ni la menos costosa. Como se ha mencionado previamente, los problemas más susceptibles de mejorar mediante el desarrollo de una GPC son los que presentan una elevada frecuencia y variabilidad en la práctica clínica, con un alto nivel de incertidumbre en la toma de decisiones. En caso contrario, la utilidad de esta herramienta puede ser mucho más limitada.
- 2.
Aunque una GPC sea excelente, debe aplicarse con buen sentido clínico. Así, es evidente que si un clínico aplica la guía a un paciente con un diagnóstico mal establecido, el resultado será pésimo. Por ejemplo, de poco valdría disponer de una excelente GPC en la que se evalúe el papel de los diversos fármacos en el tratamiento del brote de colitis ulcerosa si lo que realmente sufre nuestro paciente es una colitis infecciosa.
- 3.
La elaboración de una GPC implica un proceso largo y costoso (en términos de tiempo y de dinero). Esto es así por el gran esfuerzo de análisis y síntesis de evidencias que requiere. El alto coste de la elaboración de una GPC supone una barrera para algunas organizaciones, e incluso puede llegar a hacer inviable su realización. El tiempo medio necesario para finalizar una GPC oscila entre uno y 2 años, lo que hace que su elaboración se parezca más a una carrera de resistencia que de velocidad. Por tanto, las expectativas de confeccionar guías muy rápidamente utilizando métodos basados en la evidencia están condenadas al fracaso.
- 4.
No todas las GPC son iguales, y no siempre están basadas estrictamente en la evidencia científica. Así, se pueden distinguir diferentes tipos de GPC según el método que se utilice para su elaboración: pueden estar basadas en la opinión de expertos, en el consenso o, idealmente, en la evidencia. En estas últimas, la metodología empleada en su elaboración (tanto en la búsqueda de la literatura científica como en la síntesis de la evidencia para construir las recomendaciones finales) se realiza de forma sistemática, explícita y reproducible, lo que minimiza los sesgos en las recomendaciones. La principal ventaja de la estrategia basada en la evidencia es su explicitud, de manera que cualquier error que se cometa durante el proceso puede ser detectado por quienes revisan los resultados. Por el contrario, las GPC basadas en revisiones narrativas (en lugar de sistemáticas) o desarrolladas únicamente por consenso (lamentablemente muchas de ellas pertenecen a este grupo) se basan más en opiniones subjetivas que en pruebas objetivas y, por tanto, son menos explícitas y reproducibles. Parece aquí adecuado recordar el acertado aforismo que afirma que «el consenso es cuando todos están de acuerdo con algo con lo que nadie estaría de acuerdo de forma individual».
- 5.
El desarrollo y la publicación de una GPC implica, necesariamente, un proceso de simplificación y síntesis, que es especialmente manifiesto cuando se pretende confeccionar un algoritmo de decisión. En medicina, como todo en la vida, las cosas frecuentemente no son ni blancas ni negras, sino que pueden adquirir multitud de matices grises. Sin embargo, la necesaria simplificación que conlleva el seguimiento de un árbol de decisión (con decisiones dicotómicas y respuestas categóricas obligadas, del tipo sí/no), hace que a menudo se pierdan los matices inherentes a la complejidad de la valoración clínica del paciente en condiciones de práctica clínica. En relación con lo anterior, en ocasiones las guías pueden ser demasiado rígidas para aplicarlas a pacientes individuales. Debemos recordar que las GPC no son reglas fijas de actuación sino que, como se ha mencionado previamente, las recomendaciones que proponen deberían integrarse en la práctica con las preferencias tanto de los clínicos como de los pacientes y con las circunstancias de cada lugar de trabajo; esto es fácil de decir, pero difícil de poner en práctica, pues para ello se requiere destreza en la adaptación local y en la comunicación con los usuarios, habilidades para las que no siempre estamos suficientemente entrenados.
- 6.
Aunque todos los pasos del desarrollo de una GPC se hayan realizado con rigor y de forma sistemática siempre habrá alguna decisión (p. ej., al establecer la recomendación final) que conlleva un juicio de valor y, por tanto, un cierto componente subjetivo (sobre todo cuando se trata de sopesar los beneficios frente a los riesgos de una determinada actitud). Así, es inevitable que en mayor o menor medida las recomendaciones se vean influidas por las opiniones, la experiencia clínica o la composición de los integrantes del grupo que elabora la GPC. Esto puede explicar el hecho de que 2 guías sobre el mismo tema puedan llegar a conclusiones diferentes, incluso aunque la evidencia científica identificada sea la misma. Por ejemplo, incluso en el caso de que haya argumentos científicos de calidad (procedentes de ensayos clínicos aleatorizados) a favor de una determinada intervención, la magnitud del efecto beneficioso puede que sea marginal y ello llevar a que la recomendación final sea contraria a su uso (quizá porque se asocie con efectos adversos relevantes o porque su coste sea muy elevado).
- 7.
Aunque son una gran herramienta de trabajo, las GPC no siempre nos permiten encontrar respuestas a todas las preguntas que a diario nos hacemos en la práctica clínica. Las buenas GPC deberían hacer constar lo que se sabe y también lo que se desconoce sobre cada una de las preguntas relevantes que pretendamos responder. En ocasiones, la respuesta a una pregunta de una GPC puede ser sencillamente que «no hay evidencia suficiente como para establecer una recomendación específica». Incluso en estos casos la información será útil, pues habremos detectado una laguna de conocimiento hacia la que deberán dirigirse los esfuerzos investigadores futuros. Por ejemplo, imaginemos que en una GPC dedicada al tratamiento de la colitis ulcerosa nos preguntamos si, en el brote grave de este enfermedad, es más eficaz la ciclosporina o el infliximab; aunque hay experiencias clínicas que nos aportan información de dichos fármacos por separado, no disponemos hasta el momento de ningún estudio comparativo directo entre ambos. Por tanto, es evidente que se precisa profundizar en esta laguna de conocimiento y, de hecho, ya se ha puesto en marcha un ensayo clínico aleatorizado diseñado a tal efecto.
- 8.
No siempre es posible generalizar las conclusiones de una GPC a todos los pacientes. A veces, lo que es mejor para los enfermos en general (que es lo que se recomienda en la GPC) puede no serlo para un paciente particular con unas características específicas. Para decidir si esto es así, se debe comprobar si la población diana a la que va dirigida la GPC se ajusta a las características de los pacientes del que la utiliza: edad, sexo, prevalencia de la enfermedad y de los diferentes factores de riesgo de ésta, ámbito de aplicación (primaria o especializada), etc. Si la población diana es sustancialmente diferente, es posible que las recomendaciones puedan no ser aplicables a nuestro paciente. Por ejemplo, una GPC sobre la efectividad del cribado (screening) de cáncer de colon mediante colonoscopia en pacientes con colitis ulcerosa se basa en una serie de estudios que evalúan dicha estrategia en pacientes con una enfermedad de una determinada extensión y duración, frecuencia de tratamiento de mantenimiento con aminosalicilatos (fármacos con efecto protector frente a esta neoplasia) y con una determinada incidencia basal de cáncer de colon. Por tanto, los usuarios de esta GPC deberán decidir si los participantes en los estudios incluidos son razonablemente similares a su propia situación. Es también importante tener en cuenta las preferencias y creencias de los pacientes; aunque la fuerza de la recomendación de la GPC sea muy elevada, si no son aceptadas por ellos difícilmente serán aplicables. Finalmente, las circunstancias sanitarias concretas –con sus prioridades y recursos– pueden limitar también la generalización de las conclusiones, recalcando una vez más que las GPC no son universales; en este sentido, muchas GPC anglosajonas, por ejemplo, requieren ser adaptadas para su correcta implantación en nuestro ámbito.
- 9.
La ciencia evoluciona muy rápidamente, lo que hace que las recomendaciones de una GPC puedan quedar obsoletas en un breve período y obliga a planificar su revisión y actualización regular. Como se ha mencionado previamente, esto es especialmente cierto en el caso de las GPC, pues su elaboración precisa un gran esfuerzo y tiempo, y esta obligada demora puede hacer que en el momento de la publicación de la guía su actualidad no sea ya la adecuada. Si además no se lleva a cabo el proceso de revisión periódica, podemos encontrarnos con que unas recomendaciones ya caducas se perpetúen en el tiempo.
- 10.
De nada valdría haber desarrollado una magnífica GPC si luego nadie la lee ni la utiliza. Para ello, es necesario que las guías se incorporen en la práctica clínica, es decir, que los profesionales sanitarios adopten sus recomendaciones y las apliquen a sus pacientes. Que las GPC sirvan de ayuda real y mejoren la calidad de la asistencia no depende sólo de las actitudes de los profesiones ante ellas, sino también del apoyo institucional y las mejoras en su desarrollo e implementación. Con frecuencia primero se piensa en que hay que confeccionar la GPC, una vez confeccionada, propagarla, y después buscar estrategias para ponerla en marcha y facilitar que los usuarios las empleen. Sin embargo, es improbable que los programas de implantación de GPC sean efectivos a menos que consideren a las estrategias de diseminación como parte integrante del mismo proceso de desarrollo. Esto explica que, finalmente, la implantación de muchas GPC en la práctica diaria sea relativamente modesta, ya que el desarrollo de una buena guía no garantiza en absoluto que sus usuarios potenciales la empleen de forma adecuada. Por tanto, con el objetivo de que las GPC se incorporen a la práctica clínica diaria, el desarrollo de cualquier guía debe incluir un plan –elaborado a priori– de difusión e implementación. Las estrategias basadas en métodos pasivos de diseminación e implementación (como la mera publicación de las GPC en revistas científicas) tienen una eficacia muy limitada y raramente consiguen cambiar el comportamiento o los «hábitos» profesionales de los médicos. Por otra parte, el paso más difícil en la implementación de una GPC está en la adaptación y la implantación local (entendiendo como local el área de salud que engloba los centros de atención primaria, centros de especialidades y el hospital de referencia); así, conseguir que el personal sanitario sin conocimientos básicos en metodología en investigación y de trabajo en calidad asistencial, escaso tiempo, limitado apoyo institucional e incentivos casi inexistentes sean capaces de realizar este proceso supone todo un reto.
- 11.
Finalmente, es necesario conocer las dificultades o barreras –los factores que impiden o dificultan los cambios que se pretenden alcanzar– que pueden interferir a la hora de implementar una GPC en su ámbito de aplicación. El diagnóstico de las barreras que pueden encontrarse y de las estrategias útiles para resolverlas debería preceder a cualquier intento de implantar una GPC. A la hora de identificar estas barreras debe primar el pragmatismo y la factibilidad sobre la rigurosidad metodológica (que era la protagonista indiscutible en las fases previas de la elaboración de una GPC). Aunque habitualmente las dificultades o barreras suelen ser multifactoriales y afectan no sólo a los profesionales, sino también a pacientes y recursos disponibles, con objetivos didácticos las podemos clasificar en 4 grandes grupos:
- –
Barreras que dependen de las características de la GPC. A su vez, pueden estar relacionadas con el proceso de desarrollo de la guía (p. ej., un objetivo de la guía poco definido o unas recomendaciones ambiguas), con la redacción (demasiado larga o con un formato de publicación incómodo para el manejo en la consulta), con el contenido (por su falta de validez, fiabilidad y reproducibilidad, lo que dificultará su credibilidad por parte de los clínicos).
- –
Barreras relacionadas con el clínico. Tienen que ver con los conocimientos y las habilidades del médico, su actitud, la sobrecarga asistencial o la resistencia al cambio.
- –
Barreras relacionadas con el medio local y con la propia organización sanitaria. Por ejemplo, como consecuencia de un escaso apoyo institucional o la falta de recursos para el desarrollo e implementación de las guías.
- –
Barreras relacionadas con el propio proceso de implementación. Debidas, por ejemplo, a la ausencia de una planificación estructurada desde el inicio para la implementación.