La enfermedad celíaca constituye un problema sanitario de primera magnitud por su elevada prevalencia. Las complicaciones asociadas a largo plazo y la dificultad que supone su diagnóstico han hecho plantear la necesidad del cribado poblacional. Los métodos serológicos para la detección de la enfermedad celíaca incluyen la determinación de anticuerpos antiendomisio y antitransglutaminasa, cuya sensibilidad y especificidad es alta (cercana al 100%) para las formas con atrofia y baja (del 15-30%) en pacientes con lesiones mínimas, lo que plantea una lógica dificultad diagnóstica en este grupo de individuos. Si bien se desconoce el riesgo de aparición de complicaciones tardías para este grupo de pacientes con enteritis linfocítica, se sabe que pueden estar igual de sintomáticos que los pacientes con atrofia y, por tanto, también se beneficiarían de una dieta sin gluten. El cribado sistemático permite detectar un mayor número de pacientes con enteropatía sensible al gluten, pero todavía carecemos de datos suficientes para valorar el impacto económico y social de su aplicación.
Due to its high prevalence, celiac disease is a major health problem. Because of the long-term complications and difficulty of diagnosing this disease, the need for populationbased screening has been raised. Serological methods for detection of celiac disease include antiendomysial and antitransglutaminase antibody detection, which has high sensitivity and specificity (nearly 100%) in forms with atrophy and low sensitivity and specificity (between 15 and 30%) in patients with minimal lesions, thus posing diagnostic difficulties in this group of individuals.
The risk of late complications is unknown in this group of patients with lymphocytic enteritis. However, this group may be just as symptomatic as patients with atrophy and consequently would also benefit from a gluten-free diet. Systematic screening allows a greater number of patients with gluten-sensitive enteropathy to be detected. However, there are insufficient data to be able to evaluate the economic and social impact of systematic screening.
La enfermedad celíaca (EC) es una de las más prevalentes en nuestro medio1. La aparición de posibles complicaciones derivadas de un diagnóstico tardío y la dificultad de establecerlo centran el debate actual.
El «iceberg celíaco» se ha utilizado a menudo para ilustrar el gran volumen de pacientes, no sólo con enteropatía clásica (atrofia vellositaria), sino también con lesiones duodenales mínimas (enteropatía Marsh I) que quedan sin detectar2,3. La importancia de este hecho radica en que, tal como se ha demostrado recientemente, ambos grupos pueden estar igual de sintomáticos, sin que dependa, por tanto, de la gravedad de la lesión histológica4. La introducción de una dieta sin gluten (DSG) es prioritaria, ya que restablece la percepción de salud en los pacientes con clínica asociada5. Sin embargo, todavía no disponemos de datos suficientes para conocer si todo el espectro histológico que comprende la enteropatía sensible al gluten (ESG) se ve sujeto a las mismas complicaciones a largo plazo (neoplasias intestinales, osteoporosis o asociación de otras enfermedades autoinmunes), por lo que se desconoce si todos los pacientes son tributarios de seguir una DSG. Este hecho se ha estudiado en pacientes con atrofia completa, pero no en los que presentan lesiones menores6,7.
ABORDAJE DEL CRIBADO POBLACIONAL. ¿CUÁNDO REALIZARLO?Si nos atenemos a los principios de Wilson y Jungner, publicados en 1968 por la Organización Mundial de la Salud8, para establecer la necesidad de cribado poblacional (tabla I), parece evidente que la EC es una buena candidata: su prevalencia es elevada, está infradiagnosticada, y disponemos de métodos serológicos no invasivos para su detección9,10 y un tratamiento eficaz. No obstante, la búsqueda sistemática de la enfermedad en grupos de riesgo ha permitido diagnosticar un gran número de pacientes que se mantienen absolutamente asintomáticos. La necesidad de instaurar una DSG y la dificultad de su adherencia en este grupo de pacientes ha llevado a cuestionar una vez más la utilidad del cribado masivo11. A continuación se revisan algunos puntos a favor y en contra de la realización del cribado.
Principios de Wilson y Jugner para la detección precoz de una enfermedad
| Principios | Enfermedad celíaca |
| La enfermedad debe constituir un importante problema sanitario | Sí |
| Disponibilidad de un tratamiento aceptado para la enfermedad | Sí |
| Facilidades para el diagnóstico y tratamiento | Sí |
| Existencia de una fase precoz o latente identificable | Sí |
| Existencia de una prueba diagnóstico aceptable para la población | Sí |
| Buen conocimiento de la historia natural de la enfermedad, incluida la evolución desde formas latentes a formas clínicas e histológicamente evidentes | No |
| Acuerdo consensuado sobre a quién hay que tratar | No |
| El cribado debe ser coste-eficaz | ? |
| La identificación de pacientes debe ser un proceso continuo | ? |
Múltiples estudios realizados, tanto en Europa12–15 como en el norte de África16,17, Asia18,19, Sudamérica20–22 y Estados Unidos23, ponen de manifiesto la elevada prevalencia de la EC, que por lo general se estima entre 1:100 y 1:250. Si bien estas diferencias pueden estar determinadas por factores ambientales y genéticos, hay otras variables igualmente importantes. El método diagnóstico utilizado (tipo de marcador serológico, estudio genético y biopsia duodenal como prueba de referencia) y los condicionantes relacionados con la población evaluada serían los más destacables. En los distintos estudios de cribado poblacional se utilizan de forma heterogénea los anticuerpos antigliadina (AGA), antitransglutaminasa (t-TGA) y antiendomisio (EmA), a pesar de que es bien conocido que los primeros tienen una especificidad y una sensibilidad bajas. Por otro lado, la confirmación histológica no siempre se lleva a cabo. Además, el escaso conocimiento acerca de la evolución de la EC hace que la prevalencia, según el grupo de edad estudiado, pueda ser sustancialmente distinta. En este sentido, la mayoría de estudios se realiza en muestras de población adulta o pediátrica, y los pocos que realizan un análisis que incluyen todos los grupos de edad no han contemplado el ajuste a la pirámide poblacional. En la actualidad se está llevando a cabo un estudio en nuestro medio con inclusión de individuos ajustados a la pirámide poblacional, que ayudará a dar respuesta a esta cuestión. Cabe destacar que la mayor parte de los trabajos incluyen una muestra de población perteneciente a donantes de sangre. Este hecho supone un sesgo evidente por 2 motivos: a) estos individuos suelen tener una percepción de salud más elevada que el resto, y b) quedan excluidos todos los pacientes con anemia e hipertransaminasemia que, como es bien sabido, son manifestaciones de la EC. Por todo ello, la impresión es que la prevalencia global de la EC continúa estando subestimada, y se requiere una búsqueda sistemática para su diagnóstico.
Complicaciones asociadasHay una elevada morbilidad asociada a la EC no diagnosticada. Actualmente se sabe que la presentación clínica clásica de la enfermedad no es, ni mucho menos, la forma habitual de inicio en la población adulta. El conocimiento de este hecho ha sido posible, en parte, gracias a programas de cribado en grupos de riesgo. Con ellos se ha observado que muchos pacientes con atrofia intestinal o con lesiones mínimas padecían síntomas inespecíficos y muy prevalentes en la población sana (flatulencia, astenia, distensión)24,25, a los que se «acostumbraban» considerándolos «normales», sin consultar a ningún facultativo por este motivo. Este grupo de individuos, con enfermedad «silenciada» (que no «silenciosa»), es únicamente detectable mediante una evaluación sistemática de la población. Otra complicación a largo plazo de no seguir una DSG es la osteopenia/osteoporosis26. Se dispone de datos acerca de la aparición de pérdida de masa ósea tanto en individuos con formas histológicamente leves como en pacientes con atrofia vellositaria5. El hecho de que esta desmineralización implique un aumento de fracturas es controvertido27,28, aunque parece una hipótesis lógica26. Dado que la EC tiene un sustrato autoinmune en su patogenia, la aparición de enfermedades autoinmunes monoorgánicas asociadas (la diabetes mellitus tipo 1 y la tiroiditis han sido las más estudiadas) también se ha visto aumentada en esta población29. Se ha sugerido que este riesgo puede estar asociado al tiempo de exposición al gluten. Sin embargo, otra teoría defiende que la relación de la EC con enfermedades autoinmunes no se debe al tiempo de exposición al gluten sino a un sustrato genético común30.
La EC no diagnosticada conlleva también un aumento de la mortalidad, que se ha visto relacionada, sobre todo, con la aparición de neoplasias. Hasta hace poco se creía que el riesgo global de padecer cáncer en los pacientes con enfermedad celíaca era muy superior al de la población general. Recientemente se ha demostrado que este riesgo no está tan aumentado31. Si bien se han publicado casos de pacientes celíacos que han desarrollado linfoma B no hodgkiniano intestinal y extraintestinal, adenocarcinomas de esófago, de orofaringe y neoplasias del sistema hepatobiliar y páncreas32,33, esta asociación sigue siendo controvertida34,35, y la única relación bien establecida con la EC no tratada es la del linfoma T primariamente intesti-nal36. Por otra parte, no disponemos de evidencia científica respecto al aumento de neoplasias en pacientes con lesiones mínimas. Todas estas complicaciones son evitables mediante la instauración precoz de una DSG. Parece pues razonable pensar que los pacientes sintomáticos con lesiones mínimas, así como los que no han sido identificados por presentar síntomas inespecíficos, son los que más se beneficiarían de un cribado poblacional. Si esta medida puede influir en la supervivencia global de todos los pacientes celíacos está todavía por demostrar37,38.
Métodos diagnósticosLas indicaciones clásicas para realizar pruebas serológicas diagnósticas para la EC incluyen dolor abdominal o flatulencia de causa no aclarada, diarrea crónica con o sin malabsorción, anemia ferropénica de origen desconocido, ser familiar de primer grado de un paciente celíaco, etc.
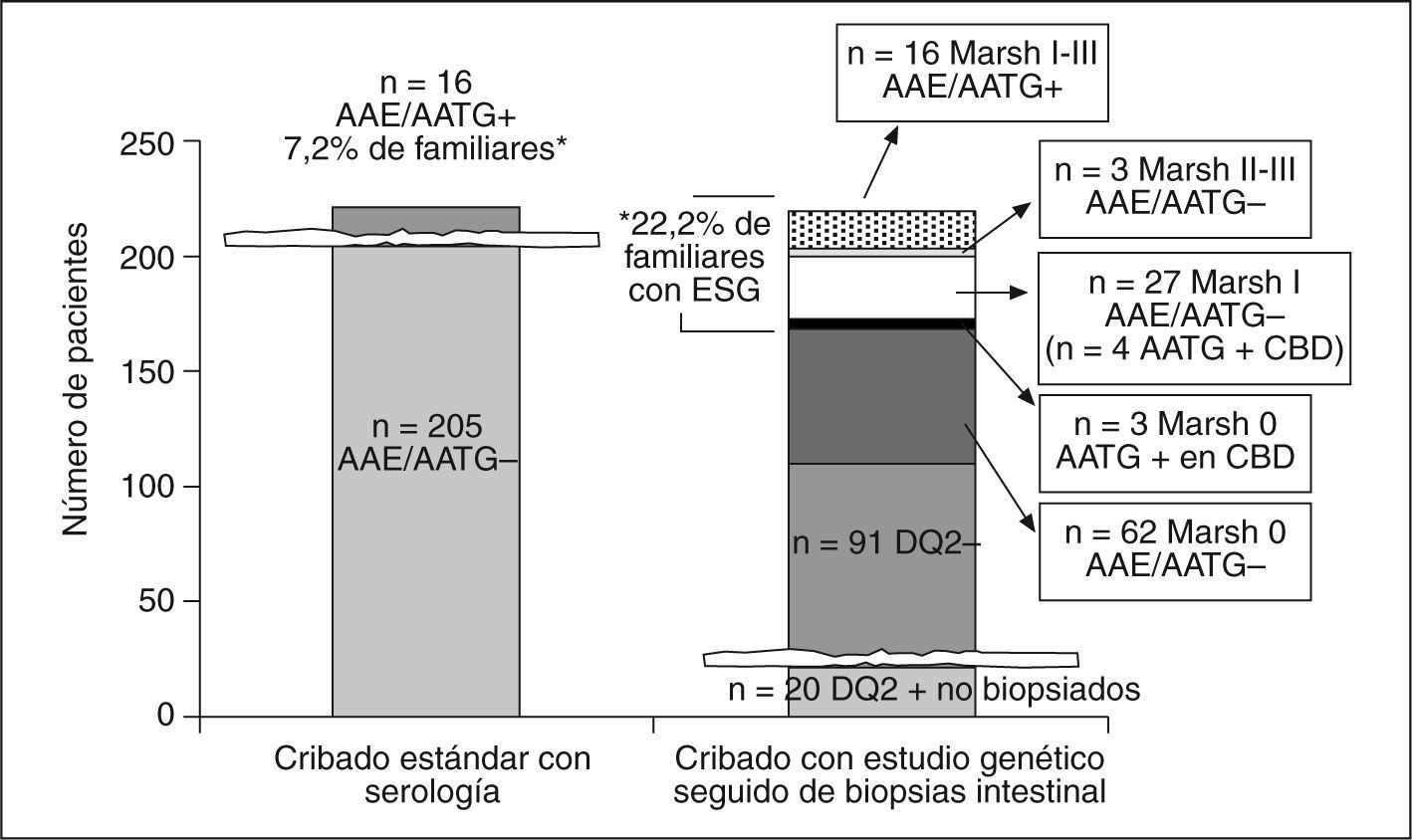
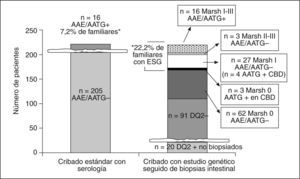
Hasta hace relativamente poco tiempo se utilizaba de forma sistemática la determinación de los anticuerpos AGA para la detección de EC, práctica que ha quedado obsoleta, puesto que su sensibilidad y especificidad ha demostrado ser muy baja. Actualmente, se utilizan indistintamente los anticuerpos IgA EmA y t-TGA, cuya especificidad y sensibilidad es cercana al 100% para las formas histológicamente graves de la enfermedad (atrofia)10. Los títulos de estos anticuerpos se correlacionan con el nivel de gravedad histológica, lo que supone que esta elevada sensibilidad y especificidad desciende hasta un 15-30% cuando la población evaluada está afectada de formas histológicamente leves4,10. Esto conlleva una evidente limitación para la detección de estos pacientes que, como se ha demostrado en un trabajo reciente publicado por nuestro grupo, pueden estar igual de sintomáticos que los pacientes con atrofia intestinal y, por tanto, también se beneficiarían de una DSG4,5. Este hecho ha llevado a elaborar nuevas estrategias diagnósticas para poder diagnosticar todo el espectro histológico que comprende la ESG. Es bien conocido que el alelo HLA-DQ2 se identifica en el 90-95% de los pacientes celíacos, y el 5% restante es positivo para HLA-DQ8. En nuestro trabajo se introducen estos marcadores genéticos para determinar la población de estudio dentro del grupo de riesgo «familiares de primer grado». Así, se practica una biopsia duodenal a todos los individuos con estudio genético positivo, hecho que permite profundizar en el «iceberg celíaco», diagnosticando hasta 3 veces más de pacientes con ESG (fig. 1). En cualquier caso, hasta un 20% de la población sana sin evidencia de celiaquía es portadora del gen HLA-DQ2, por lo que esta estrategia diagnóstica no es aplicable en el contexto de la población general, ya que no parece aceptable someter a una biopsia duodenal a un 20% de individuos39. Sin embargo, quedan por evaluar otros grupos de riesgo, como los pacientes con diabetes mellitus tipo 1, los afectados por otras enfermedades autoinmmunes o los que presentan síntomas de riesgo, como anemia ferropénica o hipertransaminasemia de causas no explicadas, en los que la utilidad de la estrategia descrita está por probar.
Utilidad del estudio genético (HLA-DQ2) seguido de biopsia intestinal en los casos positivos en familiares de primer grado de pacientes con enfermedad celíaca. La evaluación de 221 familiares de 82 casos índice DQ2+ permite identificar un 22,2% de los pacientes con enteropatía sensible al gluten (ESG) frente a un 7,2% identificados por serología4. CBD: cultivo de biopsia duodenal. *p < 0,000 (McNemar’s test).
La EC es una enteropatía autoinmune única, ya que se conoce el precipitante ambiental que la produce: el gluten. Con la retirada permanente de la dieta de esta sustancia proteica (presente en los derivados de trigo, cebada y centeno) la restitución de la mucosa intestinal suele ser completa. Este hecho es paralelo a la desaparición de síntomas y a la de las complicaciones asociadas. Si bien se sabe que la EC es un trastorno crónico, algunos datos recientes han sugerido que, aun estando bajo una ingesta normal de gluten, la lesión histológica puede revertir de forma espontánea, hasta en un 20% de los pacientes40. Este fenómeno de regresión puede deberse a que la distribución parcheada de la EC condicione una falsa remisión según donde se biopsie, o a una fase evolutiva inestable de la enfermedad, con posterior reaparición de las lesiones al cabo de meses o años. De forma inversa, se ha observado una progresión de la enfermedad desde formas leves (enteritis linfocítica) a formas graves (atrofia), aunque en un porcentaje muy pequeño de pacientes41. Los pacientes con enteritis linfocítica tienden a permanecer en este grado histológico de la enfermedad durante muchos años, lo que constituye la forma de presentación más habitual de la ESG en la población adulta4. Parece pues recomendable que todos los pacientes diagnosticados de ESG que, por motivos diversos, han decidido no iniciar una DSG, deberían someterse a un seguimiento estrecho, analítico (con determinación de marcadores serológicos, hemograma, perfil hepático, etc.) y clínico, con el fin de detectar la aparición eventual de complicaciones o progresión de la propia enfermedad.
Tratamiento de la enfermedad celíacaUna dieta libre de gluten es la única pauta aceptada y eficaz para el tratamiento de la enfermedad celíaca, y los datos de que disponemos hacen pensar que ésta debe mantenerse durante toda la vida42. Ello supone alteraciones evidentes en los hábitos dietéticos del paciente, a veces difíciles de seguir. El desconocimiento social mayoritario de esta enfermedad y la aún escasa sensibilización de la administración sanitaria, hacen que, la mayor parte de centros escolares o instituciones, así como de los restaurantes, no dispongan todavía de las infraestructuras necesarias para poder ofrecer una dieta exenta de gluten. Dónde sí parece observarse un aumento creciente de productos aptos para celíacos es en el mercado comercial, con el gran inconveniente de que su precio suele acarrear un incremento económico sustancial que no siempre está al alcance de todos los pacientes. Esta situación se ve agravada además por la falta de subvenciones que la sanidad pública de nuestro país ofrece para la adquisición de dichos alimentos, teniendo en cuenta que no dejan de ser un «fármaco» más. Estas limitaciones han sido otro de los argumentos utilizados por los profesionales que se muestran en desacuerdo con el cribado poblacional sistemático. A todo ello se añade que los individuos detectados en programas de cribado son los que suelen permanecer asintomáticos, y en algunos estudios son los que han mostrado una peor adhesión a la DSG11,43. Sin embargo, la experiencia no es homogénea, ya que algunos trabajos han señalado una buena aceptación y seguimiento de la DSG, incluso en el grupo de pacientes sin clínica asociada44. En referencia a este tema, en un trabajo realizado por nuestro grupo, en el que se incluyeron 1.868 individuos evaluados en un servicio de salud laboral mediante serología (datos personales pendientes de publicación: UEGW Congreso París, 2007), se alcanzó un porcentaje de aceptación de la biopsia del 81%. A los pacientes en que se confirmó histológicamente la presencia de ESG (grados I-III de Marsh) se les recomendó hacer una DSG, que se mantuvo, tras 1 año de seguimiento, en un porcentaje superior al 60%.
No debemos olvidar que, aunque la DSG es, sin duda, el pilar básico del tratamiento de la EC, hay puntualizaciones al respecto. En la evaluación inicial del paciente celíaco se debe valorar de forma sistemática la presencia de déficit producidos por la malabsorción crónica (calcio, hierro, vitamina B12, ácido fólico, etc.), y aportar suplementos en los pacientes en quienes se detecten dichos déficit. Éstos no son exclusivos de la atrofia intestinal, sino que los pacientes con enteritis linfocítica, aun estando asintomáticos, también pueden presentarlos. Ésta sería otra razón para no dejar en el olvido a un grupo de pacientes que, de no ser detectados mediante cribado poblacional, permanecerán sin diagnóstico ni tratamiento.
Coste-eficacia del cribado poblacionalEl coste económico real que supone la EC y las complicaciones que de ella se derivan cuando no se trataron todavía desconocidos. Algunos trabajos han evaluado el coste-efectividad de distintas estrategias diagnósticas y serológicas, pero pocos han analizado el impacto que supone evaluar de forma sistemática a toda la población. En este sentido, un trabajo reciente concluye que, asumiendo una tasa de mortalidad estandarizada (TME) de 1,5 para pacientes celíacos no tratados, el cribado es coste-efectivo para poblaciones con una prevalencia relativamente elevada (1:200) y en individuos pertenecientes a grupos de riesgo (familiares de primer grado, diabetes mellitus tipo 1, etc.)45. Estos modelos teóricos tienen sus limitaciones, ya que son únicamente aplicables cuando se cumplen las asunciones sobre las que se basan, que no siempre son reales (la TME de los pacientes que se siguen una DSG es de 1,1, mientras que oscila entre 1,3 y 5,8 en los estudios que evalúan la mortalidad y EC). Por otro lado, los datos (todavía no publicados) de un trabajo realizado en Países Bajos sugieren que sólo el coste nominal de 5 de las posibles complicaciones a largo plazo de la EC asciende a 9 millones de euros por año46. Si tenemos en cuenta que el coste debido a otras complicaciones distintas de las 5 evaluadas no ha sido nunca estudiado, y que en la actualidad todavía se desconoce la prevalencia de las complicaciones en pacientes con lesiones mínimas, esta cantidad puede estar subestimada.
En conclusión, parece justificado realizar el cribado poblacional de la EC mediante serología (EmA y t-TGA) en los pacientes que pertenecen a algún grupo de riesgo. No obstante, la determinación del estudio genético mediante HLA DQ2 o DQ8 (según el caso índice), seguido de biopsia intestinal en los casos positivos, ha demostrado ser de gran utilidad en el grupo de riesgo de «familiares de primer grado». A pesar de que los datos de que disponemos apuntan posibles beneficios del cribado poblacional, todavía carecemos de estudios que evalúen de forma prospectiva, y en poblaciones bien delimitadas, los costes, los beneficios y las consecuencias de la detección sistemática de la EC en comparación con una población control.