INTRODUCCIÓN
El colangiocarcinoma periférico (CP) o intrahepático se define como la neoplasia maligna primaria hepática originada en el epitelio de las vías biliares intrahepáticas. Es preciso diferenciarlo del colangiocarcinoma hiliar, también llamado tumor de Klastkin, que se origina en las vías biliares extrahepáticas proximales al hígado y se caracteriza por ocluir totalmente el confluente biliar y producir precozmente ictericia obstructiva aun cuando el tamaño tumoral sea pequeño. El CP se origina en los conductos biliares proximales a la segunda bifurcación y alcanza un gran tamaño sin producir, generalmente, ictericia hasta fases muy avanzadas. Su presentación clínica, tratamiento y pronóstico se asemejan a los del hepatocarcinoma que aparece en un hígado normal; incluso un 5% de los casos son formas anatomopatológicas mixtas de hepatocolangiocarcinoma. La mayoría de los CP son tumores de gran tamaño, ya que se diagnostican cuando el paciente presenta síntomas. La resección quirúrgica radical es la única opción curativa. Generalmente requieren una cirugía hepática muy agresiva para conseguir la extirpación radical1-3. El trasplante hepático en el CP irresecable obtiene unos resultados pobres, por lo que está contraindicado4,5. Los tratamientos paliativos de radioterapia y quimioterapia son poco efectivos, aunque últimamente han aparecido nuevos fármacos como la gencitabina que consiguen mejorar el porcentaje de respuestas6-8. En Estados Unidos se ha descrito un aumento de la incidencia de este tumor de un 9% anual, con un incremento de 10 veces en la mortalidad por CP desde 19739.
Los objetivos de este trabajo son exponer nuestra experiencia en el tratamiento quirúrgico de estos tumores y establecer factores pronóstico de recidiva y supervivencia.
PACIENTES Y MÉTODOS
Se trata de un estudio de una cohorte de casos con diagnóstico de CP recogidos en la base de datos de resecciones hepáticas de nuestra unidad, que se ha obtenido de manera prospectiva durante el período comprendido entre 1988 y 2004. En este período se realizaron en nuestra unidad 540 resecciones hepáticas, 195 por tumores malignos primarios y en 21 casos por CP, lo que corresponde al 3,8% de las hepatectomías y al 10,7% de las resecciones por tumor maligno primitivo. Durante dicho período se diagnosticó a 29 pacientes de CP. Se descartó a uno de ellos para cirugía por presentar un tumor de 7 cm en el lóbulo derecho de un hígado con cirrosis hepática e hipertensión portal. Recibió tratamiento con quimioembolización transarterial y sorprendentemente sobrevivió 3 años. Se intervino a 28 pacientes con intención curativa y en 7 no se practicó resección: en 4 por invasión extrahepática linfática o peritoneal; en uno porque presentaba cirrosis hepática que imposibilitó realizar una hepatectomía derecha, y en 2 porque tenían tumores que afectaban casi todos los segmentos o invadían todas las venas de drenaje suprahepático. En los 21 pacientes en quienes se practicó resección, ésta fue con intención curativa; solamente en un caso el estudio anatomopatológico mostró invasión microscópica del margen de resección (índice de resecabilidad del 75%).
Se estudiaron los datos demográficos de los pacientes y la presentación clínica. Las pruebas de imagen realizadas fueron en todos los casos ecografía y tomografía axial computarizada toracoabdominal con el objetivo de estudiar la afectación tumoral intrahepática, la invasión vascular portal y suprahepática, y la afectación extrahepática abdominal en ganglios linfáticos y peritoneo. El estudio de las vías biliares se realizó en los últimos años mediante colangiorresonancia magnética (el 46% de los casos). Recientemente se indicó tomografía por emisión de positrones para el estudio de la invasión extrahepática en 2 casos. También se estudiaron la afectación pulmonar, el funcionalismo hepático, la serología vírica de los virus de la hepatitis C (VHC) y B y los marcadores tumorales antígeno carcinoembrionario y CA-19.9.
Se consideraron criterios de irresecabilidad la afectación extrahepática a distancia (pulmonar, linfática y peritoneal), la afectación bilateral del parénquima que dejaba menos del 25% del hígado libre de tumor o la afectación vascular que impedía conservar unos segmentos hepáticos que permitiesen realizar la hepatectomía con seguridad. En caso de duda se indicó una laparotomía para comprobar estos criterios de irresecabilidad, ya que la única posibilidad de estos pacientes es la extirpación quirúrgica. Si existía invasión linfática hiliar extirpable mediante una disección radical del hilio hepático y el tumor hepático era resecable con técnicas convencionales, se decidió proceder a la extirpación. Cuando la resección hepática era de alto riesgo y había diseminación linfática hiliar, se desestimó la resección.
Técnica quirúrgica
En primer lugar se procedió a la exploración de toda la cavidad abdominal para descartar la invasión peritoneal y de las cadenas ganglionares de drenaje hepático. Después se realizó la ecografía intraoperatoria para comprobar la situación del tumor, los posibles nódulos satélites y también la afectación o proximidad a los elementos vasculares, en especial de la parte del hígado que quedaría después de la hepatectomía. Se efectuó siempre un estudio perioperatorio de los ganglios linfáticos del hilio hepático y frecuentemente una linfadenectomía del hilio hepático cuando estaban invadidos o existían dudas. En general estas tumoraciones eran de gran tamaño, infiltrantes, mal delimitadas y situadas en los segmentos centrales cerca del hilio hepático, vena cava inferior y venas suprahepáticas. Según predominara la afectación del lóbulo derecho o del izquierdo se realizó hepatectomía derecha ampliada a segmento 1 o hepatectomía izquierda ampliada a segmento I y segmentos anteriores derechos. En los casos que presentaban afectación de la vía biliar extrahepática se asoció a la hepatectomía una exéresis radical de la vía biliar extrahepática y se reconstruyó el flujo biliar mediante anastomosis del conducto hepático restante a un asa yeyunal en Y de Roux.
Se realizó el estudio histopatológico de las piezas de resección, que siempre llevó a cabo el mismo patólogo, prestando especial atención a los criterios de tamaño, delimitación, grado de diferenciación, satelitosis, invasión vascular microscópica o macroscópica, linfática, márgenes de resección, grado de necrosis e invasión de órganos vecinos.
Se recogieron las complicaciones postoperatorias, la mortalidad y sus causas y la estancia hospitalaria. El seguimiento de todos los pacientes en consulta externa se realizó cada 3 meses e incluyó pruebas de imagen y analítica con los marcadores tumorales antígeno carcinoembrionario y CA-19.9. Tras la resección se realizó tratamiento adyuvante quimioterápico en 2 casos. Cuando se detectó una recidiva tumoral hepática, se valoró la posibilidad de un nuevo tratamiento quirúrgico o mediante radiofrecuencia. Los casos irresecables se remitieron al Servicio de Oncología para valorar tratamiento paliativo quimioterápico.
Se realizó un análisis de la recidiva tumoral, su localización y tratamiento, y se calculó la supervivencia actuarial libre de enfermedad. Se analizaron la supervivencia de los pacientes, las causas de mortalidad y los factores de riesgo de mortalidad y de recidiva tumoral.
Análisis estadístico
El análisis de la supervivencia se realizó mediante el método de Kaplan-Meier, empleando el test de rangos logarítmicos para comparar supervivencias entre grupos. La comparación de las variables cualitativas se realizó con la prueba de la *2 o la prueba exacta de Fisher, y la de las variables cuantitativas con la prueba de la t de Student. Para el análisis multivariado se utilizó el método de regresión logística de Cox. Se consideraron significativos los valores de p < 0,05.
RESULTADOS
Datos demográficos, presentación clínica y diagnóstico
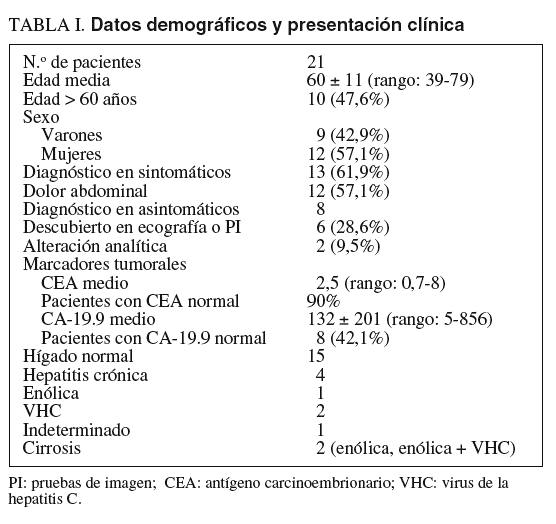
La edad media de los pacientes fue de 60 años y entre ellos predominaban las mujeres. Seis (28,6%) presentaban hepatopatía crónica: 2 cirrosis hepática y 4 hepatitis crónica activa (tabla I). La mayoría presentaba síntomas. La clínica predominante fue el dolor en el hipocondrio derecho, que presentó la mitad de los pacientes. En 8 casos asintomáticos el tumor se diagnosticó por una alteración en la analítica hepática o como hallazgo en una ecografía abdominal realizada por otra indicación. Los marcadores tumorales fueron normales en el 42% de los casos. En 3 pacientes se establecieron diagnósticos erróneos de hemangioma o de tumor benigno, lo cual retrasó el tratamiento.
Tratamiento quirúrgico
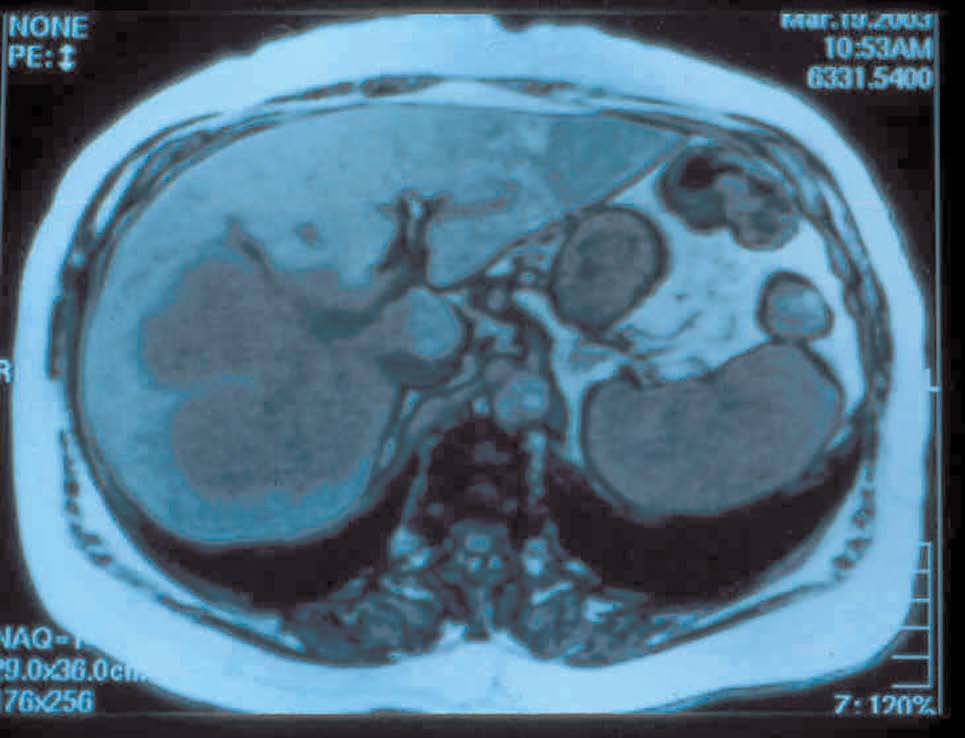
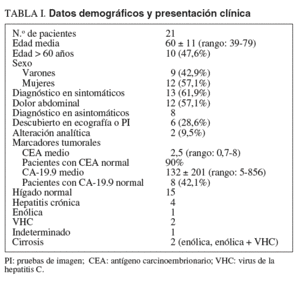
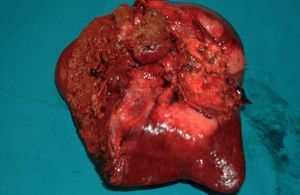
Al tratarse de tumores de gran tamaño la resección hepática que se practicó fue una hepatectomía mayor en el 90% de los casos (figs. 1 y 2), siendo 11 (52%) hepatectomías mayores ampliadas (tabla II). En el caso de tumores múltiples se combinó la hepatectomía ampliada izquierda con la tumorectomía en el segmento lateral derecho restante. En un caso de trisegmentectomía izquierda fue necesaria la resección parcial y reanastomosis de la vena suprahepática derecha, y en otro caso el tumor afectaba a la vena cava inferior retrohepática y obligó a un clampaje y resección parcial de dicha vena, junto a la hepatectomía derecha ampliada a segmento I y resección de la vía biliar con anastomosis del conducto hepático izquierdo al yeyuno. Estos 2 pacientes fallecieron como consecuencia de una insuficiencia hepática. En el 71,4% de los casos se asoció a la hepatectomía una linfadenectomía radical del hilio hepático, y en 4 se resecó la vía biliar extrahepática con reconstrucción mediante la anastomosis del conducto hepático derecho o izquierdo a un asa intestinal en Y de Roux. A un paciente con trombopenia autoinmunitaria por el VHC se le realizó una esplenectomía junto a la hepatectomía. El primer firmante del trabajo realizó 19 de las 21 intervenciones.
Fig. 1. Resonancia magnética del caso 1: mujer de 72 años con gran tumoración que afecta a casi todo el lóbulo derecho y segmento I.
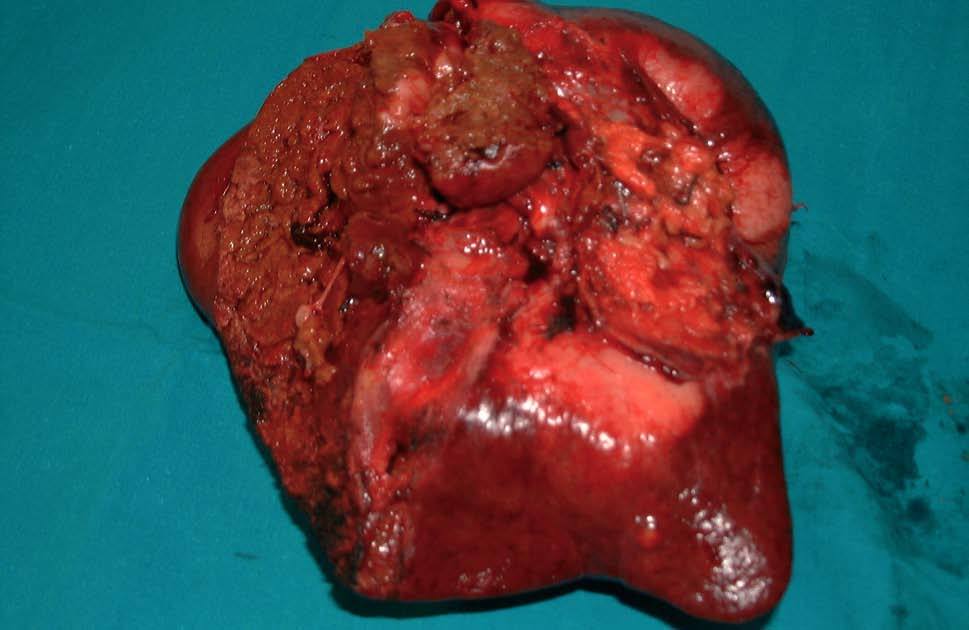
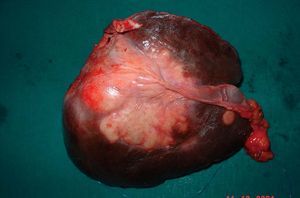
Fig. 2. Caso 1: hepatectomía derecha ampliada a segmento I (cara inferior de la pieza operatoria).
Mortalidad y complicaciones
La mortalidad postoperatoria fue de 3 casos (14,3%). Un paciente cirrótico al que se practicó una hepatectomía derecha falleció por shock cardiogénico el cuarto día del postoperatorio, y los 2 pacientes ya descritos fallecieron por insuficiencia hepática, renal y fallo multiorgánico a los 14 y 25 días de la intervención, respectivamente. La estancia postoperatoria media fue de 10 días y el 33% presentó complicaciones, entre las que destacaron sola reoperación por hemoperitoneo y 3 bilirragias autolimitadas. Un paciente requirió drenaje percutáneo de una colección biliar subhepática. Dos pacientes reingresaron poco después del alta, uno por presentar un episodio de colangitis y otro por insuficiencia hepática caracterizada por ascitis e ictericia; ambos se recuperaron con tratamiento médico.
Tratamientos complementarios
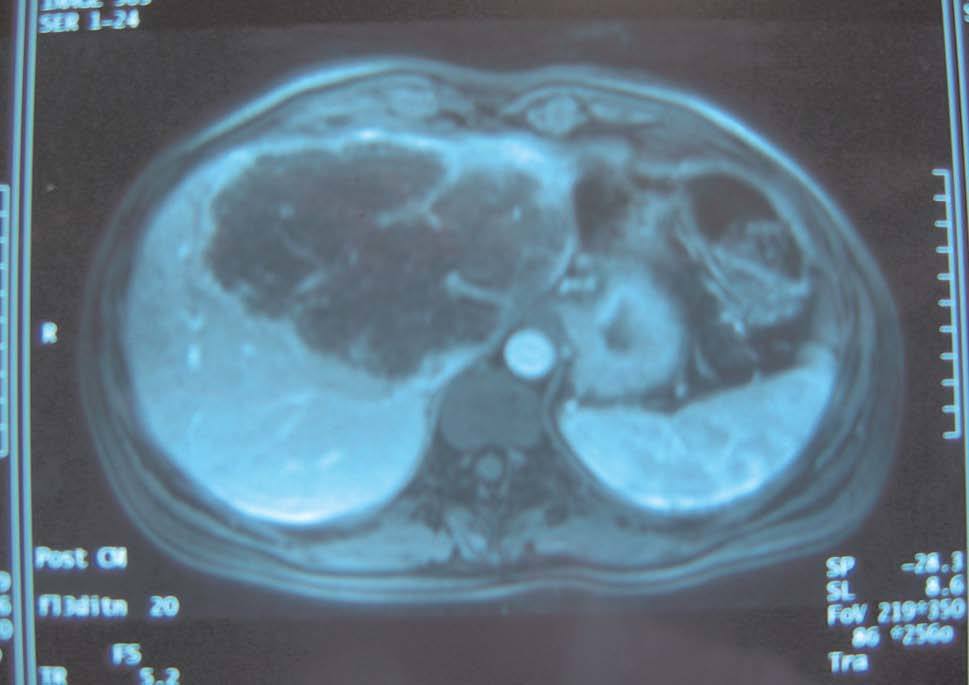
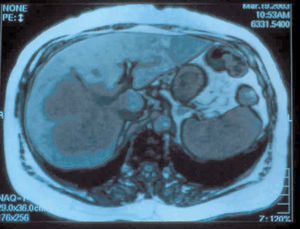
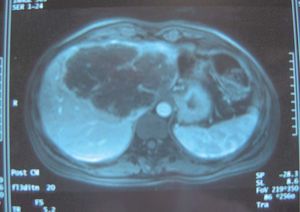
Solamente en un caso se realizó tratamiento quimioterápico neoadyuvante antes de la resección. Se trataba de una paciente de 39 años diagnosticada de un CP de 12 cm multicéntrico, con afectación de las venas suprahepáticas y considerado irresecable en otra unidad de cirugía hepática. La paciente recibió quimioterapia con oxaliplatino y gencitabina, y después con una pauta de altas dosis de gencitabina quincenal. Se consiguió una respuesta parcial, con disminución del tamaño tumoral a 8 cm, y fue intervenida con éxito un año después del diagnóstico (figs. 3 y 4). Esta paciente y otro enfermo con un tumor con invasión vascular y linfática fueron los únicos que recibieron quimioterapia adyuvante tras la resección.
Fig. 3. Resonancia magnética del caso 2: mujer de 41 años con gran tumoración que afecta al lóbulo izquierdo hepático y se extiende a segmentos anteriores derechos.
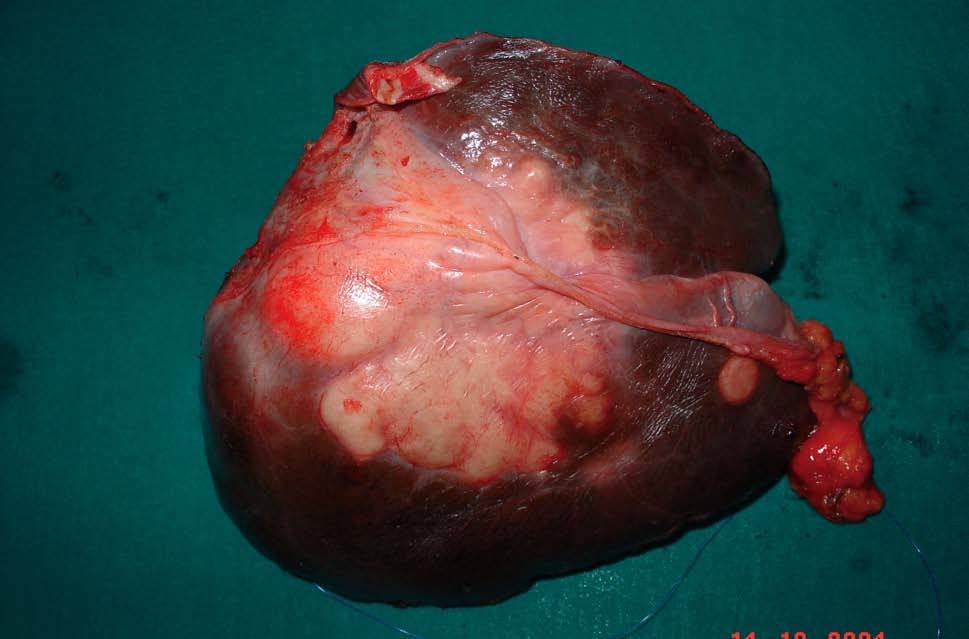
Fig. 4. Pieza operatoria del caso 2: hepatectomía izquierda ampliada a segmentos V-VIII y tumorectomía en segmento VI.
Estudio anatomopatológico
El tamaño tumoral medio (± desviación estándar) fue de 7,1 ± 3 cm. La mayoría eran tumores avanzados de tamaño superior a 5 cm (16 casos; 76%) y 5 medían más de 10 cm. Tres casos presentaban tumores múltiples y el 19% nódulos satélites. Solamente 5 eran tumores bien diferenciados. El 38% tenía invasión tumoral de los ganglios linfáticos del hilio hepático y en un caso también del territorio de la arteria coronaria estomáquica. En 8 casos había invasión vascular, que era macroscópica en 3 y microscópica en 5. Se consiguieron unos márgenes libres de tumor en la pieza de resección superiores a 1 cm en el 68% de los casos; en un solo caso existía invasión microscópica del borde de resección. En 2 casos había invasión del diafragma y en otros 2 de la glándula suprarrenal.
Recidiva tumoral y su tratamiento
Presentaron recidiva tumoral 9 pacientes (43%), con una mediana de tiempo después de la resección de 8 meses (rango: 1-17 meses). Cinco presentaron recidiva hepática y 4 extrahepática en pulmón (n = 1), huesos (n = 1) y linfáticos (n = 2). La recidiva ganglionar en hilio hepático produjo ictericia obstructiva en 2 casos que requirieron drenaje por vía endoscópica (n = 1) o transparietohepática (n = 1).
Se realizó tratamiento de la recidiva hepática con aplicación de radiofrecuencia en 2 casos. Una paciente con recidiva tumoral de 6 cm presentó, después del tratamiento con radiofrecuencia por laparotomía, insuficiencia hepática con ascitis y sepsis, y falleció durante el postoperatorio. El segundo paciente con una recidiva tumoral pequeña, de 1,5 cm, recibió tratamiento con radiofrecuencia percutánea y un año después de este procedimiento seguía vivo sin recidiva. Un paciente con recidiva ganglionar peripancreática fue tratado con radioquimioterapia y seguía vivo 6 meses después. Tres pacientes recibieron quimioterapia con oxaliplatino y 5-flourouracilo y/o gencitabina.
De los 9 pacientes con recidiva, 6 fallecieron, con una mediana de supervivencia después de la recidiva de 6,6 ± 4 meses, mientras que 3 pacientes seguían vivos después del tratamiento de la recidiva, con un seguimiento medio después de ésta de 5 meses.
Supervivencia de los pacientes
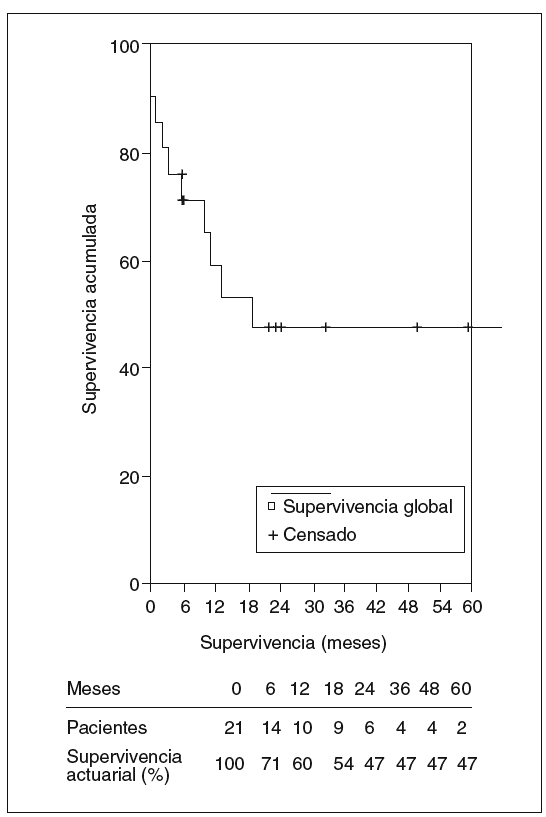
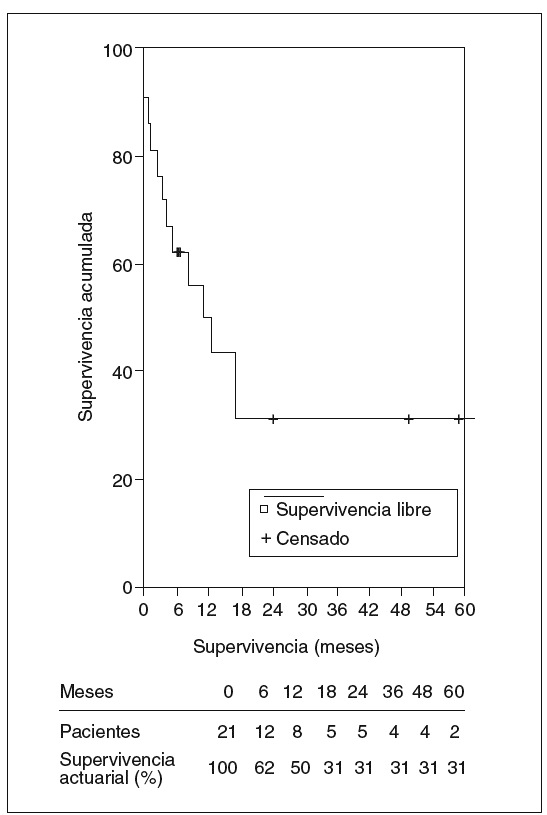
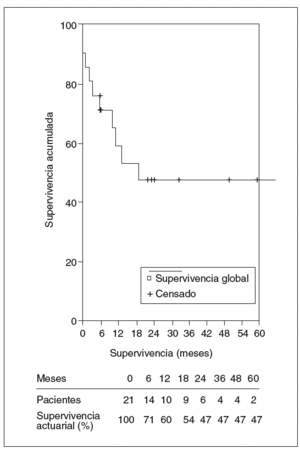
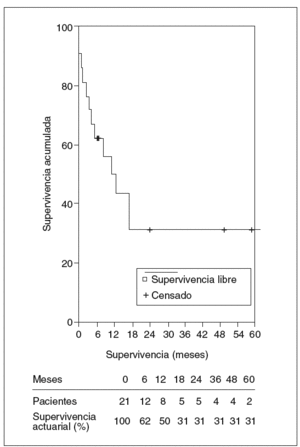
La mediana de seguimiento de los 21 pacientes a quienes se practicó resección fue de 10,8 meses y la media de 25,5 ± 38,1 meses (rango: 1-164 meses). La mortalidad fue de 10 pacientes: 3 en el postoperatorio y 7 en el seguimiento, todos éstos por recidiva tumoral, menos un paciente que falleció a los 3 meses por complicaciones de un tratamiento de esclerosis endoscópica de una úlcera duodenal hemorrágica que presentó un abdomen agudo y descompensación hepática. En la laparotomía se halló ascitis infectada por perforación en la zona ulcerosa. La mediana de supervivencia fue de 10,8 meses y la supervivencia actuarial al año, 3 y 5 años fue del 60, el 47 y el 47%, respectivamente. Ocho pacientes siguen vivos sin recidiva, mientras que la supervivencia actuarial libre de enfermedad al año, 3 y 5 años fue del 50, el 31 y el 31%, respectivamente (figs. 5 y 6).
Fig. 5. Supervivencia actuarial de los pacientes resecados.
Fig. 6. Supervivencia actuarial libre de enfermedad.
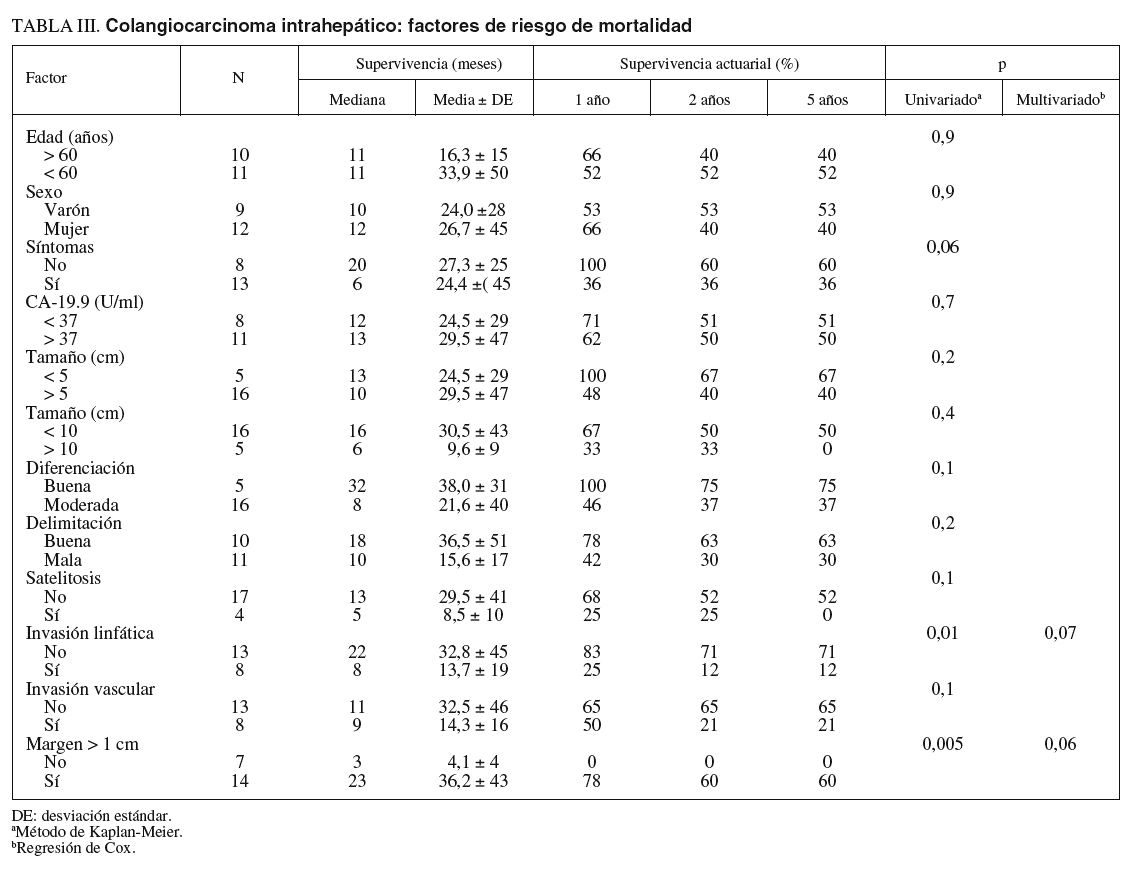
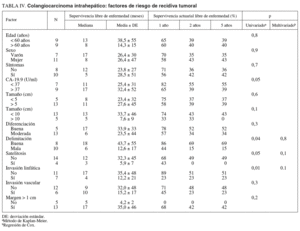
Factores de riesgo de mortalidad (tabla III)
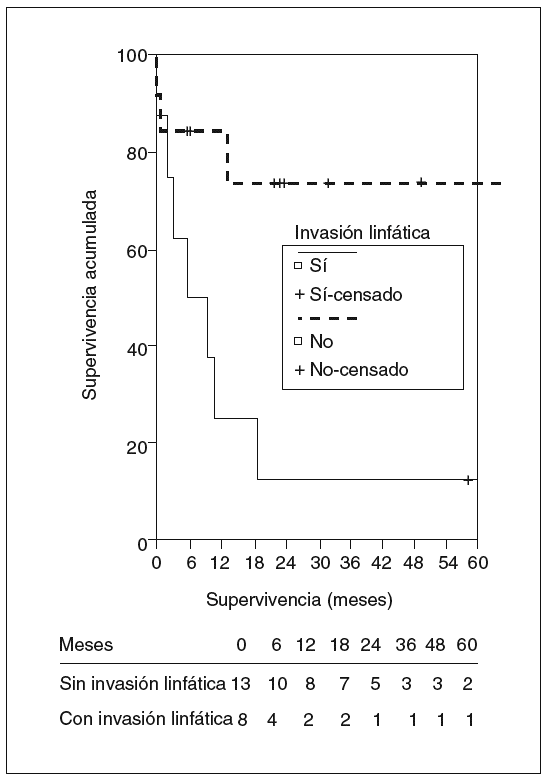
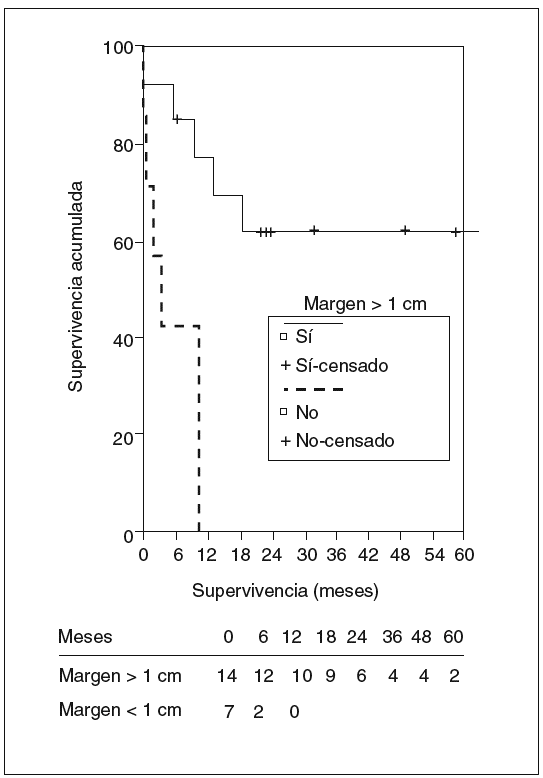
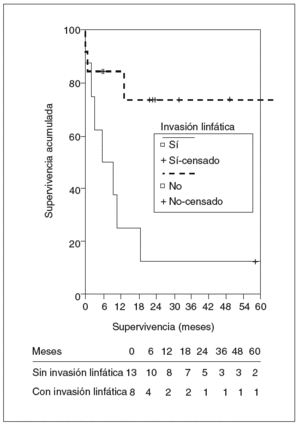
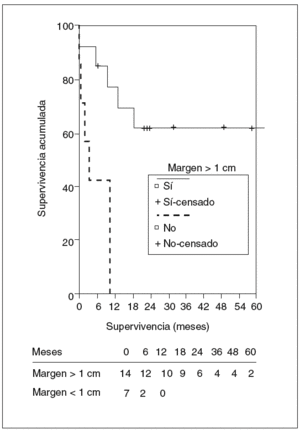
En el estudio de los factores de riesgo de mortalidad se incluyó a todos los pacientes intervenidos. La invasión linfática y el margen inferior a 1 cm fueron factores de riesgo de peor supervivencia, alcanzando diferencias significativas en el estudio univariado, mientras que la presencia de síntomas casi alcanzó la significación. En el estudio multivariado ningún factor alcanzó un nivel de significación estadística (figs. 7 y 8). La edad, el tamaño tumoral y la invasión vascular no influyeron en la supervivencia.
Fig. 7. Supervivencia actuarial de los pacientes según la presencia de invasión linfática.
Fig. 8. Supervivencia actuarial de los pacientes según el margen de resección.
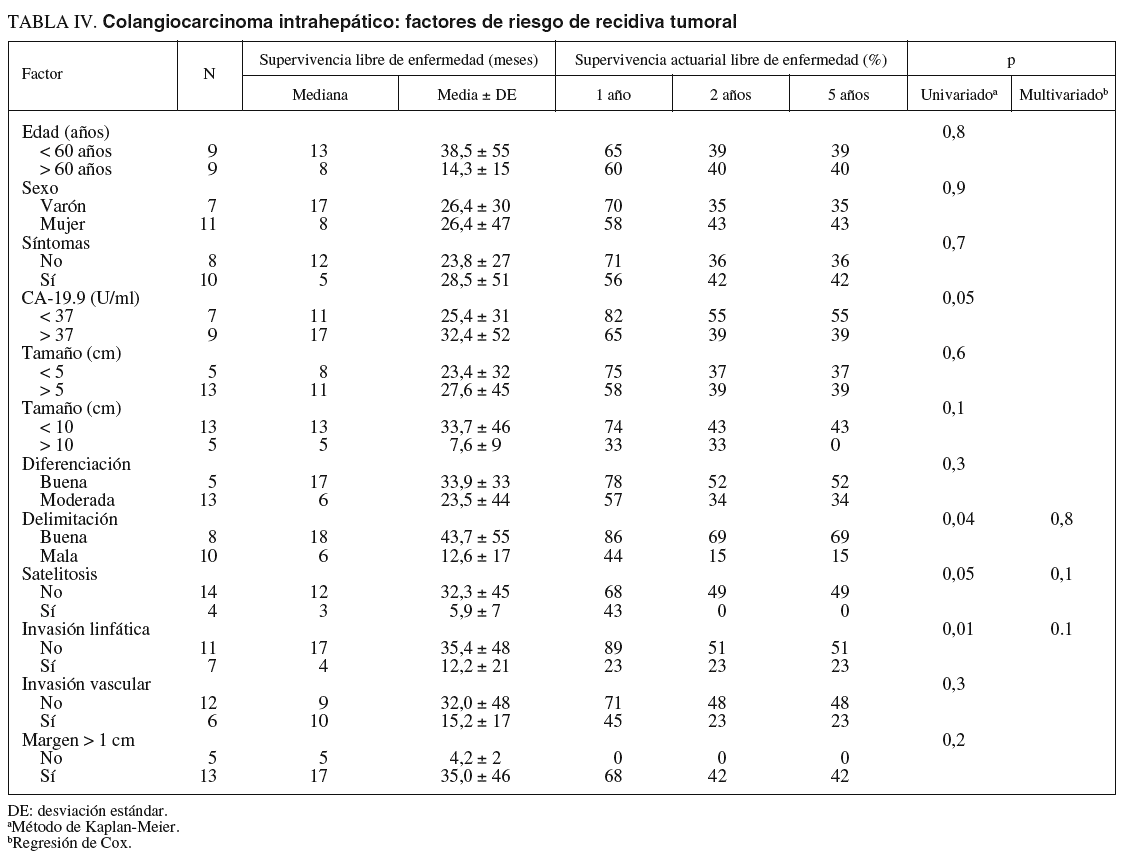
Factores de riesgo de recidiva tumoral (tabla IV)
Se estudió a los 18 pacientes que sobrevivieron a la cirugía. En el estudio univariado los factores de recidiva tumoral que alcanzaron significación estadística fueron la invasión linfática, la mala delimitación del tumor y la satelitosis. La edad, el sexo, la elevación del CA-19.9, la invasión vascular y el tamaño no influyeron en la recidiva. Ningún paciente con margen de resección inferior a 1 cm sobrevivió al año de la intervención, pero este parámetro, debido al escaso número de pacientes, no alcanzó la significación estadística. En el estudio multivariado ningún factor alcanzó la significación.
DISCUSIÓN
El CP es el segundo tumor maligno primario del hígado después del hepatocarcinoma. Es un tumor poco frecuente, aunque parece que su incidencia está aumentando en las últimas décadas9. Aparece en la gran mayoría de los casos en un hígado normal y no tiene una predilección de sexo, aunque afecta más a las mujeres. Se diferencia, por tanto, del hepatocarcinoma, que aparece en un 80% de los casos en hígados patológicos, sobre todo cirróticos, y afecta predominantemente al sexo masculino. Existen formas mixtas de hepatocolangiocarcinoma, pero las características clínicas y de comportamiento tumoral son más parecidas al CP10. En el mundo occidental la mayoría de CP se presentan en un hígado normal sin ningún antecedente patológico hepático o de las vías biliares. Sin embargo, un estudio de casos y controles realizado en Estados Unidos identificó otros factores de riesgo como la cirrosis, la infección por el VHC y el virus de la inmunodeficiencia humana, la diabetes y la enfermedad inflamatoria intestinal11. El diagnóstico precoz es difícil y por lo general se diagnostica tardíamente, cuando el paciente presenta síntomas, sobre todo dolor. El diagnóstico por la imagen del CP en la resonancia magnética se basa en el hallazgo de una masa hipointensa en T1 e hiperintensa en T2 con hipodensidad central. El refuerzo periférico en las imágenes dinámicas es característico. También se acompaña a veces de dilatación segmentaria de las vías biliares12,13. Últimamente la tomografía por emisión de positrones con 18-fluorodesoxiglucosa (18F-FDG) para la estadificación del CP permite identificar con mayor seguridad la enfermedad hepática y sobre todo la extrahepática, que puede contraindicar la cirugía de exéresis. Kim et al14 diagnosticaron enfermedad extrahepática no identificada en 4 de 11 casos de CP. La resecabilidad en nuestra serie es del 75%, similar a otras experiencias. La afectación hepática masiva no detectada en los estudios de imagen previos debido a satelitosis y la invasión ganglionar a distancia y de los vasos del hilio hepático o del parénquima pancreático fueron las causas de irresecabilidad.
La cirugía de exéresis hepática es el único tratamiento potencialmente curativo15-17. Por tanto, todos los pacientes que no presenten metástasis a distancia o afectación linfática masiva deben ser valorados por un cirujano hepático experto antes de descartarse la única opción curativa. Estos tumores de gran tamaño y situación central requieren para su extirpación radical una cirugía hepática mayor de gran envergadura. En nuestra experiencia la mitad de las hepatectomías fueron resecciones mayores ampliadas, que incluían la resección de todo un lóbulo derecho o izquierdo, los segmentos anteriores del lóbulo caudado o segmento I, la disección de la vena cava inferior y a veces su resección parcial. La disección radical del hilio hepático es obligada en la mayoría de los casos por la frecuencia de la invasión ganglionar. Sin embargo, el punto clave de estas resecciones son las venas suprahepáticas que están invadidas o muy cerca del tumor. En ocasiones la única vena suprahepática libre debe resecarse y reimplantarse. El estudio preoperatorio anatomopatológico de los ganglios del hilio hepático es muy importante antes de decidir la realización de una exéresis ampliada hepática de riesgo, ya que la invasión linfática es un factor que incide muy negativamente en la supervivencia de los pacientes y el beneficio que se obtiene con una resección hepática comprometida es casi nulo18.
Los factores que influyen en la supervivencia son la invasión linfática y la radicalidad de la exéresis; es decir, cuando es posible conseguir más de 1 cm de margen de seguridad, los resultados son significativamente mejores (un 60% de supervivencia a los 5 años), lo que vuelve a demostrar la importancia de la cirugía radical con buenos márgenes como un factor determinante del resultado18-21. Por tanto, en los pacientes sin invasión linfática en los que conseguimos un margen de más de 1 cm la mediana de supervivencia es de 24 meses y la supervivencia a los 5 años, muy buena, del 79%.
El alto porcentaje de recidiva tumoral tras la resección obliga a valorar el papel de la quimioterapia adyuvante22. Las nuevas combinaciones basadas en la gencitabina, oxaliplatino y doxorrubicina han demostrado que aumentan el porcentaje de respuestas en los tumores avanzados irresecables y alargan la supervivencia en algunos casos6-8. Quizá debería plantearse el tratamiento adyuvante tras la resección en los casos que tienen factores de riesgo de recidiva, como invasión linfática y vascular, márgenes insuficientes o tumores con satélites. El tratamiento neoadyuvante con estos quimioterapéuticos también podría tener un papel en los casos irresecables de entrada por el gran tamaño tumoral. Nuestra experiencia en un caso nos permitió resecar posteriormente el tumor después de la reducción del tamaño tumoral.
El tratamiento de las recidivas hepáticas se basa por lo general en valorar la realización de una nueva resección, que es difícilmente factible después de estas grandes hepatectomías ampliadas; normalmente tendremos que recurrir a los tratamientos ablativos con radiofrecuencia, ya sea por vía percutánea o intraoperatoria si se ha intentado resecar quirúrgicamente el tumor o éste está localizado en zonas inaccesibles al acceso percutáneo. El tratamiento paliativo con quimioterapia de la recidiva hepática o a distancia también está indicado en los pacientes que mantienen un buen estado general y no tienen colestasis6-8. En ocasiones la recidiva se localiza en el hilio hepático y produce un cuadro de ictericia obstructiva que requiere tratamiento mediante drenaje biliar por endoscopia o transhepático.
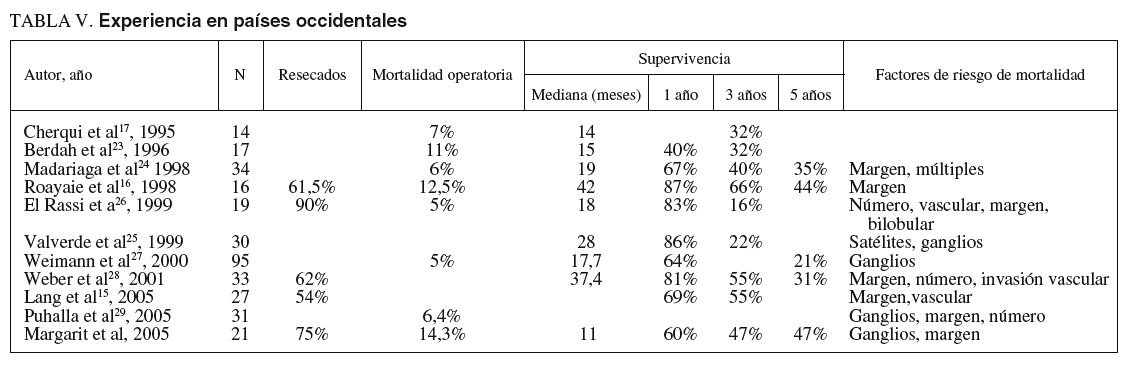
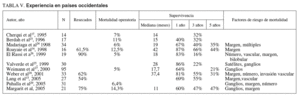
La experiencia en los países occidentales, donde no existe la infestación por parásitos y la hepatolitiasis es excepcional, es escasa y se han publicado series con un escaso número de pacientes (tabla V)15-17,23-29. La nuestra es la más importante publicada en nuestro país y comparable a las más importantes del mundo occidental. En la gran mayoría las conclusiones son similares: se trata de tumores avanzados, el índice de resecabilidad oscila entre el 51 y el 90%, y las resecciones radicales R0 con márgenes libres suficientes no se consiguen en todos los casos debido a la situación y tamaño de los tumores. La mortalidad operatoria oscila entre el 3 y el 16%. Los factores de riesgo que influyen en la mortalidad son la invasión ganglionar y la ausencia de márgenes de seguridad, mientras que la invasión vascular, la presencia de satelitosis y los tumores múltiples son otros factores negativos.
En conclusión, el tratamiento quirúrgico radical, con márgenes superiores a 1 cm, de los CP que no presentan invasión linfática obtiene una buena supervivencia y altas posibilidades de curación, aun cuando se trate de tumores de gran tamaño.