Estimar la incidencia, características anatomopatológicas, patrones de tratamiento y supervivencia-mortalidad del cáncer gástrico en la población de Segovia durante los años 2005-2008.
MétodosEstudio descriptivo retrospectivo. Se incluyeron los 163 pacientes diagnosticados de cáncer gástrico en el Hospital General de Segovia en dicho periodo.
ResultadosEstimamos una incidencia de 25 casos/100.000 habitantes con una proporción varones/mujeres de 1,6:1 y una edad media de presentación de 72 años. El diagnóstico en estadios avanzados III y IV (64,5%), la alta frecuencia del carcinoma intestinal (56,4%) y el antro gástrico como localización más frecuente (48,8%), han sido las características del tumor más destacables. Al final del estudio un 54,2% de los pacientes habían fallecido, presentando una media de supervivencia global de 19 meses. La estadificación tumoral, el número de ganglios afectados y el tipo histológico difuso fueron los principales factores pronóstico desfavorables. A pesar de recibir tratamiento quirúrgico con intención curativa, el 63,2% de los tumores en estadios iniciales (I y II) presentaron recidiva durante el estudio.
ConclusionesEl riesgo de cáncer gástrico en Segovia es mayor en varones con edad en torno a los 70 años. Los estadios avanzados son la presentación más frecuente al diagnóstico y las recidivas en estadios iniciales son comunes, lo que dificulta las posibilidades de curación. Es necesario hacer un diagnóstico precoz del cáncer gástrico y mejorar los tratamientos.
To estimate the incidence, pathological characteristics, treatment patterns, survival and mortality of gastric cancer in Segovia from 2005-2008.
MethodsWe conducted a retrospective, descriptive study of 163 patients diagnosed with gastric cancer at the Segovia General Hospital during the study period.
ResultsWe estimated a gastric cancer incidence of 25 cases/100,000 inhabitants. The ratio of men to women was 1.6:1. The mean age was 72 years. The most important findings were diagnosis in stages III and IV (64.5%), the high frequency of intestinal carcinoma (56.4%) and the gastric antrum as the most frequent localization (48.8%). At the end of the study, 54.2% of patients had died and the median overall survival was 19 months. The main factors for an unfavorable prognosis were advanced tumoral stage (III and IV), the number of nodes involved, and diffuse histological type. Despite surgical treatment with curative intent, 63.2% of tumors at early stages (I and II) recurred during the study.
ConclusionsThe risk of gastric cancer in Segovia is higher in men aged over 70 years. Most tumors are diagnosed at advanced stages and recurrences are common, limiting the possibility of cure. Early diagnosis of this entity and improved treatments are required.
El cáncer gástrico es el segundo tumor de mayor mortalidad en el mundo después del cáncer de pulmón1. En España es la quinta causa de muerte tumoral en hombres tras el cáncer de pulmón, colorrectal, de próstata y de vejiga con una tasa de mortalidad estandarizada en 2009 de 12,12 hombres por cada 100.0002. En mujeres ocupa una quinta posición después del cáncer de mama, colorrectal, de pulmón y de páncreas con una tasa de 5,242.
La alta frecuencia de diagnóstico en estadios avanzados y la ausencia de opciones de tratamiento curativo para estos estadios hacen que la supervivencia global sea muy pobre. Sin embargo, en las últimas décadas, la mejoría de las condiciones de vida y conservación de los alimentos, así como el diagnóstico y tratamiento de la infección por Helicobacter pylori, entre otros, han contribuido a que las tasas de incidencia y mortalidad muestren un descenso lento y progresivo en España3, Europa4,5 y,en general, a nivel mundial6. En España se ha estimado que desde 1975 el descenso en la mortalidad es de aproximadamente un 3% anual7 y es paralelo al descenso en la incidencia, aunque apenas existen registros de esta.
Las estadísticas españolas siempre han mostrado diferencias geográficas en las tasas de mortalidad, observándose un patrón costa-interior, norte-sur. Las mayores tasas las presentan las regiones del interior y norte de España, con Castilla y León a la cabeza, y en contraste el sur, la costa mediterránea y los dos archipiélagos con tasas más bajas4,8.
Los últimos datos reflejan una cierta tendencia a la homogeneidad4 debido, entre otros, a que la disminución de la mortalidad que se ha producido en todas las provincias ha sido más acentuada en las regiones con mayor tasa de incidencia8. Ejemplo de ello son las tasas de mortalidad estimadas en el periodo1976-1980 para Castilla y León y Baleares, las regiones de mayor y menor tasa de mortalidad de España, que eran de 46,98 y 18,58, respectivamente, y las estimaciones más recientes referidas al periodo 2001-2005 las sitúan en 20,14 para Castilla y León y 10,10 para las islas Baleares4. A pesar de la tendencia, estos datos y los aportados por otros estudios siguen mostrando diferencias regionales9.
Apenas existen estudios de cáncer gástrico a nivel estatal. Dada esta situación, y que Castilla y León siempre ha sido una de las regiones con mayor tasa de incidencia y mortalidad de este tipo de cáncer y que no existen estudios previos publicados sobre las características del cáncer gástrico en nuestra área, hemos analizado los datos epidemiológicos de esta enfermedad en el Hospital General de Segovia, perteneciente a la red sanitaria pública española y centro de referencia para la asistencia oncológica de la provincia.
Nuestro análisis no pretende ser explicativo de la etiopatogenia y factores condicionantes de nuestra región, sino descriptivo de incidencia, características anatomopatológicas, terapéuticas y supervivencia de los pacientes diagnosticados durante el periodo 2005-2008 con el objetivo de obtener un registro epidemiológico que facilite un mayor conocimiento de esta neoplasia y permita una mejora asistencial y preventiva.
Material y métodosEstudio observacional retrospectivo en el que se incluyeron los pacientes diagnosticados de adenocarcinoma gástrico por métodos anatomopatológicos tratados y seguidos en el Hospital General de Segovia entre el 1 de enero de 2005 y el 31 de diciembre de 2008.
El Hospital General de Segovia es un hospital de segundo nivel y referencia de un área sanitaria que atiende a los 155.517 habitantes de la provincia (dato de población del Instituto Nacional de Estadística Español a 1 enero de 2005, fecha de inicio del estudio).
Para la identificación de los pacientes se revisaron los registros del servicio de anatomía patológica, del departamento de estadística de dicho hospital y de las historias clínicas. Se consideró como fecha de diagnóstico la que constaba en el informe de anatomía patológica. Se excluyeron los pacientes sin diagnóstico anatomopatológico y aquellos no diagnosticados ni tratados en este hospital. La muestra final fue de 163 enfermos a los que se hizo seguimiento hasta el 31 de julio de 2009, fecha de cierre del estudio.
Se recogieron variables habituales de los pacientes, del tumor y de los tratamientos aplicados, así como fechas de diagnóstico, recaída y fallecimiento. El análisis se realizó con el programa SPSS, versión 15.0 para Windows. La evaluación de diferencias significativas se realizó con la chi-cuadrado. La probabilidad de supervivencia se calculó con el método de Kaplan-Meier. Los factores pronóstico se evaluaron mediante modelos de riesgos proporcionales de Cox.
Se consideró intervención con intención curativa cuando no existía enfermedad residual apreciable al término de la misma y paliativa en caso contrario. En la valoración histológica se utilizó la clasificación de Lauren. La estadificación tumoral se realizó según las normas del American Joint Committee on Cancer (AJCC) y el sistema TNM de 2002. Para establecer el tiempo de supervivencia y mortalidad se revisaron las historias y los registros clínicos hasta la fecha de cierre del estudio y se solicitaron datos de los registros de la Unidad de Cuidados Paliativos Domiciliarios de la Asociación Española contra el Cáncer del área de Segovia.
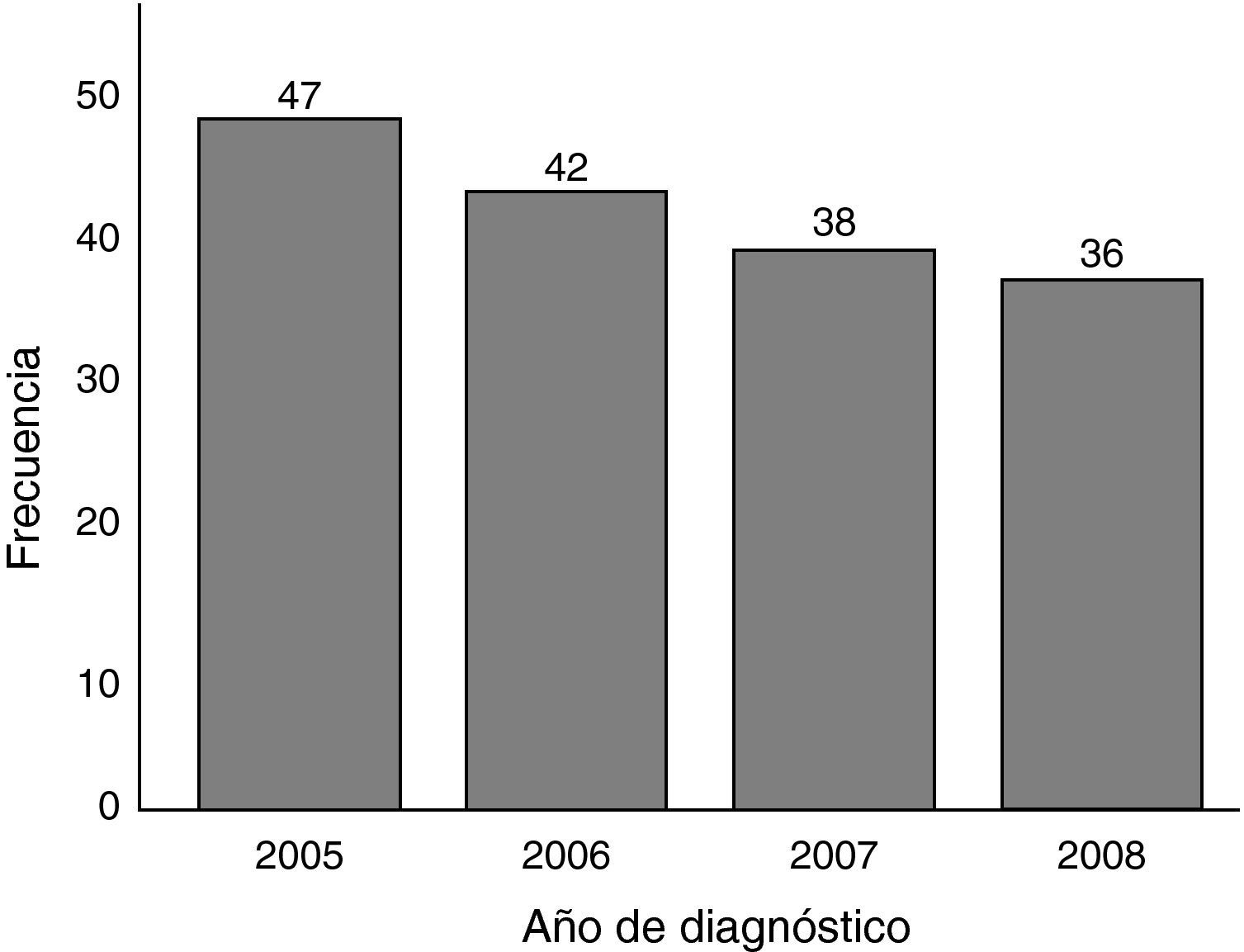
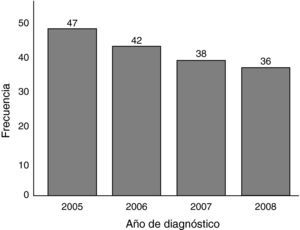
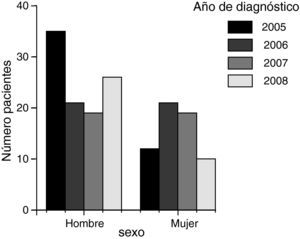
ResultadosEl total de casos de cáncer gástrico diagnosticados en 4 años fue de 163. Se observó una tendencia no significativa hacia el descenso en el número de casos diagnosticados por año durante el estudio (fig. 1). Con los datos obtenidos y teniendo en cuenta la población media de Segovia durante el periodo comprendido entre el 1 de enero de 2005 y el 1 de enero de 2009 (datos de población del Instituto Nacional de Estadística español), que se calcula fue de 160.185 habitantes, 80.972 hombres y 79.213 mujeres; estimamos una tasa de incidencia bruta aproximada de cáncer gástrico de 25 casos/100.000 habitantes y año, 31 hombres y 20 mujeres por cada 100.000 habitantes y año.
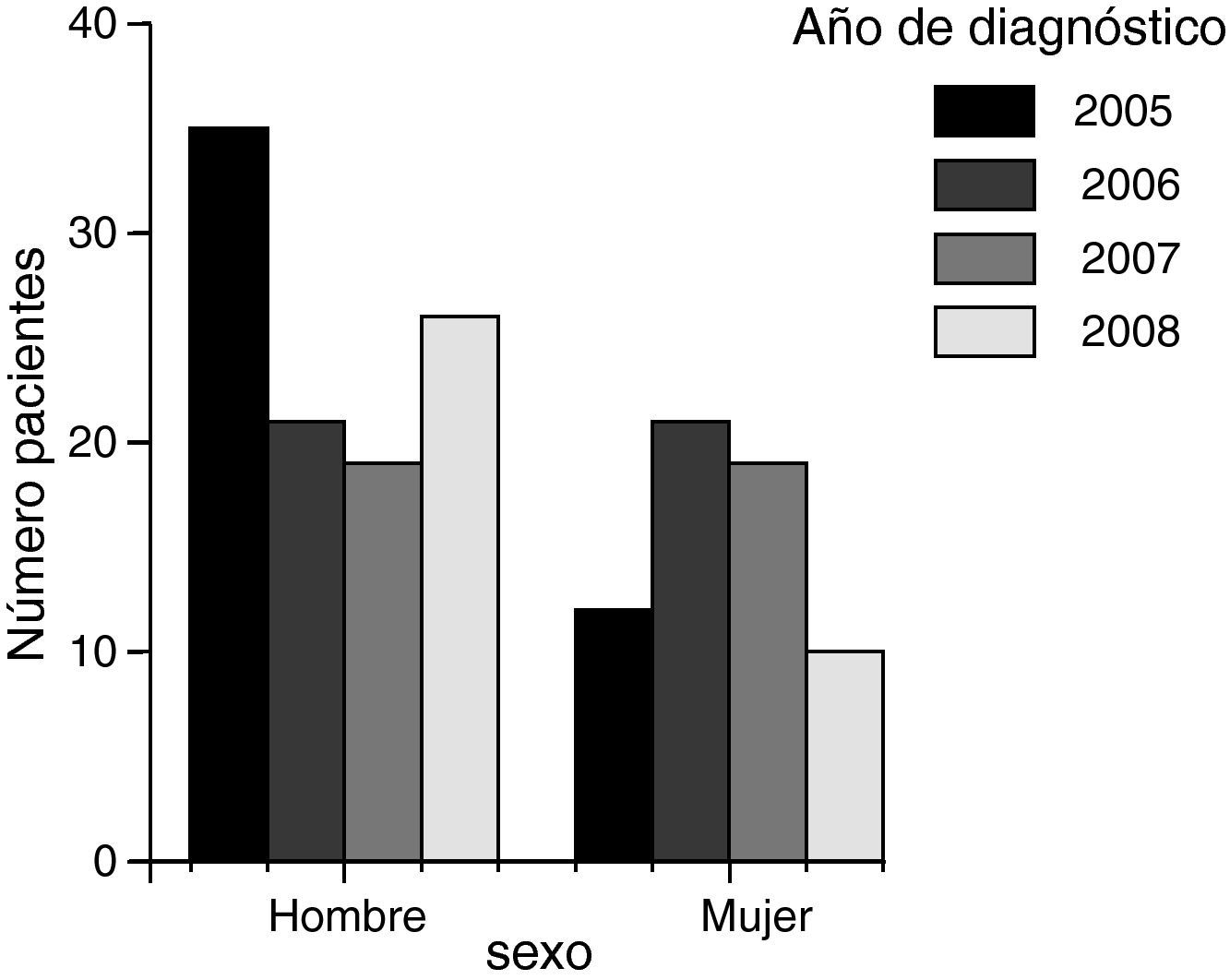
Un 62% fueron hombres y un 38% fueron mujeres, con una diferencia significativa (p=0,02) y una razón de 1,6. El rango de edad estaba comprendido entre los 41 y los 98 años, con una media global de 72 años (IC 95%: 70,9-75,5) y una mediana de 74 años, sin diferencias significativas en la edad por sexos (fig. 2).
Localización tumoral y tipo histológicoEl antro fue la localización más habitual (48,8%), seguido del cuerpo gástrico (34,6%), la unión gatroesofágica (12,3%) y un 4,3% de otras localizaciones, con diferencias significativas (p<0,05). Se compararon las distintas localizaciones del tumor con el sexo, la edad al diagnóstico, así como con la histología y el estadio tumoral sin observar diferencias significativas. El 48,7% de los adenocarcinomas presentaba un grado de diferenciación histológica moderado, el 40,7% tenían mala diferenciación, un 8,8% estaban bien diferenciados y un 1,8% eran indiferenciados. Cerca de un 16% de los pacientes presentaban invasión linfática, perineural y/o vascular.
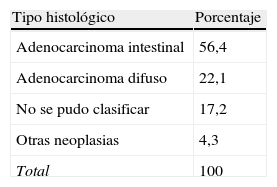
El adenocarcinoma intestinal fue el subgrupo histológico más frecuente (56,4%) (tabla 1). No se encontraron diferencias significativas en la histología por sexos (p=0,426) pero sí una ligera tendencia no significativa de mayor frecuencia del adenocarcinoma intestinal en hombres. También se observó una tendencia no significativa de mayor frecuencia en el tipo histológico difuso en menores de 66 años (p=0,262).
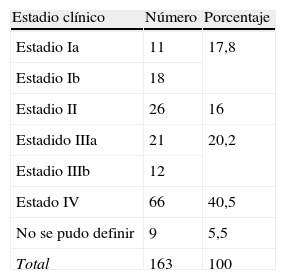
Estadio clínicoEn el momento del diagnóstico destacó una elevada proporción de casos en estadios avanzados de la enfermedad: 40,5% en estadio IV, 20,2% en estadio III, seguido por los estadios I y II con un 17,8 y un 16% de los enfermos, respectivamente; con diferencias muy significativas (p<0,05) (tabla 2).
El estadio tumoral no presentó diferencias significativas al comparar los pacientes por edad al diagnóstico, por localización, por tipo histológico ni por sexo. Un 36,6% de los pacientes presentaban metástasis al diagnóstico y un 63,4% no, con diferencias significativas (p=0,001). La localización metastásica única más frecuente fue la hepática (39,3% de los pacientes), seguida de un 21,4% que presentaban metástasis peritoneales; un 25% tenía varias localizaciones metastásicas.
TratamientoAl 72,7% de los pacientes se les practicó cirugía. El tiempo medio de espera prequirúrgica fue 18 días (IC 95%: 15,9-21,3) y la mediana de 15 días. Se realizó gastrectomía total al 41,5% de los pacientes intervenidos, subtotal al 48,3% y derivativa al 10,2%. Hubo intención quirúrgica curativa en un 65,3% y paliativa en un 34,7%. Se encontraron diferencias significativas en el tipo de cirugía según edad (p=0,046) siendo en mayores de 75 años la gastrectomía parcial más frecuente que la total y en menores de 75 años la total más frecuente que la subtotal. También se observaron diferencias significativas (p<0,05) al comparar el tipo de cirugía según la localización tumoral: la cirugía total fue más frecuente que la parcial en los tumores de la unión gastroesofágica y cuerpo y viceversa en los tumores de antro.
En un 65,2% de los pacientes intervenidos se hizo resección ganglionar, extirpando más de 15 ganglios en el 27,4% y, de estos, el 10,8% presentaron afectación de más de 15 ganglios; del total de pacientes, el 72,4% presentó alguna afectación ganglionar. No se observaron diferencias significativas al comparar el número de ganglios metastásicos con el tipo histológico.
El 22% de los pacientes recibieron quimioterapia adyuvante siendo tratados el 88,9% con 5-fluorouracilo. El 18,9% recibieron radioterapia, concomitante en el 100% de los casos a quimioterapia. De los pacientes en estadio I ninguno recibió quimioterapia, un 60% en estadio II la recibieron, un 51,5% en estadio III y un 8% en estadio IV.
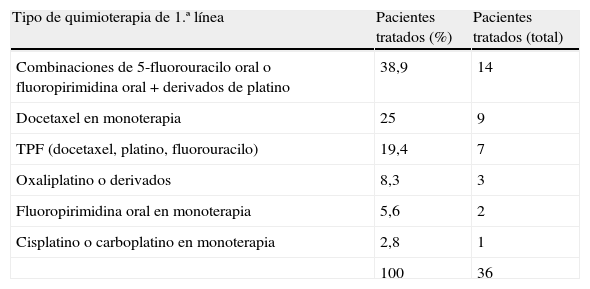
Del total de pacientes, el 22,1% recibieron quimioterapia paliativa de primera línea (tabla 3).
Modalidades de tratamiento quimioterapéutico de primera línea: estudio de frecuencias
| Tipo de quimioterapia de 1.ª línea | Pacientes tratados (%) | Pacientes tratados (total) |
| Combinaciones de 5-fluorouracilo oral o fluoropirimidina oral + derivados de platino | 38,9 | 14 |
| Docetaxel en monoterapia | 25 | 9 |
| TPF (docetaxel, platino, fluorouracilo) | 19,4 | 7 |
| Oxaliplatino o derivados | 8,3 | 3 |
| Fluoropirimidina oral en monoterapia | 5,6 | 2 |
| Cisplatino o carboplatino en monoterapia | 2,8 | 1 |
| 100 | 36 |
Hubo recaídas en un 10,7% de los pacientes en estadio I y un 43,5% del estadio II. El resto de enfermos de estos estadios permanecieron libres de enfermedad durante el seguimiento. No se observaron diferencias significativas en la recidiva al comparar el tipo histológico, la localización y el número de ganglios metastásicos, solo una ligera tendencia a la recidiva si había más de 15 ganglios afectados.
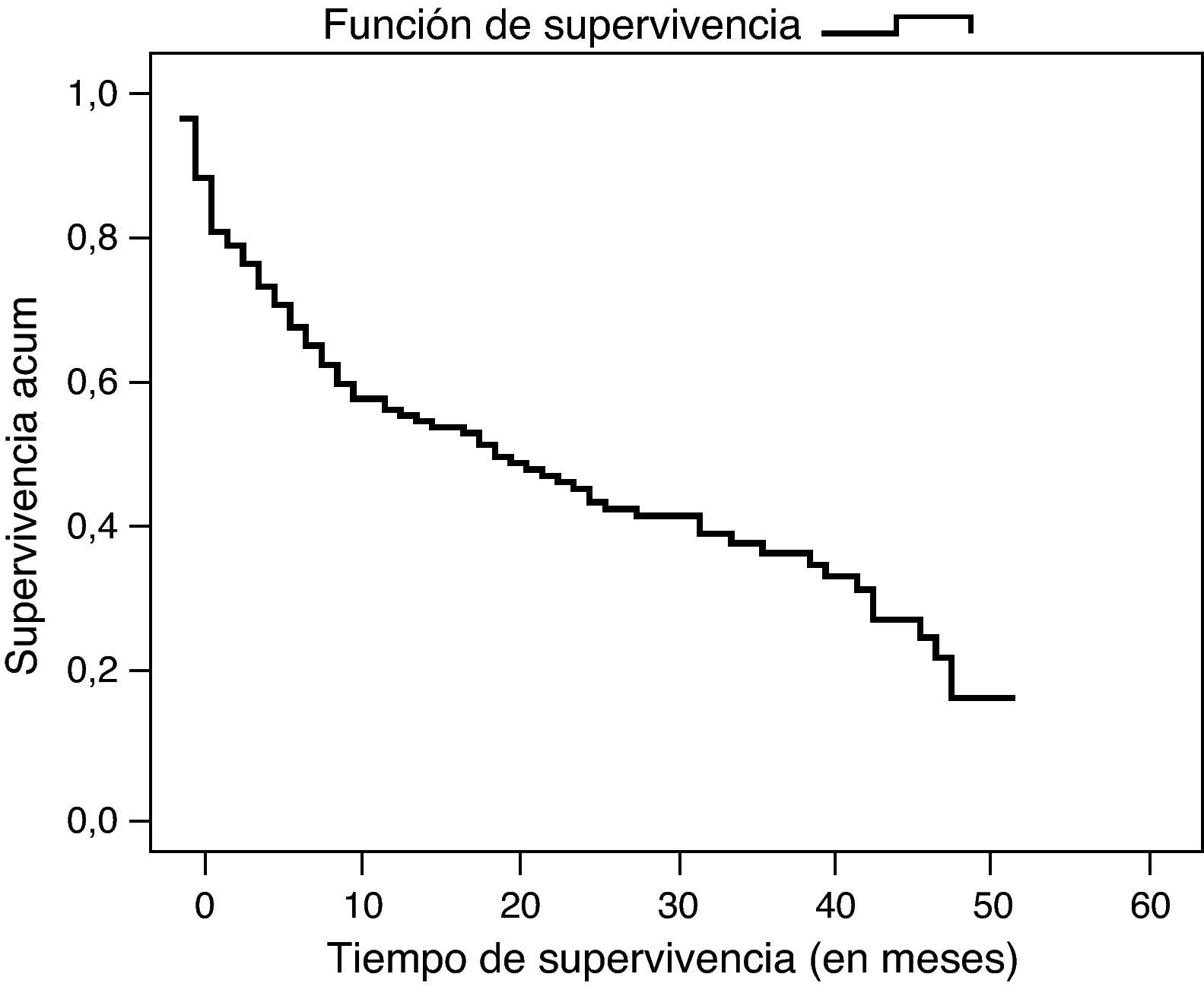
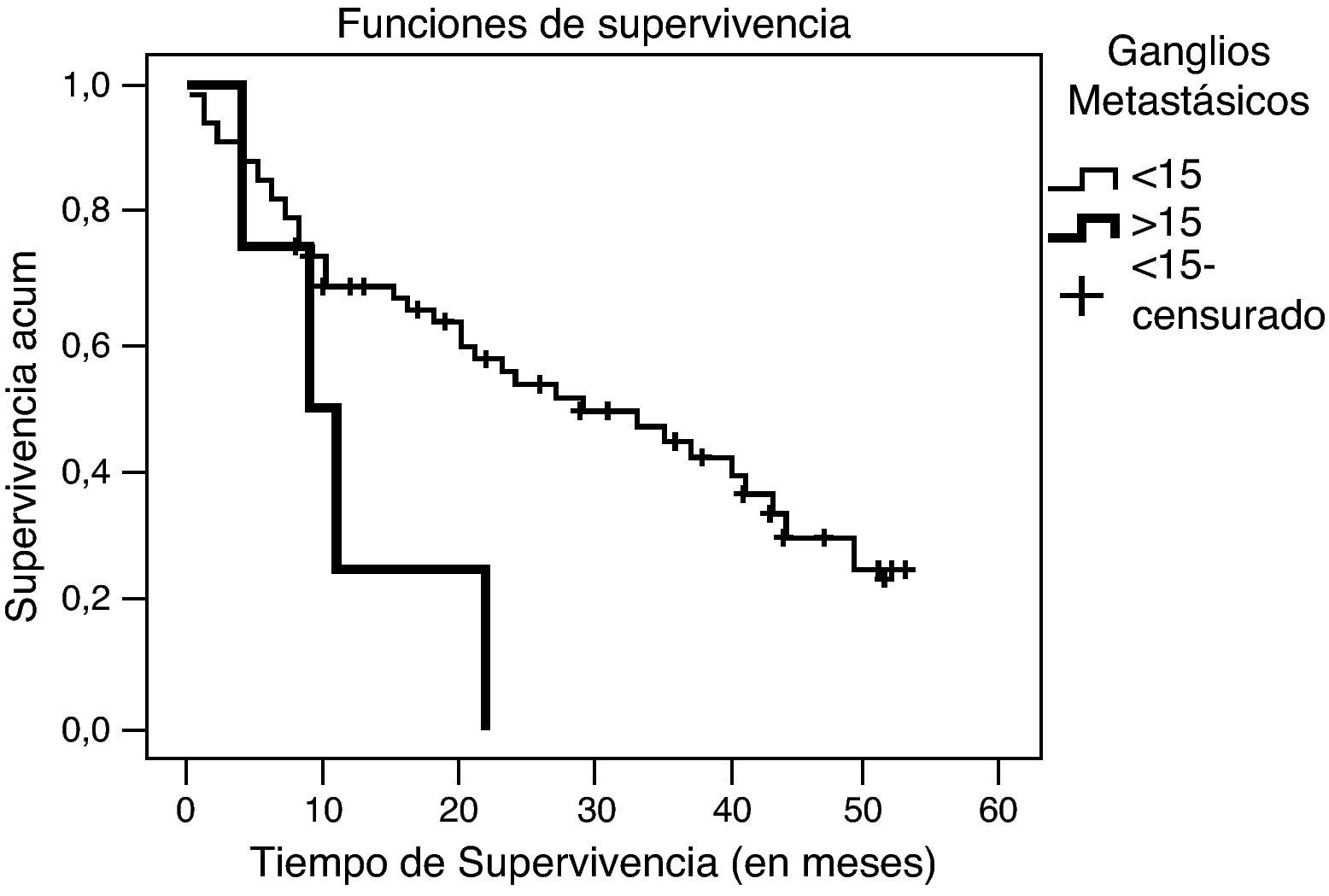
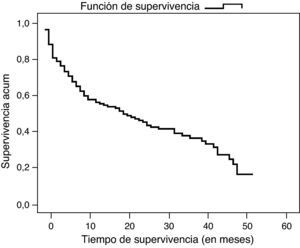
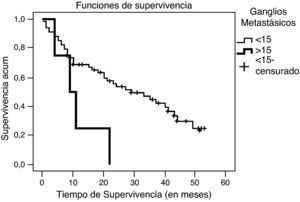
En la fecha del cierre del estudio, 57 enfermos estaban vivos. La probabilidad global de supervivencia fue del 35,8%, siendo al año del 54%, a los 2 años del 43% y a los 3 años del 34%. El tiempo medio global de supervivencia fue de 23 meses y la mediana de 19 meses (fig. 3). No hubo diferencias en función del sexo, edad, localización del tumor ni el tipo de cirugía. Sí se encontraron diferencias significativas (p=0,036) al comparar el tipo histológico mostrando mayor supervivencia el adenocarcinoma intestinal con una mediana de 33 meses respecto al difuso con una mediana de 9 meses. También la afectación ganglionar mostró diferencias significativas en la supervivencia (p=0,029), con una mediana de 29 meses en pacientes con metástasis en menos de 15 ganglios y de 9 meses en los de más de 15 ganglios afectados (fig. 4). Finalmente se observaron diferencias significativas (p<0,005) en la supervivencia entre los distintos estadios y los pacientes intervenidos quirúrgicamente y los que no. En el estadio I la mediana de supervivencia global fue de 49 meses, en el estadio II de 40 meses, en el estadio III de 30 meses y en el IV de 4 meses. En el estadio IV no se observaron diferencias significativas en la supervivencia en los pacientes que presentaban metástasis al diagnóstico y los que no las presentaban, siendo la mediana de supervivencia global de 5 meses en los metastásicos y de 2 meses en los no metastásicos.
Respecto al análisis del tratamiento por estadios y supervivencia, no se pudo realizar en el estadio I ya que de los 29 pacientes, 28 fueron intervenidos y ninguno recibió quimioterapia. De los 26 pacientes en estadio II, el 100% fueron intervenidos quirúrgicamente y el 57,7% fueron tratados con terapia adyuvante sin observar significación estadística en la supervivencia en función del tratamiento (p=0,126). En el estadio III (33 pacientes), el 93,9% fueron intervenidos quirúrgicamente y el 51,5% recibieron quimioterapia; en los tratados con quimioterapia se observaron diferencias significativas en la supervivencia (p=0,033) que tuvo una estimación media de 37,5 meses respecto a 23,5 meses en los que no la recibieron. En estadio IV, de los 67 pacientes, a 29 se les realizó una intervención quirúrgica y el resto fueron pacientes no quirúrgicos, sin encontrar diferencias significativas en la supervivencia entre ambos (p=0,126). Solo 6 pacientes en estadio IV recibieron tratamiento quimioterápico, 2 de ellos presentaban metástasis al diagnóstico; se observaron diferencias significativas (p=0,023) con una mediana de supervivencia de 13 meses en los pacientes tratados con quimioterapia y de 4 meses en los no tratados. La supervivencia en estadios II, III y IV según los distintos esquemas de tratamiento quimioterápico utilizados no mostró datos concluyentes.
DiscusiónEl tamaño muestral de nuestro estudio con 163 pacientes es lo suficientemente grande para que los resultados sean concluyentes, pero han de tenerse en cuenta las limitaciones y posibles sesgos en la recogida de datos y metodología utilizada.
La ausencia de registros poblacionales nos impide ser más exactos en el cálculo de la incidencia de cáncer gástrico y solo podemos basarnos en los datos hospitalarios. Con estos datos estimamos una incidencia bruta anual de cáncer gástrico en Segovia de 25 casos por 100.000 habitantes, 31 hombres por cada 100.000 y 20 mujeres por cada 100.000. Estas cifras serían más elevadas, sumando los pacientes excluidos por ausencia de diagnóstico anatomopatológico (pacientes de edad avanzada, y con gran morbilidad a los que no se les han practicado pruebas diagnósticas agresivas) que, presumiblemente, en función de los resultados obtenidos por otras pruebas no cruentas presentan esta neoplasia; y el pequeño porcentaje de pacientes tratados y diagnosticados en centros privados o en hospitales fuera de nuestra provincia que no se han podido contabilizar y que también se excluyeron del estudio.
Se ha observado durante los años del estudio una tendencia no significativa hacia el descenso en el número de casos diagnosticados por año. Sea debido al azar, a la metodología de recogida de datos o a factores inherentes a la población y a su posible cambio de hábitos, es un dato al menos a tener en cuenta, y sería preciso hacer un seguimiento en años futuros para observar esa tendencia, que coincidiría con la evolución de otras áreas desarrolladas6.
El riesgo de presentar cáncer gástrico fue 1,6 veces mayor en los varones respecto a las mujeres, encontrándose en los límites bajos respecto a otros estudios10,11 y que contrasta con los valores de otras regiones españolas con razones ligeramente más elevadas9,12,13. Estos datos podrían explicarse por la presencia de diferentes factores ambientales y/o genéticos que producirían un mayor riesgo relativo de cáncer gástrico en mujeres en regiones como Segovia respecto a otras9,14 o a un descenso en la incidencia menor al que reflejan las tasas mundiales de cáncer gástrico en mujeres14,15.
Existen, además de este, pocos estudios de otras provincias de Castilla León 16,17, pero los datos siguen confirmando que en esta región el cáncer gástrico tiene una incidencia, morbimortalidad y connotaciones diferentes a los de otras regiones de España9,15,18.
La inespecificidad de la sintomatología, la ausencia de pruebas de cribado para la población general, el bajo seguimiento en pacientes de riesgo, así como la ausencia de protocolos de actuación y de campañas de concienciación en la población pueden ser las principales causas del diagnóstico tardío (estadios III y IV [64,5%]). En nuestro estudio los porcentajes alcanzan el 40,5% en estadio IV, superior al encontrado en un amplio estudio realizado en Galicia, que era de 30,2%19. El envejecimiento de la población y la dispersión rural posiblemente retrasa el tiempo de consulta. Habría que investigar el grado de educación sanitaria de la población y el conocimiento sobre el cáncer gástrico. Plantearse métodos de cribado coste-efectivos para un diagnóstico precoz en áreas como Segovia podría disminuir las tasas de mortalidad.
A pesar de estos datos, a la mayoría de nuestros pacientes (72,7%) se les realizó cirugía con un 65,3% de intención curativa, porcentaje algo más elevado que el encontrado en el estudio gallego, que fue del 46,4%19. En un 65,2% de los intervenidos se hizo resección ganglionar, sin embargo solo se resecaron más de 15 ganglios en el 27,4% de los pacientes intervenidos. La extirpación de ganglios suficientes ha demostrado una mejor estadificación del tumor y un mejor enfoque terapéutico y pronóstico del paciente20,21.
La localización distal del tumor en nuestro estudio sigue siendo la más frecuente, sin embargo la tendencia mundial refleja su descenso, así como el aumento de la localización en la unión gastroesofágica15,22. El tipo intestinal, la presentación más habitual en pacientes de mayor edad y hombres23, mostró en nuestra serie esa misma tendencia sin llegar a ser estadísticamente significativa. En otros estudios realizados en España los datos son similares17.
En cuanto a la terapia adyuvante radioterapia-quimioterapia, que es en el momento actual nuestro tratamiento estándar según consenso de la comunidad oncológica24, el 22% de nuestros pacientes la recibieron, siendo el 5-fluorouracilo el fármaco más habitual. La edad avanzada de la población, la ausencia de datos decisivos a favor del tratamiento quimioterápico posquirúrgico25, la toxicidad y los efectos secundarios, así como la dificultad de muchos pacientes para desplazarse a otros centros, complica en muchos casos la administración de este tipo de tratamientos y hace que los pacientes ancianos no sean los candidatos óptimos.
Un total de 36 pacientes con cáncer gástrico avanzado fueron tratados con quimioterapia de primera línea de acuerdo a los esquemas considerados estándar en la práctica habitual: combinaciones de cisplatino y 5-fluorouracilo26. Algunos de nuestros pacientes también recibieron quimioterapia de segunda y tercera líneas. Los esquemas más utilizados fueron: docetaxel e irinotecan. Aunque todavía no dispongamos de evidencia científica que apoye con rigor la utilización de segundas y terceras líneas, en muchos centros es una práctica habitual27.
Se observaron diferencias estadísticamente significativas en la supervivencia en los pacientes en estadio III tratados con adyuvancia (16 pacientes) respecto a los que no la recibieron (17 pacientes) y en los pacientes en estadio IV que recibieron quimioterapia (6 pacientes) respecto a los que no la recibieron. Dadas las pequeñas muestras y teniendo en cuenta que la selección de pacientes se basa en condiciones óptimas para la tolerancia del tratamiento en ambos estadios de nuestro estudio, tomamos los datos con cautela y esperamos poder ampliarlo y aportar datos más concluyentes. Queda mucho campo por investigar en nuevas combinaciones que pudieran mostrar beneficios en la adyuvancia28 y en líneas paliativas. Dado el elevado porcentaje de casos en estadios avanzados, la adquisición de nuevos fármacos y estrategias terapéuticas se convierten en una urgencia en la investigación. La participación de los pacientes en ensayos clínicos ha de ser estimulada y considerada como una opción primordial para obtener datos más concluyentes acerca de las distintas opciones de tratamiento quimioterápico. Recientemente el trastuzumab ha demostrado recientemente mejorar el pronóstico en tumores avanzados con positividad para el HER229; podría ser una futura línea de investigación en nuestra área.
Respecto al riesgo de recaída en estadios precoces (54,2%) un estudio americano que incluyó 1.172 pacientes encontró un porcentaje de recidivas tras resección curativa similar, del 48%30. Ya sea por el tipo de protocolos de tratamiento que se aplican o por los métodos de cribado y seguimiento, estos datos suponen peores resultados de los que reflejan algunos estudios asiáticos31.
No podemos aportar datos de supervivencia a los 5 años ya que el estudio finalizó antes de concluir el periodo y actualmente permanece abierto para su continuidad. La supervivencia global tuvo una media de 19 meses y apenas un 25% de pacientes que sobreviven más de 44 meses desde el momento del diagnóstico. La supervivencia mundial del cáncer gástrico a los 5 años sigue aportando malos datos con cifras alrededor del 20%7. En Europa y España las cifras alcanzan el 24,9 y 31,8%, respectivamente32.
Encontramos en nuestra serie como factores de mal pronóstico: la estadificación tumoral, la ausencia de cirugía curativa, el tipo histológico difuso y la afectación ganglionar, al igual que otras series españolas33. El sexo no fue un factor pronóstico34 y tampoco lo fueron la edad, la localización del tumor, ni la realización de cirugía total o subtotal33,35.
En nuestro país, y principalmente en nuestra comunidad y provincia, apenas existen series provenientes de hospitales generales, amplias y actualizadas, que describan la incidencia y características del cáncer gástrico, sin embargo, la existencia de importantes diferencias regionales sigue poniéndose de manifiesto y nos recuerda la necesidad de dedicar más esfuerzos e inversiones en investigación y recursos para estos estudios.
Profundizar en la etiopatogenia responsable de esas diferencias y poder variar determinados hábitos dietéticos (si fuera el caso), analizar la posible influencia de casos familiares, favorecer la detección y cirugía precoz, hoy por hoy parecen ser lo único que mejoraría las cifras de curación, la morbilidad y la supervivencia de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.