Introducción Los tumores estromales gastrointestinales (GIST) son los tumores mesenquimales más frecuentes del tracto gastrointestinal. Han surgido numerosas publicaciones de GIST asociados con otras neoplasias.
ObjetivosEl objetivo de este estudio fue investigar esta posible asociación en una población aislada genéticamente.
MétodosSe realizó un estudio retrospectivo de pacientes con GIST en nuestro centro entre los años 2002-2009. Se compararon datos epidemiológicos, patológicos y familiares de pacientes con GIST sin neoplasias asociadas (grupo A) frente a pacientes con GIST y neoplasias asociadas (grupo B). Se investigó un posible mecanismo genético común entre GIST y las neoplasias asociadas mediante la detección, en todos los tumores, por el marcador inmunohistoquímico CD117.
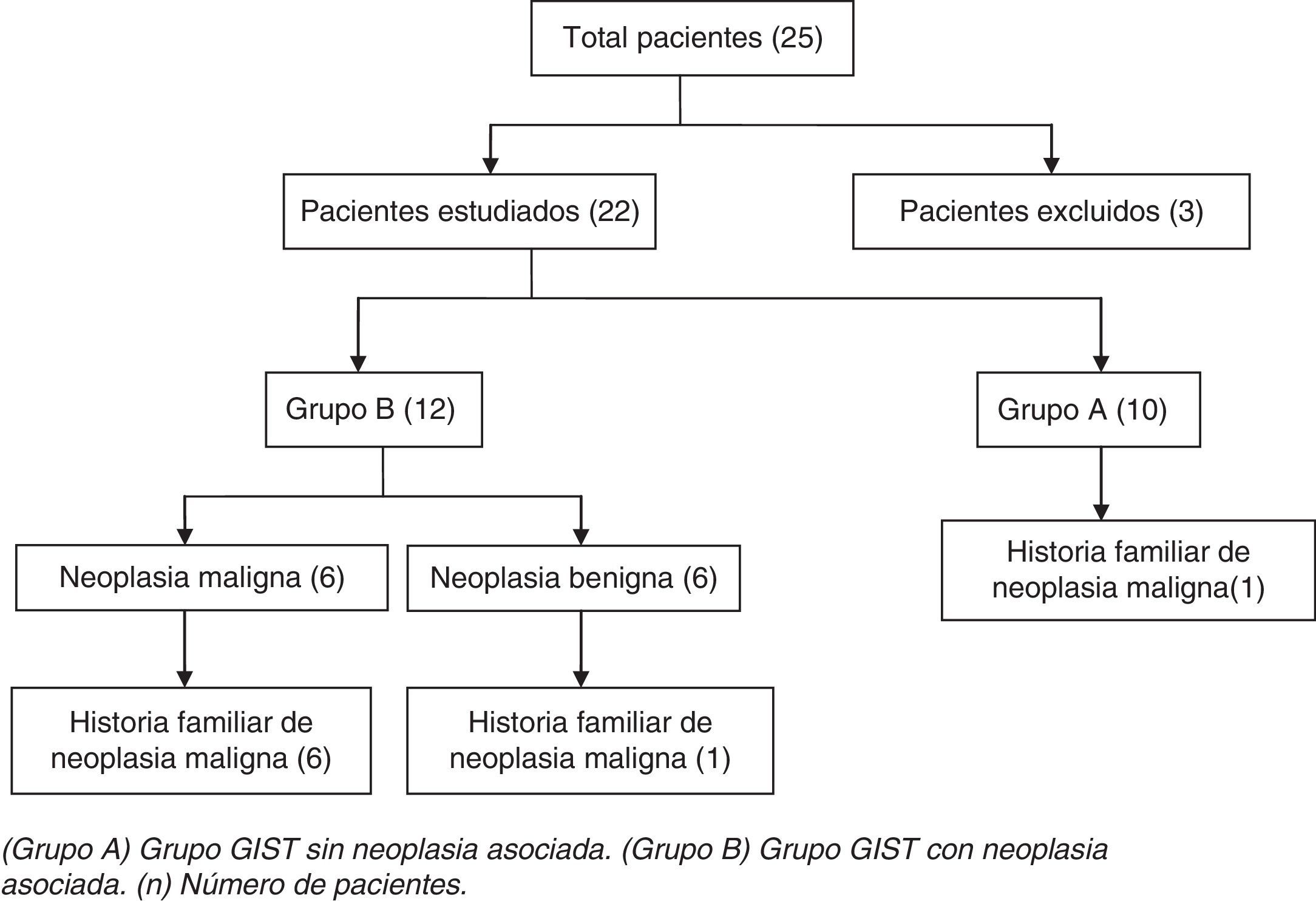
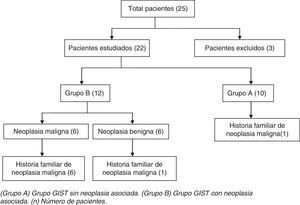
ResultadosSe hallaron 22 pacientes con GIST, 10 del grupo A (45%) y 12 del grupo B (55%). En el grupo B, el tumor asociado fue maligno en 6 pacientes (50%) y benigno en otros 6 (50%). De 22 pacientes con GIST, 8 (36%) presentaron antecedentes familiares de neoplasia maligna. De estos 8 pacientes, 7 eran (87,5%) del grupo B (p=0,03) y en 3 (37,5%) coincidieron el tipo anatomopatológico de neoplasia padecida por el paciente y su familiar. No hubo GIST en ningún familiar. Todos los GIST mostraron positividad para el CD117, mientras que las neoplasias asociadas fueron negativas para este marcador.
ConclusionesNo se ha demostrado positividad inmunohistoquímica para CD117 en las neoplasias asociadas. Dadas las especiales características de la población a estudio, la relación entre GIST y las neoplasias asociadas posiblemente sea casual.
Gastrointestinal stromal tumors (GIST) are the most common mesenchymal tumors of the gastrointestinal tract. Numerous studies have reported the association between GIST and other neoplasms.
ObjectivesThe aim of this study was to investigate the possible association between GIST and other tumors in a genetically isolated population.
MethodsA retrospective study was conducted of patients with GIST between 2002 and 2009 at our center. Epidemiological, pathological and family data in patients with GIST alone (group A) were compared with those in patients with GIST associated with other neoplasms (group B). A possible common genetic mechanism was investigated between GIST and associated malignancies by testing the detection of the immunohistochemical marker, CD117, in all tumors.
ResultsTwenty-two patients with GIST were identified, 10 in group A (45%) and 12 in group B (55%). In group B, the associated tumor was malignant in 6 patients (50%) and benign in another 6 (50%). Of the 22 patients with GIST, 8 (36%) had a family history of malignancies. Of these 8 patients, 7 (87.5%) were in group B (p=0.03) and 3 (37.5%) showed the same pathological type of neoplasm as their relatives. All GIST were positive for CD117 whereas associated malignancies were negative for this marker.
ConclusionWe did not find immunohistochemical positivity for CD117 in malignancies associated with GIST. Given the special characteristics of the study population, the association between GIST and associated malignancies may be incidental.
Los tumores estromales gastrointestinales (GIST) son los tumores mesenquimales más frecuentes del tracto gastrointestinal1-9. Tienen una incidencia anual de 8-40 casos por cada millón de habitantes2. Su origen se cree que está en las células intersticiales de Cajal. Estas células se localizan dentro del plexo mientérico y alrededor de este y actúan como marcapasos produciendo el movimiento autónomo del tracto gastrointestinal6,7. Tanto las células intersticiales de Cajal como los GIST expresan el receptor tirosina quinasa c-kit, proteína transmembrana codificada por el protooncogén c-kit, situado en el cromosoma 4q11-q12. La mayor parte de los GIST (75-85%) tienen una mutación en el oncogén c-kit que se traduce en una ganancia de función de la proteína c-kit y en la proliferación celular que da lugar al tumor. Hay casos de GIST (5-10%) en los que la mutación detectada está en el gen del receptor del factor de crecimiento derivado de plaquetas α (PDGFRA) y otros (10-15%) en los que no se ha determinado la mutación que los producen (GIST wild-type)10.
La proteína c-kit presenta de forma característica una tinción intensa para el antígeno CD117 en la mayoría de los GIST (75-85%). Este hecho permite hacer el diagnóstico diferencial con neoplasias de músculo liso (leiomiomas y leiomiosarcomas), tumores neurógenos (schwanomas) y fibromatosis desmoides, que no muestran esta tinción6. Los GIST también pueden presentar tinción positiva para otros marcadores como CD34 (60-70%), actina de músculo liso (40%) y, excepcionalmente, desmina o proteína S-1002,6.
En los últimos años han surgido numerosos trabajos publicados, sobre todo casos clínicos, de GIST con otras neoplasias asociadas sincrónicas o asincrónicas3,5,8,9,11-20. Se sabe que, tanto los GIST, como la leucemia mieloide crónica, tumores de células germinales, carcinoma de células pequeñas de pulmón, carcinoma de mama, carcinoma colorrectal, carcinoma de próstata y adenocarcinoma de pulmón pueden presentar una mutación o expresión desregulada de c-kit2,21,22. Sin embargo, se desconoce si esta relación de GIST con otros síndromes o tumores es incidental o resultado de procesos patofisiológicos relacionados2.
Algunas poblaciones isleñas, como la de nuestro estudio, pueden considerarse genéticamente «aisladas» durante generaciones. Su aislamiento geográfico hace que los estudios de naturaleza genética sean muy interesantes. Nuestro objetivo fue identificar un posible origen genético común entre GIST y otras neoplasias por la mutación del gen c-kit y expresión del CD117 en la población isleña de Tenerife.
Material y métodosSe llevó a cabo un estudio retrospectivo observacional. Entre los años 2002-2009, 25 pacientes con GIST fueron tratados en nuestro centro. Estos pacientes recibieron tratamiento quirúrgico, realizándose exéresis del tumor y posterior estudio anatomopatológico e inmunohistoquímico. Aquellos que no nacieron y/o tenían algún ancestro no originario de la isla de Tenerife (teniendo en cuenta hasta la segunda generación previa al caso) fueron excluidos. Además, se excluyeron los casos no operados en nuestro centro.
Se revisaron las neoplasias padecidas aparte del GIST y los pacientes fueron divididos en 2 grupos: grupo A (pacientes con GIST sin neoplasias asociadas) y grupo B (pacientes con GIST y neoplasias asociadas).
VariablesLas variables analizadas fueron: edad; sexo; antecedentes oncológicos en familiares de primer (hijos, hermanos y/o padres) y/o segundo grado (el resto de familiares); antecedentes oncológicos personales y tipo de neoplasia padecida si estos existían; potencial maligno del GIST según criterios ya descritos por Fletcher et al. (tamaño del tumor y tasa de mitosis)23, y tiempo transcurrido (en meses) entre el diagnóstico de GIST y neoplasia/s asociada/s. La recogida de datos fue obtenida siguiendo los protocolos establecidos en dicho centro para el acceso a los datos de las historias clínicas y material anatomopatológico. Los procedimientos utilizados en los pacientes y controles fueron realizados tras la obtención del consentimiento informado.
Análisis de la pieza tumoralLas piezas quirúrgicas y/o biopsias de los GIST y otras neoplasias halladas en cada paciente fueron sometidas a estudio con el anticuerpo CD117. En los GIST además se analizaron otros marcadores inmunohistoquímicos: CD 34, actina de músculo liso, desmina y proteína S-100. Se valoró el resultado del análisis imnunohistoquímico del tumor como: positivo (+) si presentó tinción positiva para el marcador inmunohistoquímico; negativo (-) si no presentó tinción para el marcador inmunohistoquímico y marcador inmunohistoquímico no determinado (0) por no existir neoplasia asociada al GIST.
La pieza con el tumor se procesó de forma habitual con fijación en formaldehído al 4% e inclusión en parafina. Se realizaron secciones de 3μ y se tiñeron con hematoxilina-eosina. Para la técnica inmunohistoquímica se desparafinaron los cortes en estufa y se hidrataron las muestras. Se incluyeron en solución tampón salina (TBS) para hacer la recuperación antigénica. Posteriormente se colocaron en el Autostainer de Dako (Dako, Dinamarca), en el que de forma automatizada se le añade el anticuerpo a estudio (todos ellos prediluidos en Dako), un sistema de visualización y el cromógeno (diaminobenzidina). Se tiñeron finalmente con hematoxilina. Se deshidrataron las muestras y se montaron las preparaciones. Se visualizaron al microscopio óptico. Todas las muestras a estudio contienen controles externos positivos para cada anticuerpo.
Estudio estadísticoLas comparaciones de proporciones entre grupos se llevaron a cabo con las pruebas de Kruskal-Wallis, exactas y asintóticas, según procediera. Las comparaciones de edad se realizaron con la prueba de Mann-Whitney. Se aceptó estadísticamente significativo un valor de p menor de 0,05. El programa estadístico empleado fue SPSS v. 17.0 (Chicago, Ill) y StatXact v. 5.0.3 (Cytel Software, Cambridge, Massachusetts).
ResultadosSe identificaron 25 pacientes con GIST. Se excluyeron 3 pacientes por no disponer de las muestras de biopsia y/o pieza quirúrgica de la neoplasia en nuestro centro. El total de pacientes estudiados fueron 22: 10 (45%) del grupo A y 12 (55%) del grupo B (fig. 1).
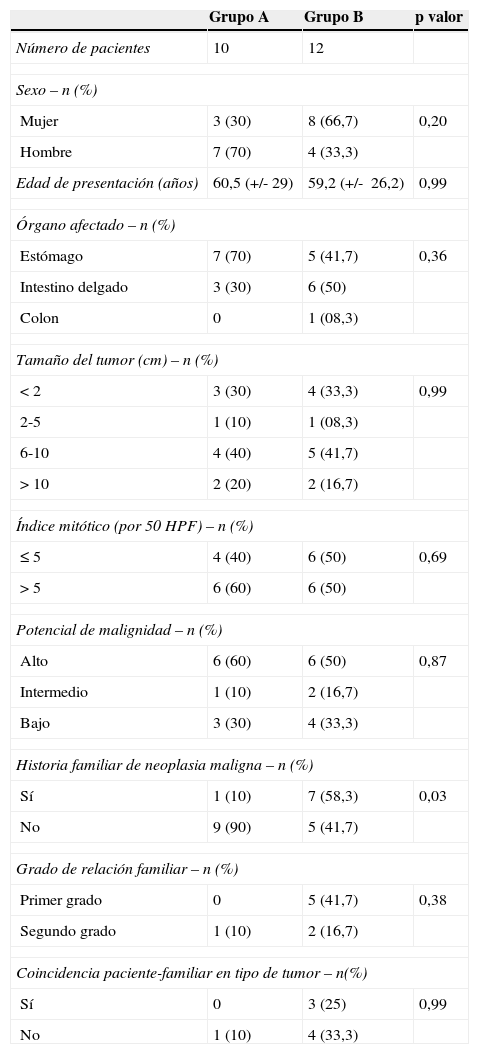
No se observaron diferencias estadísticamente significativas en la edad de presentación, sexo, órgano de localización del GIST, tamaño del tumor, número de mitosis ni potencial maligno entre los grupo A y B (tabla 1).
Datos epidemiológicos, anatomopatológicos y familiares
| Grupo A | Grupo B | p valor | |
|---|---|---|---|
| Número de pacientes | 10 | 12 | |
| Sexo – n (%) | |||
| Mujer | 3 (30) | 8 (66,7) | 0,20 |
| Hombre | 7 (70) | 4 (33,3) | |
| Edad de presentación (años) | 60,5 (+/-29) | 59,2 (+/- 26,2) | 0,99 |
| Órgano afectado – n (%) | |||
| Estómago | 7 (70) | 5 (41,7) | 0,36 |
| Intestino delgado | 3 (30) | 6 (50) | |
| Colon | 0 | 1 (08,3) | |
| Tamaño del tumor (cm) – n (%) | |||
| <2 | 3 (30) | 4 (33,3) | 0,99 |
| 2-5 | 1 (10) | 1 (08,3) | |
| 6-10 | 4 (40) | 5 (41,7) | |
| >10 | 2 (20) | 2 (16,7) | |
| Índice mitótico (por 50 HPF) – n (%) | |||
| ≤5 | 4 (40) | 6 (50) | 0,69 |
| >5 | 6 (60) | 6 (50) | |
| Potencial de malignidad – n (%) | |||
| Alto | 6 (60) | 6 (50) | 0,87 |
| Intermedio | 1 (10) | 2 (16,7) | |
| Bajo | 3 (30) | 4 (33,3) | |
| Historia familiar de neoplasia maligna – n (%) | |||
| Sí | 1 (10) | 7 (58,3) | 0,03 |
| No | 9 (90) | 5 (41,7) | |
| Grado de relación familiar – n (%) | |||
| Primer grado | 0 | 5 (41,7) | 0,38 |
| Segundo grado | 1 (10) | 2 (16,7) | |
| Coincidencia paciente-familiar en tipo de tumor – n(%) | |||
| Sí | 0 | 3 (25) | 0,99 |
| No | 1 (10) | 4 (33,3) | |
Grupo A (GIST sin neoplasia asociada) y grupo B (GIST con neoplasia asociada). HPF: campos de gran amplitud; n: número de pacientes.
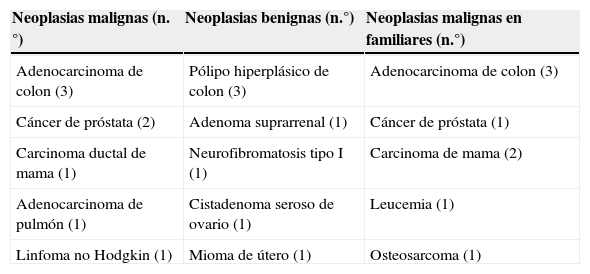
El total de neoplasias malignas y benignas detectadas en el grupo B fueron 15, presentando 3 casos, 2 neoplasias asociadas en el mismo paciente (tabla 2). Dentro de las neoplasias malignas, la más frecuente fue el cáncer de colon (37,5%), mientras que la más frecuente entre las benignas fue el pólipo de colon (42,5%). En 3 pacientes (25%), el diagnóstico de neoplasia maligna fue sincrónico al diagnóstico del GIST. En los casos no sincrónicos, el tiempo medio entre el diagnóstico del GIST y la neoplasia asociada fue 8+-5,6 meses.
Tipos anatomopatológicos de neoplasias asociadas a GIST y neoplasias halladas en familiares
| Neoplasias malignas (n.°) | Neoplasias benignas (n.°) | Neoplasias malignas en familiares (n.°) |
|---|---|---|
| Adenocarcinoma de colon (3) | Pólipo hiperplásico de colon (3) | Adenocarcinoma de colon (3) |
| Cáncer de próstata (2) | Adenoma suprarrenal (1) | Cáncer de próstata (1) |
| Carcinoma ductal de mama (1) | Neurofibromatosis tipo I (1) | Carcinoma de mama (2) |
| Adenocarcinoma de pulmón (1) | Cistadenoma seroso de ovario (1) | Leucemia (1) |
| Linfoma no Hodgkin (1) | Mioma de útero (1) | Osteosarcoma (1) |
n.°: número de pacientes que presenta cada tipo de neoplasia.
De los 22 pacientes con GIST, 8 pacientes (36%) presentaron antecedentes familiares de neoplasia maligna, siendo más frecuentes en el grupo B que en el grupo A (p=0,03). En el grupo B, 5 pacientes (41,7%) fueron familiares de primer grado (tabla 1). Seis de los 8 familiares (75%) padecieron los mismos tipos de neoplasia que las halladas en el grupo B. Además, en 3 casos (2 cáncer de colon y un cáncer de mama) coincidió el tipo anatomopatológico de neoplasia padecida por el paciente (en el grupo B) con el de su familiar (todos eran familiares de primer grado). No se apreció GIST en ningún familiar (tabla 2).
Los GIST fueron positivos para CD117 (100%), CD 34 (50%), actina de músculo liso (14%), desmina (5%) y proteína S-100 (23%). Sin embargo, ningún tumor asociado presentó positividad para CD117 (tabla 3).
Resultados de los marcadores inmunohistoquímicos para GIST y las neoplasias asociadas
| Número de casos GIST/neoplasia asociada | CD 117 | CD 34 | SMA | Desmina | Proteína S-100 |
|---|---|---|---|---|---|
| 1/Linfoma no Hodgkin | +/- | - | - | - | - |
| 2/No | +/0 | - | + | - | - |
| 3/Mioma de útero | +/- | + | - | - | - |
| 4/Adenocarcinoma de colon | +/- | - | - | - | - |
| 5/Cistoadenoma seroso de ovario | +/- | + | - | - | - |
| 6/Adenoma suprarrenal/Pólipo hiperplásico de colon | +/-/- | - | - | - | + |
| 7/Pólipo hiperplásico de colon | +/- | + | - | - | - |
| 8/No | +/0 | - | - | - | - |
| 9/Neurofibromatosis tipo I | +/- | - | - | - | + |
| 10/No | +/0 | - | - | - | - |
| 11/No | +/0 | + | - | - | + |
| 12/Carcinoma de próstata/Adenocarcinoma de pulmón | +/-/- | + | - | - | - |
| 13/Adenocarcinoma de colon | +/- | + | - | - | - |
| 14/Pólipo hiperplásico de colon | +/- | + | + | - | - |
| 15/Carcinoma ductal de mama | +/- | + | + | + | - |
| 16/No | +/0 | + | - | - | - |
| 17/No | +/0 | - | - | - | - |
| 18/No | +/0 | + | - | - | + |
| 19/Carcinoma de próstata/Adenocarcinoma de colon | +/-/- | - | - | - | - |
| 20/No | +/0 | - | - | - | + |
| 21/No | +/0 | - | - | - | - |
| 22/No | +/0 | + | - | - | - |
No: GIST sin neoplasias asociadas; SMA: actina de músculo liso;.+: marcador positivo; -: marcador negativo: 0: marcador indeterminado (sin neoplasia asociada).
La presencia de otras neoplasias en pacientes con antecedentes de GIST ha sido ampliamente mencionada en la literatura1,2,18. En una revisión realizada por Agaimy et al.1 se hallaron 444 casos (9,3%) de neoplasia maligna en 4.777 pacientes con GIST. Según sus datos, la frecuencia de neoplasia maligna en pacientes con GIST para los diferentes estudios analizados varió del 4,5 al 33%. Liszka et al.2 en un estudio realizado a 82 pacientes con GIST 22 pacientes (26,8%) presentaron otras neoplasias asociada benigna o maligna. Wronski et al.18 hallaron en 4 de 28 pacientes (14%) con GIST otra neoplasia maligna gastrointestinal de manera sincrónica. Estas diferencias en la frecuencia de neoplasias asociadas a GIST probablemente se deban a que las características del grupo «neoplasias asociadas» varían de un estudio a otro. Mientras que Liszka et al.2 contemplan neoplasias benignas y malignas asociadas a GIST, Wronski et al.18 solo incluyen las malignas, sincrónicas y localizadas en el tracto gastrointestinal. En nuestro estudio hemos obtenido unos resultados de prevalencia de GIST asociados a neoplasias similares o superiores a estas series: 55% para neoplasias benignas y malignas, 27% para neoplasias malignas y 14% para neoplasias malignas sincrónicas. Esto podría deberse al alto nivel de consanguinidad presente en la población de nuestro estudio comparado con otras poblaciones de mayor intercambio genético.
Se han escrito varias hipótesis que intentan explicar la relación entre los GIST y otros tumores. Se ha sugerido que podría deberse a la acción de una mutación genética o un agente carcinogénico común17,24. Reşorlu et al. propusieron la asociación entre un GIST y un carcinoma papilar renal por la mutación del c-kit y el c-met respectivamente, protooncogenes que codifican tirosina quinasas14,25. Sailors et al.19 establecieron una posible relación entre estos tumores mediante el c-kit, que puede expresarse tanto en GIST como en otras neoplasias ya mencionadas. Bellone et al.26 publicaron la sobreexpresión de c-kit en el cáncer colorrectal y mostraron que la activación de c-kit favorece el crecimiento, la supervivencia, la migración e invasión de las células DLD-1 del carcinoma de colon. Micke et al.22 observaron que el receptor c-kit es frecuentemente expresado en el adenocarcinoma de pulmón. En un estudio realizado por di Lorenzo et al.21 se halló en 26 de 94 pacientes con cáncer de próstata expresión positiva para el c-kit. Eroğlu et al.27 mostraron que un alto nivel de expresión de c-kit ocurre frecuentemente en cánceres invasivos de mama. Estos hechos sugieren que podría existir una relación entre GIST y las neoplasias asociadas por medio del c-kit. Sin embargo, no está claro si la relación entre estos tumores y los GIST es casual o no. En nuestro estudio, los tumores asociados mostraron una respuesta negativa al antígeno CD117, mientras que la de los GIST fue positiva. Estos hallazgos apoyan la hipótesis que plantean algunos autores sobre la ausencia de relación entre GIST y otros tumores, siendo solo casual28–29.
A diferencia de estos estudios que también han sugerido una relación casual de los GIST con otras neoplasias28–29, debemos resaltar que nuestro estudio fue realizado en una población con baja variabilidad genética. La población de la isla de Tenerife tiene una historia demográfica de posible aislamiento desde su fundación, debido a razones no solo geográficas sino también históricas basadas en el proceso de colonización llevado a cabo por los castellanos. Este aislamiento sufrido por estas poblaciones durante siglos, hasta el siglo XXI, hace pensar que ha habido una considerable deriva genética durante alrededor 20 generaciones. La deriva genética podría reducir la variabilidad alélica en la población bien mediante un efecto fundador o bien debido a un efecto de cuello de botella. La magnitud de este efecto es inversamente proporcional al tamaño de la población. Hay también un mayor grado de consanguinidad debido al bajo número de fundadores30 que los hacen muy interesantes para estudios genéticos. De esta manera, si hubiera cualquier mutación común en GIST y otras neoplasias, debería ser mantenida dadas las especiales características de la población a estudio.
No hemos encontrado diferencias cuando analizamos la edad de presentación de los tumores en ambos grupos, aunque algunos autores describen que las poblaciones de GIST con neoplasias asociadas son de mayor edad que las que no presentan esta asociación.
Los carcinomas del tracto gastrointestinal, próstata, mama, riñón, pulmón, tracto genital femenino y linfoma/leucemia son los tipos de neoplasias que con más frecuencia se asocian a GIST1. El tumor más frecuente observado en nuestro estudio fue el adenocarcinoma de colon. Esto probablemente se deba, en parte, a que el cáncer colorrectal es uno de los más prevalentes, sobre todo en Tenerife. En la población de Tenerife hemos descrito una nueva mutación para el síndrome de Lynch31, con características de mutación original, que posiblemente ha variado su penetrancia a lo largo de las diferentes generaciones. Sin embargo, la citada mutación ha experimentado un descenso de la capacidad para la reparación de genes responsables del cruzamiento en la población32. Este factor debería también haber facilitado la progresión de mutaciones del c-kit por la acción de la deriva genética y consanguinidad en esta población con una historia demográfica de aislamiento. Estudios publicados revelan que los GIST asociados a otros tumores son preferentemente de pequeño tamaño, bajo índice mitótico y, por tanto, bajo potencial de malignidad. Además, se localizan con mayor frecuencia en el estómago1,2. Sin embargo, en nuestra serie no hemos hallado diferencias en el tamaño, índice mitótico, localización ni potencial de malignidad entre los grupos.
Curiosamente, cuando analizamos la historia familiar de tumores malignos en los pacientes con GIST, casi todos los casos correspondieron al grupo B. Los tipos de neoplasias más frecuentes en los familiares fueron el cáncer de colon y el cáncer de mama (la mayor parte eran familiares de primer grado) y no se observó GIST en ningún familiar. Estos hallazgos refuerzan la influencia de determinados genes responsables de las características hereditarias del tumor en poblaciones aisladas que tienen aumentada su frecuencia alélica frente a poblaciones con mayor intercambio genético. Las condiciones históricas y geográficas en la isla de Tenerife pudieron haber producido un fenómeno de «deriva genética» de tal manera que se produjera un pequeño número de fundadores que se fueron trasmitiendo a lo largo de sucesivas generaciones dadas las condiciones de aislamiento. Estas características explicarían la elevada asociación de cánceres de colon y mama, los cuales son los más estrechamente relacionados con una predisposición familiar. La ausencia de historia familiar de GIST en una población genéticamente tan estable sugiere una baja frecuencia de mutaciones germinales de c-kit, ya que si bien en los tumores GIST estas mutaciones germinales son poco frecuentes porque generalmente los producen mutaciones somáticas, probablemente en condiciones de aislamiento habrían podido manifestarse más frecuentemente como casos de GIST familiar, y por el contrario este hecho no se ha producido. Se han descrito, no obstante, otras mutaciones genéticas que podrían predisponer a la aparición de GIST asociados con otras neoplasias33,34.
En conclusión, el estudio de la presencia de la mutación c-kit en tumores asociados a GIST ha sido negativa en todos los casos. Por tanto, no podemos demostrar la existencia de un factor oncogénico común entre los GIST y los tumores asociados. Sin embargo, desde un hipotético punto de vista, los tumores asociados podrían desarrollarse por un mecanismo relacionado a GIST diferente al c-kit (PDFGRA y wild-type), que en nuestra población parece poco probable. Teniendo en cuenta la influencia de las características especiales de la isla, con una alta tasa de consanguinidad y baja variabilidad genética, si hubiera existido esta asociación debería haber sido trasmitida a lo largo de sucesivas generaciones con elevada endogamia. A diferencia de algunos tumores de mama y cáncer colorrectal, las mutaciones de c-kit raramente afectan la línea germinal sino que son mutaciones somáticas excepto en los raros casos de GIST familiar. Dadas las especiales características de la isla con un fenómeno de deriva genética, alguna de estas mutaciones podría haber producido un efecto fundador que no se ha dado. Por tanto, es posible pensar que los genes involucrados en la patología de GIST y los tumores asociados son diferentes. En nuestra población, la coexistencia de GIST con otros tumores es casual. No hay, por tanto, relación entre ellos.
FinanciaciónEste manuscrito ha sido realizado sin apoyos económicos, no teniendo ninguno de los autores relación financiera o personal que pudiera dar lugar a un conflicto de intereses en relación con este manuscrito. La información del manuscrito no ha sido presentada previamente en congresos ni reuniones.
AutoríaRodríguez-González, Diana: Diseño del estudio y redacción del artículo; Delgado-Plasencia, Luciano: Diseño del estudio y revisión crítica de la versión final; Hernández-León, Carmen: Redacción del artículo y adquisición de datos; Torres Monzón, Esther: Adquisición y recogida de datos; Castro-Peraza, M. Elisa: Adquisición y recogida de datos; Cruz-Jurado, Josefina: Análisis e interpretación de los resultados; Bravo-Gutiérrez, Alberto: Análisis e interpretación de los resultados; Medina Arana, Vicente: Revisión crítica y aprobación de la versión final.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.