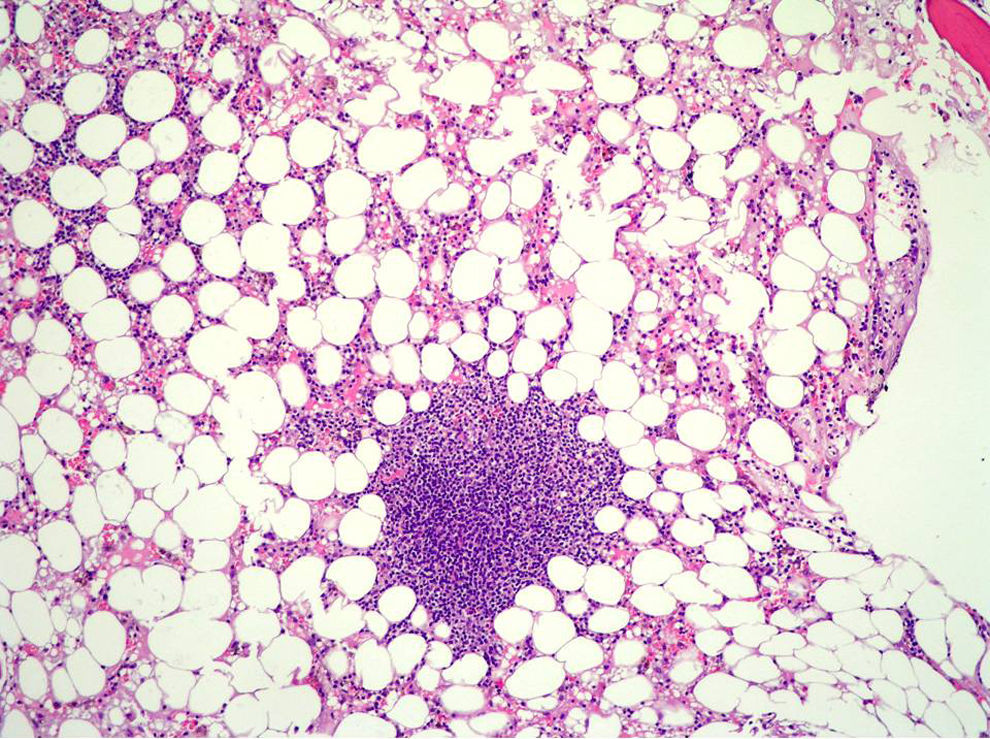
La aplasia medular es una enfermedad de la célula madre hematopoyética que se caracteriza por el fracaso en la producción de células sanguíneas. Su etiología es múltiple: infecciones, radiaciones ionizantes, carenciales, fármacos e idiopática. Presentamos el caso de un varón de 56 años, sin alergias medicamentosas ni hábitos tóxicos, peso de 63kg y con un IMC de 20,8, diagnosticado en 2012 de hepatopatía crónica por VHC genotipo 1, polimorfismo IL28 T/C sin datos de hipertensión portal; adquisición postransfusional en la juventud. No seguía tratamiento habitual. Analíticamente presentaba una carga viral mayor de 9 millones de copias, hemograma normal: AST 87U/l, ALT 109U/l y un grado de fibrosis hepática de 12,5kp por fibroscan (equivalente a un grado 3 de fibrosis sobre un máximo de 4 según la escala METAVIR), por lo que se inició tratamiento con triple terapia con interferón pegilado (peg-IFN) 2-180μg/semana, ribavirina (RBV) 400mg/12h y telaprevir 750mg/8h, inicialmente bien tolerado clínica y analíticamente en el seguimiento. En la cuarta semana coincidiendo con epixtasis, el paciente presentaba leucocitos normales, hemoglobina 11,2g/dl y 6.000 plaquetas, lo que obligó a suspender el tratamiento y transfundir plaquetas. Cinco días después persistía trombocitopenia (17.000μl) asociando neutrófilos 501μl y hemoglobina 9,6g/dl, pautándose darbopoetina alfa 13μg/semanal. Dos días después ingresa por astenia, fiebre elevada sin foco (radiografía de tórax, ecografía abdominal, hemocultivos, serología a VHS, parvovirus, VEB y CMV normales/negativos) presentando analíticamente: plaquetas 4.000μl, neutrófilos 12μl, hemoglobina 7,7g/dl, siendo los reticulocitos, hemostasia y perfil hepático normal, frotis de sangre periférica sin displasia ni células anormales e inmunofenotipo sanguíneo con ausencia de proliferación linfoide monoclonal. La biopsia de médula ósea confirmó una médula ósea hipocelular con áreas de severa hipoplasia y estudio microbiológico negativo (fig. 1). Recibió tratamiento con vancomicina, imipenem, filgastrim 300μg/24h, transfusión de hematíes según requerimientos, pool plaquetario/48h y vitamina B12/folato. Tras 15 días el paciente permanecía sin datos infecciosos, aunque mantenía aplasia severa sin mejoría, iniciándose tratamiento con prednisona 1mg/kg/peso con descenso 10mg/semanal, sin requerir tratamiento con timoglobulina por mejoría del hemograma a los 20 días (neutrófilos 412μl, hemoglobina 8,1μg/dl y 39.000 plaquetas), retirándose en ese momento el tratamiento inicial excepto los esteroides y B12/folato.
Se realizó seguimiento semanal con mejoría progresiva del hemograma hasta su normalización a los 40 días, manteniendo un perfil hepático normal, una carga viral mayor a 3 millones de copias, y en espera de alternativas terapéuticas futuras, si las circunstancias del paciente así lo permiten.
La aplasia medular adquirida (20%) se han asociado a fármacos como antiinflamatorios no esteroideos, cloranfenicol, sulfamidas, nifedipino, sales de oro y algunos antiepilépticos1. En otros casos, la aplasia medular puede estar precedida de infecciones virales como hepatitis B, C, G, virus de Epstein-Barr y el herpes simple; cuyo mecanismo inmunológico puede activar células T citotóxicas que reconoce Ag similares a lo expresado en el hígado2,3. El tratamiento del VHC en la última década, ha sido principalmente la biterapia con peg-INF más RBV. El peg-IFN tiene como principales acciones la inmunomodulación, capacidad antiviral y actividad antiproliferativa. Como análogo sintético de los nucleósidos, la RBV tiene actividad antivírica e inmunomoduladora. Sin embargo, las tasas de respuesta virológica sostenida que se alcanzan son del 55%. Los efectos adversos conocidos y en ocasiones graves incluyen alteraciones hematológicas como la anemia, principalmente por ribavirina; así como neutropenia y trombocitopenia por peg-INF4. La aparición de los nuevos inhibidores de la serin-proteasas (telaprevir, boceprevir) a la pauta de peg-INF y RBV ha mejorado de forma sustancial la respuesta viral en pacientes con genotipo 15. El telaprevir presenta como efectos secundarios descritos, anemia (quizás más frecuente que en la biterapia en las 12 primeras semanas), trombocitopenia y linfopenias, en orden de frecuencia, describiéndose de manera infrecuente pancitopenias severas en experiencias clínicas, así como en su ficha técnica, pero no aplasias medulares tan severas6. En la literatura médica revisada hemos encontrado casos descritos de aplasia medular asociada a biterapia (peg-IFN más RBV), atribuyéndose generalmente la toxicidad a peg-INF, así como escasos reportes en el contexto de la triple terapia; sin poder definir como en este caso el grado de responsabilidad aplásico atribuido a cada fármaco, ante la ausencia de otros datos justificantes7.