Análisis coste-efectividad de sofosbuvir con peginterferón/ribavirina (SOF/PEG-IFN/RBV) en pacientes con hepatitis C crónica genotipo 1 (HCC-GT1) no tratados previamente con diferentes grados de fibrosis, desde la perspectiva del Sistema Nacional de Salud (SNS).
MétodosModelo de Markov para estimar costes y resultados en salud (años de vida ganados [AVG] y años de vida ajustados por calidad [AVAC]), con una tasa de descuento del 3% anual de dos estrategias: SOF/PEG-IFN/RBV en fases precoces (fibrosis leve-moderada, F2-F3) o tardías (cirrosis compensada, F4). La eficacia (respuesta virológica sostenida), probabilidades anuales de transición, costes del manejo de la enfermedad y utilidades se obtuvieron de la literatura. Se consideraron costes directos expresados en € 2014. Se realizó un análisis de sensibilidad probabilístico (ASP).
ResultadosSOF/PEG-IFN/RBV en F2-F3 fue más efectiva (19,12 AVG y 14,14 AVAC) que en F4 (16,36 AVG y 9,27 AVAC). En 1.000 pacientes, SOF/PEG-IFN/RBV en F2-F3 podría evitar 66 casos de cirrosis descompensada, 60 de carcinoma hepatocelular y 4 trasplantes, en comparación con F4. El coste total de la terapia con SOF/PEG-IFN/RBV en F2-F3 (43.263€) fue menor que en F4 (49.018€). Administrar el tratamiento en F2-F3 frente a F4 representó una estrategia dominante (más efectiva y con menor coste). En el ASP, la administración de SOF/PEG-IFN/RBV en F2-F3 permaneció dominante en el 100% de las simulaciones.
ConclusionesLa administración de SOF/PEG-IFN/RBV en F2-F3, comparada con la terapia en F4, disminuyó la incidencia de complicaciones de la enfermedad hepática y se asoció con un ahorro en costes para el SNS en pacientes HCC-GT1.
Cost-effectiveness analysis of sofosbuvir combined with peginterferon alpha-2a and ribavirin (SOF/Peg-IFN/RBV) in early versus advanced fibrosis in previously untreated patients with chronic hepatitis C genotype 1 (CHC-GT1), from the perspective of the Spanish National Health System (NHS).
MethodsA Markov model was developed to compare lifetime costs and outcomes (life years gained [LYGs] and quality-adjusted life years [QALYs]) of 2 treatment strategies: SOF/Peg-IFN/RBV administered during early fibrosis (mild-moderate fibrosis; F2-F3) or advanced fibrosis (cirrhosis; F4). Efficacy (sustained virologic response), annual transition probabilities, disease management costs and utilities were obtained from the literature. Costs and outcomes were discounted annually at 3%. Direct costs were considered, expressed in Euros (€, 2014). Probabilistic sensitivity analysis (PSA) was also performed.
ResultsSOF/Peg-IFN/RBV therapy at F2-F3 was more effective (19.12 LYGs and 14.14 QALYs) compared to F4. In a cohort of 1,000 patients, SOF/Peg-IFN/RBV prevented 66 cases of decompensated cirrhosis, 60 hepatocellular carcinomas and 4 liver transplantations compared with therapy in advanced fibrosis. The total lifetime cost of early therapy (€43,263) was less than the cost of treatment in the advanced stage (€49,018). Early therapy was a dominant strategy, more effective and less costly in all simulations. In the PSA analysis, administration of SOF/PEG-IFN/RBV at F2-F3 was dominant in all simulations.
ConclusionsStarting SOF/Peg-IFN/RBV therapy at F2-F3, compared with therapy at F4, reduced the incidence of liver disease complications and was associated with cost savings for the Spanish NHS in CHC-GT1 patients.
La infección por virus de hepatitis C (VHC) afecta aproximadamente a un total de 160 millones de personas a nivel mundial1. De ellos, 9 millones viven en países europeos2. La hepatitis C crónica (HCC) es una patología de presentación asintomática en fases precoces, pero que puede evolucionar a cirrosis hepática a medida que la enfermedad progresa. Hasta un 25% de los pacientes con HCC desarrolla cirrosis3, un 4% de los cuales evoluciona anualmente a cirrosis descompensada, con un riesgo asociado de aproximadamente un 1,6% por año de desarrollar un carcinoma hepatocelular (CHC)3. La infección por VHC es la principal causa de trasplante hepático y se estima que es responsable de 350.000 fallecimientos anuales4.
El genotipo 1 (GT1) es el más frecuente a nivel mundial5. En España, es responsable del 65,4-76% de los casos6,7. Los tratamientos actualmente recomendados para pacientes infectados por virus C GT1 se basan en terapias con antivirales orales de acción directa, libres de interferón (IFN)8.
Sin embargo, estos antivirales no están disponibles en todos los países, e incluso en los países donde sí están comercializados se dan situaciones que dificultan el acceso de los pacientes a los tratamientos9. En algunos entornos, el tratamiento únicamente es reembolsado en pacientes que presentan cirrosis, por lo que los pacientes con fibrosis leve se tratan con regímenes basados en IFN, o deben esperar a que la enfermedad progrese10 para que el tratamiento con estos fármacos cumpla los criterios de financiación por los sistemas sanitarios11.
El criterio de respuesta virológica sostenida (RVS), definida como ausencia de ARN de VHC detectable en suero al final de 12semanas de tratamiento12, es ampliamente aceptado y reconocido como indicativo de éxito terapéutico12,13.
Los beneficios clínicos asociados al criterio de RVS son evidentes a varios niveles. Los pacientes que alcanzan una RVS presentan una esperanza de vida similar a la de la población general14, ya que se relaciona con una reducción sustancial de la mortalidad global15,16. Además la RVS se asocia con regresión de la fibrosis hepática, incluso en casos de cirrosis leve17, con la consecuente reducción del riesgo de desarrollo de CHC18, que sin embargo no llega a eliminarse por completo en aquellos pacientes con cirrosis, aunque hayan respondido satisfactoriamente al tratamiento19-21.
La eficacia de la terapia antiviral en pacientes con fibrosis avanzada o cirrosis es significativamente menor que en pacientes con fibrosis leve, resultando en una menor probabilidad de alcanzar una RVS22,23.
Entre los regímenes con IFN disponibles, la combinación de sofosbuvir (SOF) con peginterferón alfa-2a y ribavirina (Peg-IFN/RBV) en terapia de 12semanas en pacientes naïve con GT1 proporciona tasas elevadas de RVS (90%), sin que se hayan observado casos de rebote virológico o resistencia a los fármacos24. Las tasas de RVS asociadas a este régimen son superiores en pacientes con fibrosis leve o moderada que en aquellos con cirrosis, con un perfil de seguridad que se asocia a un ligero incremento de efectos adversos en los pacientes que presentan cirrosis. De ello se deriva que el tratamiento en fases tempranas de la enfermedad puede asociarse con un incremento de la calidad de vida y, consecuentemente, con un potencial ahorro de costes para los sistemas sanitarios25.
El objetivo del presente estudio fue evaluar la relación coste-efectividad de la administración de SOF combinado con Peg-IFN/RBV (SOF/Peg-IFN/RBV) en pacientes con GT1 sin tratamiento previo, con estados precoces de fibrosis frente a estados con fibrosis avanzada, desde la perspectiva del Sistema Nacional de Salud en España.
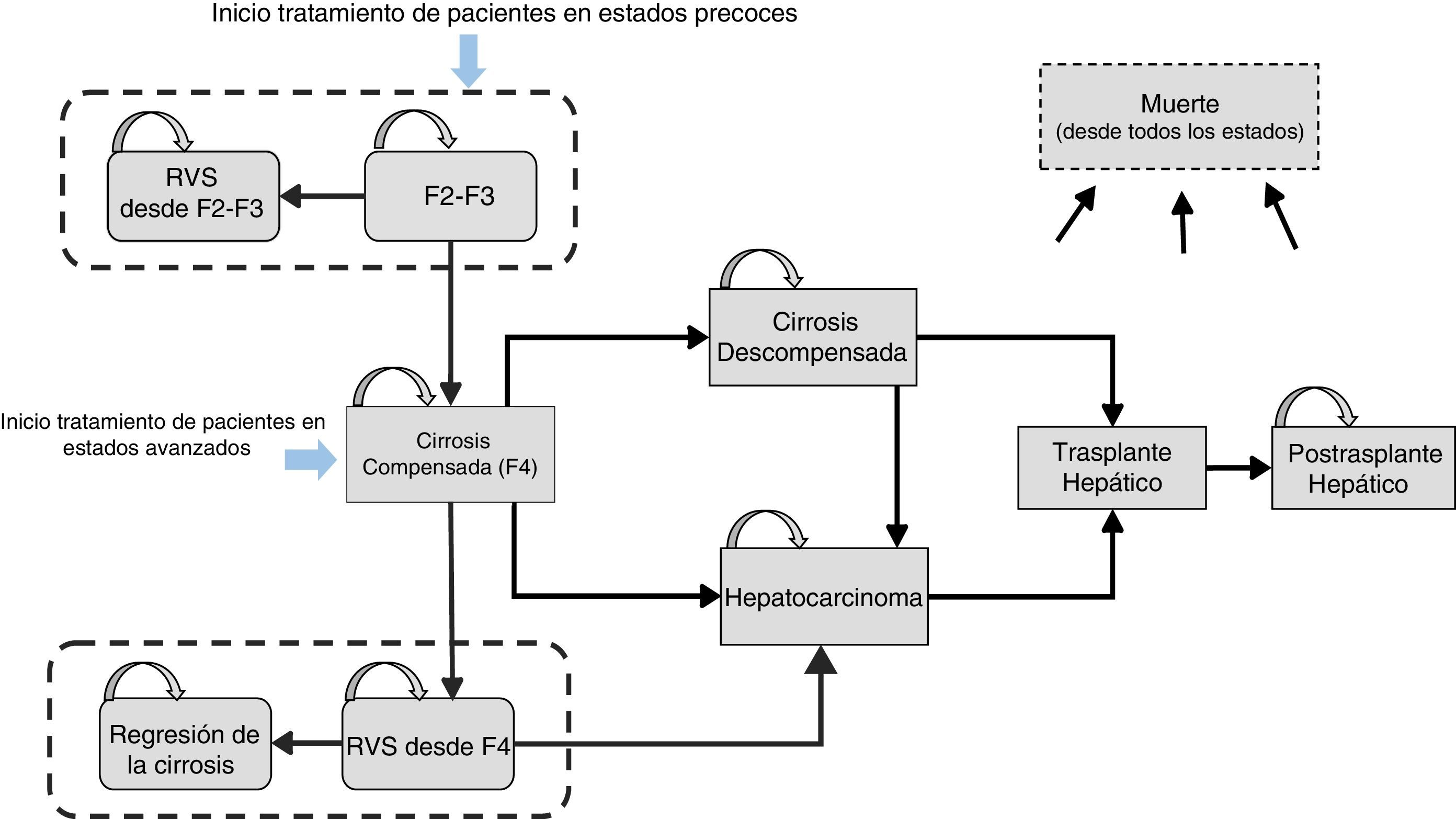
Material y métodosDiseño del modeloSe diseñó un modelo analítico de decisión con estructura de Markov, mediante el programa Microsoft Excel 2013, para simular la historia natural de pacientes naïve con HCC, GT1 (fig. 1), y evaluar los costes y resultados en salud producidos por 2 estrategias de tratamiento con SOF/Peg-IFN/RBV durante 12semanas, en 2 diferentes estadios de fibrosis hepática: a) administración en fases tempranas de la enfermedad, representada por pacientes con fibrosis leve-moderada (METAVIR F2-F3, sin cirrosis), y b) administración en fases de fibrosis avanzada (METAVIR F4, con cirrosis compensada).
En el modelo se consideró un horizonte temporal a largo plazo, contemplando toda la esperanza de vida de los pacientes. De esta forma, se estimaron los años de vida ganados (AVG), los años de vida ajustados por calidad (AVAC) ganados, así como los costes totales atribuibles a cada una de las 2 estrategias de tratamiento, desde la perspectiva del Sistema Nacional de Salud.
Estructura del modelo y probabilidades de transiciónEl modelo, que incluye 10 estados de salud mutuamente excluyentes, se basa en probabilidades dinámicas anuales, que reflejan la progresión de la enfermedad. Las probabilidades de referencia se obtuvieron de la literatura17,26-28, y fueron posteriormente ajustadas para cada año en base a las tasas ajustadas por edad de mortalidad por cualquier causa y de mortalidad por causa no hepática (tabla 1). La duración de los ciclos de Markov fue de un año, excepto para el primer ciclo en el que se computaron 2 periodos de 6meses, con objeto de aplicar de forma más apropiada la eficacia reportada en los ensayos clínicos24.
Parámetros utilizados en el modelo. RVS, probabilidades y utilidades
| Variable | Valor basal anual |
|---|---|
| Tasa de RVS en estadios F2-F324 | 0,913a |
| Tasa de RVS en estadio F424 | 0,808a |
| Probabilidades anuales de transición de referencia | |
| F2-F3 a F426 | 0,073 |
| F4 | |
| A cirrosis descompensada26 | 0,040b |
| A carcinoma hepatocelular26 | 0,015 |
| A muerte31 | 0,021 |
| RVS desde estadio F4 | |
| A regresión de la cirrosis17 | 0,169 |
| A carcinoma hepatocelular27,28 | 0,005 |
| Cirrosis descompensada | |
| A carcinoma hepatocelular31 | 0,068 |
| A trasplante hepático28 | 0,023 |
| A muerte31 | 0,138 |
| Carcinoma hepatocelular | |
| A trasplante hepático28 | 0,040 |
| A muerte26 | 0,860 |
| Trasplante hepático a muerte26 | 0,210 |
| Postrasplante hepático a muerte26 | 0,057 |
| Valores de utilidad por estados de salud | |
| Estadios F2-F3f | 0,72c |
| RVS desde estadios F2-F3f | 0,77 |
| F438 | 0,55 |
| RVS desde estadio F4f | 0,59d |
| Regresión de la cirrosisf | 0,59d,e |
| Cirrosis descompensada34 | 0,45 |
| Carcinoma hepatocelular34 | 0,45 |
| Trasplante hepático34 | 0,45 |
| Postrasplante hepático34 | 0,67 |
Estadios F2-F3: fibrosis leve-moderada; Estadio F4: cirrosis compensada; RVS: respuesta virológica sostenida.
La tasa de RVS fue ajustada a los pacientes con GT1 según el estadio de fibrosis y el número total de pacientes por genotipos.
La probabilidad incluye los subestados contemplados en cirrosis descompensada (ascitis, encefalopatía hepática, hemorragia gastrointestinal por hipertensión portal e infección bacteriana severa).
EL valor de utilidad en estadios F2-F3 se estimó con el promedio de utilidades en estadio F2 y estadio F3.
El modelo estimó los costes y beneficios en salud alcanzados en 2 cohortes hipotéticas (pacientes tratados con SOF/Peg-IFN/RBV en fases tempranas y pacientes tratados con SOF/Peg-IFN/RBV en fases de fibrosis avanzada) con las mismas características basales: 1.000 pacientes naïve con edad promedio de 52años, con infección por VHC GT1.
Se realizaron simulaciones individuales para cada una de las 2 cohortes, asumiendo en ambos casos que los pacientes completaban un único tratamiento de 12semanas de duración, sin considerar discontinuación o interrupción del tratamiento por falta de respuesta o efectos adversos, ni retratamiento.
Las tasas de eficacia —RVS— se obtuvieron del estudio NEUTRINO24. En este ensayo se obtuvieron tasas del 92,3% y 79,6% para pacientes con y sin cirrosis, respectivamente. La tasa de RVS está disponible para cada uno de los diferentes genotipos (89,4% para GT1), pero no de forma desagregada para los pacientes GT1 con o sin cirrosis24. En ausencia de esta información, se realizó un ajuste de las tasas de RVS para estimar la probabilidad de transición requerida por el modelo.
La simulación de la cohorte tratada en fases tempranas se inició con la entrada de los pacientes en el estado F2-F3. Los pacientes que alcanzaron una RVS se consideraron curados desde un punto de vista clínico y virológico y transitaron al estado «RVS desde estadios F2-F3». Por otra parte, la simulación de la cohorte tratada en fibrosis avanzada se inició con todos los pacientes en el estadio F4. Aquellos pacientes con RVS se consideraron virológicamente curados, lo que supuso la transición al estado «RVS desde estadio F4», pero manteniendo cierto riesgo de desarrollo de CHC29 (fig. 1). De acuerdo a la evidencia publicada, cierta proporción (61%)17 de los pacientes cirróticos que alcanzan una RVS tras el tratamiento pueden mostrar mejoría clínica, lo que en el presente modelo se refleja en la posibilidad de transición al estado «regresión de la cirrosis» de aquellos pacientes con RVS desde estadio F4.
Basándose en los resultados de otros estudios que han evidenciado la asociación entre RVS y curación12,13,16,18,30, los pacientes con RVS desde estadios F2-F3 y los pacientes en regresión de la cirrosis se consideraron pacientes sanos, por lo que no se asoció posibilidad de complicaciones relacionadas con la HCC durante el resto de la simulación, aplicándose, a este grupo, la esperanza de vida de la población general.
En contrapartida, los pacientes sin RVS se consideraron como fracasos del tratamiento y continuaron en riesgo de progresión de la enfermedad a estadios más avanzados, como cirrosis compensada (CC), cirrosis descompensada (CD) y CHC, según la historia natural de la enfermedad (fig. 1). Los pacientes que presentaron CD o CHC fueron susceptibles de recibir un trasplante hepático. Aquellos supervivientes al trasplante hepático transicionaron al estado «postrasplante hepático» con la consiguiente posibilidad de progresión al estado muerte (fig. 1).
Los datos de mortalidad por causa hepática para los estados de CD, CHC, trasplante hepático y postrasplante hepático se estimaron a partir de diversos estudios26,31. Las muertes por causa hepática fueron atribuidas a complicaciones hepáticas, excluyendo otras causas de fallecimiento. Además, el modelo contempló la posibilidad de muerte por causa no hepática, cuyas probabilidades fueron estimadas tras considerar los datos de mortalidad por cualquier causa32 y de mortalidad hepática33, ajustadas por edad para la población española.
UtilidadesCon objeto de incluir la calidad de vida relacionada con la salud en este tipo de pacientes, se aplicaron valores de utilidad obtenidos de la literatura para los diferentes estados de salud34. Las utilidades se representan en un intervalo de cero a 1, donde cero representa la muerte y 1 un estado de salud perfecta. Los valores de utilidad anual empleados reflejan los datos obtenidos mediante el cuestionario EuroQol 5 (EQ-5D) en una muestra representativa de población de Reino Unido34 (tabla 1).
CostesEn consonancia con la perspectiva del análisis, en el modelo únicamente se consideraron costes directos sanitarios (coste farmacológico y coste de manejo de la enfermedad en cada estado de salud).
Los costes farmacológicos de las 12semanas de tratamiento se calcularon en base a la posología recomendada: 400mg diarios de SOF, junto a 1.000mg o 1.200mg de RBV en función del peso de la población española (<75kg [43,8%] o ≥75kg [56,2%])35 y una dosis semanal de 180μg de Peg-IFN alfa-2a24. Los costes de SOF y Peg-IFN se estimaron a partir de los precios de venta laboratorio (PVL) publicados aplicando la deducción requerida por el Real Decreto 8/201036. Para el coste de RBV se seleccionó la RBV de menor precio. Los precios de fármacos se obtuvieron del Catálogo de Medicamentos del Consejo General de Colegios Oficiales de Farmacéuticos37.
Los costes de manejo de la enfermedad en cada estado de salud se obtuvieron de la literatura publicada para España38,39 y fueron actualizados a valores de 2014 con el IPC correspondiente40.
Todos los costes se expresan en euros (€), valores del 2014. En la tabla 2 se muestran los costes unitarios empleados.
Costes farmacológicos y por estados de salud
| Coste farmacológico | Coste semanal en € |
|---|---|
| SOF (Sovaldi®, 400mg/día)37 | 3.237,50 |
| PegIFN-2a (Pegasys®, 180μ/semana)37 | 177,07 |
| RBV genérica (1.000mg/día (<75kg)37 | 59,19 |
| RBV genérica (1.200mg/día (≥75kg)37 | 71,03 |
| Costes por estados de salud | Coste anual en € |
|---|---|
| Estadios F2-F338 | 241,92 |
| RVS desde estadios F2-F3a | 0,00 |
| Estadio F439 | 449,32 |
| RVS desde estadio F4a | 449,32 |
| Regresión de la cirrosisa | 0,00 |
| Cirrosis descompensada39 | 1.532,73 |
| Carcinoma hepatocelular39 | 7.019,17 |
| Trasplante hepático39 | 143.647,97 |
| Postrasplante hepático39 | 14.863,97 |
Estadio F2-F3: fibrosis leve-moderada; Estadio F4: cirrosis compensada; PegIFN: peginterferón alfa-2a; RBV: ribavirina; RVS: respuesta virológica sostenida; SOF: sofosbuvir.
Se aplicó una tasa de descuento del 3% anual tanto a costes como a resultados en salud41.
Análisis de sensibilidadSe realizaron análisis de sensibilidad determinísticos (ASD) univariantes y análisis de sensibilidad probabilístico (ASP) para evaluar la robustez del modelo y la incertidumbre de los resultados del caso base.
En el ASD se aplicó un rango de variación de los parámetros considerados más relevantes. Las probabilidades de transición (probabilidad de CC desde F2-F3, riesgo de CHC en pacientes con RVS desde estadios F2-F3 y regresión de la cirrosis en pacientes con RVS desde F4), los costes de manejo de la enfermedad y los valores de utilidad fueron modificados en un rango ±25%. Las tasas de RVS fueron modificadas con el valor superior e inferior del intervalo de confianza al 95% (IC 95%) comunicado en el estudio NEUTRINO24. También se exploró la influencia de valores alternativos de tasa de descuento anual (0% y 5%).
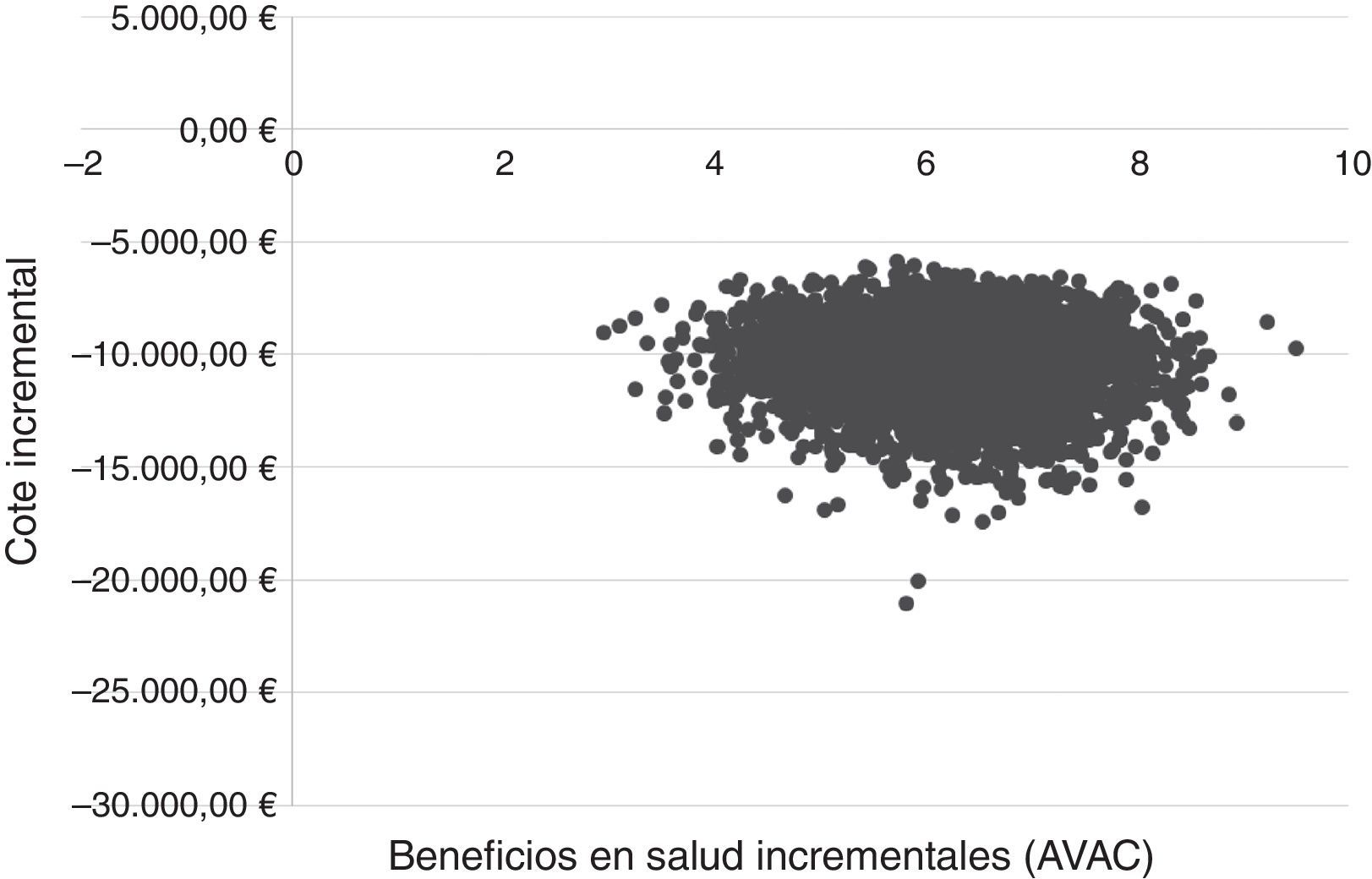
El ASP se realizó mediante 5.000 simulaciones de MonteCarlo, aplicando la distribución Dirichlet a las probabilidades de transición. Los valores de utilidades se modificaron mediante una distribución beta, y los costes de manejo de la enfermedad con una distribución gamma42.
La relación coste-efectividad incremental (RCEI) derivada de los resultados de costes y beneficios en salud de cada una de las 5.000 simulaciones realizadas se mostrarán gráficamente en un plano coste-efectividad43.
ResultadosCaso baseLa terapia con SOF/Peg-IFN/RBV en fases tempranas (F2-F3) generó 19,12 AVG y 14,14 AVAC, mientras que la terapia en fibrosis avanzada (F4) se asoció a 16,36 AVG y 9,27 AVAC. En términos de supervivencia, la estrategia de inicio de la terapia en pacientes infectados por VHC en fases tempranas resultó más efectiva que el inicio del tratamiento en fibrosis avanzada (tabla 3).
Resultados del caso base
| Terapia en fase temprana | Terapia en fibrosis avanzada | Diferencia incremental (fase temprana vs. fibrosis avanzada) | |
|---|---|---|---|
| AVG | 19,12 | 16,36 | 2,76 |
| AVAC | 14,14 | 9,27 | 4,87 |
| Coste total promedio | 43.263,44€ | 49.018,85€ | –5.755,41€ |
| Número de casos | Terapia en fase temprana | Terapia en fibrosis avanzada | Casos evitados (fase temprana vs. fibrosis avanzada) |
|---|---|---|---|
| Cirrosis descompensada | 38 | 104 | 66 |
| Carcinoma hepatocelular | 17 | 77 | 60 |
| Trasplante hepático | 1 | 5 | 4 |
Terapia en fase temprana (F2-F3); Terapia en fibrosis avanzada (F4).
AVAC: años de vida ajustados por calidad; AVG: años de vida ganados.
En la cohorte hipotética de 1.000 pacientes, la terapia con SOF/Peg-IFN/RBV en fases tempranas reduciría la incidencia de complicaciones hepáticas, resultando en la prevención de 66 casos de CD, 60 casos de CHC y 4 casos de trasplante hepático durante el periodo analizado, en comparación con el inicio de la terapia en fases de fibrosis avanzada (tabla 3).
Los costes totales estimados para la terapia en fases tempranas fueron menores que el coste total de la terapia en fases de fibrosis avanzada (43.263,44€ versus 49.018,85€) (tabla 3).
Con mayor efectividad y menor coste, la estrategia de inicio de la terapia en fases tempranas resultó una opción de tratamiento dominante respecto al inicio de la terapia en fases de fibrosis avanzada.
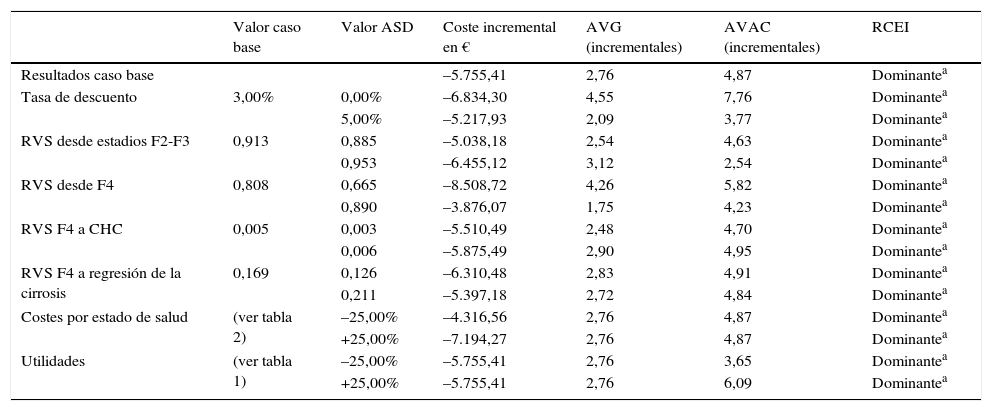
Análisis de sensibilidadEn los ASD, los parámetros con mayor influencia en los resultados fueron las tasas de RVS en cada estado de fibrosis, la tasa de descuento y los valores de utilidad. Cuando las tasas de RVS se modificaron con la misma proporción en ambos grupos, no se observaron diferencias respecto a los resultados del caso base, manteniéndose mayores beneficios en salud y mayores ahorros cuando la terapia se inicia en pacientes en fases tempranas respecto al inicio de la terapia en fibrosis avanzada. El aumento de la tasa de RVS de la terapia, cuando se administra en pacientes con fibrosis avanzada, supuso una reducción de las diferencias incrementales de la terapia en fases tempranas respecto a la administración en fases de fibrosis avanzada.
En el ASD realizado con las tasas de RVS comunicadas en el ensayo NEUTRINO (92,3% en pacientes F2-F3 y 79,6% en pacientes F4)24, se obtuvieron 5,04 AVAC, en lugar de los 4,87 AVAC en el caso base, al emplear las tasas de RVS estimadas para pacientes con GT1 (91,3% y 80,8%, para fases tempranas y fibrosis avanzada, respectivamente).
La terapia con SOF/Peg-IFN/RBV en fases tempranas resultó una opción dominante (más efectiva y con menor coste asociado) respecto a la terapia en fases de fibrosis avanzadas en todos los ASD realizados (tabla 4).
Resultados del análisis de sensibilidad determinístico (pacientes en fase temprana [F2-F3] vs. pacientes en fases avanzadas [F4])
| Valor caso base | Valor ASD | Coste incremental en € | AVG (incrementales) | AVAC (incrementales) | RCEI | |
|---|---|---|---|---|---|---|
| Resultados caso base | –5.755,41 | 2,76 | 4,87 | Dominantea | ||
| Tasa de descuento | 3,00% | 0,00% | –6.834,30 | 4,55 | 7,76 | Dominantea |
| 5,00% | –5.217,93 | 2,09 | 3,77 | Dominantea | ||
| RVS desde estadios F2-F3 | 0,913 | 0,885 | –5.038,18 | 2,54 | 4,63 | Dominantea |
| 0,953 | –6.455,12 | 3,12 | 2,54 | Dominantea | ||
| RVS desde F4 | 0,808 | 0,665 | –8.508,72 | 4,26 | 5,82 | Dominantea |
| 0,890 | –3.876,07 | 1,75 | 4,23 | Dominantea | ||
| RVS F4 a CHC | 0,005 | 0,003 | –5.510,49 | 2,48 | 4,70 | Dominantea |
| 0,006 | –5.875,49 | 2,90 | 4,95 | Dominantea | ||
| RVS F4 a regresión de la cirrosis | 0,169 | 0,126 | –6.310,48 | 2,83 | 4,91 | Dominantea |
| 0,211 | –5.397,18 | 2,72 | 4,84 | Dominantea | ||
| Costes por estado de salud | (ver tabla 2) | –25,00% | –4.316,56 | 2,76 | 4,87 | Dominantea |
| +25,00% | –7.194,27 | 2,76 | 4,87 | Dominantea | ||
| Utilidades | (ver tabla 1) | –25,00% | –5.755,41 | 2,76 | 3,65 | Dominantea |
| +25,00% | –5.755,41 | 2,76 | 6,09 | Dominantea |
ASD: análisis de sensibilidad determinístico; AVAC: años de vida ajustados por calidad; AVG: años de vida ganados; CHC: carcinoma hepatocelular; RCEI: relación coste-efectividad incremental; RVS: respuesta virológica sostenida.
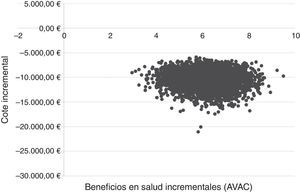
En el ASP, la estrategia de tratamiento con SOF/Peg-IFN/RBV en fases tempranas resultó dominante versus el tratamiento en fibrosis avanzada en el 100% de las simulaciones (fig. 2).
DiscusiónEn conocimiento de los autores, el presente estudio supone el primer análisis coste-efectividad que evalúa estrategias de decisión del inicio de la terapia con SOF/Peg-IFN/RBV en función del grado de fibrosis hepática de los pacientes (fases tempranas, F2-F3 versus fibrosis avanzada, F4).
Los resultados del análisis del presente estudio mostraron que el inicio del tratamiento en fases tempranas se asociaría con una disminución de la incidencia de desarrollo de CD, CHC y trasplante hepático. Estos hallazgos son consistentes con los comunicados en un estudio previo que sugiere que la reducción de la incidencia de desarrollo de complicaciones hepáticas se alcanza más fácilmente al tratar pacientes en fases tempranas de la enfermedad44.
Además, los resultados apoyan la hipótesis de que el tratamiento en fases tempranas respecto al tratamiento en fases avanzadas de la enfermedad se asocia con un incremento relevante de la esperanza de vida, así como de la calidad de vida de pacientes con HCC, debido a la prevención de la progresión de la enfermedad25.
La infección por VHC presenta un importante impacto económico debido a la carga económica que suponen los pacientes con HCC15. En este sentido, el presente análisis sugiere que la terapia con SOF/Peg-IFN/RBV en fases tempranas podría representar un menor coste que la terapia en fibrosis avanzada, generando importantes ahorros económicos al sistema sanitario.
La relación coste-efectividad de estrategias terapéuticas para la HCC ha sido evaluada en diversos estudios, en diferentes poblaciones (en pacientes naïve y en previamente tratados) con diferentes genotipos de VHC y en diferentes estados de la enfermedad. Sin embargo, son escasos los trabajos que han evaluado la eficiencia de terapias con SOF en función del grado de fibrosis y/o de la existencia de enfermedad avanzada11,31,45-50.
El presente análisis presenta, sin embargo, diferencias sustanciales respecto a los análisis coste-efectividad de terapias con SOF previamente publicados. La mayoría de estos estudios compara regímenes terapéuticos con SOF versus otras terapias para la HCC. Hasta el momento, este estudio es el primero que compara el impacto clínico y económico de la decisión de inicio de tratamiento con la triple terapia combinada de SOF/Peg-IFN/RBV, en función del grado de fibrosis hepática de los pacientes. La distinción entre fases tempranas, agrupando estados METAVIR F2 y F3, y fases de fibrosis avanzada (METAVIR F4) estuvo condicionada por la disponibilidad de datos clínicos comunicados en el ensayo NEUTRINO24.
En una de las evaluaciones económicas disponibles para España46, se evaluaron diversas opciones terapéuticas con SOF, incluyendo triple terapia con SOF/Peg-IFN/RBV, en pacientes naïve o pretratados, con diferentes genotipos de VHC. El análisis demostró que el RCEI de un régimen de 12semanas de duración con SOF/Peg-IFN/RBV versus terapia combinada se encontraba por debajo del umbral de eficiencia considerado por los autores (40.000€/AVAC). El estudio incluyó ASD, donde se exploró la influencia de una diferente distribución de los grados de fibrosis (F2, F3 y F4) en la cohorte analizada, pero no estableció comparaciones entre la misma opción terapéutica administrada en cohortes con distintos grados de fibrosis.
Las diferencias existentes en términos de metodología y diseño del presente modelo dificultan la comparación con otros análisis económicos. En cualquier caso, los resultados obtenidos coinciden con otras evaluaciones publicadas, en cuanto a la reducción de casos de complicaciones hepáticas51,52.
Las principales limitaciones del estudio se asocian a la ausencia de datos de utilidades en población española en la literatura científica, lo que requirió adoptar ciertas premisas. La ausencia particular de datos específicamente referidos a población española condicionó el uso de valores de utilidades obtenidos en una muestra de pacientes infectados con VHC en Reino Unido34. Sin embargo, se ha evidenciado que los valores del cuestionario EQ-5D en países de Europa Occidental (Alemania, España, Finlandia, Holanda, Reino Unido y Suecia) se rigen por un modelo común53. El ASD que se llevó a acabo modificando los valores de estos parámetros reveló un impacto importante del incremento o decremento de las utilidades en los AVAC ganados con la terapia en fases tempranas o la terapia en fibrosis avanzada.
El presente análisis no contempló la posibilidad de discontinuación o interrupción del tratamiento por falta de eficacia o aparición de efectos adversos, aunque los datos obtenidos en el ensayo NEUTRINO24 mostraron una pequeña tasa de discontinuación (2%) en todos los pacientes. En práctica clínica, la tasa de discontinuación podría ser mayor en pacientes con fases avanzadas de la enfermedad, que en aquellos con fases tempranas, lo que tendría cierto impacto en los resultados de coste farmacológico proporcionados por el presente modelo. Esta potencial disminución del coste farmacológico no lograría, sin embargo, compensar los costes adicionales asociados al mayor riesgo de desarrollo de complicaciones hepáticas que tienen estos pacientes, dado que el grado de progresión de la enfermedad hepática supone un incremento del consumo de recursos sanitarios que se traduce en mayores costes54.
A pesar de las limitaciones descritas y las premisas adoptadas, los resultados de los análisis de sensibilidad confirmaron que la incertidumbre asociada a los parámetros no supuso una desviación importante respecto a los resultados obtenidos en el caso base, lo que avala la conclusión de que la estrategia de inicio de la terapia en fases tempranas es una opción más eficiente que la estrategia de inicio de la terapia en fibrosis avanzada. En los ASD, la variación individual de cada uno de los parámetros tuvo poco impacto en los resultados. El ASP confirmó además la robustez de los resultados del caso base.
Hay que señalar que en el último año han surgido nuevas terapias libres de IFN que mejoran cada vez más las tasas de RVS, lo que ha causado que el tratamiento con SOF/Peg-IFN/RBV no sea considerado como terapia de elección en algunos subgrupos de pacientes. Independientemente de lo anterior, el objetivo del análisis se enfocó en demostrar la eficiencia del tratamiento en estados precoces frente a estados avanzados. Los resultados obtenidos avalaron que la administración en fases precoces evita la evolución de la enfermedad y, con ello, el desarrollo de complicaciones hepáticas e incluso el trasplante hepático, lo que podría ser extrapolable a la hora de elegir el momento idóneo de inicio de tratamiento con las nuevas terapias disponibles.
La presente evaluación económica demostró la eficiencia del inicio de la terapia con SOF/Peg-IFN/RBV en pacientes naïve con VHC GT1 en fases tempranas de la enfermedad, comparada con la administración de la terapia en pacientes con fibrosis avanzada. La decisión de tratamiento en fases tempranas incrementó la supervivencia de los pacientes y evitó el desarrollo de casos de cirrosis y otras complicaciones hepáticas.
Conflicto de interesesMaria Buti es asesor de Gilead Sciences, Bristol Myers Squibb, MSD y Novartis.
Raquel Domínguez-Hernández, Itziar Oyagüez y Miguel Ángel Casado son trabajadores de Pharmacoeconomics & Outcomes Research Iberia, una consultora especializada en evaluación económica de intervenciones sanitarias que ha recibido una financiación no condicionada de Gilead Sciences.