Como uno de los más grandes logros de la medicina se encuentra la comprensión de la infección por el virus del papiloma humano (VPH) y su relación causal con algunos tipos de cáncer. La mayoría de las personas con infecciones por este virus no presenta síntomas, por lo que puede pasar inadvertida y haber sido limitada por el hospedero. Es importante tomar en cuenta que en menos de 10% de los pacientes se presenta una infección persistente, la cual puede derivar en el desarrollo de malignidad. El VPH requiere de una lesión o bien, situarse en un área de transición de epitelios, como la que existe en el cuello uterino, ano o amígdalas, para poder infectar las células. Los genotipos del VPH que afectan las mucosas, se transmiten por vía sexual y se clasifican como de bajo y alto riesgo. Los genotipos de alto riesgo se asocian con cáncer cervicouterino (CaCu), vulvar, vaginal, pene, ano y con tumores orofaríngeos. Se considera y es aceptado que hasta 25% de las personas sexualmente activas se infectan por VPH genital y que más de 50% se infectará por lo menos una vez a lo largo de su vida.
Una parte esencial del manejo de las infecciones por VPH es la prevención por lo que las vacunas representan una herramienta valiosa. La vacuna tetravalente contra el VPH está disponible desde el 2006 y la literatura considera muy importante el grado de protección que ofrece contra verrugas genitales y CaCu.
One of the greatest achievements of medicine is the understanding of the infection from human papillomavirus (HPV) and its causal relation to some types of cancer. Most people with HIV infections have no symptoms, so it may go unnoticed and the infection is limited by the host. It is important to note that less than 10% of patients have a persistent infection, which can lead to the development of malignancy. HPV requires a small tissue damage placed in a transitional area of epithelia, such as the existent in the cervix, anus or tonsils, to infect cells. The genotypes of HPV that affect the mucous membranes are sexually transmitted and are classified as low and high risk. The high-risk genotypes are associated with cervical cancer, vulvar, vaginal, penile, anal and oropharyngeal tumors. It is accepted that up to 25% of sexually active people are infected with genital HPV and more than 50% will be infected at least once during their lifetime.
An essential part of managing HPV infections is prevention so that vaccines represent a valuable tool. The quadrivalent vaccine against human papillomavirus is available since 2006 and the literature considers it as a very important implement, due to the degree of protection provided against genital warts and cervical cancer.
Generalidades
Los virus del papiloma humano (VPH) son miembros de la familia Papillomaviridae. Las partículas virales son pequeñas y contienen una cadena de ADN de doble hebra. Existen más de 200 genotipos descritos, de los que cerca de una tercera parte tienen como objetivo infectar las mucosas del hospedero1,2. Pudo observarse por primera vez en 1950, en imágenes obtenidas con microscopio electrónico en muestras de papilomas de piel2.
Los virus de la familia Papillomaviridae fueron clasificados inicialmente como una subfamilia de los Papovaviridae en 1962, pero se reclasificaron en 2002 como una familia independiente. Esta familia contiene 29 géneros, de los cuales 5 pertenecen al papiloma humano2. Se identificaron las clases de los 2 primeros serotipos, VPH1 y VPH2 en 1977 y se completó la secuencia genómica del VPH1 en 19822.
Uno de los más grandes avances de la ciencia médica ha sido el mayor entendimiento y comprensión de la historia natural de la infección por VPH3. La mayor parte de las infecciones causadas por el VPH no causan síntomas en la mayoría de las personas, por lo que pueden pasar incluso inadvertidas y combatidas por el hospedero. No obstante, algunos genotipos virales pueden causar cáncer cervicouterino (CaCu), vulvar, vaginal, peneano, anal y orofaríngeo3. Sin embargo, en una gran proporción de casos, la infección por VPH se autolimita y en menos de 10% de los pacientes se presenta una infección persistente1.
El VPH tiene la particularidad de requerir una microabrasión o un área de transición de epitelios, como la que existe en el cuello uterino, ano o amígdalas, para poder infectar las células3. La infección se presenta en los queratinocitos basales del epitelio escamoso estratificado y el virus se replica en el núcleo de las células infectadas, además de interferir en la diferenciación de estas mismas células2.
Los genotipos del VPH que afectan las mucosas, por lo regular se transmiten por vía sexual y se pueden subdividir entre bajo y alto riesgo. Los de alto riesgo se asocian con CaCu, vulvar, vaginal, pene, ano y con otros tumores orofaríngeos1. Más de 40 genotipos pueden propagarse por contacto directo durante el sexo vaginal, anal y oral4. Se considera y es aceptado que hasta 25% de las personas sexualmente activas se infectan por VPH genital hacia los 21 años de edad1. También se estima que más de 50% se infectará al menos una vez a lo largo de su vida1, y que alrededor de 7% de los adultos tienen infecciones orales por VPH5,6.
Al realizar un análisis por género se puede observar una cifra global que señala que en cualquier momento de su vida, 42.5% de las mujeres tienen infección genital por VPH5.
Cuando se utilizan estudios de diagnóstico molecular se ha demostrado la presencia de VPH hasta en 80% de las mujeres sexualmente activas, las cuales cursan completamente asintomáticas. En mujeres, el pico de incidencia de infección es en pacientes menores de 24 años. También se ha observado otro pico de incidencia en algunos países, después de los 45 años de edad1.
El descubrimiento del virus
La transmisión sexual, como un factor de riesgo para el desarrollo de CaCu, fue descrita desde 1842 por Domenio Rigoni-Stern, mientras que el origen infeccioso de las verrugas fue establecido en 1907 por Giussepe Ciuffo; no fue sino hasta 1983 que se relacionó la infección por VPH como una causa de CaCu, momento en el cual el ADN del VPH16 fue aislado en cerca de 60% de las muestras de tejido que Herald zur Hausen y su equipo de investigadores habían examinado2.
Harold zur Hausen es el investigador merecedor del premio Nobel por ser el pionero en la investigación de los VPH relacionados con cáncer. Antes de que zur Hausen y colaboradores en su laboratorio de Alemania, descubrieran y aislaran los virus oncógenos se sospechaba más del virus del herpes simple tipo 2 (HSV-2) y pocos científicos apoyaban la teoría de zur Hausen. Pocos años después, la hipótesis del virus herpes simple 2 se descartó, pues no logró identificarse su genoma en la mayoría de los tumores cervicouterinos7.
Para analizar su hipótesis, zur Hausen inició una gran búsqueda de VPH en cualquier tipo de lesiones cervicales. A finales de la década de 1970, se contaba ya con la tecnología de ADN, que se utilizó para aislar el genoma de los VPH identificados en las verrugas. Mediante ensayos de hibridación y restricción demostraron que los virus que aislaron de las diferentes muestras clínicas no eran todos idénticos, así que se procedió a clasificarlos por tipos en 1, 2, 3, 4 y así de forma sucesiva, según se iban descubriendo nuevos subtipos del virus7.
En 1980, con el ADN del VPH1 como sonda, Lutz Gissman (profesor asociado en el laboratorio de zur Hausen), identificó y aisló el genoma del VPH6 de un condiloma acuminado y con la sonda del mismo virus descubrió el VPH11 en un papiloma laríngeo. El punto decisivo ocurrió en 1983, cuando Dürst, Gissman y otros colaboradores de zur Hausen aislaron el VPH16 y un año después el VPH18, a partir de muestras de CaCu. Más adelante se demostró que 60% a 70% de las mujeres con CaCu presentaba estos 2 tipos virales7.
Esta fue la primera evidencia experimental sólida de la asociación del VPH con el CaCu. De esta forma, se fortaleció la hipótesis del VPH como agente causal del CaCu y creció en gran medida el interés por la investigación entre este virus y otras neoplasias genitales. Al continuar con la investigación, el grupo de zur Hausen descubrió otros tipos virales y mecanismos moleculares en los que los VPH participan en la carcinogénesis7.
Gissman, como investigador del grupo de zur Hausen, participó en la búsqueda de los mecanismos de la respuesta inmunitaria del huésped contra el VPH y las células tumorales. Aunque en ese momento no se trabajó directamente en el desarrollo de una vacuna, sus observaciones han sido de gran utilidad puesto que sentaron las bases para el uso eficaz de los viruslike particles (VlP), que son viriones vacíos, sin genoma viral, producidos en forma recombinante en el laboratorio7.
Mecanismos genéticos virales de la infección
Como ejemplo de los descubrimientos mencionados anteriormente, en 1985 se observó que en la mayoría de las mujeres con CaCu, el virus había integrado su genoma al del hospedero, preservando siempre los oncogenes E6 y E7, con pérdida o interrupción del gen E2. Esto es importante debido a que en las lesiones preinvasoras del cuello uterino, el genoma viral se encuentra en forma episomal (circular), esto es, fuera del genoma celular y con el gen E2 completo. Este último inhibe la actividad de los oncogenes virales, por lo que el rompimiento del gen E2 durante la integración se considera un fenómeno indispensable para la activación de los oncogenes virales y con ello, la evolución tumoral de las lesiones preinvasoras a cáncer invasor7.
El VPH tiene la capacidad de estimular de forma continua el crecimiento tumoral, lo que favorece que en un periodo habitualmente largo se generen mutaciones al azar en el genoma celular, con la esperable consecuencia de que algunas de ellas le confieran mayor capacidad oncógena a la célula neoplásica. Con base en datos experimentales generados desde los trabajos de zur Hausen, se ha postulado que para que se evolucione a un fenotipo invasor, se requiere una pérdida sucesiva de distintos genes supresores tumorales7.
El profesor zur Hausen, Gissmann y su grupo cedieron las sondas de los VPH6, 11, 16 y 18, y diversos grupos de investigación en todo el mundo descubrieron otros subtipos, lo cual permitió un rápido avance para entender cómo los virus causan el cáncer; con estos datos se inició el desarrollo de vacunas. Hoy día, se considera que 5% de los tumores en humanos se relacionan con el VPH7.
Variedades de VPH
Los VPH son un grupo heterogéneo de agentes infecciosos que colonizan tejidos epiteliales y que se han relacionado con diversas enfermedades neoplásicas7,8. Todos los VPH tienen estructura y organización genética similar; están compuestos por una molécula de ADN circular de doble hebra, de 8,000 pares de bases y una cápside icosaédrica compuesta de 72 capsómeros formados por 2 proteínas estructurales, sin envoltura nuclear. El ADN viral tiene 8 genes, de los cuales 6 codifican para proteínas tempranas (E) y 2 para proteínas tardías (L). Las proteínas E5, E6 y E7 participan en la transformación neoplásica, mientras que la E1 y E2 en la replicación del genoma viral; E2 también regula la expresión de los genes tempranos y reprime la expresión de los oncogenes E6 y E77,9. Los genes L1 y L2 codifican para las proteínas de la cápside. Además de estos genes, el genoma viral tiene una región de 800 pares de bases conocida como región reguladora, que contiene diversos elementos de regulación de la transcripción y de la replicación del virus7,9.
Esta familia tiene alrededor de 200 genotipos, muchos de los cuales producen verrugas benignas o papilomas, mientras que una pequeña parte de ellos son oncógenos o clasificados como de alto riesgo puesto que producen tumores invasivos del cuello uterino, entre otros tipos de cáncer2,8,10,11. Los tipos 16 y 18 se asocian con el CaCu7,11,12 y, los 6 y 11 con lesiones benignas, como el condiloma acuminado1.
Los virus de bajo riesgo, como los VPH6, 11, 40, 42, 43, 44, 54, 61, 72 y 81, se asocian con el condiloma acuminado, la neoplasia intraepitelial de bajo grado y las infecciones asintomáticas1,2. Se han identificado 15 tipos virales de alto riesgo (oncógenos) asociados con el CaCu y con la neoplasia intraepitelial cervical de alto grado, los más comunes son los VPH16, 18, 31, 33, 35, 39, 45, 52, 56, 58 y 591,2,12,13.
Se considera que el VPH afecta hasta 20% de la población; la incidencia de la infección varía dependiendo del tipo de VPH y del grupo de edad de la población que se observe. En términos generales se puede clasificar en 2 grandes grupos que son infección cutánea o de mucosa, dependiendo del sitio anatómico en que se encuentre la lesión1.
Respecto a la infección de mucosas, existen patrones que se han observado claramente relacionados con el género, edad y genotipo del VPH. Este tipo de infección afecta a 10.4% de la población femenina, alrededor del mundo. Debe aclararse que esta prevalencia varía entre y dentro de las distintas poblaciones1. Casi la mitad de los virus infecta los conductos genitales y el resto produce verrugas no malignas, entre otras lesiones en la piel y las mucosas no genitales1,7.
Tipos virales con mayor potencial oncógeno
Cuando se ajusta por edad, el CaCu, en mujeres de todo el mundo, es el segundo tipo de cáncer más frecuente. La incidencia ajustada por edad es de 8.1 por cada 100,0001.
Después del CaCu, el cáncer anal es el siguiente tipo de cáncer más frecuente, asociado con el VPH. Se estima que 90% de los casos están asociados con el virus, en particular los tipos 16 y 18 son los genotipos predominantes en el cáncer anal1.
Como se mencionó anteriormente, hasta 70% de los casos de infección se autolimitan después de un año y 90% al cabo de 2 años, pero cuando la infección es causada por uno de los genotipos de alto riesgo, hay una alta probabilidad de que se desarrollen lesiones premalignas, que posteriormente progresarán a carcinoma invasor3.
La infección por tipos oncógenos del VPH es la causa principal de la neoplasia intraepitelial cervical. El riesgo de progresión de lesiones de bajo grado a lesiones de alto grado parece ser mayor en pacientes con infección persistente por tipos oncógenos de VPH y valores altos de carga viral13,15.
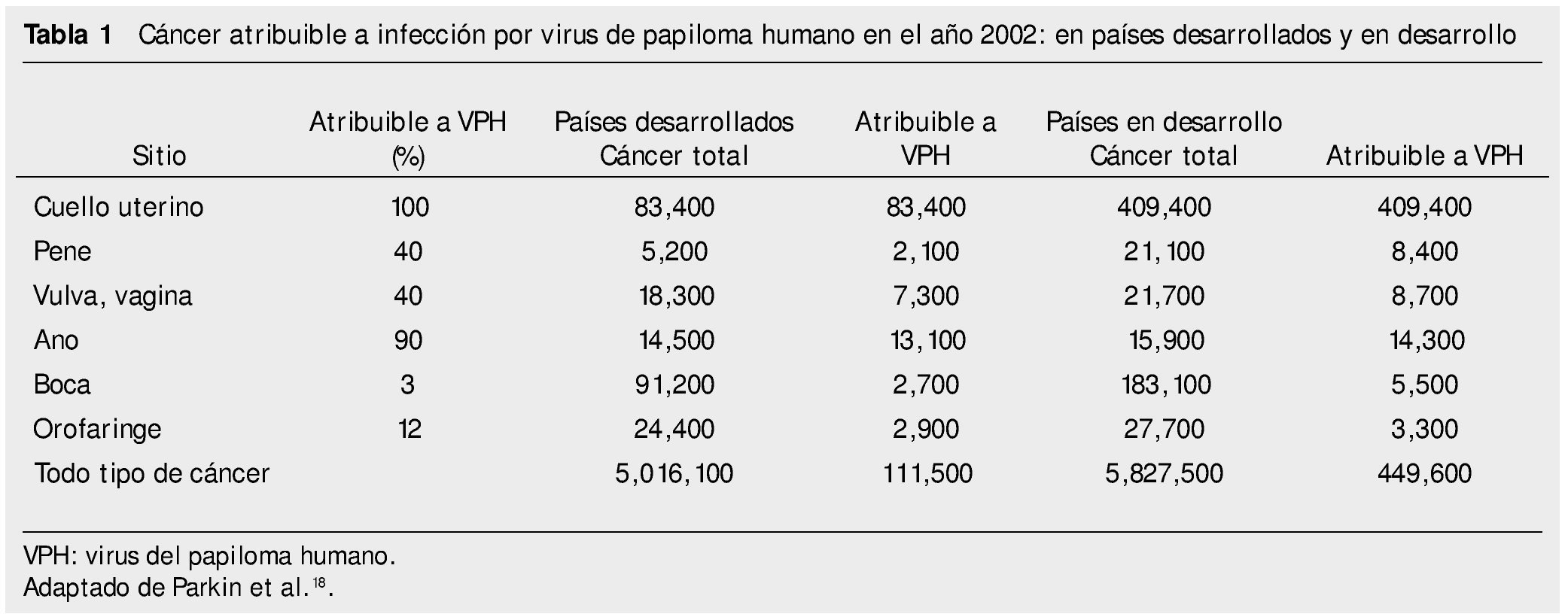
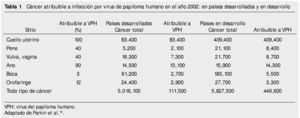
Las variantes genéticas del VPH difieren entre sí hasta en 2% de su genoma, y algunos de estos se han relacionado con lesiones más avanzadas o tipos histológicos de comportamiento más agresivos13,14. La incidencia de CaCu tiene una variación endémica importante como lo demuestra el hecho de que en diferentes regiones y países puede relacionarse con una distribución específica de variantes virales (tabla 1). Por ejemplo, las variantes del VPH16 tienen distribución distinta entre los 5 continentes. Las variantes asiático-americanas se encuentran principalmente en México, Centro, Sudamérica y España; las variantes africanas en África; las asiáticas en el sudeste de Asia y las variantes europeas en todas las regiones, excepto en África7,16.
Se conocen variantes virales para los VPH18, 33, 45, 52, 53, 58 y 66, entre otros7,16 y en México se han detectado variantes del VPH18, 31, 35 y 45, algunas de ellas asociadas con tipos histológicos de CaCu, cuyo comportamiento es más agresivo14,17. De forma reciente se descubrió en México la variedad asiático-americana (compuesta por subclases asiático-americanas en América del norte y asiático-americanas de Centroamérica) 17 del VPH16, detectada en cerca de 25% de las mujeres mexicanas con CaCu; su prevalencia es nula o muy baja en el resto del mundo. Las variantes de otros tipos del virus se han estudiado poco o aún no se investiga la mayor parte de ellas7,16.
Pocos estudios se han ocupado de la relación de las infecciones cervicales con tipos específicos del VPH y el grado de anormalidades citológicas14. Los resultados de un estudio indicaron que los valores de carga viral varían entre los diferentes tipos de VPH. Esto se basa en los valores de carga viral por equivalente de células observadas por infecciones únicas por VPH (VPH16, 31, 52 y 58). Para infecciones múltiples por VPH, los valores de carga viral parecieron ser menores que en las infecciones de tipo simple. El tamaño de la muestra de este estudio no permitió evaluar la asociación de tipos de VPH en forma individual, aunque cuando se analizaron los tipos agrupados de VPH oncógenos, se observó una asociación significativa con el aumento de la gravedad de las lesiones. En otro estudio se encontró un mayor riesgo de desarrollar CaCu invasor conforme aumentaban los valores de carga viral19. En este estudio prospectivo, los autores descubrieron cocientes de posibilidades muy similares para VPH16 a los valores que registró el estudio anteriormente citado y que también demostró que la carga viral elevada (cuantificada por la captura de híbridos) fue un factor asociado de forma independiente con los resultados histológicos. La captura de híbridos es principalmente informativa puesto que es semicuantitativa y no puede discriminar entre diferentes tipos de VPH oncógenos que influyen en la carga viral. Para estudiar más a fondo la asociación de VPH carga viral y el grado de las lesiones cervicales, se evaluó el número de copias de VPH absoluta de tipo específico mediante RT-PCR en las mujeres participantes en el estudio frontera Estados Unidos-México20.
Aunque parece haber una asociación entre la carga viral de VPH16 y el resultado citológico, estudios recientes sugieren que la carga viral puede no ser un predictor adecuado de carcinoma cervical21,22. Sherman et al. Estudió el efecto de las lesiones de bajo grado en la mucosa que rodean una lesión de alto grado y concluyó que la carga viral del tejido circundante limita la interpretación clínica de la carga viral, lo que funciona como un determinante del riesgo de desarrollar malignidad cervical21. Por lo tanto, lograr definir la importancia de la carga viral como una herramienta de pronóstico para determinar la regresión, progresión o perfil de recurrencia de la infección por VPH está limitada por diversos factores. La falta de homogeneidad en las mediciones de carga viral y la subjetividad del diagnóstico citológico dificulta la comparación entre los diferentes estudios y no permite lograr un consenso respecto a la utilidad de la carga viral21. El mecanismo subyacente de la carga viral y las lesiones cervicales es incierto. Se desconoce si al aumentar el número de copias, se produce en forma simultánea un aumento en la expresión de la proteína viral23. Hoy día, no se conoce la alteración específica de las funciones celulares entre diferentes tipos de VPH oncógenos que pueden inducir lesiones cervicales. Dadas las diferencias filogenéticas y polimorfismos dentro del genoma del VPH, es plausible que las oncoproteínas del VPH específicas de cada tipo difieran en su afinidad por sus respectivas proteínas celulares específicas. Por ejemplo, in vitro, la oncoproteína E6 de alto riesgo se une más fuertemente a p53 en comparación con la oncoproteína E6 de bajo riesgo24. También se ha sugerido que las características específicas del ciclo productivo para VPH16 se correlacionan con la gravedad de la progresión de las lesiones cervicales25.
Vacunas contra el VPH
Las vacunas son actualmente consideradas uno de los milagros de la medicina moderna26; dado que el CaCu en la mujer y las verrugas genitales en ambos géneros, guardan estrecha relación con infecciones por el VPH1, se han desarrollado 2 vacunas altamente inmunogénicas. Una es cuadrivalente contra el VPH6, 12, 16 y 18, y otra es contra los tipos 16 y 1826.
En vista de que una parte fundamental en el manejo de las infecciones por VPH es el aspecto preventivo, las vacunas representan una opción extraordinaria. La vacuna tetravalente contra el VPH está presente desde el 2006 y la literatura considera como excelente el grado de protección que ofrece, además de que protege contra verrugas genitales y CaCu26.
Las características particulares de las vacunas contra el VPH son:
a. Vacuna tetravalente VPH6, 11, 16 y 18. Se prepara mediante una proteína recombinante sintetizada en levaduras y se administra también con un compuesto alumínico convencional. El esquema de vacunación es con fecha 0, 2 y 6 meses después de la dosis inicial27.
b. Vacuna bivalente VPH16 y 18. Sintetizada mediante un sistema de expresión celular de un baculovirus, combinado con un compuesto de aluminio más lípido A monofosforilado (AS04), que permite la protección e inducción de altos y prolongados títulos de anticuerpos, además de un aumento de la inmunidad mediada por células. Su protocolo de administración es la aplicación de una dosis con fecha 0, 1 y 6 meses, después de la dosis inicial27.
En las mujeres sin infección previa ni actual por los genotipos de VPH presentes en esas vacunas, ambas proporcionan una protección > 90% frente a la infección persistente por VPH durante periodos de hasta 5 años tras la vacunación (el máximo tiempo de seguimiento en los estudios realizados). El mayor impacto debería obtenerse con la vacunación de las mujeres antes de la edad de exposición a los VPH. Como las vacunas anti-VPH no eliminan el riesgo de CaCu, siguen siendo necesarias pruebas de detección de esta neoplasia para reducir al mínimo su incidencia27.
Un mes después de la tercera dosis de la vacuna contra VPH, cerca de 100% de las mujeres con edades entre 15 a 26 años, presentan anticuerpos detectables para cada genotipo del VPH, en concentraciones de 12 a 26 veces más altas que aquellas que se registran en pacientes sin infección previa28.
Se ha encontrado que las respuestas de anticuerpos tanto de la vacuna para la hepatitis B (recombinante) y la vacuna cuadrivalente para VPH son similares, ya sea que se administren en la misma visita o en distintas visitas29.
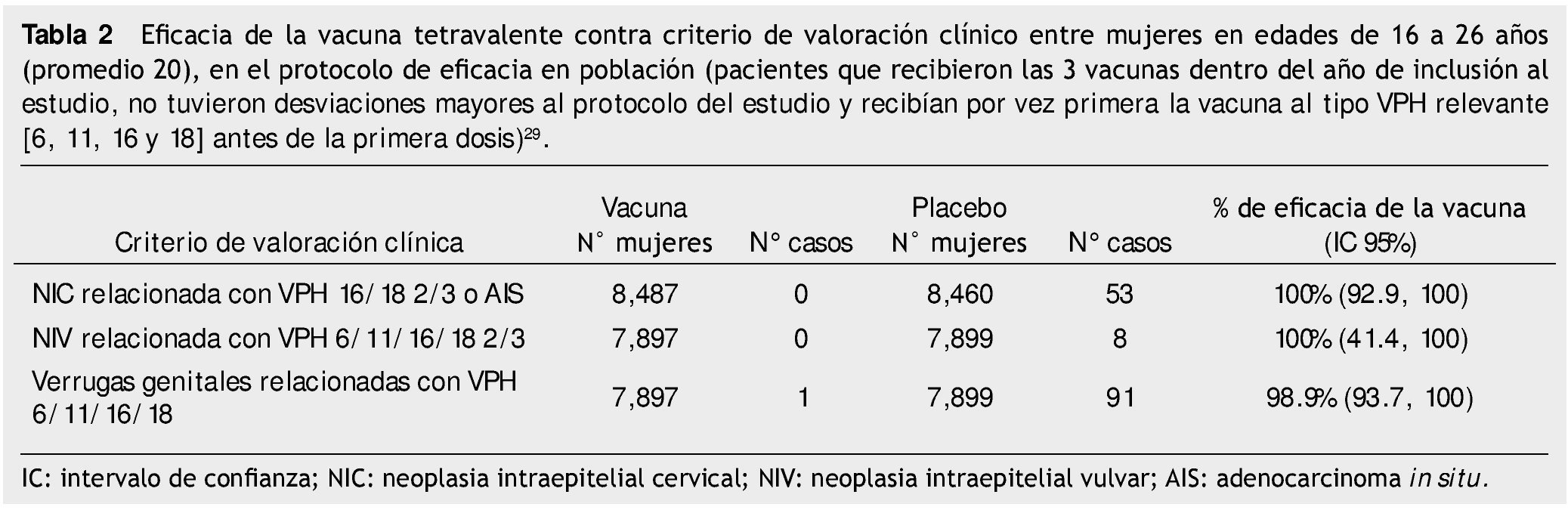
Las vacunas actualmente disponibles han demostrado una eficacia > 90% en contra de la infección persistente debida a genotipos 16 o 18, en mujeres que recibieron 3 dosis29-31. Para la vacuna bivalente, ensayos en fase II han mostrado 0 casos de neoplasia intraepitelial cervical (NIC) relacionada con tipos 16 y 18 entre 481 mujeres vacunadas y 5 casos entre 470 mujeres del grupo placebo, para una eficacia de 100% (IC 95%=-7.7,100)31. Para la vacuna tetravalente, la tabla 2 muestra los resultados con una media de 1.5 años posteriores a la vacunación.
Debido al largo periodo necesario para la formación de cáncer cervical invasor, el mejor marcador de la eficacia de las vacunas destinadas a la prevención de esta patología es el desarrollo de alteraciones citológicas. La neoplasia intraepitelial cervical fue designada por la FDA como un marcador sustituto eficaz para estudios clínicos y es el desenlace clínico primario en todos los estudios de eficacia que analizan las vacunas destinadas al cáncer cervical. Sin embargo, la evaluación de NIC 1 no es un marcador de la prevención de cáncer, ya que inequívocamente se resuelve con el tiempo. Las lesiones NIC 2 y especialmente las NIC 3 sirven como marcadores más factibles para la prevención de cáncer, ya que su progresión a cáncer es más probable29.
Factores determinantes y cofactores del CaCu
Estudios realizados con técnicas de biología molecular de alta sensibilidad y con muestras biológicas adecuadas detectan al VPH de alto riesgo en prácticamente todos los casos de carcinoma escamoso de cuello uterino. Las lesiones intraepiteliales escamosas de alto grado (HSIl) se detectan en 70%-90% de los casos y las lesiones intraepiteliales escamosas de bajo grado (LSIL) en un 50%-70%. La detección de células epiteliales escamosas de significado incierto (ASCUS) es cercana a 50%17.
La asociación observada entre VPH y CaCu se considera entre las más consistentes de las identificadas en cancerología humana y hay un consenso creciente en calificarla como causa necesaria, aunque insuficiente, ya que no todas las infecciones por VPH persisten o progresan a carcinoma del cuello uterino4,32,33. Los factores determinantes que se conocen para que esta progresión ocurra, son:
1. Dependientes del virus:
• Tipo viral (genotipo)34.
• Persistencia de la infección en exámenes repetidos.
• Carga viral por unidad celular (factor probable).
2. Ambientales:
• Anticoncepción hormonal oral. El uso de hormonas durante 5 años o más se asocia de forma significativa con la neoplasia cervical34.
• Paridad. Se ha observado una asociación positiva que se comporta de forma lineal, a mayor número de embarazos a término, mayor es el riesgo. Este factor junto con el anterior, sugieren una asociación positiva entre VPH y hormonas esteroideas34.
• Tabaquismo. Se ha encontrado mayor riesgo de carcinoma en pacientes fumadoras, aunque no se conoce bien la dinámica de esta interacción34.
• Edad de inicio de la vida sexual activa. Es un factor de riesgo conocido. La prevalencia de VPH más alta comprende las edades inmediatas al inicio de las relaciones sexuales y responde a los patrones de comportamiento sexual de la comunidad35. El grupo de edad en el que ocurre el pico de contagio es el que incluye a pacientes de hasta 24 años. El riesgo acumulado a 3-5 años es mayor a 40%. Después de este pico, sigue una disminución marcada, que se comporta de forma lineal con la edad1.
En algunas poblaciones se ha observado un segundo pico de prevalencia en mujeres posmenopáusicas, postulándose que quizá representa la reactivación de una infección latente que se asocia a la reducción fisiológica de la inmunidad natural con la edad1.
• Coinfecciones. Chlamydia trachomatis parece ser un cofactor que actúa por inducción de inflamación crónica y metabolitos mutágenos36,37. El herpes simple tipo 2 también parece actuar como cofactor, con una evidencia algo más dudosa35.
• Deficiencias nutricionales34.
• Conducta sexual de la población. El contagio por el virus se produce por contacto directo. Los lugares más susceptibles de invasión viral son aquellos donde se producen procesos de rápida replicación y diferenciación celular, como la zona de transformación escamo-columnar del cuello uterino (más activa aún en mujeres jóvenes) y la línea pectínea anal, por lo que son sitios de mayor frecuencia para el desarrollo de displasias y neoplasias. Se ha considerado que el uso de condón es un factor protector, aunque no de forma total, ante el contagio y adquisición de lesiones precursoras38. Al parecer la circuncisión masculina también puede ser un factor protector39.
• El VPH además se relaciona con el cáncer de vulva. Este tipo de cáncer responde a 2 modelos etiológicos. El primero ocurre en mujeres menores de 50 años, está ligado a infección por VPH y cursa con lesiones precursoras como neoplasia vulvar intraepitelial de alto grado (NIV II-III). El segundo tipo se produce en mujeres mayores de 50 años, es independiente de la infección viral y no cursa con lesiones precursoras. La fracción de casos atribuible al VPH es de aproximadamente un 50%40.
• Es importante remarcar el papel del virus de la inmunodeficiencia humana (VIH), como muestran los estudios en los que se detectó que en mujeres VIH positivas el riesgo de infección por VPH de alto y bajo riesgo sería de entre 1.8 y 2.7 veces superior, con una persistencia 1.9 veces mayor41.
• Finalmente, se ha calculado que la prevalencia de VPH en mujeres dedicadas a la prostitución es de 48% en Japón, de 50% en México y de 61.6% en españa42,43.
Conclusiones
El VPH constituye hoy una seria amenaza para la salud en todo el mundo, ya que se le relaciona directamente con el desarrollo del CaCu. Esta infección, transmitida principalmente por contacto sexual, afecta a ambos géneros y representan una de las alteraciones más frecuentes de este tipo. La interrelación que guardan con el desarrollo de cáncer ha sido investigada por diversos autores, quienes han concluido que los tipos 16 y 18, son aquellos que se asocian indudablemente con el CaCu. Las variantes genéticas del VPH difieren entre sí hasta en 2% de su genoma, pero se ha determinado que algunos tipos se relacionan con lesiones más avanzadas o tipos histológicos más agresivos, aunque se desconoce la alteración específica de las funciones celulares entre los diferentes tipos de VPH oncógenos.
El desarrollo de las vacunas específicas en contra del VPH vino a dar una luz de esperanza para la prevención (por desarrollo consecutivo) del CaCu, que hoy día ocupa uno de los primeros lugares como causa de mortalidad en todo el mundo. Tanto la vacuna bivalente como la tetravalente, han demostrado una elevada eficacia como herramientas preventivas en contra de este tipo de cáncer. En ensayos clínicos diversos se ha comprobado, por ejemplo, que la vacuna tetravalente evita hasta 100% de las lesiones cervicales precancerosas moderadas y graves asociadas a los tipos 16 y 18, en pacientes no infectadas previamente por estos tipos de VPH.
Analizando los factores y cofactores del CaCu, la aplicación sistemática de la vacuna contra VPH representa, fehacientemente, la mejor opción preventiva contra este agresivo padecimiento. En números subsiguientes seguiremos comentando otros aspectos del VPH.
Conflicto de intereses
El autor declara no tener ningún conflicto de intereses.
Financiamiento
El autor no recibió patrocinio para llevar a cabo este artículo.
* Autor para correspondencia:
Av. San Fernando N° 22, Colonia Sección XVI, Delegación Tlalpan,
C.P. 14080, México D.F., México.
Correo electrónico: ochoacarrillo@prodigy.net.mx (Francisco Javier Ochoa-Carrillo).