Los tumores neuroendocrinos son poco frecuentes, pero su incidencia está aumentando gradualmente. En el presente estudio se evaluaron las características demográficas y tumorales, el tipo de tratamiento, las tasas de respuesta y la supervivencia de pacientes con tumores neuroendocrinos. Cuarenta y dos pacientes con diagnóstico de tumor neuroendocrino de un centro de tercer nivel fueron evaluados retrospectivamente. La supervivencia global y la supervivencia libre de progresión fueron calculadas por el método de Kaplan-Meier.
No encontramos diferencias en cuanto al género; la media de edad fue de 62 años. El sitio primario más común fue el estómago (26%), seguido por pulmón (21%). Se encontró síndrome carcinoide en un 14% de los pacientes. El 43% presentaba enfermedad localizada al momento del diagnóstico y la tasa de resección quirúrgica fue del 59.5%. En el 100% de los pacientes se realizó inmunohistoquímica para cromogranina y el 50% de los pacientes tenía por patología un grado 2. Al 62% se le ofreció tratamiento con análogos de la somatostatina, en tanto que al 14% se le administró quimioterapia con un esquema basado en cisplatino/etopósido. La mediana de supervivencia global en los tumores primarios gástricos fue de 30 meses, en tanto que para los primarios de pulmón fue de 23.5 meses.
Neuroendocrine tumours are rare, but their incidence is gradually increasing. In this study, the demographic and tumour characteristics, treatment modalities and response rates, and survival rates were assessed in patients with neuroendocrine tumours. Forty-two patients with neuroendocrine tumours from a tertiary care centre were retrospectively assessed. Overall survival and progression-free survival rates were estimated using the Kaplan–Meier method.
No differences were found in terms of gender. The median age was 62 years. The most common primary site was the stomach (26%), followed by lung (21%). Carcinoid syndrome was found in 14% of patients. Forty-three percent had localised disease at diagnosis, and surgical resection rate was 59.5%. In 100% of the patients, immunohistochemistry for chromogranin was performed, and 50% of the patients had pathological grade 2 disease. Treatment with somatostatin analogues was offered to 62%, while chemotherapy was given to 14%, with a regimen based on cisplatin/etoposide. Median overall survival in gastric primary tumours was 30 months, whereas for lung primary tumours it was 23.5 months.
El tumor carcinoide fue descrito por primera vez en 1888 por Lubarsch1 en 2 autopsias de pacientes, donde encontró múltiples tumores en íleo. Más tarde, Oberndorfer2 introdujo el término karzinoid (similar a carcinoma) en 1907. Los carcinoides son sinónimo de tumores neuroendocrinos (TNE) por su origen a partir de células derivadas del neuroectodermo, pudiendo presentarse en cualquier parte del cuerpo. En EE. UU., la ultima incidencia reportada es de 5.25/100,000, con un incremento observado durante las últimas décadas (p=0,001)3. En México solo han sido publicados reportes de casos, por lo que no es posible obtener una estadística adecuada.
En términos de sitio de origen, los TNE ocurren más comúnmente en el tubo digestivo (70%) y en el sistema broncopulmonar (25%)3.
La inactivación del gen supresor de tumores de la neoplasia endocrina múltiple tipo 1 (MEN 1) (11q13) se relaciona con la pérdida de la heterocigosis y es responsable de la carcinogénesis de los TNE enteropancreáticos hasta en un 40%4,5, mientras que los tumores carcinoides bronquiales y de timo pueden ser parte de MEN 1 en un 5-15%6,7.
En general, las características neuroendocrinas son compartidas por todas las neoplasias, en tanto que algunos aspectos clínicos y patológicos son específicos del órgano de origen8 y están relacionados con una amplia gama de síntomas locales o sistémicos que pueden generar un efecto de masa y/o la secreción de numerosas hormonas y aminas (tumores funcionales) que llegan a desencadenar un síndrome carcinoide. Sin embargo, al menos un 50% de los TNE cursan asintomáticos9.
La diferenciación del tumor es la principal variable para determinar el pronóstico de los pacientes y los enfoques terapéuticos10.
La Organización Mundial de la Salud (OMS) clasifica los TNE de pulmón en 4 subtipos histológicos: tumores de bajo grado (carcinoides típicos), tumores de grado intermedio (carcinoides atípicos) y 2 neoplasias de alto grado (carcinoma neuroendocrino de células grandes y carcinoma de células pequeñas) 11.
Por su morfología, los TNE gastroenteropancreáticos (GEP) pueden ser clasificados como bien diferenciados o pobremente diferenciados. La OMS en 201011 y la Sociedad Europea de Tumores Neuroendocrinos (ENETS–European Neuroendocrine Tumors Society)12 han introducido un sistema de clasificación basado en el índice de proliferación, el cual divide a los TNE en grado bajo, intermedio y alto (G1, G2 y G3, respectivamente). El índice mitótico y el índice proliferativo de Ki67 son utilizados concomitantemente para la determinación del grado11,12.
El G1 se caracteriza por un bajo índice de proliferación y es típico en los tumores bien diferenciados; el G3 presenta una alta tasa proliferativa y es típico en los carcinomas mal diferenciados. El G2 tiene una relevancia clínica y pronóstica doble: 1. en los tumores sin evidencia de actividad maligna, G2 puede ser la expresión de un mayor riesgo de recurrencia y, por lo tanto, indica un seguimiento más estrecho de los pacientes; 2. en los tumores malignos, el G2 puede ser predictivo de un comportamiento más agresivo13.
La cirugía es la única opción curativa en los tumores localizados. En los pacientes con enfermedad metastásica o localmente avanzada, el tratamiento médico es recomendado en los TNE GEP G1/G2 e incluye análogos de somatostatina, interferón alfa, terapia ablativa con radionúclidos y, más recientemente, terapias dirigidas. Para los TNE primarios de pulmón y mediastino no existe un tratamiento definido, debido a que los estudios clínicos presentan pocos casos con estas localizaciones14.
La quimioterapia es utilizada en los pacientes con G3, particularmente en TNE originados en páncreas y pulmón. La combinación cisplatino/etopósido es considerada la primera línea de tratamiento14.
Pacientes y métodosDurante el periodo comprendido entre enero de 2006 y diciembre 2012 fueron identificados pacientes con diagnóstico de TNE tratados dentro del servicio de Oncología Médica del Centro Médico Nacional de Occidente, quienes han sido incluidos en el presente estudio retrospectivo, prolectivo y descriptivo.
Los pacientes fueron evaluados en cuanto a características demográficas y tumorales, modalidades de diagnóstico, tratamiento y tasas de supervivencia.
Análisis estadísticoSe utilizó estadística descriptiva para el análisis de las características clínicas y demográficas de los pacientes, así como en los esquemas de manejo administrados. Los resultados de supervivencia se analizaron por prueba de supervivencia y curvas de Kaplan-Meier. Para los análisis se utilizó el programa informático SPSS, versión 15.
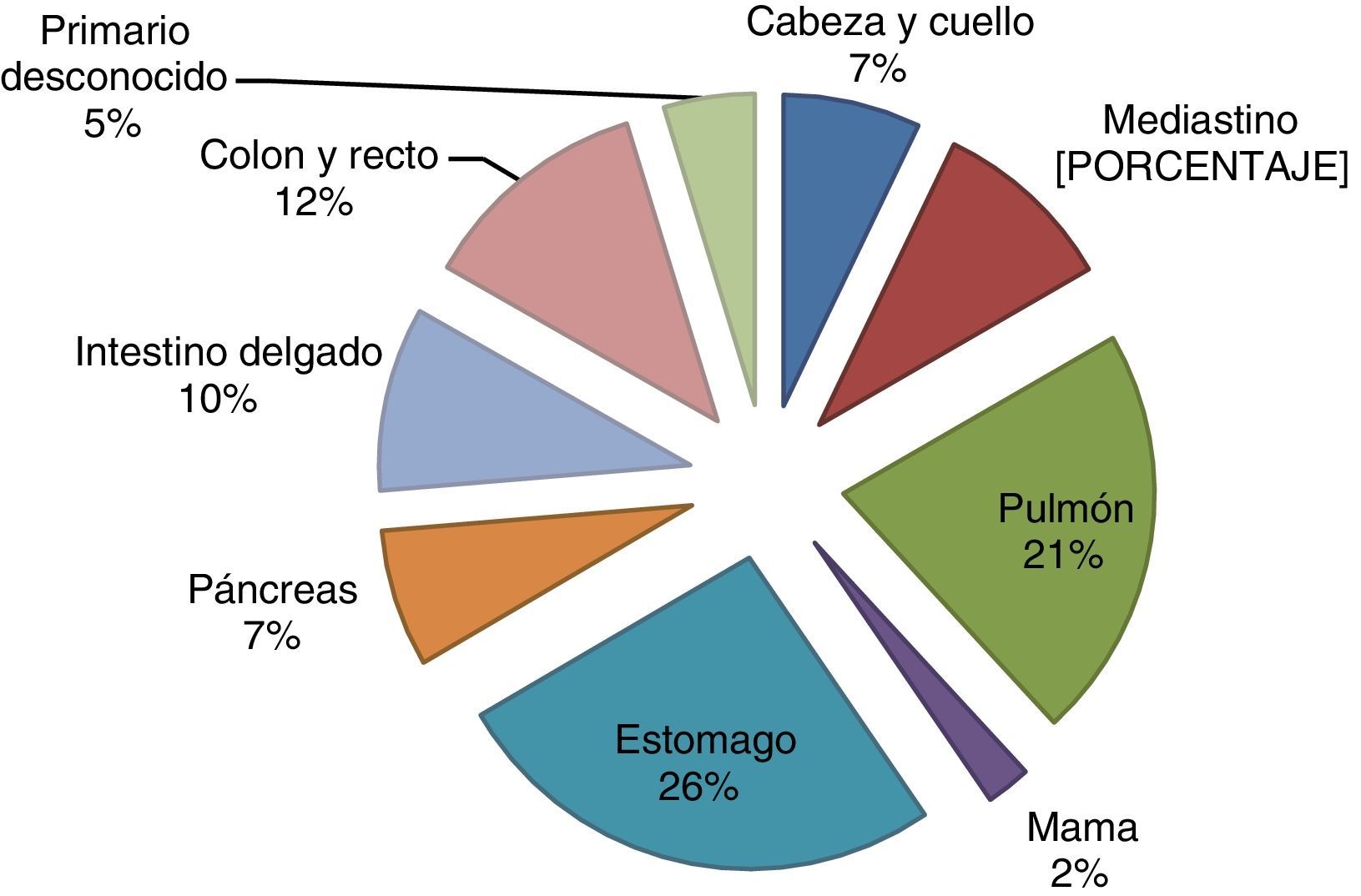
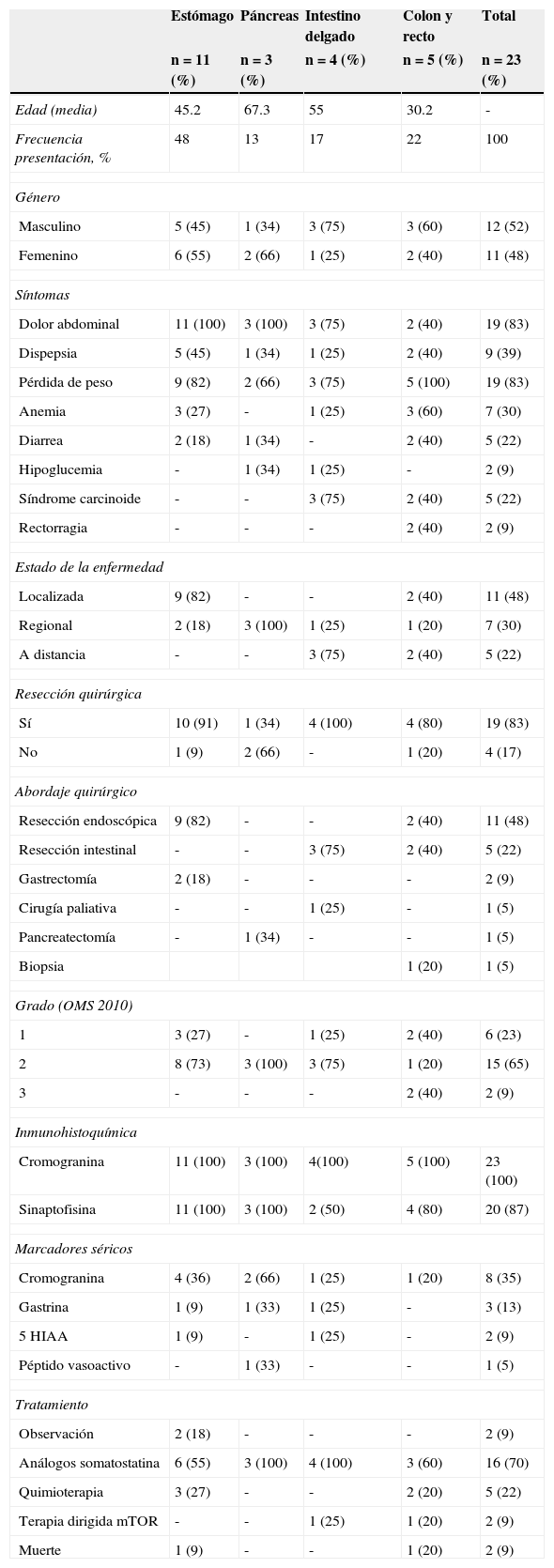
Reporte de casosSe documentaron 42 pacientes con diagnóstico de TNE. Sitios primarios: 13 pacientes (30.9%) en pulmón (21.4%) y mediastino anterior (9.5%); 23 pacientes (54.7%) presentaron tumores GEP, divididos en 11 (26%) en estómago, 5 (12%) en colon y recto, 4 (9.7%) en intestino delgado y 3 (7.1%) en páncreas. Otras localizaciones fueron cabeza y cuello con 2 (4.7%), primario desconocido y una lesión (2.3%) en mama (fig. 1).
Tumores neuroendocrinos de pulmón y mediastinoTrece pacientes presentaron TNE en tórax (tabla 1), 9 con tumores primarios en pulmón y 4 en mediastino. La media de edad fue de 55 años (32-78 años), con una distribución similar por género. Los síntomas de presentación más frecuentes fueron disnea y tos crónica en el 77% de los casos. En 2 pacientes, el diagnóstico se realizó por incremento de sintomatología respiratoria durante el embarazo.
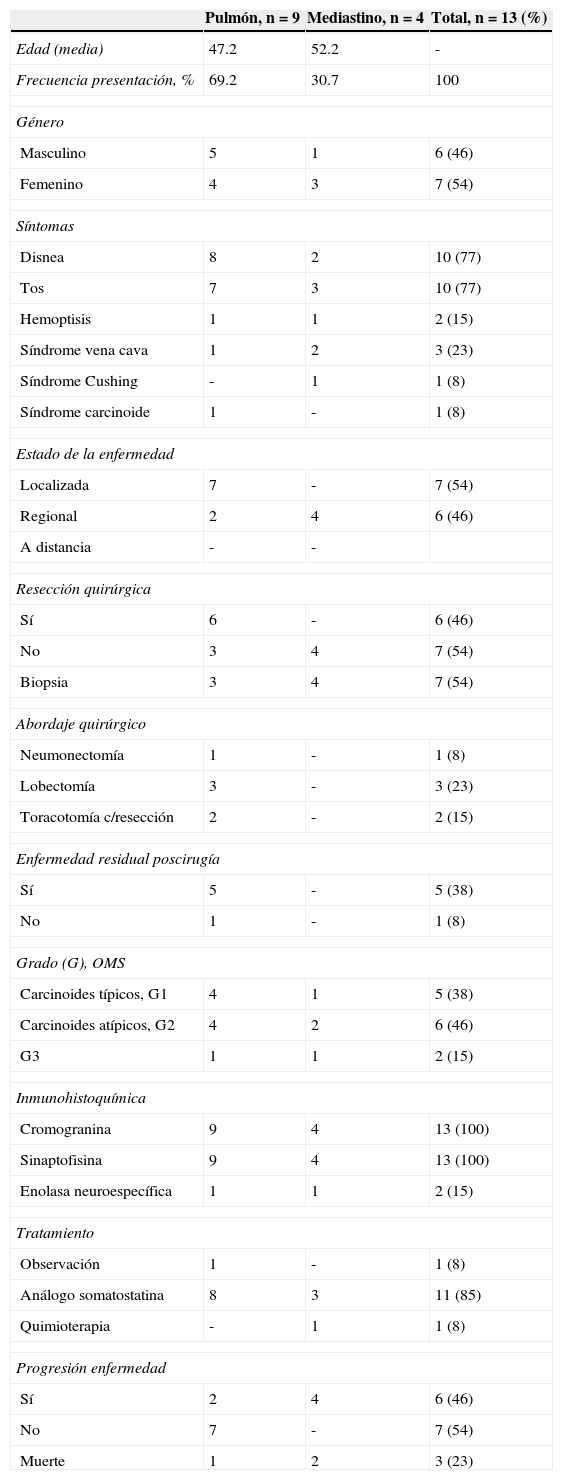
Datos demográficos y características clínicas, diagnósticas y terapéuticas de los pacientes con TNE de pulmón y mediastino (n=13)
| Pulmón, n=9 | Mediastino, n=4 | Total, n=13 (%) | |
|---|---|---|---|
| Edad (media) | 47.2 | 52.2 | - |
| Frecuencia presentación, % | 69.2 | 30.7 | 100 |
| Género | |||
| Masculino | 5 | 1 | 6 (46) |
| Femenino | 4 | 3 | 7 (54) |
| Síntomas | |||
| Disnea | 8 | 2 | 10 (77) |
| Tos | 7 | 3 | 10 (77) |
| Hemoptisis | 1 | 1 | 2 (15) |
| Síndrome vena cava | 1 | 2 | 3 (23) |
| Síndrome Cushing | - | 1 | 1 (8) |
| Síndrome carcinoide | 1 | - | 1 (8) |
| Estado de la enfermedad | |||
| Localizada | 7 | - | 7 (54) |
| Regional | 2 | 4 | 6 (46) |
| A distancia | - | - | |
| Resección quirúrgica | |||
| Sí | 6 | - | 6 (46) |
| No | 3 | 4 | 7 (54) |
| Biopsia | 3 | 4 | 7 (54) |
| Abordaje quirúrgico | |||
| Neumonectomía | 1 | - | 1 (8) |
| Lobectomía | 3 | - | 3 (23) |
| Toracotomía c/resección | 2 | - | 2 (15) |
| Enfermedad residual poscirugía | |||
| Sí | 5 | - | 5 (38) |
| No | 1 | - | 1 (8) |
| Grado (G), OMS | |||
| Carcinoides típicos, G1 | 4 | 1 | 5 (38) |
| Carcinoides atípicos, G2 | 4 | 2 | 6 (46) |
| G3 | 1 | 1 | 2 (15) |
| Inmunohistoquímica | |||
| Cromogranina | 9 | 4 | 13 (100) |
| Sinaptofisina | 9 | 4 | 13 (100) |
| Enolasa neuroespecífica | 1 | 1 | 2 (15) |
| Tratamiento | |||
| Observación | 1 | - | 1 (8) |
| Análogo somatostatina | 8 | 3 | 11 (85) |
| Quimioterapia | - | 1 | 1 (8) |
| Progresión enfermedad | |||
| Sí | 2 | 4 | 6 (46) |
| No | 7 | - | 7 (54) |
| Muerte | 1 | 2 | 3 (23) |
Solo el 15% de los casos comenzó con hemoptisis, en tanto que el 23% lo hizo con síndrome de vena cava. Se registró un caso asociado a síndrome de Cushing y otro más que cursa con hiperparatiroidismo e hiperinsulinemia (NEM 1).
Al momento del diagnóstico, el 54% de los pacientes presentaba enfermedad localizada, el 46% fue sometido a resección quirúrgica y un 46% comenzó con enfermedad regional.
El 38% se clasificó como G1, el 46% como G2 y el 15% como G3. Por inmunohistoquímica, el 100% exhibió tinción de cromogranina y sinaptofisina positivas con variación desde tinción débil hasta intensamente positiva. Adicionalmente, en un 15% se realizó la prueba de enolasa neuroespecífica.
El 85% de los pacientes recibe tratamiento con análogos de somatostatina por enfermedad residual o recurrente y solo un 8% recibió quimioterapia.
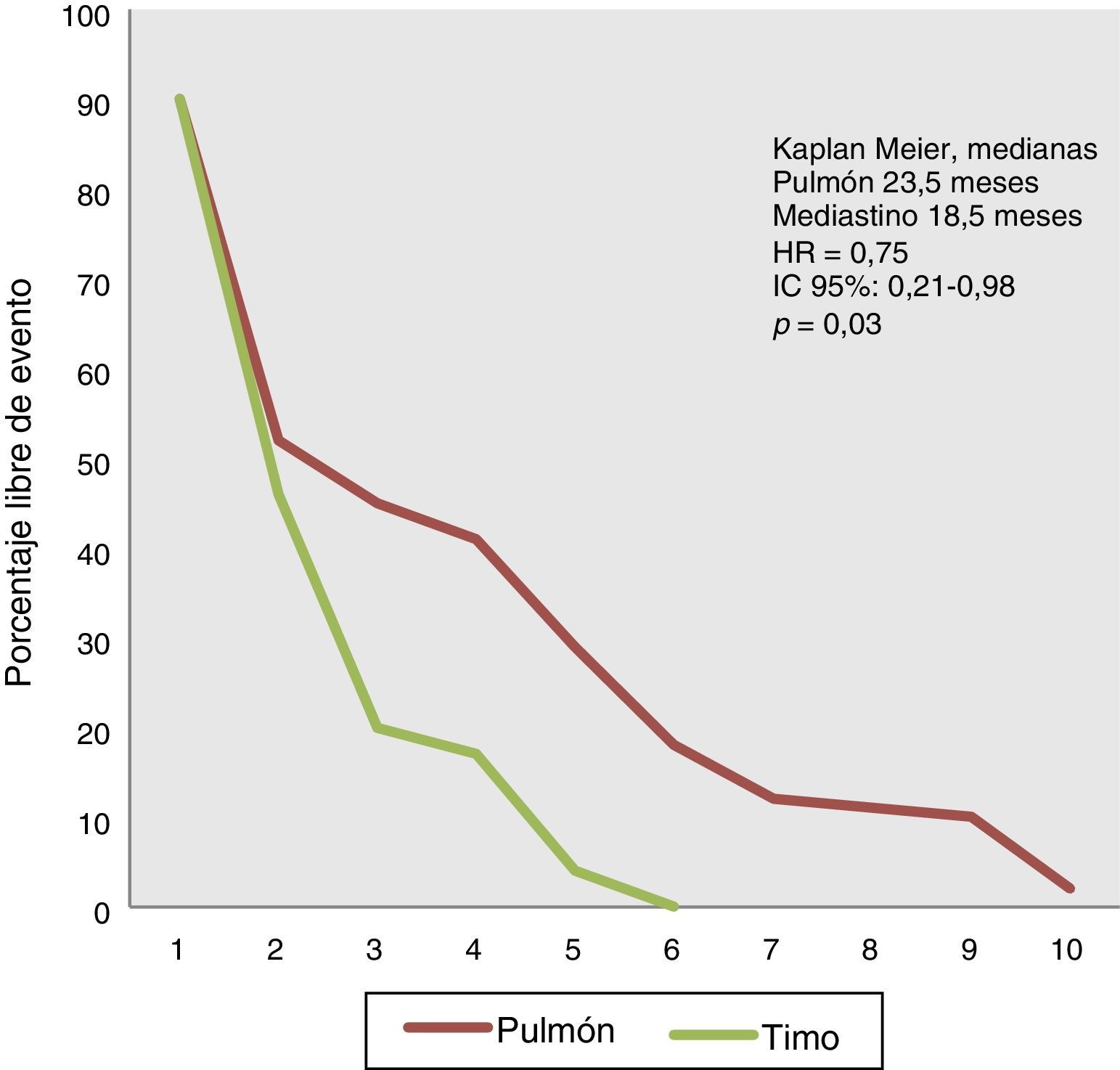
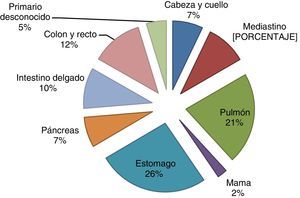
La mediana de supervivencia en los tumores primarios de pulmón fue de 23.5 meses (10-52 meses), en tanto que en los tumores localizados en el mediastino la mediana fue de 18.5 meses (4-46 meses) con una HR de 0.75 (IC del 95%: 0.21-0.98), p=0.03 (fig. 2).
Tumores neuroendocrinos gastroenteropancreáticosSe registraron 23 pacientes con TNE GEP (tabla 2), de los cuales 11 (48%) presentaron tumores gástricos; la media de edad en este subgrupo fue de 45 años (29-60 años). Los síntomas que con mayor frecuencia condujeron al diagnóstico fueron dolor abdominal en el 100% y pérdida de peso en el 82% de los pacientes. En 9 pacientes (82%) con enfermedad localizada se realizó resección endoscópica, en tanto que en 2 pacientes con enfermedad regional se optó por la gastrectomía.
Datos demográficos y características clínicas, de imagen y terapéuticas de los pacientes con TNE gastroenteropancreáticos
| Estómago | Páncreas | Intestino delgado | Colon y recto | Total | |
|---|---|---|---|---|---|
| n=11 (%) | n=3 (%) | n=4 (%) | n=5 (%) | n=23 (%) | |
| Edad (media) | 45.2 | 67.3 | 55 | 30.2 | - |
| Frecuencia presentación, % | 48 | 13 | 17 | 22 | 100 |
| Género | |||||
| Masculino | 5 (45) | 1 (34) | 3 (75) | 3 (60) | 12 (52) |
| Femenino | 6 (55) | 2 (66) | 1 (25) | 2 (40) | 11 (48) |
| Síntomas | |||||
| Dolor abdominal | 11 (100) | 3 (100) | 3 (75) | 2 (40) | 19 (83) |
| Dispepsia | 5 (45) | 1 (34) | 1 (25) | 2 (40) | 9 (39) |
| Pérdida de peso | 9 (82) | 2 (66) | 3 (75) | 5 (100) | 19 (83) |
| Anemia | 3 (27) | - | 1 (25) | 3 (60) | 7 (30) |
| Diarrea | 2 (18) | 1 (34) | - | 2 (40) | 5 (22) |
| Hipoglucemia | - | 1 (34) | 1 (25) | - | 2 (9) |
| Síndrome carcinoide | - | - | 3 (75) | 2 (40) | 5 (22) |
| Rectorragia | - | - | - | 2 (40) | 2 (9) |
| Estado de la enfermedad | |||||
| Localizada | 9 (82) | - | - | 2 (40) | 11 (48) |
| Regional | 2 (18) | 3 (100) | 1 (25) | 1 (20) | 7 (30) |
| A distancia | - | - | 3 (75) | 2 (40) | 5 (22) |
| Resección quirúrgica | |||||
| Sí | 10 (91) | 1 (34) | 4 (100) | 4 (80) | 19 (83) |
| No | 1 (9) | 2 (66) | - | 1 (20) | 4 (17) |
| Abordaje quirúrgico | |||||
| Resección endoscópica | 9 (82) | - | - | 2 (40) | 11 (48) |
| Resección intestinal | - | - | 3 (75) | 2 (40) | 5 (22) |
| Gastrectomía | 2 (18) | - | - | - | 2 (9) |
| Cirugía paliativa | - | - | 1 (25) | - | 1 (5) |
| Pancreatectomía | - | 1 (34) | - | - | 1 (5) |
| Biopsia | 1 (20) | 1 (5) | |||
| Grado (OMS 2010) | |||||
| 1 | 3 (27) | - | 1 (25) | 2 (40) | 6 (23) |
| 2 | 8 (73) | 3 (100) | 3 (75) | 1 (20) | 15 (65) |
| 3 | - | - | - | 2 (40) | 2 (9) |
| Inmunohistoquímica | |||||
| Cromogranina | 11 (100) | 3 (100) | 4(100) | 5 (100) | 23 (100) |
| Sinaptofisina | 11 (100) | 3 (100) | 2 (50) | 4 (80) | 20 (87) |
| Marcadores séricos | |||||
| Cromogranina | 4 (36) | 2 (66) | 1 (25) | 1 (20) | 8 (35) |
| Gastrina | 1 (9) | 1 (33) | 1 (25) | - | 3 (13) |
| 5 HIAA | 1 (9) | - | 1 (25) | - | 2 (9) |
| Péptido vasoactivo | - | 1 (33) | - | - | 1 (5) |
| Tratamiento | |||||
| Observación | 2 (18) | - | - | - | 2 (9) |
| Análogos somatostatina | 6 (55) | 3 (100) | 4 (100) | 3 (60) | 16 (70) |
| Quimioterapia | 3 (27) | - | - | 2 (20) | 5 (22) |
| Terapia dirigida mTOR | - | - | 1 (25) | 1 (20) | 2 (9) |
| Muerte | 1 (9) | - | - | 1 (20) | 2 (9) |
En los 11 pacientes se efectuó la tinción para sinaptofisina y cromogranina, y en el 36% se detectó elevación de cromogranina sérica. Por grado, el 73% era G2 y el 27% G1. En la actualidad, el 18% de los pacientes se encuentra en observación, mientras que el 55% ha recibido análogos de la somatostatina por enfermedad residual o recurrente.
En los pacientes con TNE de páncreas (3), la media de edad al diagnóstico fue de 67 años (57-75 años). Describimos 3 diferentes subtipos: glucagonoma asociado a eritema migratorio con elevación de cromogranina y gastrina sérica, insulinoma con historial de hipoglucemias de repetición, y un VIPoma con antecedentes de diarrea crónica y elevación sérica de péptido vasoactivo. Solo uno de los 3 pacientes, aquel con diagnóstico de glucagonoma, ha podido ser sometido a resección quirúrgica. Los 3 pacientes son G2, mostraron tinciones positivas a cromogranina en el 100% y a sinaptofisina en el 50% y reciben tratamiento con análogos de somatostatina.
En cuanto al intestino delgado, 2 pacientes fueron diagnosticados con tumores localizados en duodeno y 2 con sitio primario en íleo. La distribución por género fue de 3 hombres y una mujer, con una media de edad de 55 años (16-75 años). El 75% presentó síndrome carcinoide persistente a pesar de resección intestinal, con elevación de marcadores séricos. Se observó un caso asociado a síndrome de Zollinger-Ellison. El G2 fue el más frecuente. La tinción de cromogranina fue positiva en los 4 pacientes y de sinaptofisina en 2 de ellos. Los 4 pacientes han recibido tratamiento con análogos de la somatostatina y uno de ellos además recibe everolimus por progresión.
En 5 pacientes (22%) con TNE de colon y recto, la media de edad al diagnóstico fue de 30.2 años (18-70 años). Los síntomas más frecuentes fueron pérdida de peso en el 100% y anemia en el 60%; el 80% de los pacientes fue sometido a resección intestinal, en un 40% por vía endoscópica. El 40% de los pacientes presentó G1 o G3, respectivamente, y solo el 20% mostró G2. La tinción de cromogranina fue positiva en el 100% y de sinaptofisina en el 80%. Tres pacientes reciben tratamiento con análogos de la somatostatina, uno de ellos recibe también terapia dirigida con everolimus y 2 pacientes quimioterapia.
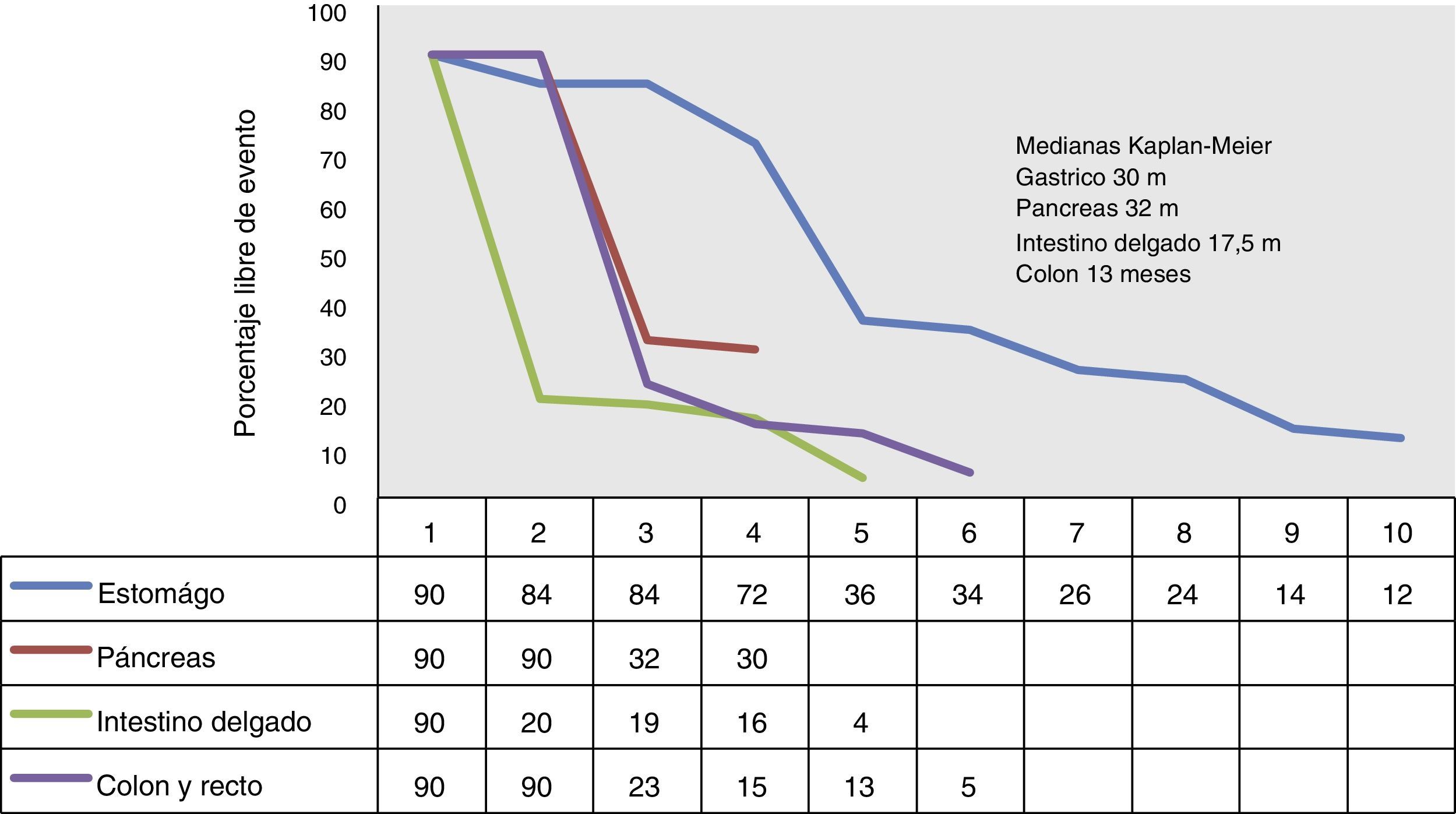
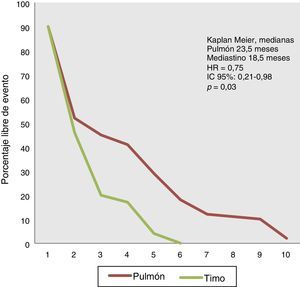
La mediana de supervivencia global en los pacientes con tumores gástricos fue de 30 meses (6-84 meses), en los de páncreas fue de 32 meses (30-154 meses), en los de intestino delgado de 17.5 meses (4-20 meses) y en los de colon 13 meses (1.5-27 meses). No se encontró diferencia estadística al realizar una comparación de las tasas de supervivencia entre los TNE gástricos y pancreáticos (HR=1.12; IC del 95%: 0.57-1.09; p=0.86), pero es evidente la ventaja de supervivencia en aquellos pacientes con tumores gástricos en comparación con aquellos con primarios de intestino delgado (HR=0.63; IC del 95%: 0.31-0.87; p<0.001) y colon y recto (HR=0.61; IC del 95%: 0.58-0.98; p<0.0001), respectivamente (fig. 3).
Otros tumores neuroendocrinosDentro de los TNE de cabeza y cuello han sido diagnosticados 3 hombres con una media de edad de 69 años (60-80 años) y con las siguientes localizaciones: etmoides, laringe y seno maxilar. Los 3 tumores eran de alto grado y aunque los pacientes fueron tratados con quimioterapia, fallecieron por progresión de la enfermedad sobre 2 líneas de quimioterapia.
Dos pacientes masculinos con TNE de primario no conocido, con evidencia de metástasis hepáticas, historial de diarrea crónica y manifestaciones de síndrome carcinoide, son tratados con análogos de la somatostatina, con control de los síntomas en un 90%.
Por último, una paciente con diagnóstico de cáncer de mama, G3, ha recibido tratamiento con quimioterapia adyuvante y en la actualidad se encuentra libre de enfermedad.
Los pacientes con primarios desconocidos presentaron una mediana de supervivencia de 30 meses (24-36 meses) y aquellos con tumores de cabeza y cuello mostraron una mediana de supervivencia de 8 meses (4-12 meses). En cuanto a supervivencia libre de progresión, en los TNE primarios de mediastino, la mediana fue de 12 meses, en los de intestino delgado de 5 meses y en cabeza y cuello 8 meses. Los tumores primarios de pulmón, páncreas, estómago y colon se han mantenido libres de progresión de la enfermedad.
DiscusiónEn las últimas décadas, la incidencia y la prevalencia de los TNE se han incrementado de forma importante. Esto puede obedecer a 2 razones: un mejor conocimiento de la biología tumoral y una mejora en los métodos diagnósticos.
La incidencia de TNE de pulmón es baja: los tumores carcinoides típicos comprenden el 1-2% y los carcinoides atípicos solo el 0.2% de las neoplasias pulmonares15. La prevalencia de los TNE de timo es del 3% de la cifra total de TNE en todas las localizaciones anatómicas16. La asociación de un síndrome hereditario como MEN 1 es detectada hasta en el 15% de los casos6 (en nuestro estudio en un caso).
La edad a la presentación de los TNE de pulmón es de 64 años, en tanto que en el caso de los TNE de timo es de 59 años7. En nuestra serie de casos, la media de edad a la presentación de tumores primarios de pulmón es 16 años inferior a la descrita en la literatura y de 52 años en el caso de los tumores de timo.
Hasta el 90% de los pacientes con TNE de pulmón central presenta síntomas, mientras que los tumores periféricos pueden diagnosticarse de manera incidental17. La mayoría de los casos de TNE de timo son completamente asintomáticos en las fases incipientes de la enfermedad7. El 76% de nuestros pacientes mostraron como síntomas de presentación más frecuentes disnea y tos; solo un 23% presentó síndrome de vena cava.
Ambos TNE se asocian frecuentemente a hipersecreción hormonal, incluida la secreción ectópica de hormona adrenorcorticotropa, la cual da lugar al síndrome de Cushing (en nuestro estudio en un caso), y la hipersecreción de hormona del crecimiento, lo cual genera acromegalia18,19.
La broncoscopia es el método de elección en el diagnóstico preoperatorio7. En nuestra serie se realizó en el 100% de los pacientes y permitió establecer un diagnóstico histológico en el 57% de los casos. El 80% de los carcinoides típicos expresaron receptores de somatostatina19,20. El OctreoScan (gammagrafía con receptores de somatostatina) es útil en los casos de recidiva y sospecha de enfermedad metastásica21.
Las técnicas quirúrgicas de elección en pulmón son la lobectomía o la resección en mango de la lesión22. En nuestros pacientes, solo en un 66% fue posible realizar algún tipo de cirugía. Los TNE de timo deben, siempre que sea posible, ser sometidos a resección quirúrgica radical; sin embargo, en ninguno de nuestros pacientes fue posible realizar resección quirúrgica debido a la presencia de enfermedad regional.
Por desgracia, hay una gran carencia de estudios fase ii y iii en TNE de pulmón y timo; los resultados terapéuticos provienen exclusivamente de datos recuperados de la literatura en series heterogéneas o reportes de casos. En 2013 fue publicado un subanálisis del estudio RAD001 en Tumores Neuroendocrinos Avanzados23 (RADIANT 2–RAD001 in Advanced Neuroendocrine Tumors), en el que se evaluó la eficacia y la seguridad de la administración de everolimus y octreotide de acción prolongada (LAR) en una cohorte de pacientes con TNE de pulmón de grado bajo e intermedio. Se encontró una mediana de supervivencia libre de progresión de 13.6 meses en el brazo experimental en comparación con 5.59 meses en el brazo con placebo (riesgo relativo: 0.72; IC del 95%: 0.31–1.68; p=0.228)14. En la presente serie, nuestros pacientes con TNE de pulmón permanecen libres de progresión, en tanto que en aquellos con TNE de mediastino, la supervivencia libre de progresión registrada ha sido de 12 meses. La supervivencia global es 15 meses superior en los TNE de pulmón en comparación con los de mediastino (HR=0.75; IC del 95%: 0.21-0.98; p=0.03).
La incidencia de los TNE GEP también se ha incrementado en los últimos años, y es variable de acuerdo al sitio de localización: estómago 0.30/100,000; páncreas 0.32/100,000; intestino delgado 0.32-1.12/100,000; y colon y recto 0.86/100,000. El tumor primario más común es el de estómago, seguido por intestino delgado y recto3,24. En nuestra serie de casos, por orden de frecuencia, encontramos como primario más frecuente el gástrico (48%), seguido por colon y recto (22%) e intestino delgado (17%).
En general, el TNE GEP puede aparecer a cualquier edad, con una incidencia más elevada entre la quinta y la sexta década de vida en los pacientes con MEN 1, en tanto que la enfermedad de von Hippel-Lindau puede tener un inicio 15 a 20 años antes que los TNE esporádicos24. Existe una propensión ligeramente superior en los hombres, excepto en el caso de los TNE gástricos, donde en la última década se ha incrementado la incidencia en mujeres25. Nosotros no encontramos diferencias en cuanto al género y la media de edad de presentación de nuestros pacientes con TNE fue de 45 años en estómago, 67 años en páncreas, 55 años en intestino delgado y de 30 años en recto.
Los síntomas de presentación varían de acuerdo al tumor primario pero, en general, en nuestros pacientes, independientemente del sitio de origen, los síntomas más frecuentes fueron dolor abdominal y pérdida de peso, ambos en el 87%. El diagnóstico histológico es indispensable en todos los casos y frecuentemente se realiza por biopsia endoscópica o guiada por ultrasonido para las metástasis hepáticas24. El síndrome carcinoide es encontrado más frecuentemente en los TNE de intestino delgado hasta en un 30% de los pacientes24; en nuestros pacientes fue descrito en 3 casos con TNE de intestino delgado y solo en 2 con TNE de colon y recto.
Los TNE GEP constituyen un grupo heterogéneo, pero todos comparten un fenotipo neuroendocrino con inmunorreactividad a marcadores específicos como cromogranina A y sinaptofisina. Otros marcadores útiles incluyen la enolasa neuroespecífica y CD5624. En el 100% de nuestros pacientes se realizó tinción para cromogranina y para sinaptofisina en un 87%.
Es indispensable la determinación de Ki67 por inmunohistoquímica para obtener el grado del tumor de acuerdo a la clasificación de la OMS26. En el 62% de nuestros pacientes se encontró un G2, en tanto que en el 23% se halló un G1.
De ser posible debe efectuarse un OctreoScan, puesto que un 85% de los TNE GEP expresan receptores de somatostina, aunque estos también pueden ser detectados con tomografía por emisión de positrones con galio6821. OctreoScan fue el estudio más frecuentemente utilizado en nuestra serie de casos para evaluar el estado de la enfermedad. Los procedimientos de imagen deben complementarse con análisis bioquímicos de marcadores en plasma altamente específicos para TNE. La determinación de la cromogranina A27 fue el estudio sérico realizado en un 35% de nuestros pacientes. En los pacientes con tumores de intestino delgado debe ser medido el ácido 5 hidroxiindolacético, lo cual se hizo en el 9% de nuestros casos, en tanto que para los TNE primarios de páncreas se deben medir hormonas específicas en relación con los síntomas clínicos.
El tratamiento principal para los TNE GEP es la resección quirúrgica, y esta depende del tamaño y el sitio de localización28, pero siempre que sea posible debe procurarse una cirugía curativa o una cirugía citorreductora con la intención de mejorar síntomas locales. En nuestra serie, el 83% de los pacientes fueron sometidos a resección quirúrgica.
El uso de análogos de la somatostatina es la terapia de referencia en TNE funcionales de cualquier tamaño24,29. En un estudio prospectivo con asignación aleatoria y controlado con placebo de octreotide LAR 30mg cada 4 semanas en pacientes con TNE de intestino delgado (PROMID)30, se encontró eficacia antiproliferativa de octreotide LAR, con una mediana de tiempo lasta la progresión tumoral de 14.3 meses con octreotide vs. 6 meses con placebo. Con base en estos resultados, el uso de octreotide LAR es recomendando en TNE G1/G2, independientemente de que el tumor de origen muestre potencial metastásico. Un 70% de nuestros pacientes ha recibido octreotide LAR como tratamiento complementario.
Los inhibidores de mTOR (everolimus), solos o en combinación con análogos de somatostatina, fueron evaluados en el estudio fase III RADIANT 231 en pacientes con TNE de páncreas con síndrome carcinoide, quienes fueron distribuidos aleatoriamente para recibir everolimus-octreotide o placebo-octreotide, en tanto que en el estudio RADIANT 332 se observó una significativa prolongación de la supervivencia libre de progresión de 6.4 meses en el brazo con everolimus, motivo por el cual este tratamiento es ahora aceptado para los TNE de páncreas a nivel mundial. En el 9% de nuestros pacientes se ha adicionado everolimus en caso de progresión con octreotide LAR.
En nuestra serie de casos, los TNE de intestino delgado presentan una mediana de supervivencia libre de progresión de 5 meses, lo cual resulta inferior a lo reportado en la literatura y en comparación con los tumores primarios de estómago, páncreas y colon, los cuales a la fecha se encuentran libres de progresión.
La mediana de supervivencia de los pacientes con TNE gástricos es de 30 meses, en páncreas de 32 meses, intestino delgado 17 meses, y colon y recto 13 meses. Cuando comparamos los TNE gástricos con los de intestino delgado, la HR es de 0.63 (IC del 95%: 0.31-0.87; p<0.001), en tanto que en la comparación con los de colon, la HR es de 0.61 (IC del 95%: 0.58-0.98; p<0.0001).
Los inhibidores de tirosina cinasa como sunitinib y pazopanib han demostrado eficacia antitumoral significativa en pacientes con TNE pancreáticos33.
La quimioterapia es recomendada para los TNE pancreáticos G2 inoperables o con metástasis hepáticas. La combinación utilizada es estreptozotocina y 5-fluorouracilo o doxorrubicina con tasas de respuesta objetiva del 35-40%. El uso de temozolamida sola o en combinación con capecitabina puede ofrecer respuestas parciales de un 40-70%. En los carcinomas neuroendocrinos G3, la combinación cisplatino/etopósido es usualmente recomendada como primera línea de tratamiento. En nuestra serie, el 22% de los pacientes ha recibido quimioterapia citotóxica. En términos generales, no se encuentran bien establecidas las segundas líneas de tratamiento, de modo que son necesarios estudios complementarios34,35.
En conclusión, a pesar de un incremento en la incidencia de TNE, aún son infrecuentes en comparación con el resto de las neoplasias. En general no muestran mayor propensión en términos de género y la mediana de edad al momento de la presentación se ubica dentro de la sexta década de la vida. Se debe realizar un abordaje multidisciplinario y el tratamiento debe ser individualizado en función del sitio de origen. Los análogos de somatostatina deben ser empleados en aquellos pacientes que presentan captación positiva de receptores de somatostina, con la intención de mejorar los síntomas del síndrome carcinoide. La administración continua de octreotide LAR genera un incremento estadísticamente significativo en la supervivencia libre de progresión en los pacientes con TNE de páncreas G1/G2 y, ante la progresión, pueden ser utilizados inhibidores de mTOR y tirosina cinasa. Se necesitan estudios adicionales para evaluar la eficacia del tratamiento por sitio de origen.
Por último, es necesario seguir conociendo la enfermedad y su genética molecular a fin de avanzar en la clasificación y la predicción del pronóstico de los TNE, así como para favorecer el desarrollo de futuras estrategias terapéuticas.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.